El objetivo de este estudio es reportar nuestra casuística en cirugía de la anomalía de Ebstein en los últimos 10 años, analizar las consideraciones para la toma de decisiones quirúrgicas en el neonato y presentar nuestros resultados en la cirugía del «cono» de Da Silva.
MétodosEstudio observacional retrospectivo que incluye a 11 pacientes con diagnóstico de anomalía de Ebstein operados en nuestro centro desde enero de 2011 hasta agosto de 2021. A 2 neonatos se les realizó cirugía de Starnes y a 9 (fuera del período neonatal) cirugía del «cono» de Da Silva.
ResultadosLos 2 neonatos en el seguimiento se encuentran en situación de Fontan y en clase funcional i (New York Heart Association). La edad media del grupo de pacientes operados fuera del período neonatal fue de 9,1±6 años. No hubo mortalidad hospitalaria ni en el seguimiento. Como complicaciones postoperatorias, un paciente salió en ECMO de quirófano por disfunción ventricular derecha grave. No hubo bloqueo AV. El seguimiento medio fue de 5,3 años. El ecocardiograma transtorácico de seguimiento demostró una reducción significativa de la insuficiencia tricuspídea de 3,7±0,6 a 1,1±0,9 (p<0,0001), y la clase de la New York Heart Association mejoró de 2,3±0,7 a 1,2±0,4 (p<0,001). No ha habido sustitución valvular tricuspídea inmediata ni en el seguimiento.
ConclusionesLa cirugía del «cono» puede ser realizada de forma segura con escasa morbimortalidad. En el seguimiento a medio plazo, el ecocardiograma muestra una reducción significativa del grado de insuficiencia tricuspídea, los pacientes han mejorado su clase funcional y ninguno ha precisado sustitución valvular tricuspídea.
The objective of this study is to report our casuistry in the Ebstein's anomaly surgery in the last 10 years, to analyze the considerations for surgical decision making in the neonate and present our results in da Silva's “cone” tricuspid reconstruction.
MethodsRetrospective observational study that includes 11 patients diagnosed with Ebstein's anomaly operated on at our center from January 2011 to August 2021. Two neonates underwent Starnes procedure and 9 (beyond the neonatal period) Da Silva's “cone” surgery.
ResultsThe 2 neonates in follow-up are in Fontan's situation and in functional class i (New York Heart Association). The mean age of patients operated beyond the neonatal period was 9.1±6.0 years. There was no hospital mortality or at follow-up. As postoperative complications, one patient was placed on ECMO for severe right ventricular dysfunction. There was no AV block. The mean follow-up was 5.3 years. Follow-up transthoracic echocardiogram demonstrated a significant reduction in tricuspid regurgitation from 3.7±0.6 to 1.1±0.9 (P<.0001), and the New York Heart Association class improved from 2.3±0.7 to 1.2±0.4 (P<.001). There has been no immediate or follow-up tricuspid valve replacement.
ConclusionsThe “Cone” procedure can be performed safely with low morbidity and mortality. In the medium-term follow-up, the echocardiogram shows a significant reduction in the degree of tricuspid regurgitation, the patients have improved their functional class and none have required tricuspid valve replacement.
La anomalía de Ebstein (AE) es una cardiopatía congénita muy poco frecuente, con una incidencia de 1 a 5 cada 200.000 nacidos vivos y representa aproximadamente el 1% de las cardiopatías congénitas1. En la actualidad la AE se considera una malformación no solo de la válvula tricúspide sino también del ventrículo derecho (VD), derivando en un amplio espectro de lesiones. Comúnmente se observa falta de delaminación de los velos del endocardio ventricular subyacente con desplazamiento apical del velo septal (en menor proporción del velo posterior) que generan grados variables de insuficiencia valvular tricuspídea (IT), disfunción ventricular derecha y cianosis.
La mayoría de los recién nacidos con AE y cardiomegalia leve o moderada son asintomáticos. Sin embargo, cuando coexisten cardiomegalia e IT graves y lesiones cardiacas adicionales, se presentan clínicamente como grupo distinto y críticamente enfermos pudiendo presentar cianosis profunda, insuficiencia cardiaca grave y shock. Esto parece deberse, en gran parte, a la elevación persistente de las resistencias vasculares pulmonares y la incapacidad del VD para mantener un flujo pulmonar anterógrado adecuado, comportándose fisiopatológicamente como una atresia pulmonar, incluso cuando el tracto de salida del VD y la válvula pulmonar son normales. En esta situación estos pacientes dependen del ductus arterioso para mantener un flujo pulmonar adecuado. Por otro lado, las resistencias pulmonares altas empeoran la insuficiencia tricuspídea, lo que aumenta el cortocircuito de derecha a izquierda a través de la comunicación interauricular agravando la situación de hipoxemia y la acidosis.
En ocasiones, a pesar de un tratamiento médico óptimo con infusión de prostaglandinas PGE1 (para mantener la permeabilidad del ductus arterioso), óxido nítrico inhalado (para disminuir la resistencia vascular pulmonar) y soporte inotrópico, algunos neonatos requerirán una intervención quirúrgica.
El objetivo de este estudio es reportar nuestra casuística en cirugía de la AE en la edad pediátrica, analizar las consideraciones relevantes para la toma de decisiones quirúrgicas durante el período neonatal y analizar nuestros resultados en la cirugía del «cono» de Da Silva.
Pacientes y métodosDesde enero de 2011 hasta agosto de 2021, 11 pacientes con diagnóstico de AE e indicación quirúrgica fueron operados en nuestro servicio (ver características de los pacientes en las tablas 1 y 2). Dos de ellos eran neonatos con IT grave, en situación clínica crítica, conectados a ventilación mecánica en la unidad de cuidados intensivos neonatales. Ambos se paliaron inicialmente con cirugía de Starnes, con cierre de la válvula tricúspide con un parche de pericardio bovino fenestrado (4mm). Al neonato 1, con atresia pulmonar funcional y cianosis grave, se le colocó un stent ductal como primer procedimiento, a pesar del cual la cianosis grave no mejoró; durante la cirugía de Starnes se le ligó el tronco pulmonar. Al neonato 2, con comunicación interventricular apical grande en situación de hiperaflujo pulmonar y bajo gasto cardiaco, se le realizó adicionalmente banding de la arteria pulmonar y ligadura quirúrgica del ductus arterioso.
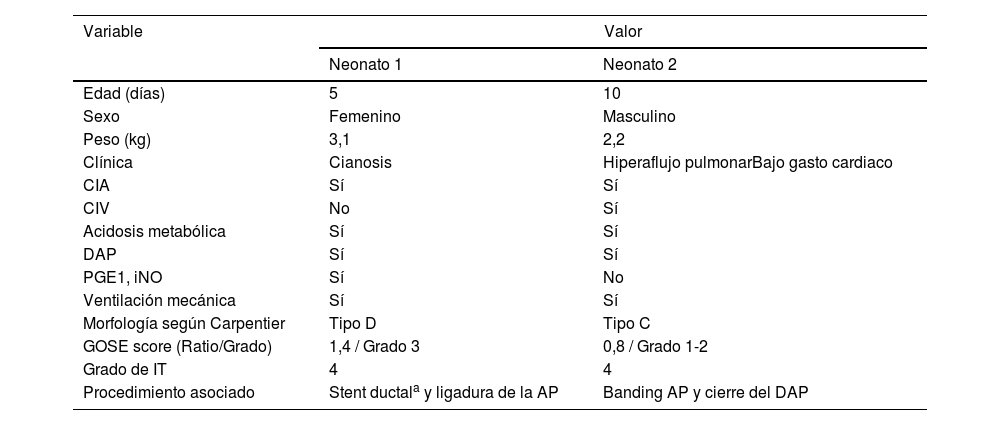
Características preoperatorias de los neonatos operados con técnica de Starnes
| Variable | Valor | |
|---|---|---|
| Neonato 1 | Neonato 2 | |
| Edad (días) | 5 | 10 |
| Sexo | Femenino | Masculino |
| Peso (kg) | 3,1 | 2,2 |
| Clínica | Cianosis | Hiperaflujo pulmonarBajo gasto cardiaco |
| CIA | Sí | Sí |
| CIV | No | Sí |
| Acidosis metabólica | Sí | Sí |
| DAP | Sí | Sí |
| PGE1, iNO | Sí | No |
| Ventilación mecánica | Sí | Sí |
| Morfología según Carpentier | Tipo D | Tipo C |
| GOSE score (Ratio/Grado) | 1,4 / Grado 3 | 0,8 / Grado 1-2 |
| Grado de IT | 4 | 4 |
| Procedimiento asociado | Stent ductala y ligadura de la AP | Banding AP y cierre del DAP |
AP: arteria pulmonar; CIA: comunicación interauricular; CIV: comunicación interventricular; DAP: ductus arterioso permeable; GOSE score: Great Ormond Street Echocardiographic score; iNO: óxido nítrico inhalado; PGE1: prostaglandinas.
aProcedimiento preoperatorio.
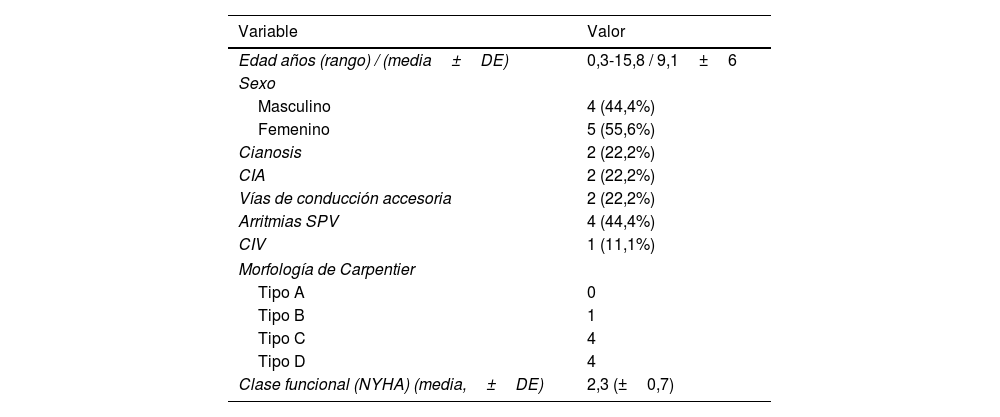
Características preoperatorias de los pacientes operados con técnica del cono
| Variable | Valor |
|---|---|
| Edad años (rango) / (media±DE) | 0,3-15,8 / 9,1±6 |
| Sexo | |
| Masculino | 4 (44,4%) |
| Femenino | 5 (55,6%) |
| Cianosis | 2 (22,2%) |
| CIA | 2 (22,2%) |
| Vías de conducción accesoria | 2 (22,2%) |
| Arritmias SPV | 4 (44,4%) |
| CIV | 1 (11,1%) |
| Morfología de Carpentier | |
| Tipo A | 0 |
| Tipo B | 1 |
| Tipo C | 4 |
| Tipo D | 4 |
| Clase funcional (NYHA) (media,±DE) | 2,3 (±0,7) |
CIA: comunicación interauricular; CIV: comunicación interventricular; DE: desviación estándar; NYHA: New York Heart Association; SPV: supraventriculares.
A los 9 pacientes restantes (fuera del período neonatal) se les realizó cirugía de reparación valvular según técnica del «cono» de Da Silva
Los criterios de cirugía en esta serie incluyen: pacientes sintomáticos en clase funcional iii o iv, pacientes cianóticos/policitémicos y pacientes con arritmias refractarias a tratamiento médico.
Se midieron variables preoperatorias, así como el estado de los pacientes en el seguimiento mediante revisión de historias clínicas y pruebas de imagen. Los datos se trataron de forma anónima.
Cirugía de StarnesLa cirugía se realiza a través de una esternotomía media longitudinal, en circulación extracorpórea normotérmica y con canulación venosa bicaval. Se lleva a cabo una auriculotomía derecha paralela al surco auriculoventricular (AV) y se excluye el VD con un parche fenestrado a 4mm de pericardio bovino, que es suturado al anillo tricuspídeo verdadero, dejando al seno coronario drenando en la aurícula derecha. Se amplía la comunicación interauricular y se reduce el tamaño de la aurícula mediante resección parcial de su pared lateral.
Adicionalmente, en el caso específico del neonato 1 se colocó preoperatoriamente un stent en el ductus arterioso permeable y se ligó la arteria pulmonar durante la cirugía de Starnes; en el neonato 2, con comunicación interventricular y en situación de hiperaflujo pulmonar, se limitó el mismo con un banding (con cinta de PTFE) de la arteria pulmonar y se cerró el ductus.
Cirugía de «cono» de Da SilvaPasos clave en la reparación del «cono» de Da Silva (figuras 1–3):
- 1.
Canulación estándar aórtica y bicava.
- 2.
Auriculotomía derecha paralela al surco auriculoventricular (se puede marcar con rotulador previamente a la auriculotomía y estando la aurícula llena el segmento de pared auricular que resecaremos en aquellos casos con aurículas derechas muy dilatadas).
- 3.
Examen anatómico de válvula tricúspide. Identificaremos: el segmento del VD auricularizado (no funcional), el nodo AV marcado generalmente por una vena pequeña (vena de D).
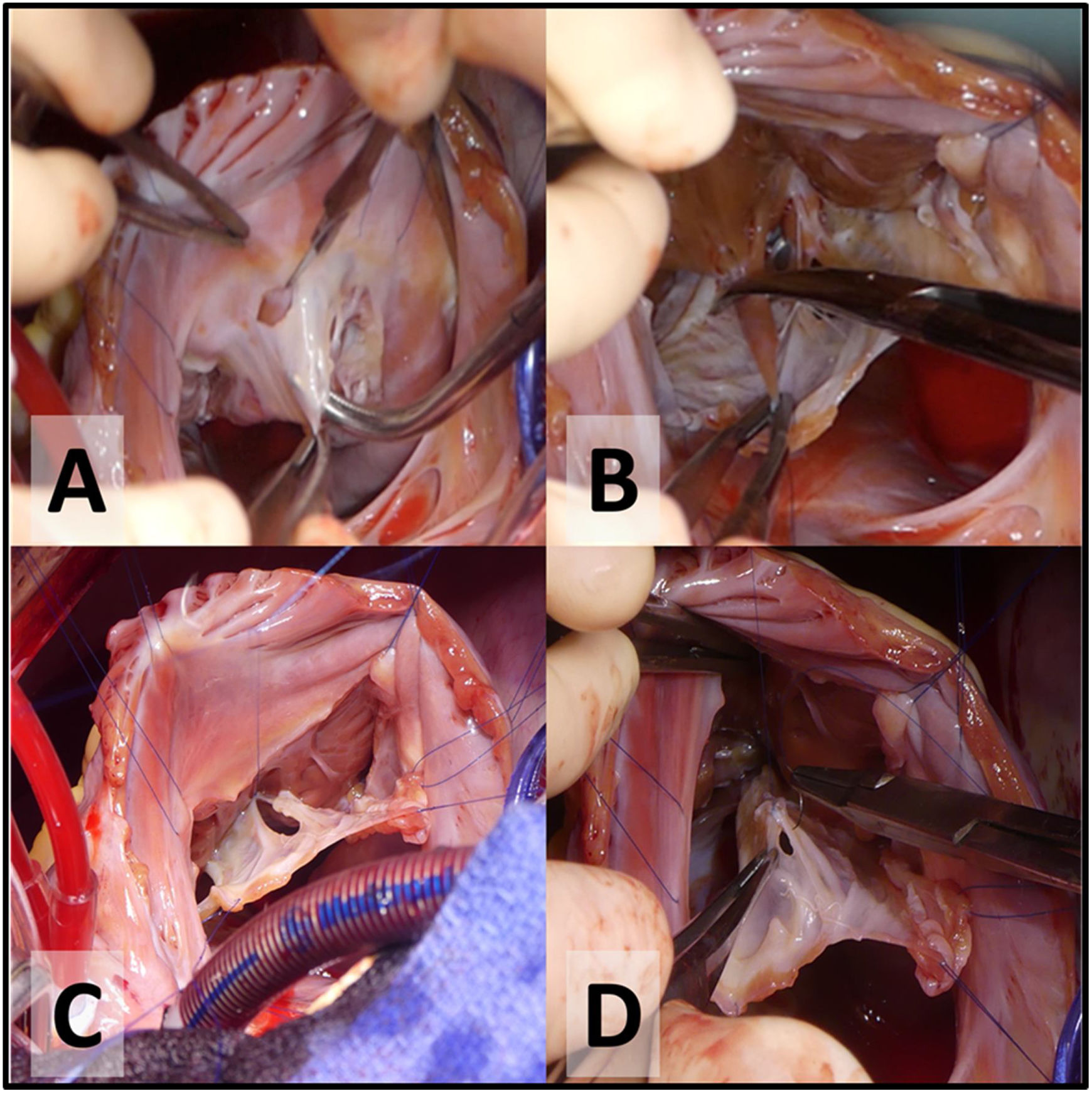
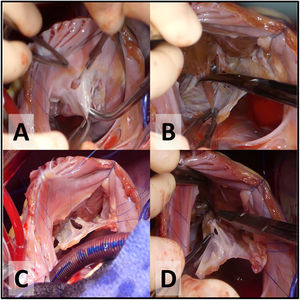
- 4.
Delaminación de la válvula tricúspide. La primera incisión se realiza a la hora 12 en el velo anterior (fig. 1A), a unos pocos milímetros del anillo verdadero. La delaminación quirúrgica es la división de las uniones fibrosas y musculares entre el cuerpo de los velos y la pared libre del VD (fig. 1B). El objetivo consiste en liberar todas las inserciones de la cara ventricular de los velos desde el surco AV hasta el borde libre de los mismos (cerca del ápex del VD) respetando las inserciones a los músculos papilares o aquellas uniones desde el borde libre a la pared ventricular. Las fenestraciones del cuerpo de los velos se cerrarán para configurar un cono (fig. 1C y D).
- 5.
Creación del cono, mediante unión lateral de los 3 velos ya delaminados (fig. 2A).
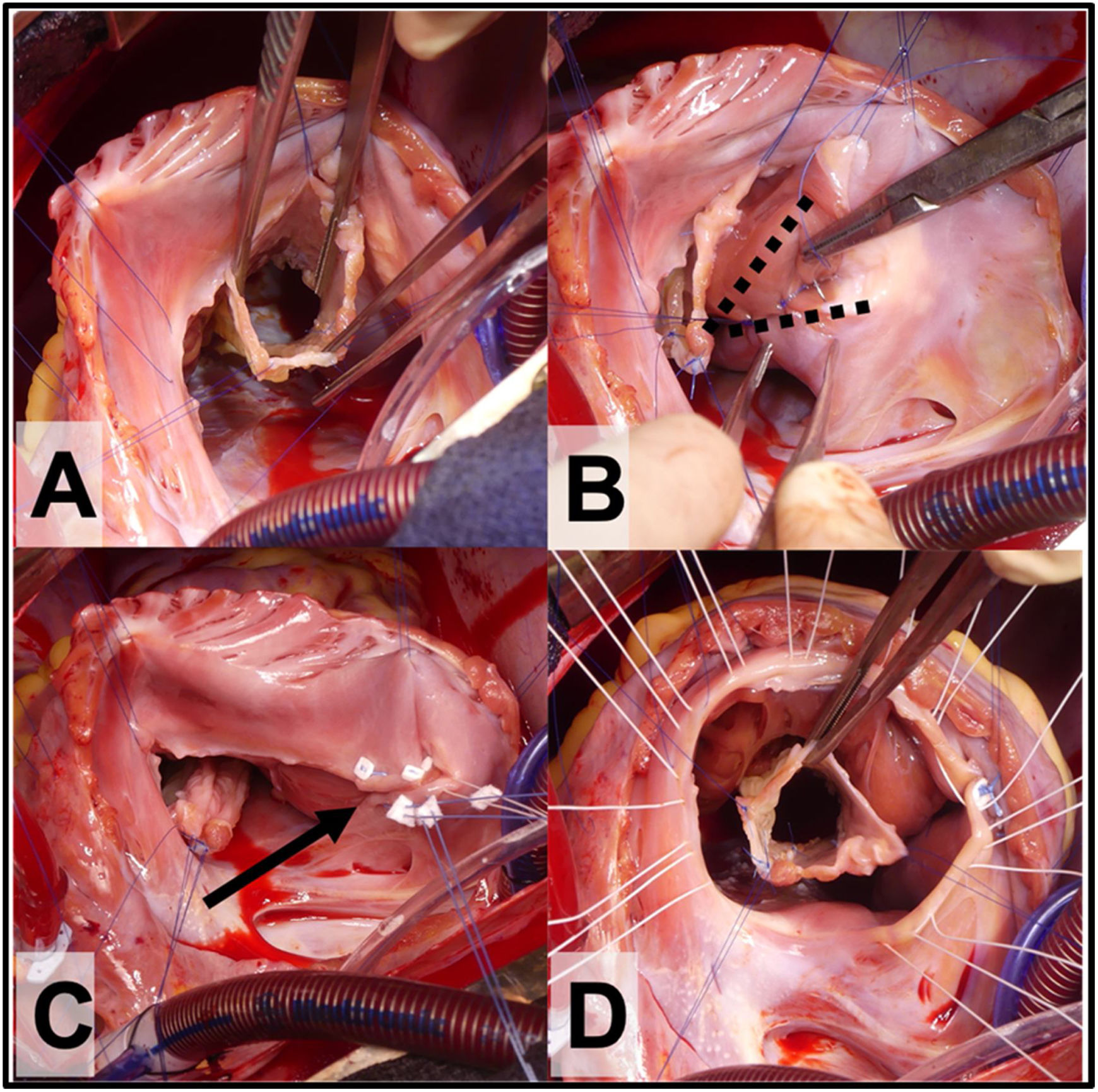
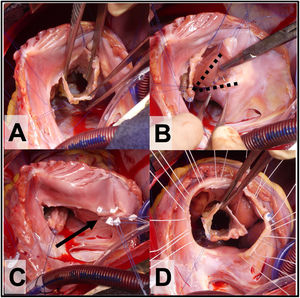
Figura 2.A. Vista del cono con 360° de tejido valvular. B. Plicatura de Carpentier, las líneas punteadas marcan el triángulo de VD no funcional que se excluye con la plicatura. C. Anuloplastia reductora con puntos sueltos (flecha) sobre la línea de la plicatura de la porción auricularizada del VD. D. Se observan los puntos sueltos de sutura a nivel del anillo verdadero que servirán para posicionar el anillo de anuloplastia reductora.
(0,49MB). - 6.
Antes de suturar la neoválvula al anillo verdadero, se examina el VD auricularizado para determinar la necesidad de una plicatura del mismo. Esta plicatura del VD auricularizado (según Carpentier) reduce la tensión de la reparación, disminuye el tamaño del anillo tricuspídeo y elimina VD no contráctil (no funcional). La plicatura se completa con sutura monofilamento no absorbible de 4-0 o 5-0, que se inicia cerca del vértice del VD y se continúa hasta el surco AV (fig. 2C). La línea de sutura es de espesor parcial, incorporando principalmente al endocardio y siempre comprobando el trayecto de la coronaria derecha para evitar lesionarla. Al nivel del anillo verdadero se refuerza la anuloplastia con algunos puntos sueltos apoyados en pledgets (fig. 2B y C). Antes de suturar la neo-válvula tricuspídea “cono” se pasan los puntos de fijación del anillo protésico (fig. 2D).
- 7.
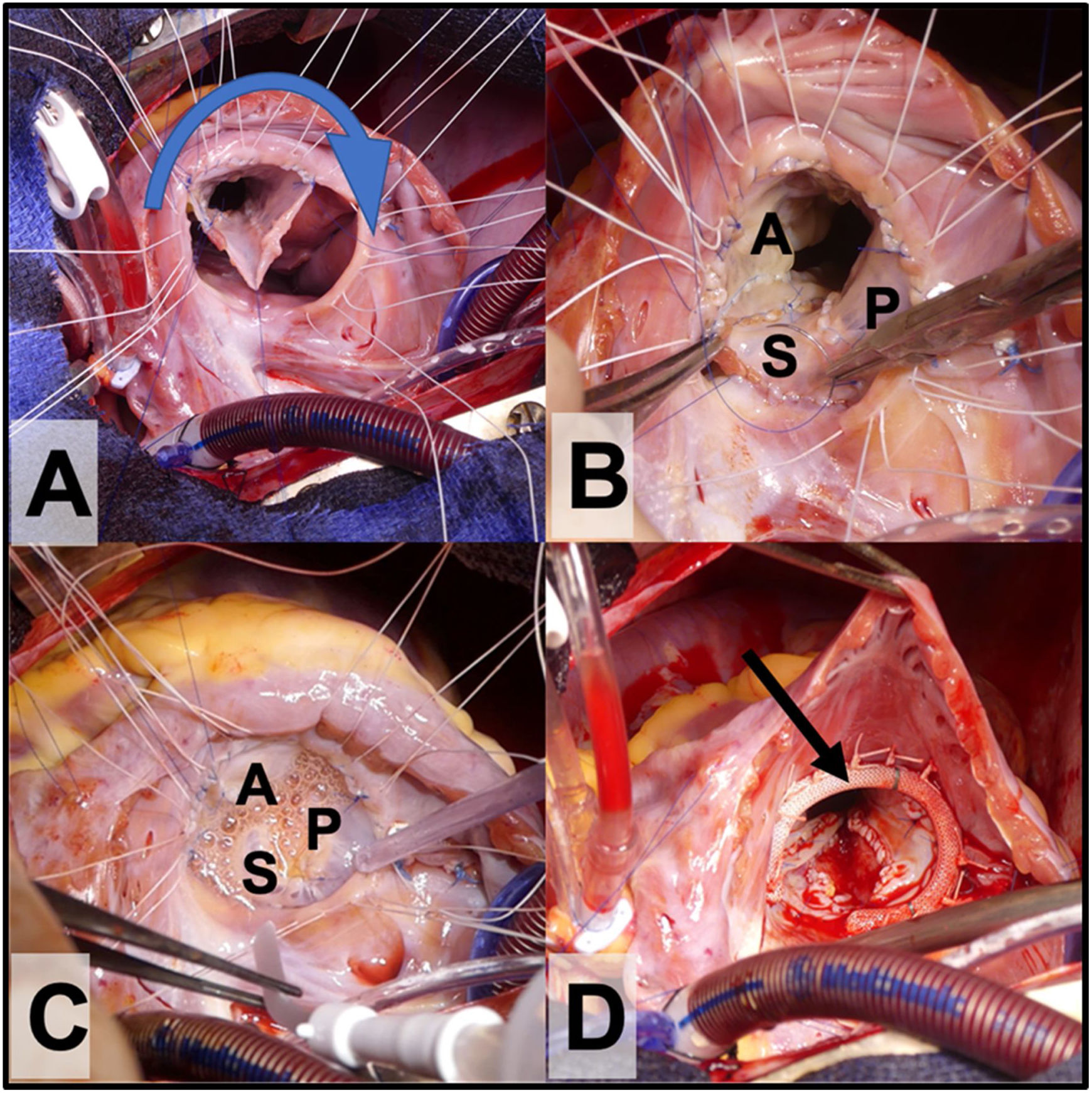
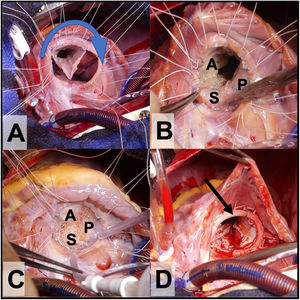
Rotación horaria del tejido valvular y fijación de este al anillo verdadero (con sutura continua o con puntos sueltos). El orificio de la válvula debe estar compuesto por 360° de tejido valvular. El velo septal se reinserta al tabique ventricular (ligeramente más craneal a la vena D y al anillo verdadero para evitar el bloqueo AV), dejando al seno coronario drenando en la aurícula derecha (fig. 3A y B).
Figura 3.A. Reimplante del cono al anillo verdadero con rotación valvular en sentido horario (sentido de la flecha). B. A: velo anterior, P: velo posterior y S velo septal. C. Prueba de competencia valvular con suero salino antes de implantar el anillo protésico tricuspídeo. D. Anillo tricuspídeo parcial semirrígido in situ (flecha).
(0,52MB). - 8.
La reducción del anillo se puede reforzar con una banda (en niños pequeños) o un anillo de anuloplastia (niños mayores y adultos); esto dará más estabilidad al neoanillo (fig. 3D).
- 9.
Finalmente, se prueba la competencia valvular con suero salino (fig. 3C) y se cierra la comunicación interauricular y la auriculotomía derecha.
Para el análisis estadístico se ha utilizado el programa SPSS versión 24. Armonk, NY: IBM Corp). Las variables cuantitativas continuas se presentan como media±desviación estándar. En las variables categóricas se expresa su frecuencia y porcentaje. Las diferencias entre grupos se analizan mediante el test de la t de Student para variables continuas y el test de Chi-cuadrado para las variables categóricas. Para todos los test, el nivel de significación estadística se estableció a partir de una p<0,05.
ResultadosLos 2 neonatos con cirugía inicial de Starnes continuaron por la vía univentricular, ambos se encuentran en situación de Fontan extracardiaco no fenestrado y en clase funcional i de la New York Heart Association.
El grupo de pacientes operados con la técnica del «cono» de Da Silva tenían una media de edad de 9,1±6 años. Los tiempos de circulación extracorpórea y pinzamiento aórtico medios fueron de 182±45min y 135±43min respectivamente. No hubo mortalidad hospitalaria. Como complicaciones postoperatorias, un paciente salió de quirófano en ECMO por disfunción ventricular derecha grave (FEVD preoperatoria por RM del 38%), pudiendo retirarse a los 4 días con función recuperada; este fue el único paciente de la serie a quien se le realizó una derivación cavopulmonar parcial (DCPP) (Glenn bidireccional). No hubo bloqueo AV posquirúrgico (tabla 3). El seguimiento medio fue de 5,5±3 años con una supervivencia del 100%. El ecocardiograma transtorácico de seguimiento demuestra una reducción significativa del grado IT, y desde el punto de vista clínico, la clase funcional también mejoró de forma significativa (tabla 4). No ha habido sustitución valvular tricuspídea inmediata ni en el seguimiento.
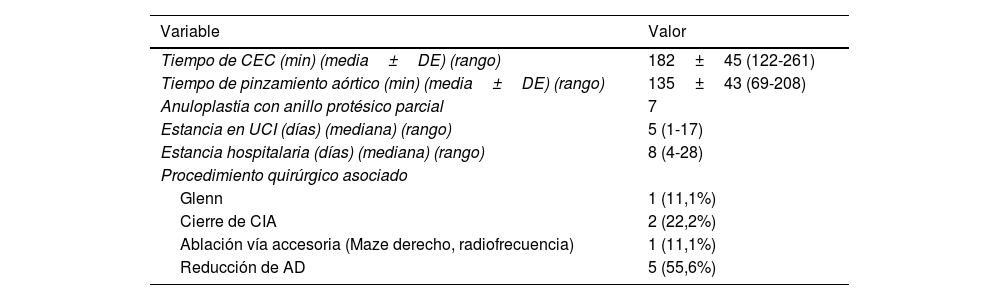
Variables operatorias de los pacientes sometidos a cirugía del cono
| Variable | Valor |
|---|---|
| Tiempo de CEC (min) (media±DE) (rango) | 182±45 (122-261) |
| Tiempo de pinzamiento aórtico (min) (media±DE) (rango) | 135±43 (69-208) |
| Anuloplastia con anillo protésico parcial | 7 |
| Estancia en UCI (días) (mediana) (rango) | 5 (1-17) |
| Estancia hospitalaria (días) (mediana) (rango) | 8 (4-28) |
| Procedimiento quirúrgico asociado | |
| Glenn | 1 (11,1%) |
| Cierre de CIA | 2 (22,2%) |
| Ablación vía accesoria (Maze derecho, radiofrecuencia) | 1 (11,1%) |
| Reducción de AD | 5 (55,6%) |
AD, aurícula derecha; CEC: circulación extracorpórea; CIA: comunicación interauricular; DE: desviación estándar; UCI: unidad de cuidados intensivos.
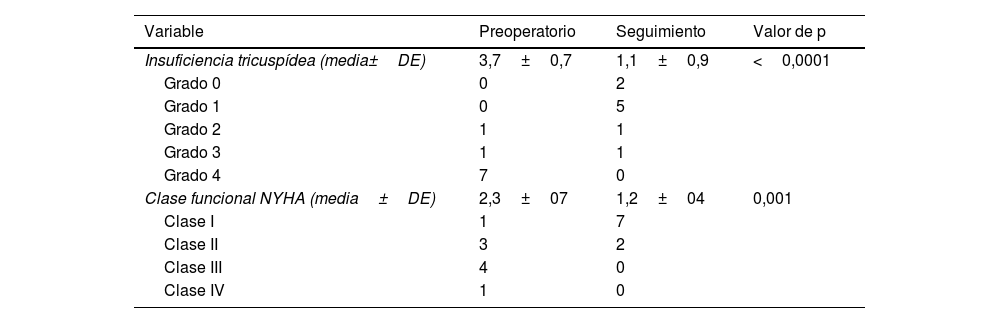
Clase funcional y grado de insuficiencia tricuspídea pre- y postoperatorias (última consulta de seguimiento)
| Variable | Preoperatorio | Seguimiento | Valor de p |
|---|---|---|---|
| Insuficiencia tricuspídea (media±DE) | 3,7±0,7 | 1,1±0,9 | <0,0001 |
| Grado 0 | 0 | 2 | |
| Grado 1 | 0 | 5 | |
| Grado 2 | 1 | 1 | |
| Grado 3 | 1 | 1 | |
| Grado 4 | 7 | 0 | |
| Clase funcional NYHA (media±DE) | 2,3±07 | 1,2±04 | 0,001 |
| Clase I | 1 | 7 | |
| Clase II | 3 | 2 | |
| Clase III | 4 | 0 | |
| Clase IV | 1 | 0 |
DE: desviación estándar; NYHA: New York Heart Association.
Los resultados quirúrgicos del neonato crítico con AE continúan siendo un desafío. Entre las opciones quirúrgicas neonatales se incluyen: 1) la reparación biventricular mediante valvuloplastia tricuspídea, auriculoplastia de reducción y cierre subtotal de la comunicación interauricular o 2) paliación a fisiología univentricular mediante la cirugía de Starnes.
En 2016 Kumar et al.2 publican sus resultados a largo plazo en el manejo del Ebstein neonatal siguiendo la vía univentricular mediante paliación inicial con la cirugía de Starnes modificada. Este abordaje consiste en la exclusión del VD con un cierre con parche fenestrado de la válvula tricúspide, reducción de la aurícula derecha y colocación de una fístula sistémico pulmonar (Blalock–Taussig modificado). Además, ligadura de la arteria pulmonar si hay insuficiencia significativa. Sus resultados a largo plazo para 27 recién nacidos fueron: 22 supervivientes hasta el alta hospitalaria en el primer estadio (no se colocó ninguna fenestración en el parche de la válvula tricúspide en los 3 pacientes iniciales y 2 de ellos murieron). Para aquellos con exclusión del VD fenestrado, la supervivencia a 1, 5 y 10 años fue del 87, 87 y 81%, respectivamente. De los 22 neonatos supervivientes, 20 se sometieron a tratamiento con Fontan con una supervivencia a 1, 5 y 10 años del 95, 95 y 89%, respectivamente. Estos resultados son impresionantes ya que la mayoría (22 de 27 pacientes) tenían atresia pulmonar anatómica o funcional y una puntuación promedio de Great Ormond Street Echocardiography score (GOSE) de 1,4 (1,3-1,8), lo que indica un subgrupo de alto riesgo. Las ventajas del procedimiento de Starnes modificado incluyen: exclusión y descompresión del VD, remodelación del VD en 2 semanas que resulta en un VD más pequeño y preservación de la función normal del ventrículo izquierdo (VI). Kumar et al. establecieron que la fenestración del parche de exclusión es necesaria, pero no la plicatura del VD. La plicatura del VD agrega tiempo al procedimiento sin afectar la remodelación del VD. Los resultados a largo plazo del procedimiento de Starnes modificado en recién nacidos con AE grave son similares a los resultados de otras lesiones complejas que requieren intervención neonatal.
En comparación, Knott-Craig y Goldberg3 mostraron una mejor supervivencia con las técnicas biventriculares aplicadas durante el período neonatal. La operación que describieron incluyó valvuloplastia tricuspídea (usando el velo anterior como monocúspide), auriculoplastia de reducción y cierre subtotal de la comunicación interauricular.
En 2011, Boston et al.4 publicaron su experiencia en reparación biventricular en 32 pacientes pediátricos, 22 eran recién nacidos y 21 tenían una reparación biventricular neonatal con un seguimiento medio de 5,9 años. El seguimiento más largo fue de 16 años. La supervivencia temprana entre los recién nacidos fue del 69,5%, con una muerte tardía. Es de destacar que la supervivencia temprana de los recién nacidos con atresia pulmonar anatómica fue solo del 40%, en comparación con el 90% de los recién nacidos con válvulas pulmonares normales.
En nuestra serie, en ambos neonatos optamos por la vía univentricular desde el inicio. Las características anatómicas y clínicas de estos hicieron imposible cualquier intento de reparación valvular para mantener una fisiología biventricular. En el neonato 1 con GOSE score grado 3 (ratio 1,4) y morfología tipo D de Carpentier, la mortalidad esperada con cianosis importante en paciente inestable era cercana al 100% (Celemajer 1992). Por otro lado, el neonato 2, aunque con anatomía valvular y del VD algo más favorable (morfología tipo C de Carpentier y una ratio de GOSE score de 0,8) la situación de hiperaflujo pulmonar y bajo gasto cardiaco, recordando que tenía 2kg de peso y una comunicación interventricular grande apical, también condicionaron la selección de una cirugía paliativa de Starnes.
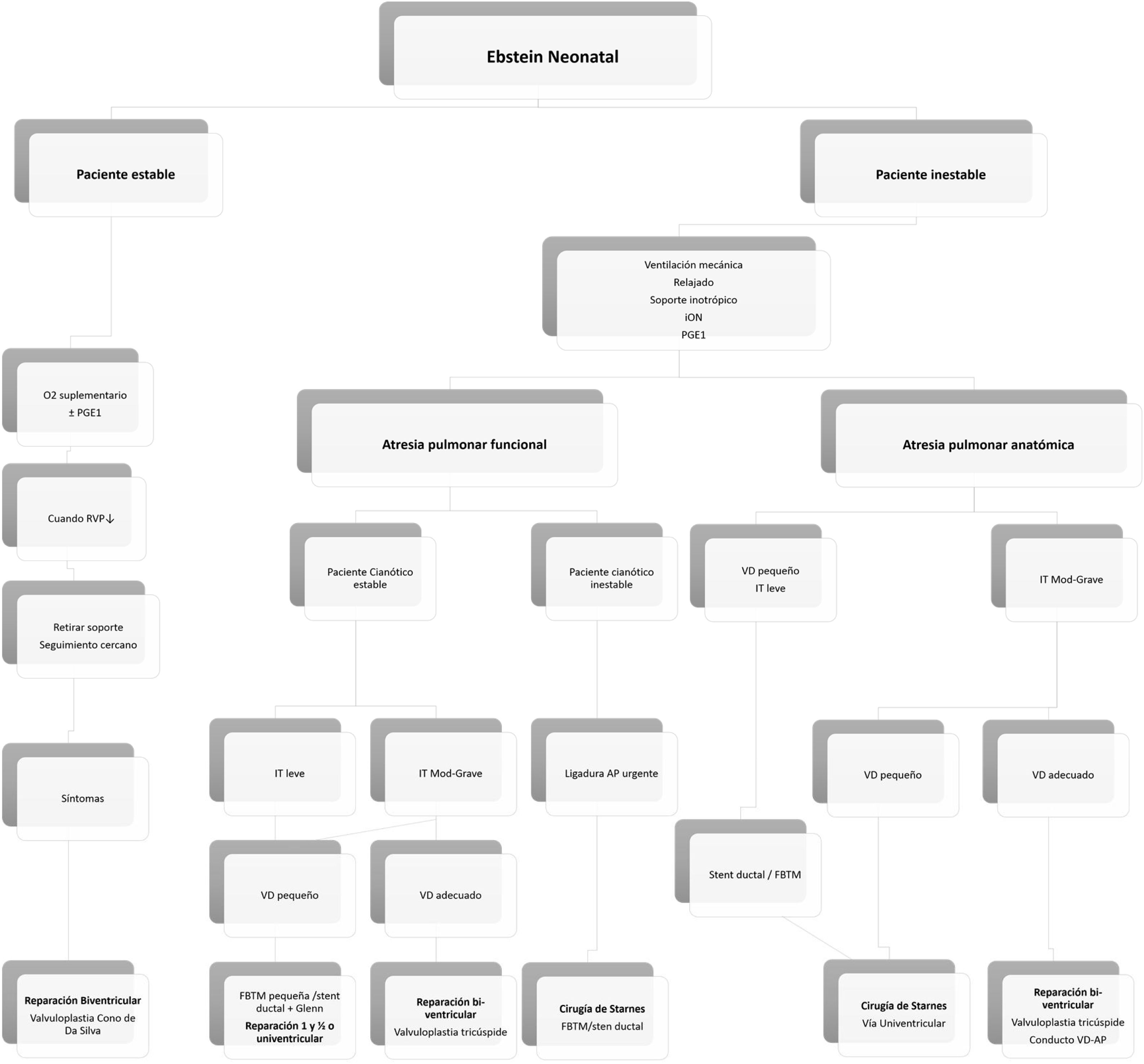
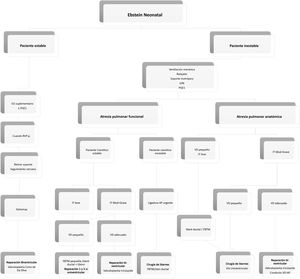
Toma de decisiones en la anomalía de Ebstein neonatalEn la figura 4 (algoritmo), resumimos nuestra conducta en la actualidad para el manejo de este grupo de pacientes.
Algoritmo. Manejo de neonatos con diagnóstico de AE. FBTM: fístula de Blalock-Taussig modificada; iON: óxido nítrico inhalado; IT: insuficiencia valvular tricuspídea; PGE1: prostaglandina; RVP: resistencias vasculares pulmonares; VD: ventrículo derecho; VD-AP: ventrículo derecho-arteria pulmonar; Instituto pediátrico del corazón. Hospital Universitario 12 de Octubre. Madrid.
Desde los primeros intentos de reparación a finales de la década de los 50 y principios de los 60, la cirugía sobre esta patología sigue representando un reto para el cirujano cardiaco5,6. Con el tiempo se han desarrollado diferentes técnicas para reparar la válvula tricúspide y recuperar su competencia, entre ellas la de Danielson7, Carpentier8, Quaegebeur9, Da Silva10; sin embargo, los mejores resultados en términos de mortalidad operatoria, recidiva de la IT y necesidad de sustitución valvular en la evolución se reportan a favor de la cirugía de «cono» de Da Silva10,11.
En pacientes seleccionados, la DCPP o Glenn bidireccional permite redirigir parte del retorno venoso sistémico desde un VD disfuncionante al pulmón, manteniendo un flujo pulsátil. Con este gesto quirúrgico añadido a la valvuloplastia tricuspídea, se logra reducir hasta un 30% el trabajo del VD12.
La hipertensión pulmonar es rara en la AE, por lo que el Glenn es generalmente factible incluso en el contexto de disfunción del VI (fracción de eyección del VI 35-40%). Sin embargo, en el marco de hipertensión pulmonar o enfermedad de las válvulas del lado izquierdo, la DCPP debe usarse con precaución.
La decisión de asociar una derivación cavopulmonar a la cirugía tricuspídea puede ser preoperatoria o intraoperatoria. El Glenn debería considerarse (preoperatoriamente) en pacientes cianóticos en reposo, ya que este hallazgo representa un marcador indirecto importante de disfunción crónica del VD. Aquellos pacientes con cianosis solo durante el ejercicio deberían ser evaluados en quirófano: una presión venosa central 1,5 veces superior a la presión de la aurícula izquierda a la salida de la circulación extracorpórea indica cierta incapacidad del VD para manejar adecuadamente un gasto pulmonar completo, y por lo tanto habría indicación para la realización del Glenn. Por otro lado, la medición del tamaño del anillo tricuspídeo puede ayudar en la toma de decisiones a la hora de indicar el Glenn en pacientes con algún grado de disfunción sistólica del VD. Si es necesario reducir el anillo más del Z-score 0 para conseguir una válvula competente o el ecocardiograma transesofágico muestra cierta estenosis de la válvula después de la reparación (gradiente medio>8-10mm Hg), el Glenn está indicado.
En contrapartida, contraindican una DCPP; la hipertensión pulmonar (presión arterial media>a 20mm Hg), resistencias pulmonares arteriolares>4 unidades Woods, y presión telediastólica del VI o presión de la aurícula izquierda>12mm Hg.
El grupo de la Clínica Mayo (2014) reporta una incidencia de Glenn del 19,4% (64 de 319 pacientes) para pacientes operados con AE13, y la indicación más frecuente fue la disfunción del VD.
En nuestra serie la incidencia de la DCPP es de un 11%, algo inferior a la de la Clínica Mayo, sin embargo, y al igual que ellos, la disfunción crónica preoperatoria del VD fue el determinante de la indicación.
Los pacientes asintomáticos pueden tratarse médicamente y permanecer bajo seguimiento estrecho cardiológico durante años. Se debe prestar especial atención a aquellos pacientes que desarrollen: arritmias, dilatación progresiva del VD, y/o deterioro de su función sistólica. Se debe considerar la cirugía cuando aparezcan síntomas, empeoramiento de la clase funcional, cianosis, embolia paradójica, dilatación o disfunción progresiva del VD, aparición de arritmias y cuando la reparación tricúspide es factible en un entorno de baja morbimortalidad.
En la serie más grande publicada de resultados quirúrgicos tardíos para AE, la supervivencia tardía general fue del 98, 94, 90, 86 y 76% a 1, 5, 10, 15 y 20 años, respectivamente. La ausencia de reoperación tardía fue del 97, 91, 82 y 70% en 1,5, 10 y 15 años, respectivamente14.
Los resultados a largo plazo de la reconstrucción del cono son limitados debido a la aplicación relativamente reciente de esta estrategia quirúrgica; sin embargo, la libertad de reoperación específica del adulto después de la reconstrucción del cono a los 6 años es del 98,8%15.
Los resultados de nuestra serie con el uso de la técnica descrita por Da Silva, aunque es pequeña y con seguimiento solo a medio plazo, son muy comparables a los publicados por otros centros con más volumen. En la actualidad hemos adoptado esta técnica como primera opción para el manejo quirúrgico de la AE.
ConclusionesLa reconstrucción del cono permite una reparación más anatómica y podemos considerarla de elección en pacientes más allá del período neonatal. En nuestra serie, los resultados a corto y medio plazo son excelentes y los resultados tardíos en literatura son alentadores.
El manejo inicial para neonatos críticamente enfermos con AE es fundamentalmente médico, debe evitarse la circulación extracorpórea; sin embargo, cuando es necesario, el procedimiento de Starnes puede proporcionar excelentes resultados y puede ser preferible a una reparación biventricular, sobre todo para aquellos pacientes más complejos, o cuando se disponga de experiencia limitada en técnicas de valvuloplastia tricuspídea del recién nacido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Consideraciones éticasSe obtuvo la aprobación del estudio por parte del Comité de Ética de la Investigación con medicamentos (CEIm) del Hospital Universitario 12 de Octubre. Los autores cuentan con el consentimiento informado de los padres de los pacientes para la publicación de este trabajo.
El artículo forma parte del monográfico del grupo de cardiopatías congénitas titulado Reparación y reconstrucción valvular en pacientes con cardiopatía congénita: ingenio, arte, técnica y resultados’.