Introducción
El dolor es uno de los síntomas más frecuentes de las personas afectadas por un cáncer y una de sus principales causas de sufrimiento. Lo sufre hasta un 30% de los pacientes en el momento del diagnóstico y el 80% en fases finales de la enfermedad.
El tratamiento farmacológico, combinado con medidas físicas y psicosociales, y las técnicas invasivas cuando sean precisas son las principales armas terapéuticas. Con su uso puede conseguirse un control satisfactorio del dolor en la mayor parte de los pacientes.
Concepto de dolor y síndromes dolorosos
Una lesión en los tejidos causa dolor, entendido como una experiencia subjetiva que depende de las características de la persona que lo experimenta. La máxima expresión de la integración de las dimensiones físicas, psíquicas y sociales del dolor acontece en las personas con cáncer en fase terminal, una situación de «dolor total»1,2.
El diagnóstico del dolor debe comprender el tipo de síndrome doloroso, la causa, la intensidad del dolor y las complicaciones asociadas. Se realiza con la historia clínica y la exploración, aunque en algunos casos, como en el dolor óseo y en el neuropático, se puede precisar estudios de imagen. En la tabla 1 se describen los diferentes síndromes dolorosos, según su mecanismo causal, el órgano afectado y su forma de presentación. El reconocimiento del tipo de dolor es imprescindible para la selección de la mejor opción terapéutica. El paciente puede tener además dolor de origen no oncológico, que también se debe tratar.
La intensidad del dolor se determina con la información del paciente, recogida en las escalas de intensidad (tabla 2). Éstas permiten conocer el grado de dolor en ese momento y comprobar la respuesta al tratamiento. La gravedad del dolor debe ser valorada, además, en función de su repercusión en la vida diaria.
Según las características del paciente y del dolor, éste se clasifica en 3 niveles (I a III, donde III es la peor graduación), con valor predictivo de las dificultades para obtener un control óptimo3-5. Aunque no existe una definición generalizada del dolor de difícil control, se puede considerar como el que no responde a diversas intervenciones terapéuticas, como el uso de dosis elevadas de opiáceos combinados con coanalgésicos. Las dosis previas de morfina, u otros opiáceos, no son indicadoras de mal pronóstico del adecuado control del dolor3-5. Sí lo son la adicción activa o reciente a alcohol y/o drogas, las psicopatías, la alteración de las funciones cognitivas, el dolor neuropático y el dolor incidental.
Tratamiento del dolor oncológico crónico. Aspectos generales
El tratamiento se basa en el uso de los analgésicos según su eficacia. Ésta es la cantidad de efecto que se puede conseguir con un fármaco dado y guarda relación con que haya un techo analgésico. Los opiáceos mayores no lo tienen y son los analgésicos más eficaces. El incremento de la dosis siempre conlleva un aumento de la analgesia.
La eficacia general del tratamiento depende, además, de: a) que se pauten los fármacos en relación con la duración de su efecto; b) la adecuada selección del analgésico y sus dosis según la intensidad y las características del dolor, y c) la revaluación continua. Las directrices generales al respecto están descritas en la tabla 3.
Los opiáceos son la mejor arma terapéutica para el control del dolor oncológico, aunque no todos los síndromes dolorosos responden igual. Los que tienen un componente neuropático suelen presentar diversos grados de resistencia y es preciso añadir un coanalgésico. Otras posibilidades terapéuticas en el tratamiento del dolor oncológico son la radioterapia paliativa, la vertebroplastia y la administración epidural de analgésicos. No se dispone de una información amplia sobre la eficacia de la neuroestimulación eléctrica transcutánea y la acupuntura como para recomendar su uso generalizado en el tratamiento del dolor de las personas con cáncer en fase terminal.
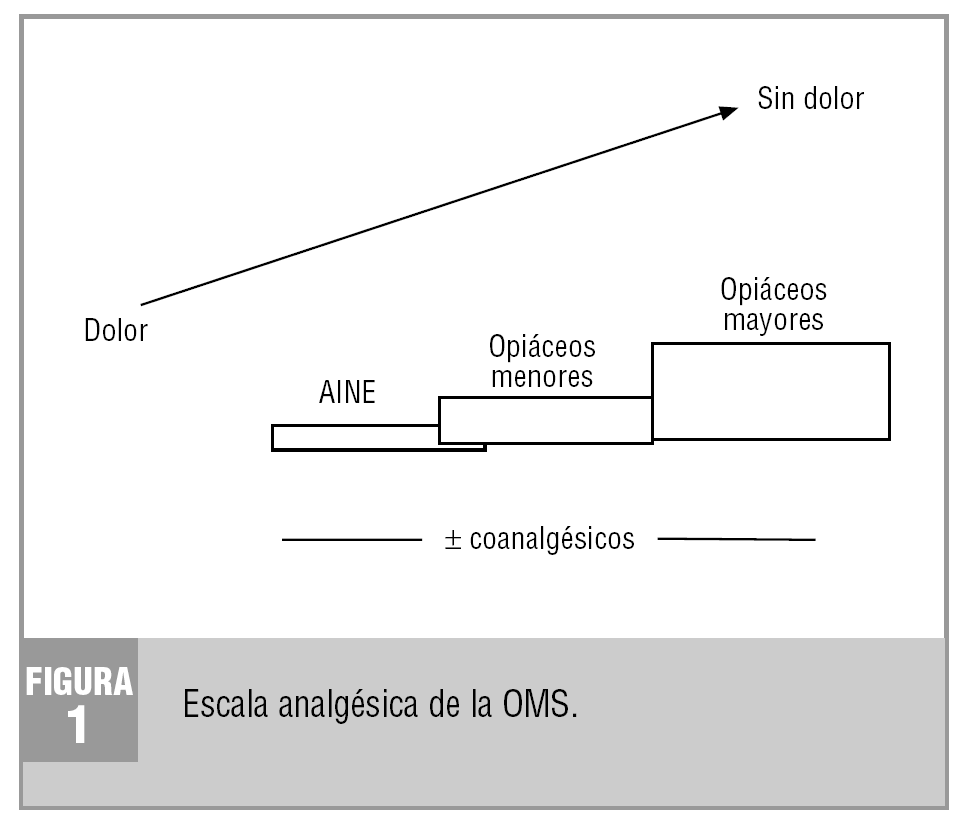
Tratamiento del dolor oncológico. Utilización de la escala analgésica de la OMS
Para el tratamiento del dolor oncológico se siguen las directrices de la escala analgésica de la OMS (fig. 1), que ya se indican en otro trabajo. Éstas definen la secuencia del tratamiento en relación con la intensidad del dolor y la eficacia de los analgésicos. Debe entenderse que: a) la utilización de un escalón terapéutico obedece a la ineficacia de los fármacos previos en el control completo del dolor; b) se debe usar los analgésicos pautados y de forma continua para conseguir una situación basal de ausencia de dolor; c) se debe agegar un coanalgésico si el dolor es neuropático, y d) las dosis de los opiáceos del tercer escalón deben incrementarse gradualmente hasta obtener un control completo del dolor, y no tienen límite de dosis6-8.
Uso de los antiinflamatorios no esteroideos en el control del dolor oncológico
Se corresponde con el primer escalón de la escala analgésica de la OMS. Los antiinflamatorios no esteroideos (AINE) son eficaces en el control del dolor de intensidad leve. No hay evidencia de que combinarlos con los opiáceos, del segundo o tercer escalón de la escala analgésica, aumente la eficacia analgésica9,10. Están especialmente indicados, solos o combinados con los opiáceos, en el tratamiento del dolor por metástasis óseas, afección hepática y tenesmo vesical y rectal10.
No se dispone de datos que muestren que un AINE sea más efectivo que otro en el control del dolor. La selección del AINE se realiza en función de su menor efecto gastrolesivo, la comodidad de su posología y su coste. El uso de inhibidores selectivos de la ciclooxigenasa sólo está justificado en pacientes con riesgo elevado de daño gastroduodenal por AINE.
Uso de los opiáceos menores en el control del dolor oncológico
Los opiáceos menores son eficaces en el control del dolor moderado, y constituyen el segundo nivel de la escala analgésica de la OMS. De ellos destacan por su extendido uso la codeína, la dihidrocodeína y el tramadol. El tramadol es más eficaz que los otros y produce menos estreñimiento, pero tiene mayor incidencia de vómitos entre las personas mayores11.
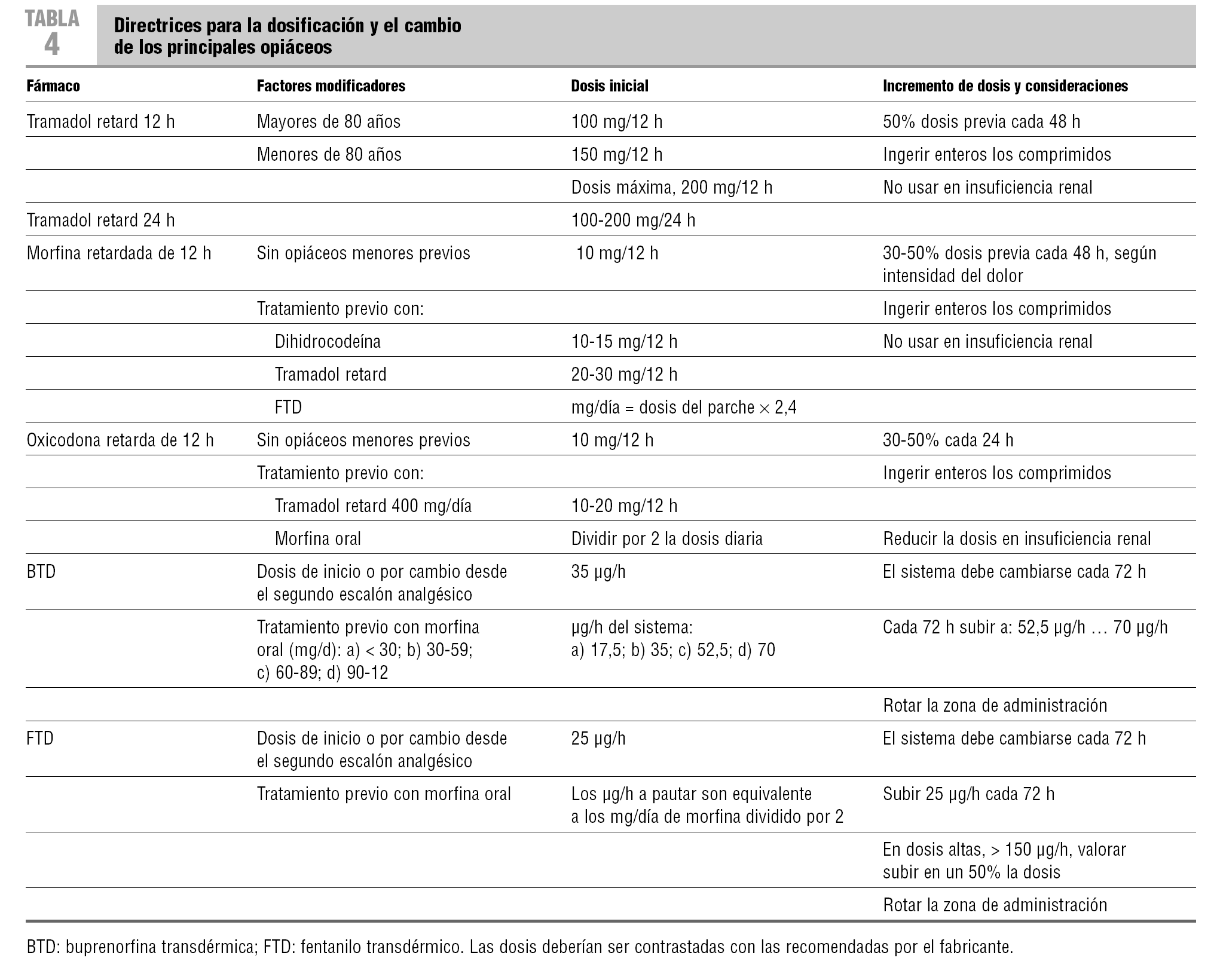
El tramadol es un agonista opiáceo débil, que modifica la actividad serotoninérgica y noradrenérgica de las vías nerviosas descendentes moduladoras del dolor. Presenta efectos secundarios similares a los de los opiáceos, pero con menor intensidad, y un muy bajo riesgo de depresión respiratoria. En la insuficiencia renal se debe reducir las dosis o evitar usarlo. Puede interaccionar con los inhibidores selectivos de la recaptación de serotonina (IRSS), por inhibición de su metabolismo hepático11. Se puede usar por vía oral, subcutánea o intravenosa, con una relación entre las dosis11 de 1:1. Se deberá sustituir por los opiáceos mayores cuando no se obtenga un control óptimo del dolor. La sustitución se realizará según sus dosis equianalgésicas (en la tabla 4 se describen los aspectos prácticos del cambio).
Uso de opiáceos mayores en el control del dolor de origen neoplásico
La morfina, la oxicodona, el fentanilo transdérmico y la metadona son igual de eficaces en el control del dolor12, y sus dosificaciones están descritas en la tabla 4. La selección de uno u otro depende de la dificultad para la ingesta oral, el coste del fármaco o la necesidad de realizar un cambio de opiáceo para obtener una mejor relación entre la eficacia y los efectos secundarios.
La morfina sigue considerándose el opiáceo de elección12. Está disponible en formulaciones para su administración: a) oral de liberación rápida y sostenida, y b) parenteral, por vía subcutánea (s.c.), intravenosa (i.v.) e intramuscular. La relación entre las dosis orales y s.c. es 2:1, y con la vía i.v., 3:1. El efecto se inicia, aproximadamente, a los 10-15 min de la administración i.v., a los 20-30 min por vía s.c., a los 45-60 min con las formulaciones orales de liberación rápida, y a las 4-5 h con las de liberación sostenida. La duración del efecto es de 4-6 h para las formulaciones parenterales y orales de liberación rápida, y de 8-12 h para las de liberación sostenida.
La oxicodona se comercializa en comprimidos, con los que presenta una liberación bifásica: una primera liberación rápida del fármaco, que hace que el efecto comience a partir de los 60-90 min, y una segunda liberación, lenta y sostenida, que hace que el efecto se mantenga al menos 12 h. Ello permite titular de forma rápida por vía oral, cada 24 h, la dosis eficaz para el control del dolor13. Presenta menor incidencia de alucinaciones, náuseas y prurito que la morfina. Puede interaccionar con los IRSS, en cuyo caso aparece una disminución de la acción de la oxicodona o se incrementa el riesgo de un síndrome serotoninérgico13.
Las características lipofílicas del fentanilo y de la buprenorfina han permitido su comercialización en presentaciones de aplicación transdérmica. El analgésico se libera desde el sistema de aplicación de forma continua, se acumula en el tejido subcutáneo, y de ahí pasa al torrente sanguíneo. Se constituye así un sistema de administración transdérmica continua de los fármacos. Por esta vía, no obstante, se produce un retraso en obtener el efecto analgésico inicial, entre 12-18 h, dependiente del tiempo necesario para que el fármaco alcance las concentraciones plasmáticas eficaces. Por eso no es una vía adecuada para obtener un rápido control del dolor. Por otro lado, la eliminación del analgésico acumulado en la dermis, una vez retirado el sistema de administración, también es lenta, lo que puede causar situaciones de sobredosificación cuando se sustituye los analgésicos transdérmicos por otros de acción rápida14,15.
En ocasiones, el cambio de morfina oral a fentanilo transdérmico (FTD) puede mejorar una situación de estreñimiento pertinaz que no responde a laxantes. Durante el cambio de morfina a FTD, puede producirse un descontrol pasajero del dolor hasta que el FTD sea efectivo, por lo que es preciso utilizar dosis extra de morfina de liberación rápida. El FTD es una buena alternativa en caso de insuficiencia renal.
Está en controversia que la eficacia analgésica de la buprenorfina transdérmica (BTD) sea igual que la de los otros opiáceos mayores en el control del dolor oncológico. Aunque en animales se ha objetivado que hay techo analgésico, éste no está demostrado en humanos16. La BTD es una buena opción en pacientes con dolores moderados y alteraciones de la ingesta, pero su papel como alternativa a los otros opiáceos mayores no está aún bien definido16.
Las formulaciones transdérmicas son especialmente útiles para asegurar el tratamiento del dolor en los últimos días de la vida cuando no se tiene acceso a los sistemas de perfusión subcutánea continua de fármacos. Se selecciona la BTD o el FTD según la intensidad del dolor.
La metadona se utiliza como alternativa en dolores intensos que no han respondido a otros opiáceos o en situaciones de toxicidad opiácea. Su utilización es compleja, con riesgo de intoxicación por su prolongada vida media y la variabilidad interindividual de la dosis de conversión desde los otros opiáceos15,17. Ello determina la recomendación de que los cambios de opiáceos en los que se introduce la metadona sean realizados por profesionales con amplia experiencia en el control del dolor.
Cambio de opiáceos
Ésta es una alternativa terapéutica para mejorar la relación entre la eficacia analgésica y la aparición de efectos secundarios del tratamiento opiáceo. Sus indicaciones son17: a) el dolor pertinaz; b) la situación de dosis límite por la aparición de efectos secundarios que dificultan el aumento de la dosis en una situación de dolor no controlado, y c) la aparición de efectos secundarios intolerables, especialmente el síndrome de neurotoxicidad opioide, que aparece por exposiciones prolongadas a dosis altas de opiáceos y consiste en delirio, alucinaciones táctiles y mioclonías, de forma aislada o conjunta7,17.
El mecanismo íntimo por el que el cambio de opiáceos mejora la analgesia es desconocido. Se postula que guarda relación con la presencia de tolerancia farmacológica incompleta entre los opiáceos, y con modificaciones en la regulación o la expresión de los receptores opiáceos17.
Las dosis de conversión entre opiáceos son: a) morfina oral/día, fentanilo transdérmico 100:1; b) oxicodona oral, morfina oral 2:1; c) metadona, morfina 1:10, y d) morfina oral/día, BTD 60-70:1. En la tabla 4 se describen los aspectos prácticos de la sustitución de opiáceos.
Consideraciones sobre los mitos de los opiáceos18
El uso de los opiáceos mayores debe iniciarse cuando no se controle el dolor con los analgésicos del segundo escalón. Que los opiáceos mayores no tengan techo analgésico hace que todo incremento de dosis conlleve un incremento de la analgesia, por lo que retrasar su uso no está justificado. El incremento de los estímulos dolorosos causados por la evolución del tumor es la principal justificación de la necesidad de aumentar las dosis con el tiempo.
El riesgo de depresión respiratoria con el uso de los opiáceos de liberación sostenida es muy bajo, incluso en los pacientes con cáncer de pulmón y disnea. El desarrollo de adicción no debería ser considerado como un problema, la evolución continua del cáncer hace prácticamente excepcional que se pueda prescindir de la analgesia aportada por los opiáceos.
No son de esperar efectos disfóricos (como alucinaciones o alteraciones del comportamiento) durante su uso prolongado. Hay que descartar trastornos metabólicos o afección tumoral del sistema nervioso central como primera causa. Si se sospecha la implicación de los opiáceos en esas complicaciones, el paciente debería ser remitido a una unidad especializada para la valoración de un cambio de opiáceo.
Control de los efectos secundarios de los opiáceos
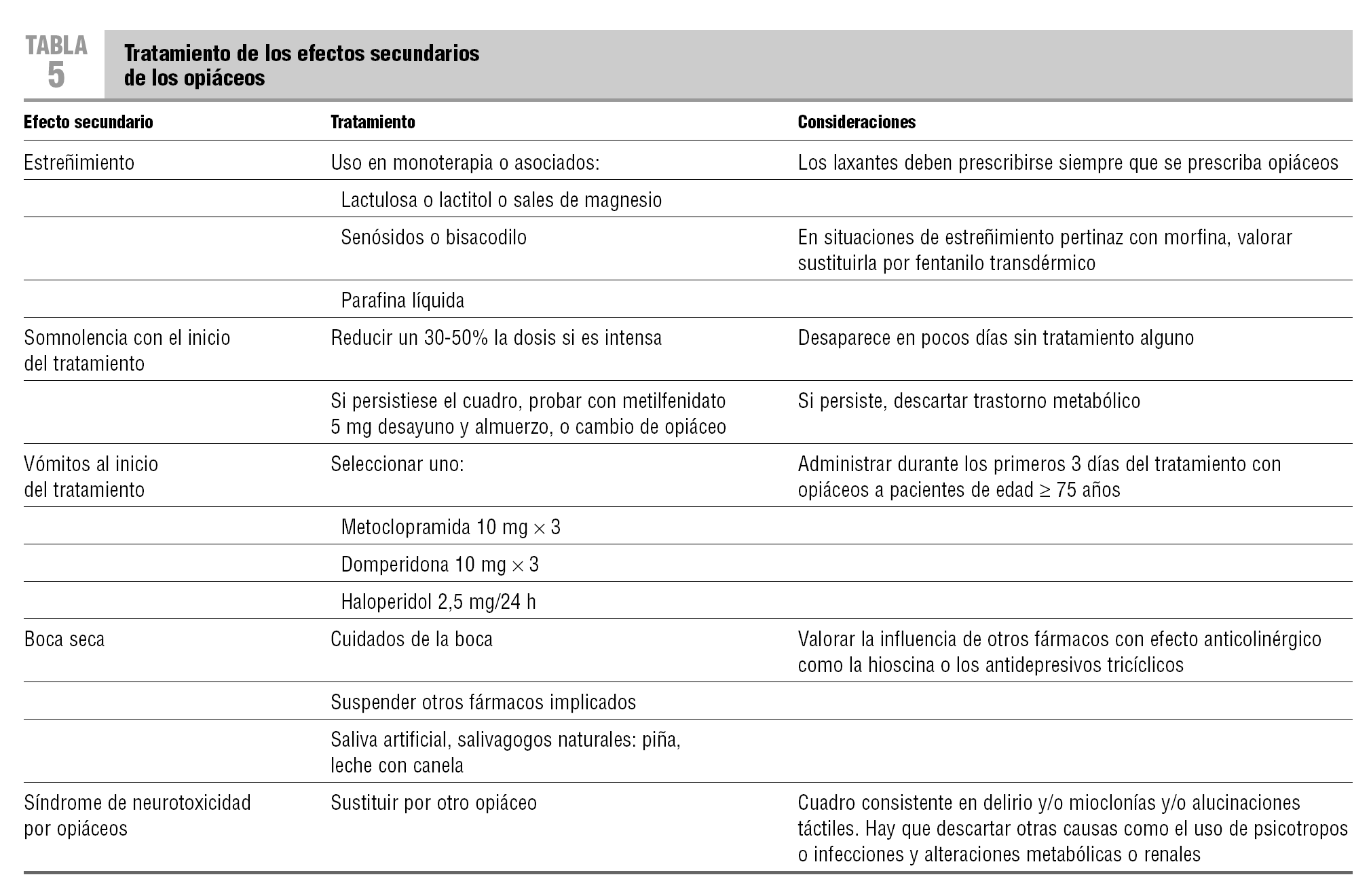
Se puede y hay que evitar algunos de los efectos secundarios de los opiáceos. Especialmente susceptibles a ello son el estreñimiento y los vómitos al inicio del tratamiento en las personas mayores. La tabla 5 recoge las directrices generales para la corrección de los efectos secundarios más frecuentes7,8,18.
Controversias sobre la utilización de la escala analgésica de la OMS
La escala analgésica de la OMS fue desarrollada para mejorar el control del dolor oncológico. Las controversias respecto a su aplicación derivan de las observaciones que muestran la ausencia de un efecto aditivo analgésico con la asociación de AINE a los opiáceos, las dudas de la mayor eficacia de los opiáceos menores respecto a los AINE y los adecuados resultados que se obtienen con el uso temprano de dosis bajas de morfina en pacientes no tratados con fármacos del segundo escalón analgésico10,19. La propuesta sería la utilización de 2 escalones analgésicos, los AINE para el dolor leve y los opiáceos mayores para el dolor que no responde a los AINE10,19. Retardar la aparición de los efectos secundarios, fundamentalmente somnolencia y estreñimiento, es una de las principales razones para seguir graduando el uso de los analgésicos en las 3 líneas clásicas8. Otra de las razones es que se desconoce el efecto y las consecuencias de aplicar la escala analgésica de sólo 2 escalones en las personas mayores.
Tratamiento del dolor irruptivo o incidental
Se realiza con la administración de dosis analgésicas de rescate, o sea, dosis extra de analgésicos. Se deben utilizar fármacos de liberación rápida, que tarden poco en conseguir el efecto analgésico. Por vía oral se han venido usando de forma empírica la morfina y la oxicodona de liberación rápida. En la actualidad, se dispone, además, del citrato de fentanilo transmucosa oral (CFTO), que es el único opiáceo del que se dispone de datos, procedentes de un metaanálisis, que muestran su eficacia analgésica específica en el dolor irruptivo20. Por otro lado, ha de considerarse que el efecto analgésico del CFTO se presenta con mucha mayor rapidez, entre 45 y 60 min antes, que el de los opiáceos con formulación oral.
Las dosis de rescate propuestas de morfina u oxicodona son el 5-10% de la dosis total diaria. Se pueden repetir a los 45-60 min si no se ha controlado el dolor.
El CFTO se absorbe rápidamente por la mucosa oral, y se obtiene el efecto en tiempos cercanos al de la morfina i.v., 10-15 min, y mantenido durante al menos 4 h. Su dosis debe titularse en cada paciente, y no se puede determinar a priori, pues no guarda relación con la dosis total de opiáceos que el paciente esté tomando. Las dosis presentes en el mercado son de 200, 400, 600, 800, 1.200 y 1.600 µg. Sus características lo hacen especialmente recomendable en situaciones en que los episodios dolorosos sean muy mal tolerados, como por ejemplo los que limitan la vida social o alteran el descanso nocturno, y los que se presentan en jóvenes y en pacientes con depresión.
El control del dolor incidental se basa en el uso de dosis de rescate antes de que acontezca la situación que desencadena el dolor; por ejemplo, antes del aseo o de un esfuerzo. La dosis de rescate se administrará tanto tiempo antes como tarde el analgésico en alcanzar su máximo efecto. Así, la morfina oral se administra 60 min antes y el CFTO, unos 20-30 min antes.
Tratamiento del dolor neuropático
Ante la aparición de un dolor neuropático, hay que descartar una lesión reversible del sistema nervioso, como la compresión medular, de plexos nerviosos o de los nervios periféricos. El tratamiento de elección es la radioterapia, con fines de disminuir el daño del sistema nervioso causado por el tumor. La irradiación paliativa es efectiva cuando la evolución del cuadro no supera las 72 h. Una vez instaurado el tratamiento específico o cuando la aplicación no es posible, se administra el tratamiento farmacológico.
Estudios recientes muestran que el dolor neuropático, generalmente secundario a lesiones benignas, puede responder a los opiáceos y que la combinación de un opiáceo y un coanalgésico permite obtener una adecuada eficacia con dosis bajas de opiáceos21-23. No obstante, la experiencia acumulada en cuidados paliativos muestra que el dolor neuropático de origen maligno suele ser resistente a los opiáceos. Una conducta terapéutica adecuada sería, por tanto, usar los opiáceos en los pacientes sin tratamiento previo, y agregar coanalgésicos si no remite el dolor o cuando aparece en pacientes que ya están con opiáceos24.
El uso de los coanalgésicos
Se llama así a los fármacos que carecen de efecto analgésico per se, aunque lo manifiestan en determinados cuadros dolorosos. El inicio de su efecto analgésico es tardío, entre 7 y 21 días después de que se ha conseguido la dosis eficaz del fármaco. Se debería considerar la falta de respuesta al tratamiento instaurado un criterio para remitir al paciente a una unidad especializada. Si ello no fuera posible, se debe intentar conseguir una situación de analgesia cambiando de fármaco o combinando 2 coanalgésicos.
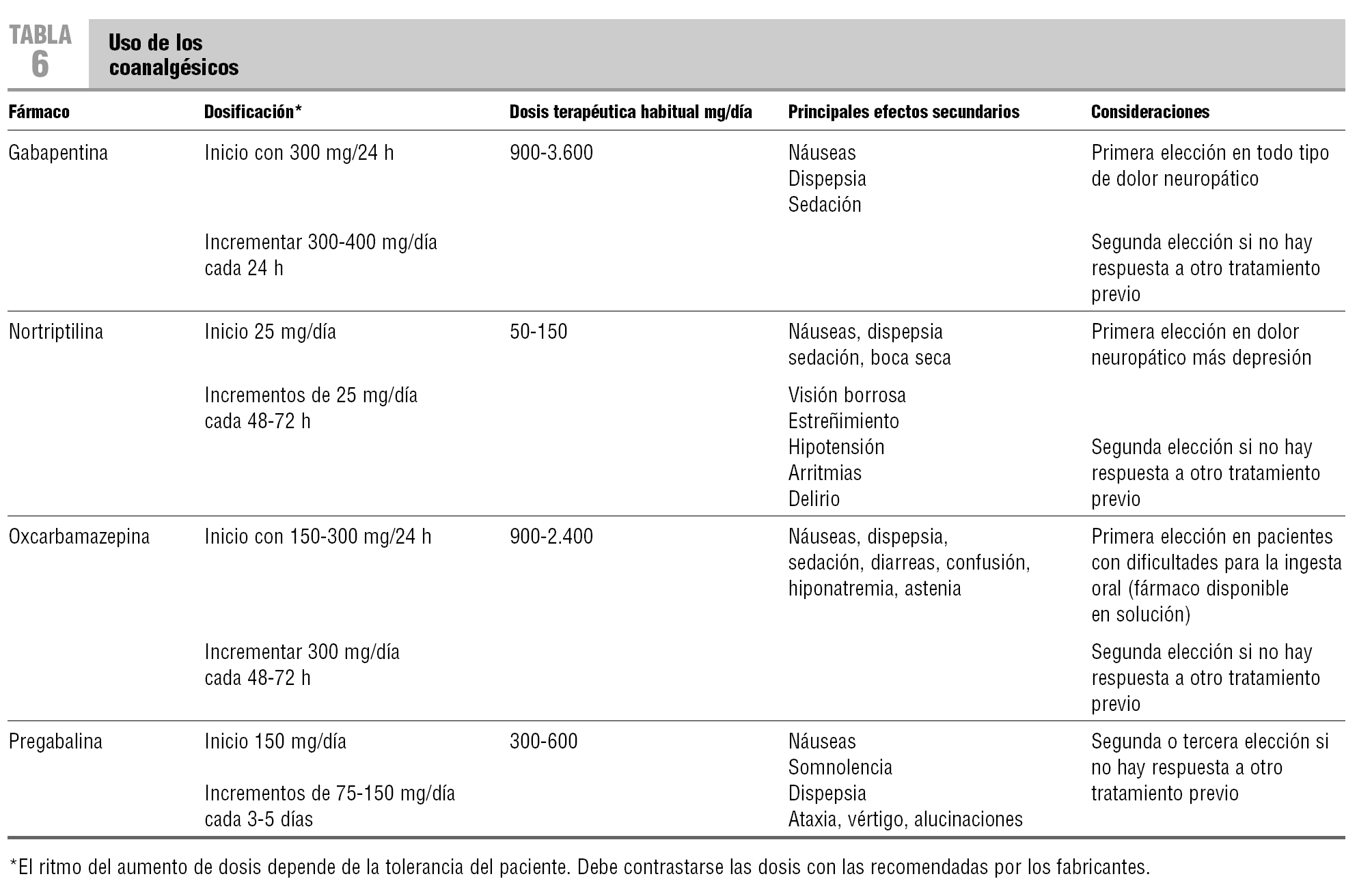
En la tabla 6 se describen las dosis de los coanalgésicos de uso habitual. La gabapentina, por sus adecuadas tolerabilidad y eficacia, es el primer fármaco con que probar21,23. Los antidepresivos tricíclicos, considerados coanalgésicos de «amplio espectro» por su eficacia en diversos dolores crónicos, son una adecuada alternativa, solos o con otros coanalgésicos21,23. Por sus menores efectos secundarios, se debería usar la nortiptilina.
La reciente introducción de la oxcarbamazepina, la pregabalina, la venlafaxina y la duloxetina amplía el arsenal terapéutico de los fármacos eficaces en el control del dolor neuropático21,23. Pueden representar una alternativa adecuada, en monoterapia o combinados, en el tratamiento del dolor neuropático oncológico pertinaz. No obstante, no se dispone de suficiente información para seleccionarlos como fármacos de primera elección. El hecho de que las dosis de carbamazepina, topiramato y lamotrigina deban ser incrementadas lentamente y sus frecuentes efectos secundarios, condicionan su uso en los pacientes oncológicos.
Otros coanalgésicos como la lidocaína o la mexiletina se utilizan con poca frecuencia por su estrecho margen terapéutico. La ketamina, en dosis subanestésicas por vía s.c. u oral, puede ser una alternativa en casos muy rebeldes25,26, aunque es de uso hospitalario.
Los corticoides también tienen actividad analgésica en el dolor neuropático (por reducción de la compresión originada por la masa tumoral) y otros dolores como el óseo, por infiltración hepática, por tenesmo rectal, por afección muscular o las cefaleas por hipertensión intracraneal. En estos casos se utilizan dosis variables sin que esté adecuadamente definida la mínima eficaz. El tratamiento puede iniciarse con 8-12 mg de dexametasona al día, titulando la dosis hasta encontrar la mínima eficaz.
Consideraciones sobre el tratamiento del dolor óseo
El dolor óseo responde adecuadamente a los AINE, los opiáceos o su combinación. Este tratamiento se administrará cuando no haya habido respuesta o posibilidad de instaurar otros tratamientos como el quirúrgico o la radioterapia paliativa.
El uso mensual de bisfosfonatos, como el pamidronato o el zolendronato, tiene efecto coanalgésico y favorece un mejor control del dolor independientemente del tipo de cáncer12. La disminución de la morbilidad ósea como las fracturas patológicas es otro de los grandes beneficios del tratamiento con bisfosfonatos.
La vertebroplastia es un procedimiento mediante el que se procede a la «cementación» del cuerpo vertebral27. Esto es, la inyección en el cuerpo vertebral de una sustancia expandible que luego se solidifica y aporta rigidez al cuerpo vertebral. Se probó inicialmente en el tratamiento de los aplastamientos y las fracturas vertebrales por osteoporosis, con muy buenos resultados en el control del dolor y la estabilidad ósea, prácticamente en 24 h. Su extensión al tratamiento de las metástasis óseas vertebrales también ha aportado buenos resultados. En este caso, la condición es que no haya daño neurológico y que la cara posterior del cuerpo vertebral esté intacta para evitar la salida del cemento al canal medular. La técnica suele ser realizada por traumatólogos especializados o unidades de radiología intervencionista.
En caso de que no se haya obtenido respuesta al tratamiento especifico, la situación funcional no recomiende el traslado del paciente o las expectativas vitales sean muy cortas, está indicado instaurar en el primer nivel de salud un tratamiento combinado de AINE y dosis crecientes de opiáceos hasta el control completo del dolor.
Uso de los métodos invasivos. La administración espinal de analgésicos
La administración espinal de opiáceos y anestésicos locales es una opción terapéutica para pacientes con dolor pertinaz por falta de respuesta a los tratamientos orales o con efectos secundarios intolerables28. Es controvertido que sea más eficaz que el tratamiento con fármacos por vía oral o subcutánea12.
Entre sus limitaciones se encuentran, principalmente, que es un método invasivo y su coste. De ahí que se considere una alternativa terapéutica sólo para pacientes con expectativa de vida superior a 3 meses12,28.
Correspondencia:
Miguel Ángel Benítez del Rosario.
Apartado de Correos 10521.
38080 Santa Cruz de Tenerife. España.
Correo electrónico: mabenitez@comtf.es