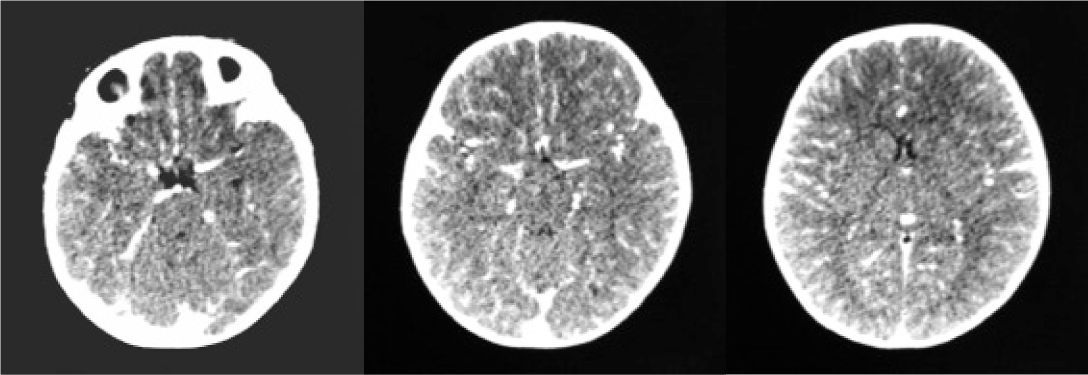
Paciente femenino de 1 año 2 meses de edad, con esquema de vacunación completo y adecuado con su edad, sin antecedentes patológicos referidos. Inició su padecimiento cinco días previos a su ingreso, con irritabilidad alternante: euforia y tendencia a la autoagresión. Dos días previos cursó con picos febriles de hasta 40°C en número de dos al día, los cuales se remitían parcialmente con paracetamol. Un día previo a su ingreso presentó supraversión de la mirada y movimientos clónicos de extremidades superiores de cinco minutos de duración. Acudió a valoración y se le encontró muy irritable alternando con somnolencia, adecuado estado de hidratación y leve palidez de piel y tegumentos, febril de 38.6°C, indiferente al medio, pupilas isocóricas, con lenta reacción al estímulo luminoso, fondo de ojo no valorable por la irritabilidad de la paciente, supraversión de la mirada con desviación a la izquierda, simetría facial, cocleopalpebral dudoso, elevación simétrica de paladar, úvula central, reflejo nauseoso presente, rigidez de nuca. Tórax sin compromiso cardiopulmonar. Precordio con frecuencia cardiaca de 200ppm, sin agregados. Abdomen sólo con resistencia muscular voluntaria. Extremidades con hipertonía generalizada, reflejos osteotendinosos incrementados, respuesta plantar flexora bilateral; sin lograr sedestación. Se solicitó a su ingreso una biometría hemática que se reportó con hemoglobina 12.7, hematocrito 37.2, leucocitos 9700, neutrófilos 63%, linfocitos 34%, monocitos 3%, plaquetas 369mil. vsg 34. Se realizó punción lumbar, el citoquímico se reportó con microproteínas 70, células 53, polimorfonucleares 22%, mononucleares 78%, glucosa 79mg con glucosa sanguínea de 110mg. Se realizó una tac de cráneo simple y contrastada.
- 1.
¿Cuál sería el diagnóstico más probable en este caso?
- a.
Meningitis bacteriana
- b.
Meningoencefalitis parasitaria
- c.
Meningitis tuberculosa
- d.
Criptococosis meníngea
- e.
Meningoencefalitis viral
- a.
- 2.
¿Cuál de los siguientes agentes sería el más probable?
- a.
Herpesvirus simple tipo 6
- b.
Listeria monocytogenes
- c.
Mycobacterium tuberculosis
- d.
Naegleria fowleri
- e.
Cryptococcus neoformans
- a.
- 3.
¿Cómo se determinaría el diagnóstico?
- a.
Aislamiento por cultivo de Listeria monocytogenes
- b.
Prueba de aglutinación en látex y enzimoinmunoanálisis con detección del antígeno del polisacárido capsular del criptococo
- c.
Aislamiento por cultivo de Mycobacterium tuberculosis
- d.
pcr positiva para herpesvirus simple tipo 6
- e.
Demostración microscópica de los trofozoítos móviles en una preparación en fresco de lcr
- a.
- 4.
¿Cuál sería el tratamiento de elección considerando el agente etiológico?
- a.
Anfotericina B desoxicolato a 1mg/kg/día cada 24 horas más flucitosina oral a 100mg/kg/día en cuatro dosis por no menos de dos semanas, con posterior uso de fluconazol a 10mg/kg/día por un mínimo de ocho a 10 semanas
- b.
Ganciclovir a 6mg/kg/dosis cada 12 horas por 21 días
- c.
Fase intensiva diaria con isoniazida a 10mg/kg/día, rifampicina a 15mg/kg/día, pirazinamida a 35mg/kg/día y etambutol a 20mg/kg/día, con posterior fase de sostén diaria a base de isoniazida, rifampicina y etambutol a las mismas dosis
- d.
Ampicilina a 300mg/kg/día por 14 a 21 días
- e.
Anfotericina B sola o combinada con miconazol u ornidazol más rifampicina
- a.
- 1.
e
- 2.
a
- 3.
d
- 4.
b
El caso previo corresponde a una meningoencefalitis viral, con clínica de un síndrome encefálico dado por la indiferencia al medio y la irritabilidad alternante con somnolencia, y un síndrome convulsivo dado por la epilepsia parcial compleja secundariamente generalizada motora sintomática. El resto de las patologías no presentaría un síndrome encefálico tan característico. Además, la evolución aguda en la paciente sugiere aún más la etiología viral, ya que el resto de las posibilidades diagnósticas cursaría con evolución subaguda o crónica. Cabe subrayar un lcr también muy sugestivo de esta etiología viral, ya que hay leve hiperproteinorraquia sin hipoglucorraquia, con leucocitos en lcr de predominio mononuclear. En el resto de las posibilidades diagnósticas comentadas también hay predominio de mononucleares pero hay por lo general mayor cuenta de leucocitos en el lcr, mayor hiperproteinorraquia, y puede haber leve hipoglucorraquia, dato que generalmente no se encuentra en una encefalitis viral. En cuanto a los posibles agentes virales, caben señalarse enterovirus, virus de Epstein Barr y herpesvirus simple tipos 1 o 6.
Características de los otros agentes virales señalados que la paciente no presentó y por lo tanto los hicieron menos probables. La paciente no presentó cuadro previo de infección de vías aéreas superiores o de enfermedad diarreica aguda sugestivos de algún enterovirus; la paciente no cursó con un síndrome de Alicia en el país de las maravillas que sugiere al virus de Epstein Barr como agente etiológico en aquellos pacientes que lo presentan, aunque este dato de cualquier forma no lo hubiera manifestado por su corta edad; y, por otro lado, tampoco se sugirió contundentemente al herpesvirus simple tipo 1 como agente etiológico. Por último, cabe señalar que este caso cursó con clínica sugestiva de herpesvirus simple tipo 6 (hhv-6) tal y como se describe en la literatura, y además se documentó por pcr.
Epidemiología y etiopatogeniaAproximadamente 20% de las consultas en urgencias de niños febriles de 6 a 12 meses de edad es atribuible a hhv-6.1 Sobrevienen convulsiones durante el periodo de hipertermia en alrededor de 10 a 15% de las infecciones primarias, como en este caso. El virus persiste y puede reactivarse. Se desconocen las circunstancias clínicas y las manifestaciones de la reactivación en personas sanas. Ésta ocurre sobre todo en pacientes inmunosuprimidos, asociada con manifestaciones como fiebre, exantema, hepatitis, supresión de la médula ósea, neumonía y encefalitis.1
El hhv-6 es un agente linfotrópico de la familia Herpesviridae. Las cepas de hhv-6 pertenecen a uno de dos grupos principales, variantes A y B; casi todas las infecciones primarias en niños son producidas por cepas de la variante B, pero se ha sugerido que la variante A tiene mayor patogenicidad neurológica. Los humanos son los únicos huéspedes naturales de hhv-6. La transmisión a un lactante se debe a la eliminación asintomática del virus en secreciones de un miembro de la familia u otro contacto cercano con infección persistente. Durante la fase febril de la infección primaria se puede aislar hhv-6 en linfocitos de sangre periférica y saliva, y se puede detectar en líquido cefalorraquídeo mediante pcr. El anticuerpo materno específico contra el virus está presente en el suero de los recién nacidos en el momento del nacimiento y confiere protección transitoria. A medida que disminuye la concentración del anticuerpo materno durante el primer año de vida, aumenta con rapidez la tasa de infección, que alcanza su valor máximo entre los seis y los 24 meses de vida.1 Por lo general los niños contraen infección primaria por hhv-6 y son seropositivos antes de los 4 años de edad. Las infecciones se producen todo el año, sin un patrón estacional. El hhv-6 se puede integrar en los cromosomas del huésped, y por tanto es posible la transmisión hereditaria de dna viral integrado, lo que determina persistencia de por vida de dna viral en las células huésped. El periodo de incubación medio del hhv-6 puede ser de nueve a 10 días.1,2
Es más frecuente que aquel paciente menor de un año con crisis convulsivas, crisis de larga duración, crisis parciales y parálisis postictal, tenga infección primaria por hhv-6. Así, el hhv-6 puede invadir el snc o reactivarse en el snc durante alguna enfermedad neurológica en la infancia.3
Cuadro clínico y gabineteLas manifestaciones clínicas de encefalitis por hhv-6 incluyen insomnio (probablemente es el síntoma más asociado con encefalitis específicamente por hhv-6), encefalopatía severa con alteración del alerta que va desde confusión hasta coma, signos neurológicos focales, cambios conductuales, alteraciones en el lenguaje, crisis convulsivas, ataxia, agitación, alucinaciones, pérdida de la memoria y opsoclonos-mioclonos. La exploración neurológica revela neuropatías craneales, disfunción cerebelar y debilidad de las extremidades.4,5
En la tomografía de cráneo realizada de manera temprana generalmente no se encuentran anomalías en la encefalopatía por hhv-6, contrario a los hallazgos en la encefalitis por herpesvirus simple tipos 1 o 2, como edema del parénquima cerebral y reforzamiento anormal de los surcos.6
Las imágenes por encefalitis por hhv-6 encontradas en la resonancia magnética nuclear incluyen anormalidades localizadas en la región tuberal del hipotálamo (exclusivo de hhv-6), cerebelo, ganglios basales, tálamo, hipocampo (generalmente correlacionando con alucinaciones), amígdala (generalmente correlacionando con pérdida de la memoria), estructuras límbicas y hemisferios cerebrales.4,5 A corto y mediano plazo, los pacientes con encefalopatía por hhv-6 generalmente tienen involucro exclusivo de los lóbulos temporales, mientras que los pacientes con encefalitis por hhv-6 tienen involucro tanto de los lóbulos temporales como de las regiones extratemporales. Además, los pacientes con encefalopatía por hhv-6 generalmente cursan con resolución de imágenes hiperintensas observadas en t2 y flair, contrario a aquellos con infección por herpesvirus simple tipos 1 o 2.6 Algunos pacientes con encefalitis por hhv-6 también manifiestan anomalías electroencefalográficas, y otros presentan secuelas neurológicas permanentes.3
DiagnósticoEl diagnóstico puede realizarse a través de medición de anticuerpos, aislamiento del virus, detección del antígeno viral y detección de dna viral por pcr en tiempo real sérica y de lcr, encontrando generalmente mayor número de copias en aquellos pacientes postransplantados.3,7
La técnica original de identificación del hhv-6 fue mediante su aislamiento, sin embargo este método es más difícil de realizar que aquellos empleados comúnmente para la mayoría de los herpesvirus.1
La medición de anticuerpos requiere muestras séricas en la fase aguda y de convalescencia para determinar una cuadruplicación en el título de anticuerpos IgG específicos, aunque esto no indica necesariamente infección nueva, porque también puede haber un aumento del título en caso de reactivación y asociación con otras infecciones. No obstante, la seroconversión de negativa a positiva en sueros emparejados es evidencia aceptable de infección primaria reciente. Un IgM positivo podría indicar infección aguda en un lactante aunque tampoco es fiable, porque pueden estar presentes en algunas personas asintomáticas previamente infectadas.1,3
El genoma viral puede ser detectado mediante técnicas de hibridación de dna, en gel de electroforesis,3 o pcr en muestras de sangre y de lcr. Empero, la integración cromosómica del dna del hhv-6 siempre determinará un resultado positivo de la pcr con una alta carga viral, lo que puede confundir la interpretación de un resultado positivo. No se debe diagnosticar infección activa por hhv-6 sin descartar primero integración cromosómica por determinación de la carga de dna en suero o en lcr y comparación con la carga de dna en sangre entera.1,2
Se ha desarrollado un método de detección simultánea y diferenciación de las dos variantes de hhv-6, empleando pcr en tiempo real específica de subtipo basado en sondas, con una sensibilidad de 95% y especificidad de hasta 99%.2
TratamientoEl tratamiento en el caso de enfermedad leve es de sostén en pacientes inmunocompetentes, ya que la recuperación es completa en algunos días. Sin embargo, la infección por hhv-6 en inmunocomprometidos puede ser persistente o severa, por lo que amerita tratamiento antiviral. En cuanto a encefalitis en todo tipo de pacientes, es esencial iniciar tratamiento antiviral, como en este caso. Se ha analizado la sensibilidad in vitro a cuatro antivirales: aciclovir, ganciclovir, foscarnet y cidofovir. Éstos se han empleado en el tratamiento de otras infecciones herpéticas. La multiplicación del hhv-6 en cultivo celular se inhibe por el ganciclovir a una concentración de 2 a 10mcg/mL, lo cual es aplicable en la práctica.1,3 Desafortunadamente, el tratamiento con ganciclovir no correlaciona con la resolución de los síntomas neurológicos, a pesar de que el hhv-6 se vuelva indetectable.4 El foscarnet a una concentración de 6mcg/mL también parece ser efectivo. El hhv-6 se inhibe por el aciclovir sólo a concentraciones de 50mcg/mL (dosis muy superiores a las requeridas para inhibir al vhs-1, vhs-2 y vvz, y probablemente tóxicas). Es por ello que no se le considera como tratamiento para este virus. El cidofovir es más tóxico que el ganciclovir, por lo que no está recomendado.1,3
Perlas clínicasLa clave para el diagnóstico adecuado y tratamiento oportuno es la sospecha de este microorganismo como agente etiológico de encefalitis viral en aquel paciente con fiebre, encefalopatía severa, datos de focalización, crisis convulsivas y ataxia, ya que es de las pocas encefalitis virales susceptibles de tratarse, pero no precisamente con aciclovir sino con ganciclovir.
Este artículo debe citarse: González-Saldaña N, Gómez-Toscano V. Herpesvirus simple tipo 6. Aten Fam. 2013;20(4):127–129.