La enfermedad de Kawasaki es una vasculitis autolimitada propia de lactantes y niños, que se caracteriza por lesiones de las arterias coronarias (especialmente aneurismas); se considera una de las principales causas de cardiopatías adquiridas en niños.
No se conoce la causa de la enfermedad de Kawasaki. Una hipótesis es que agentes infecciosos producen la enfermedad solo en pacientes genéticamente predispuestos, aunque es posible que se trate de una respuesta inmunológica desencadenada por agentes microbianos. Por razón desconocida predomina en individuos asiáticos.
El tratamiento está dirigido a prevenir la trombosis coronaria y reducir la inflamación; se basa en la administración de ácido acetilsalicílico y altas dosis de inmunoglobulinas intravenosas, las cuales reducen el desarrollo de aneurismas de un 25 a un 4%. Actualmente, se puede utilizar la angioplastia percutánea y la cirugía de revascularización coronaria para tratar la isquemia y disminuir los síntomas de angina. Aunque existen numerosos artículos relativos al manejo quirúrgico de la arteriopatía coronaria por enfermedad de Kawasaki, hay escasa información sobre el manejo anestésico durante estos procedimientos, por ello se describe el manejo anestésico de una paciente llevada a cirugía de revascularización coronaria, y se hace una revisión de la literatura existente.
Kawasaki disease is a self-limited vasculitis that occurs predominantly in infants and young children, that is characterized by coronary artery lesions (especially aneurysms). It is one of the leading causes of acquired heart disease in children.
The etiology of Kawasaki disease still remains unknown. A hypothesis is that an infectious agent produces clinically apparent disease only in certain genetically predisposed individuals. It also is possible that the disease results from an immunologic response and is triggered by different microbial agents. For unknown reason it dominates in Asians.
Treatment is directed to prevent coronary thrombosis and reduce inflammation; it is based on high-dose intravenous immunoglobulin and acetyl salicylic acid, which significantly reduce the risk of coronary artery aneurysms from 25 to 4%. In order to reduce myocardial ischemia, percutaneous coronary interventions and coronary artery bypass graft can be used. There is a lot of information about surgical techniques for coronary artery complications linked to Kawasaki disease, but minimal information about anesthetic techniques; for this reason, we describe the anesthetic management of a patient who required coronary artery bypass graft, and we present a literature review on the topic.
La enfermedad de Kawasaki (EK), es una vasculitis autolimitada propia de lactantes y niños, que se caracteriza por lesión de las arterias coronarias, y se reportó por primera vez en Japón en 1967, por el Dr. Tomisaku Kawasaki, aunque se ha encontrado en diversos grupos raciales del mundo. En la actualidad se considera una de las principales causas de cardiopatías adquiridas en niños1–4. En México, Gil Veloz et al. reportaron una serie de 22 pacientes en 7 años, de los cuales el 82% fueron menores de 5 años, con una relación masculino:femenino 1.4:15.
No se conoce la causa de la EK. Una hipótesis es que agentes infecciosos producen la enfermedad solo en pacientes genéticamente predispuestos1,4,6. Otro planteamiento es que la excesiva expresión de la enzima óxido nítrico sintetasa inducible y la elevada producción de óxido nítrico en las células mononucleares podrían estar involucradas en la patogénesis de la EK7,8. Investigaciones recientes sugieren una hipótesis alternativa: la respuesta inmune en la EK es oligoclonal y las inmunoglobulinas A desempeñan un rol central, por lo cual es posible que se trate de una respuesta inmunológica desencadenada por agentes microbianos1. En pacientes con EK, en los que no se han detectado anomalías coronarias, se han reportado cambios preclínicos, tales como: trastornos en la función endotelial, en la elasticidad de la pared, en el flujo regional miocárdico y en el flujo de reserva miocárdico2,9.
El diagnóstico se basa en la presencia de fiebre de 4 a 5días de evolución, con al menos 4 o 5 criterios clínicos principales: rash cutáneo, conjuntivitis bilateral no exudativa, inflamación de la mucosa oral, linfadenopatía cervical usualmente unilateral, enrojecimiento de palmas de las manos y plantas de los pies. No se conoce ninguna prueba diagnóstica específica, sin embargo, existen datos de laboratorio y ecocardiográficos que son altamente sugestivos1–4.
El tratamiento en fase aguda está dirigido a reducir la inflamación en las arterias coronarias y prevenir la trombosis coronaria4; se basa en la administración de ácido acetilsalicílico (AAS) y altas dosis de inmunoglobulinas intravenosas en los primeros 10días de la enfermedad, lo cual acorta la duración de la fiebre y reduce el porcentaje de aneurismas en las arterias coronarias de un 25 a un 4%1,2,4. El uso de esteroides es controversial4,10.
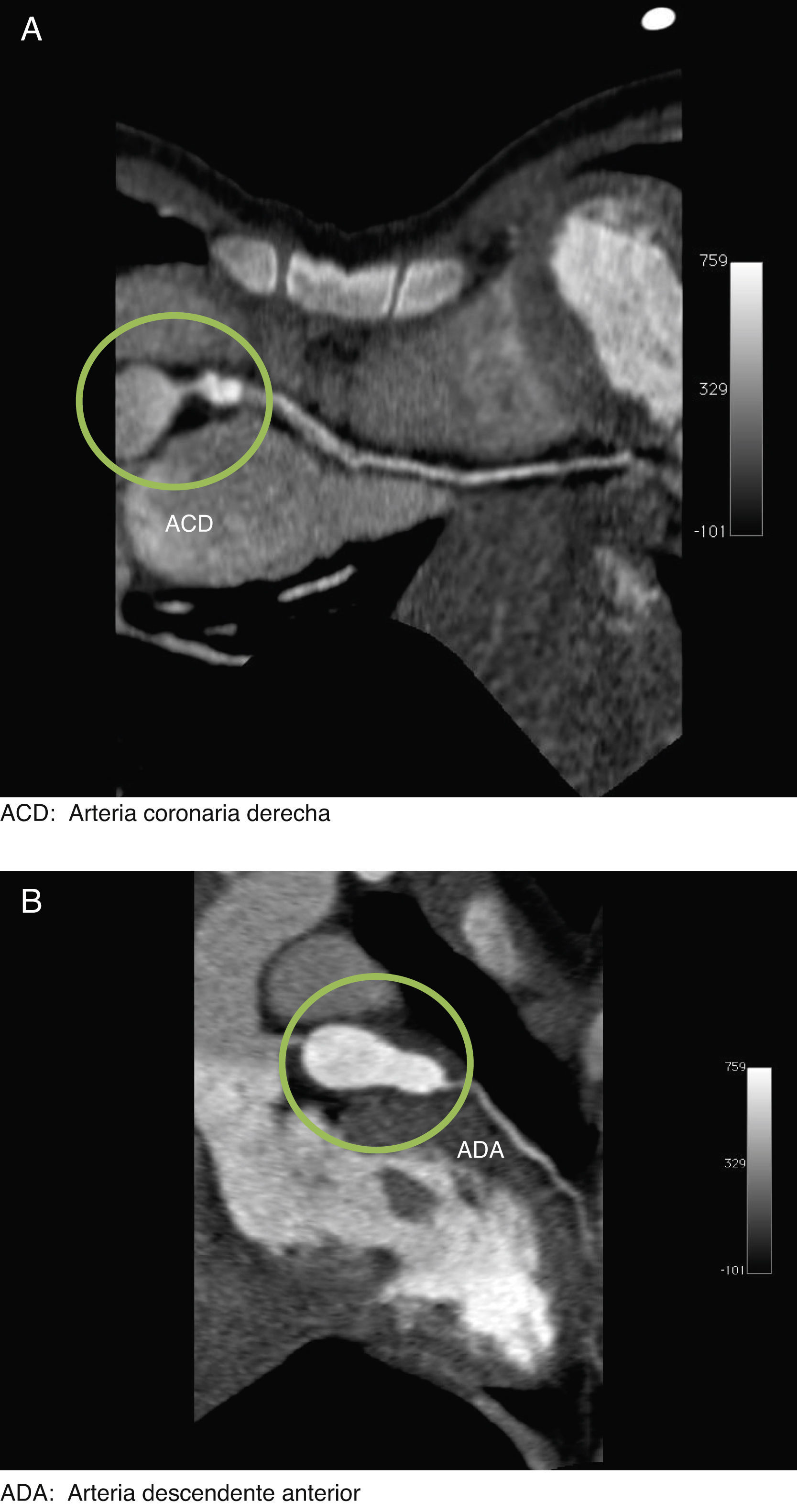
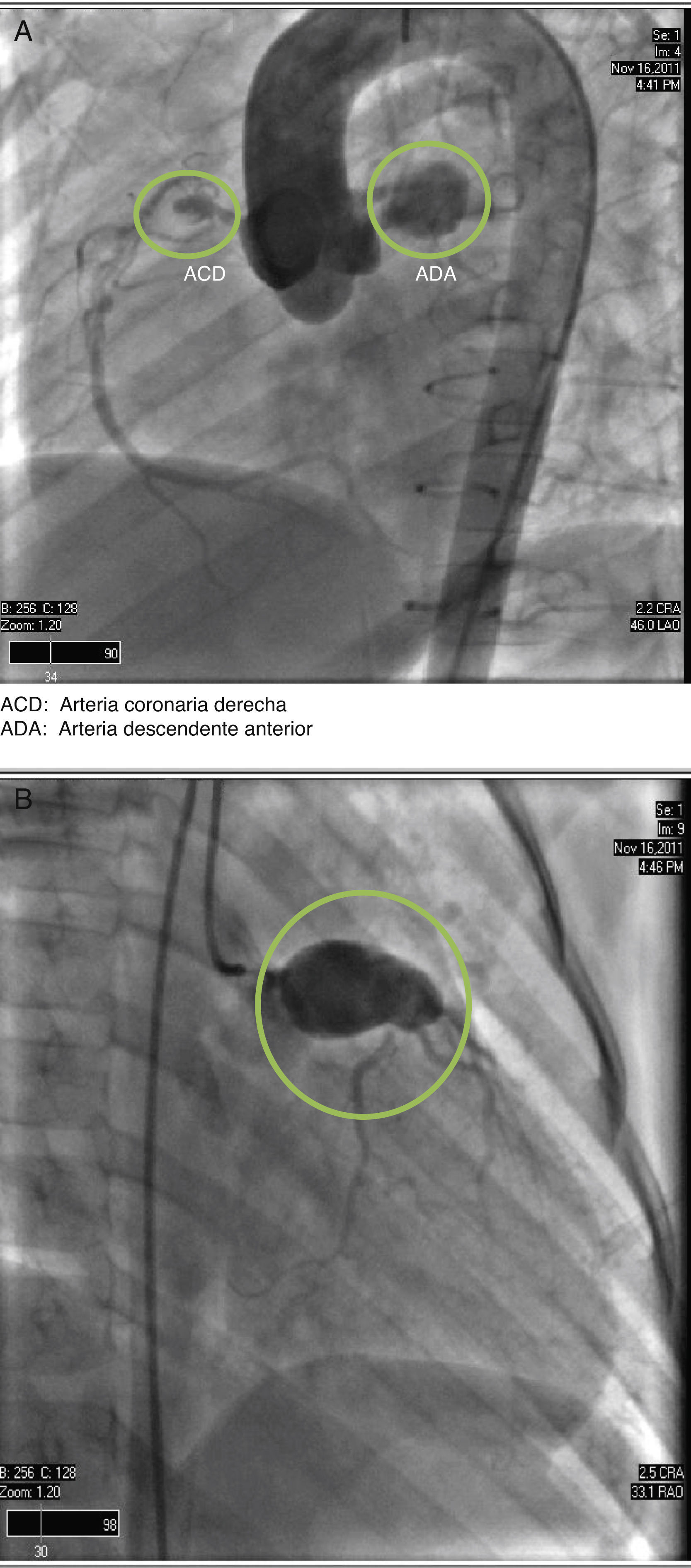
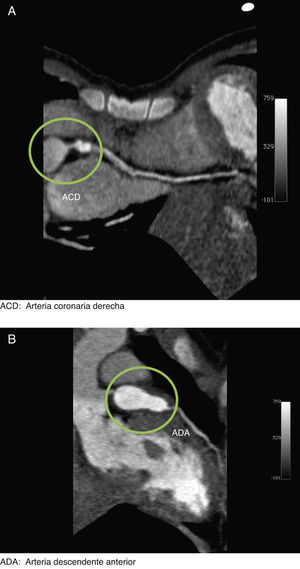
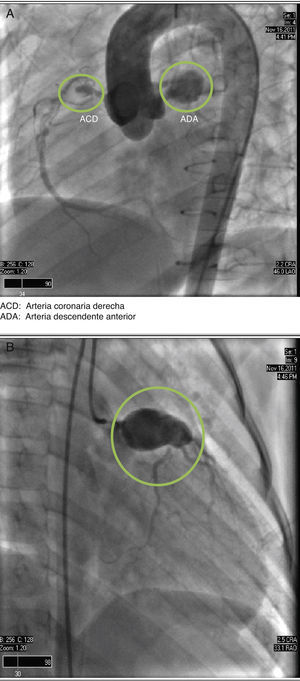
Informe de casoSe trata de una paciente femenina de 2 años de edad, hospitalizada por cuadro de 10días de evolución caracterizado por síndrome febril, sequedad nasal y diarrea acuosa, inicialmente tratada como gastroenteritis probablemente infecciosa. Progresó con dificultad para deglutir, eritema conjuntival, sequedad de mucosa oral y picos febriles de hasta 39.8°C, además de eritema en pared abdominal y dorsal. Ante estos hallazgos, se estableció el diagnóstico de EK y fue tratada con inmunoglobulinas intravenosas 2g/kg con lo que la sintomatología remitió en 48h y se realizó estudio ecocardiográfico que mostró dilatación del tronco coronario. Egresó con indicación de AAS 50mg/día, vía oral. Aproximadamente 2 semanas después, presentó fiebre, náuseas, vómitos, diaforesis, astenia y adinamia por lo que fue hospitalizada nuevamente. A su ingreso se demostró en trazo electrocardiográfico supradesnivel del segmento ST en V3. Se realizó nuevo estudio ecocardiográfico que mostró insuficiencia tricuspídea ligera, presión sistólica de la arteria pulmonar de 29mmHg, fracción de expulsión del ventrículo izquierdo de 72% y ectasia de 6mm de la arteria coronaria derecha; y estudio de angiotomografía coronaria que evidenció aneurisma de la arteria coronaria derecha proximal y de la arteria descendente anterior proximal y media (fig. 1A y B), esta última con trombo intramural, motivo por el cual fue referida a esta institución, donde se realizó cateterismo diagnóstico para definir de forma precisa la anatomía coronaria, que reportó: secuelas de EK, lesión distal del tronco de la arteria coronaria izquierda, aneurisma coronario izquierdo gigante que involucraba el ostium de la arteria circunfleja, ostium y porción proximal de la arteria descendente anterior; aneurisma coronario derecho, lesión ostial y de los segmentos proximal y medio de la arteria coronaria derecha e insuficiencia aórtica moderada (fig. 2A y B).
A) Angiografía coronaria en proyección oblicua anterior izquierda, en sentido cráneo caudal que muestra aneurismas en las arterias descendente anterior y coronaria derecha. B) Angiografía coronaria en proyección oblicua anterior derecha, en sentido cráneo caudal, que muestra el aneurisma en la arteria descendente anterior. ACD: arteria coronaria derecha; ADA: arteria descendente anterior.
Aproximadamente 3 meses después del diagnóstico de EK, se ingresó en la unidad de terapia intensiva pediátrica (UTIP) del Instituto Nacional de Cardiología Ignacio Chávez, de forma electiva, para cirugía de revascularización coronaria, la cual se realizó al día siguiente. Con signos vitales dentro de límites normales para su grupo etario, se realizó inducción inhalatoria con sevoflurano 4% más oxígeno (FiO2 100%), se cateterizó vía periférica con punzocath N.o 20 en miembro superior derecho y se administró fentanilo 125μg, así como bromuro de rocuronio 8mg. Se mantuvo ventilación asistida con máscara facial, se realizó laringoscopia directa e intubación orotraqueal con sonda N o 6.0 con globo, la cual se fijó a 13cm en comisura bucal, y se verificó ventilación de ambos campos pulmonares a través de la auscultación. Se conectó a ventilador de máquina de anestesia y se inició ventilación mecánica controlada por presión (parámetros ventilatorios: presión inspiratoria máxima 15cmH2O, frecuencia respiratoria 16rpm, PEEP 4cmH2O, relación I:E 1:2, FiO2 de 60%). En la monitorización de esta paciente se empleó cardioscopio, oximetría de pulso, presión arterial invasiva, presión venosa central, capnografía, espirometría, analizador de gases inspirados y espirados, gasometrías arteriales, determinación de sangrado y diuresis. El mantenimiento anestésico se realizó con sevoflurano 1,5-2%, fentanilo en infusión continua de 10μg/kg/h más bromuro de rocuronio (4 dosis adicionales de 4mg cada una). Asimismo, se inició la administración de nicardipina 0,01μg/kg/min una hora antes del inicio de la circulación extracorpórea (CEC), y se mantuvo la infusión de levosimendán iniciada previamente en la UTIP.
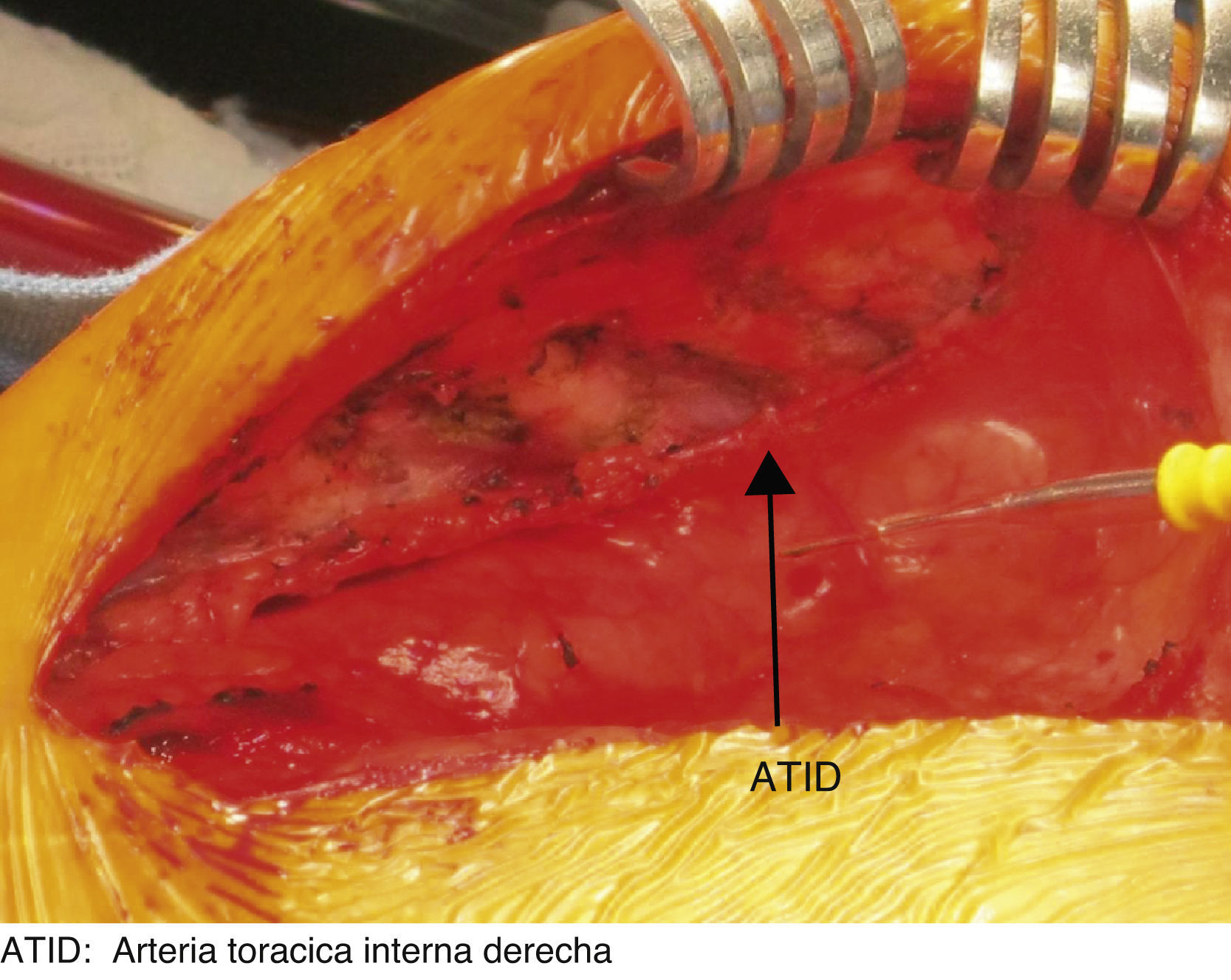
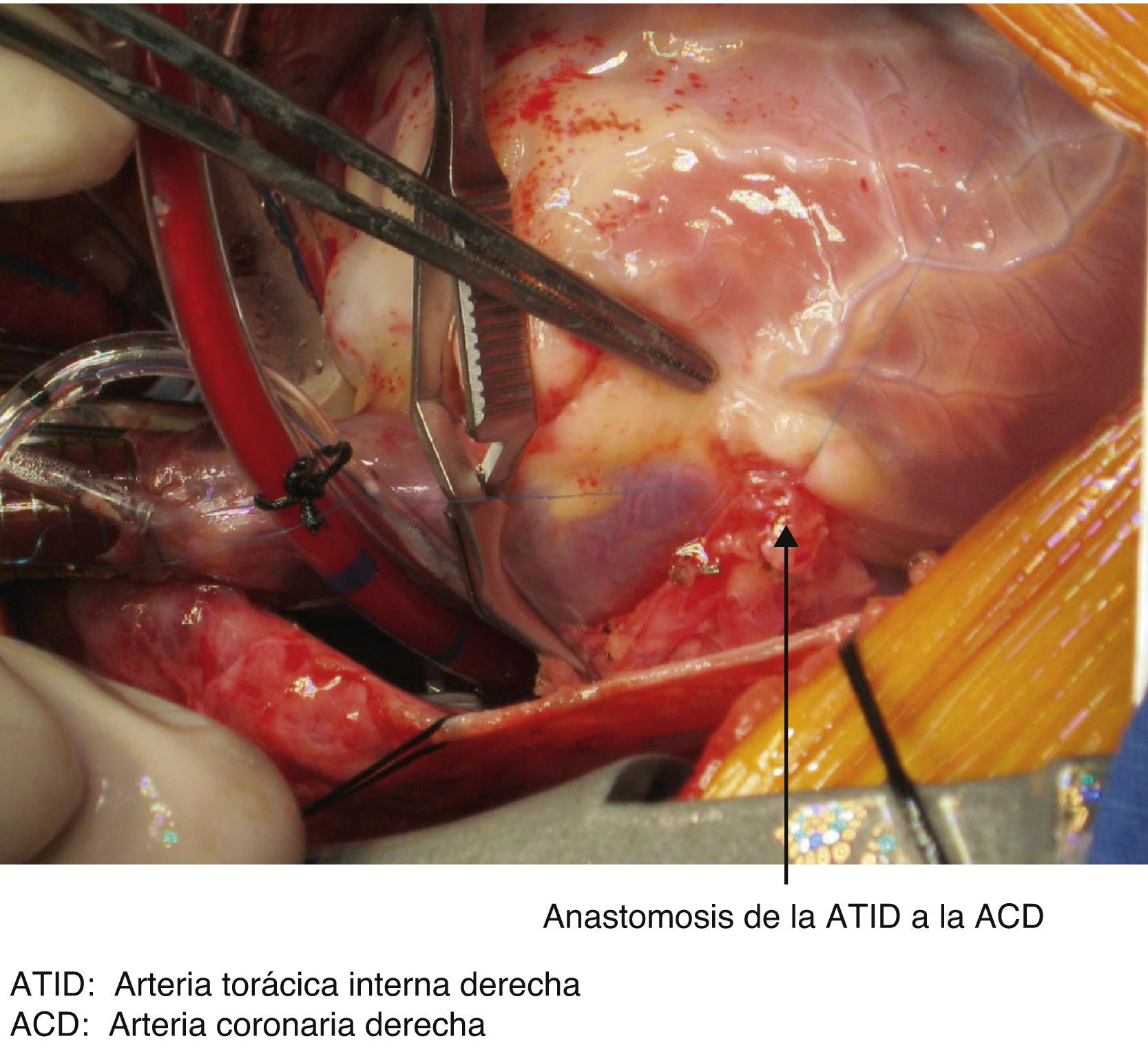
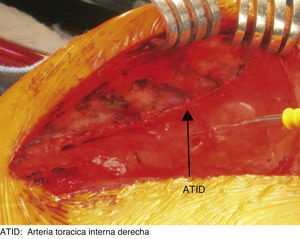
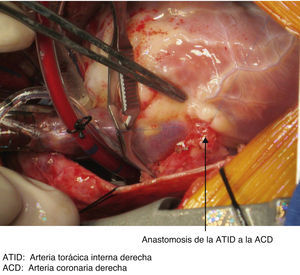
La CEC se realizó en hipotermia profunda (20°C), con flujo de 50-100ml/kg/min, con manejo de gases alfastat; para protección miocárdica se suministró cardioplejía cristaloide fría, anterógrada y retrógrada, con custodiol; para protección renal se suministró manitol 0,5g/kg; para protección cerebral, se suministró tiopental sódico 7mg/kg. La CEC tuvo una duración de 97min y el pinzamiento aórtico de 69min; una vez realizada la revascularización de la arteria coronaria derecha con injerto de la arteria torácica interna derecha (figs. 3 y 4) y de la arteria descendente anterior con injerto de la arteria torácica interna izquierda, se inició incremento de la temperatura, se despinzó arteria aorta, y se obtuvo ritmo sinusal con bloqueo de rama derecha (presente antes de la cirugía). En condiciones adecuadas de temperatura (36.5°C), hematocrito (32.3%), estabilidad hemodinámica y equilibrio ácido base, se inició salida de CEC, la cual se logró sin eventualidades. Se retiraron cánulas venosas y arterial, se revirtió el efecto de la heparina, con protamina, con lo que se alcanzó tiempo de coagulación activado (TCA) con una diferencia menor al 10% del inicial (TCA basal 130s, TCA final 135s). Posterior a la salida de CEC, y acorde a los resultados de la gasometría, se realizó corrección con bicarbonato de sodio y gluconato de calcio; asimismo se administró insulina 0,15 UI/kg, por hiperglucemia (238mg/dl). Se transfundieron 120ml de concentrado eritrocitario, 218ml de plasma fresco congelado y 70ml de aféresis plaquetaria.
Cuando terminó la cirugía se trasladó a la UTIP, intubada, sedada y relajada, con ventilación controlada, con infusión de nicardipina 0,01μg/kg/min, levosimendán 0,1μg/kg/min y fentanilo 5μg/kg/h. Signos vitales de llegada a la UTIP: FC 125lpm, PA 74/48mmHg, SpO2 99%, PVC 12cmH2O.
En la UTIP su evolución fue satisfactoria; se mantuvieron las infusiones de levosimendán (durante 3días) y nicardipina (por 5días). Se inició infusión de adrenalina (dosis variable 0,05-0,2μg/kg/min), por tendencia a la hipotensión. Se suspendió infusión de fentanilo y se sustituyó por dexmedetomidina (dosis variables 0.01-0.03μg/kg/h), y se extubó de forma satisfactoria 24h después del ingreso en UTIP. Una vez verificada la ausencia de sangrado, se inició infusión de heparina no fraccionada 8-15 UI/kg/h, con ajustes posteriores de acuerdo al INR. Egresó de la institución 10 días después de su ingreso, en buenas condiciones generales, con indicación de acenocumarina 1mg y AAS 75mg vía oral una vez al día.
DiscusiónLos pacientes con EK son tratados de acuerdos a los principios básicos de la fisiopatología, a series de casos retrospectivos, consenso de expertos y extrapolación de investigaciones clínicas de alta calidad, así como a experiencia en adultos con coronariopatías1,4,11.
Actualmente, se puede utilizar la angioplastia percutánea y la cirugía de revascularización coronaria con el objetivo de disminuir los síntomas de angina y reducir el riesgo de isquemia, infarto de miocardio o muerte súbita12–14.
El comité de investigación del Ministerio Japonés de Salud, Parto y Bienestar ha recomendado la angioplastia percutánea en los siguientes casos: presentación con síntomas isquémicos, presencia de isquemia reversible en pruebas de estrés y presencia de estenosis de por lo menos el 75% de la arteria descendente anterior. También consideran que el abordaje quirúrgico es superior al intervencionista en pacientes con disfunción ventricular izquierda severa y en vasos con múltiples segmentos de estenosis; usualmente se realiza en niños con alto grado de obstrucción en al menos 2 arterias coronarias mayores o la arteria coronaria izquierda y que están en riesgo de infarto de miocardio. No se debe indicar revascularización en pacientes sin cambios isquémicos, debido a que la tasa de reestenosis es superior a la que se encuentra en pacientes con cambios isquémicos en el momento de la cirugía12,15. Se reserva el trasplante cardíaco para pacientes con EK con cardiomiopatía isquémica en fase terminal, en los cuales la revascularización coronaria no es posible1,4.
Con relación al manejo anestésico, existe poca información en la literatura médica. Aun cuando el efecto cardioprotector de los gases halogenados sigue siendo controversial, se escogió la administración de sevoflurano en este caso, porque se ha demostrado que los pacientes sometidos a cirugía de revascularización coronaria con un régimen anestésico basado en la administración de gases halogenados presentan menor daño miocardico postoperatorio, evidenciado por menor liberación de troponina i y creatincinasa fracción MB, y una mejor recuperación postoperatoria de la función miocárdica en comparación con un régimen basado en anestésicos intravenosos16. Los agentes inhalatorios proveen protección miocárdica a través de un mecanismo de preacondicionamiento isquémico, cuando su administración se inicia previo a la isquemia miocárdica; este efecto protector miocárdico se ha atribuido a mecanismos tales como balance de oxígeno miocárdico favorable, eliminación de radicales libres, inotropismo negativo, formación de óxido nítrico, bloqueo de canales de calcio e interacción directa con la función actina-miosina17. El uso de opioides en infusión continua, en dosis intermedia, garantiza un óptimo nivel de analgesia durante el transoperatorio, favoreciendo la inhibición de la respuesta neuroendocrina al estrés, mientras se prepara al paciente para una extubación temprana en el postoperatorio18. Actualmente, se favorece el uso de relajantes neuromusculares no despolarizantes de acción intermedia, sin acción vagolítica, con el objetivo de disminuir la incidencia de taquicardia intraoperatoria y relajación residual al momento de la extubación, razón por la que se justifica la utilización de bromuro de rocuronio en el manejo anestésico de esta paciente18.
La nicardipina es un calcioantagonista de segunda generación del tipo de las dihidropiridinas, con alta selectividad vascular y fuerte actividad vasodilatadora coronaria y cerebral; su uso incrementa el gasto cardíaco, a través de la elevación del volumen sistólico, y el flujo sanguíneo coronario, afectando favorablemente el balance entre consumo y aporte miocárdico de oxígeno, por lo cual es útil en pacientes con coronariopatías e insuficiencia cardíaca19. Su efecto cardioprotector puede explicarse por la estructura amina terciaria que le confiere propiedades fisicoquímicas que la diferencian de otras dihidropiridinas; su lipofilicidad única y pH lleva a secuestro preferencial dentro de células cardíacas isquémicas, presentando una gran afinidad con el sitio de unión de los canales de calcio en las células musculares lisas vasculares, por lo que mejora la disfunción diastólica observada en pacientes isquémicos20. Además, se ha demostrado su seguridad y efectividad en la población pediátrica, en dosis de 1 a 3μg/kg/min21. Estas características fueron determinantes para la utilización de este fármaco en el manejo trans y postoperatorio de esta paciente. Como efecto adverso, se menciona la aparición de taquicardia refleja por vasodilatación, con el consiguiente incremento en el consumo miocárdico de oxígeno21, efecto que se puede evidenciar en esta paciente, aunque sin aparente repercusión clínica.
El levosimendán es un inodilatador con un mecanismo de acción dual: mejora la respuesta de los miofilamentos al calcio, por su unión con la troponina C, incrementando la contracción miocárdica, y abre los canales de potasio dependientes de ATP en miocitos y células musculares lisas, actuando como vasodilatador, con propiedades antiisquémicas. No incrementa el consumo miocárdico de oxígeno como lo hacen otros inotrópicos como la dopamina o la dobutamina, lo cual ocurre porque los inotrópicos convencionales incrementan las concentraciones de calcio en el citosol, requiriendo un alto gasto de energía para su transporte dentro del retículo sarcoplásmico; sin embargo, como el levosimendán no incrementa las concentraciones de calcio citosólico, esto no resulta en un incremento en la demanda de energía para la remoción de calcio del citosol. También tiene efecto sobre los canales de potasio en la membrana interna mitocondrial, lo cual se considera importante para el preacondicionamiento isquémico. De esta manera, el levosimendán mejora el gasto cardíaco, disminuye las resistencias vasculares sistémicas y protege al corazón del daño isquémico, y estos beneficios se obtienen sin incrementar la demanda de oxígeno, por lo cual se consideró una alternativa apropiada para favorecer el preacondicionamiento isquémico y mejorar la contractilidad cardíaca posterior a la salida de la CEC22.
El manejo anestésico que se plantea es similar al empleado por Hadid et al., en un paciente masculino de 13 años de edad, sometido a cirugía de revascularización coronaria por aneurisma de la arteria descendente anterior y oclusión de la arteria coronaria derecha, aunque estos emplearon propofol (2mg/kg) en la inducción anestésica, medicamento que se prefirió no emplear por el riesgo de inestabilidad hemodinámica asociado a su utilización; estos autores reportaron un curso trans y postoperatorio favorable, sin la necesidad de utilizar apoyo inotrópico o vasopresor23.
La supervivencia de estos pacientes con EK y arteriopatías coronarias, sometidos a cirugía de revascularización coronaria o angioplastia percutánea, es buena, sin embargo, muchos de ellos requieren reintervenciones por el remodelado vascular y la progresión de la isquemia miocárdica24.
ConclusiónOptimizar el manejo anestésico es de vital importancia no solo para garantizar el éxito del procedimiento, sino para mejorar la supervivencia y calidad de vida de estos pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.