La infección de herida quirúrgica (IHQ) es una complicación grave de la cirugía reconstructiva arterial periférica, que genera un gran coste hospitalario y se asocia, si hay afectación del injerto, a altas tasas de amputación y mortalidad.
ObjetivosAnálisis de incidencia y factores predictivos de IHQ, identificación de agente causal y supervivencia libre de amputación en pacientes con IHQ intervenidos de reparación arterial de extremidades inferiores.
Material y métodoEstudio observacional prospectivo sobre infecciones de cirugía arterial directa revascularizadora por arteriopatía obliterante de extremidades inferiores realizadas en nuestro centro desde enero de 2011 hasta diciembre de 2014. Se incluyeron como variables a estudio: datos demográficos, factores de riesgo cardiovascular, inmunosupresión, estancia hospitalaria, clínica, reintervenciones, ASA, tiempo quirúrgico, grado de urgencia, uso de drenajes, tipo de injerto, transfusiones sanguíneas y preparación preoperatoria. Las variables resultado fueron la incidencia, factores predictivos, agente causal y supervivencia libre de amputación de IHQ.
ResultadosSe reclutó a 652 pacientes, con IHQ en 94 procedimientos (mediana de seguimiento 618 días): 63 (9,7%) infecciones superficiales, 18 (2,8%) profundas y 13 (2%) protésicas. Los gérmenes aislados más frecuentes fueron enterobacterias (27,9%) y Staphylococcus aureus (20,5%). Se identificaron como factores predictivos de infección: obesidad (OR: 2,34; IC 95%: 1,26-4,34), hemodiálisis (OD: 3,21; IC 95%: 1,26-8,20), tiempo quirúrgico >180 min (OR: 2,05; IC 95%: 1,13-3,71) y edad mayor de 65 años (OD: 2,35; IC 95%: 1,12-4,92). El análisis de supervivencia señala una menor supervivencia libre de amputación en los pacientes con IHQ, pese a no ser significativo (p=0,09).
ConclusiónLa supervivencia libre de amputación fue menor en los pacientes con infección de injerto que en aquellos con infección superficial. Encontramos como factores predictivos de IHQ la obesidad, hemodiálisis, edad mayor de 65 años e intervención >180 min. La identificación correcta de estos permitiría establecer estrategias para prevenir la IHQ en cirugía arterial y evitar sus consecuencias.
Surgical site infection (SSI) is a serious complication of peripheral arterial surgery. It generates increased hospital costs, and associated with high amputation and mortality rates if the graft is affected.
AimsThe aim of this study is to analyse the incidence rate and risk factors of SSI, to identify causal bacterial agents, and amputation free survival rates in patients with SSI undergoing lower limb arterial surgery.
Material and methodsA prospective observational study of SSI in peripheral open arterial surgery was performed in our centre from January 2011 to December 2014. The variables studied were: Demographic data, cardiovascular risk factors, immunosuppression, hospital stay, clinical symptoms, re-operations, ASA, surgical time, level of urgency, use of drains, type of graft, blood transfusion, and preoperative skin preparation. Outcome variables were incidence rate and risk factors of SSI, causal agent identification, and amputation free survival rate.
ResultsA total of 652 patients were registered, identifying 94 SSI (median follow-up 618 days): 63 (9.7%) superficial infection, 18 (2.8%) deep infection, and 13 (2%) graft infection. The most common bacterial agent was enterobacter species (27.9%), followed by Staphylococcus aureus (20.5%). Obesity (OR: 2.34, 95% CI: 1.26-4.34), haemodialysis (OR: 3.21, 95% CI: 1.26-8.20), surgical time>180minutes (OR: 2.05, 95% CI: 1.13-3.71) and older than 65 years (OR: 2.35, 95% CI: 1.12-4.92) were identified as predictors of SSI. Survival analysis suggests a lower amputation-free survival rate in patients with SSI, although it is not statistically significant (P=.09).
ConclusionAmputation free survival rates are lower in patients with graft infection than those with superficial infection. Obesity, haemodialysis, over 65 years old, and surgical time > 180 min, were found to be predictors of SSI. The correct identification of these factors could help in establishing strategies to prevent SSI and avoid its consequences.
La infección de herida quirúrgica (IHQ) en la cirugía reconstructiva arterial periférica es una complicación potencialmente grave si afecta al injerto, con una incidencia de hasta el 6% en estos casos; genera un gran coste hospitalario y se asocia a altas tasas de amputación al año (40%)1. Hasta en un 7% es causa directa de muerte del paciente.
Según las guías clínicas del Center for Disease Control (CDC)2, existen diversos factores de riesgo relacionados con un aumento de IHQ tanto relacionados con el paciente, como la edad avanzada, el tabaquismo, la obesidad, la desnutrición o las transfusiones sanguíneas, como relacionados con la intervención, como la preparación preoperatoria, un tiempo quirúrgico prolongado o el uso de drenajes. No obstante, son pocos los estudios existentes específicos sobre factores de riesgo de IHQ en cirugía vascular3–7.
Los objetivos primarios del estudio son valorar la incidencia, el agente causal y los factores predictivos de IHQ en pacientes intervenidos de cirugía arterial de extremidades inferiores en nuestro hospital desde enero de 2011 hasta diciembre de 2014, valorando secundariamente la supervivencia libre de amputación.
Material y métodoRealizamos un estudio observacional prospectivo en pacientes tratados mediante cirugía arterial directa revascularizadora por arteriopatía obliterante de extremidades inferiores, incluyendo sectores aortoilíaco, femoropoplíteo y distal, y realizadas en nuestro centro desde enero de 2011 hasta diciembre de 2014. Se excluyeron procedimientos arteriales en otras localizaciones y procedimientos endovasculares percutáneos.
Se incluyen como variables a estudio factores relacionados con el paciente: datos demográficos (edad, sexo), factores de riesgo cardiovascular (obesidad (IMC>30), diabetes (glucemia en ayunas >126mg/dL o posprandial >200mg/dL, tabaquismo (fumador activo/inactivo), inmunosupresión (neoplasia activa, cirrosis, VIH+, tratamiento inmunosupresor), hemodiálisis, grado clínico (clasificación de Fontaine, isquemia aguda), reintervenciones en la extremidad y riesgo anestésico (ASA). Valoramos factores relacionados con el perioperatorio: preparación preoperatoria correcta (profilaxis antibiótica y rasurado), tiempo quirúrgico (>180 min), grado de urgencia (programado/urgente), uso de drenajes, tipo de injerto (vena/prótesis [PTFE, dacron]) transfusiones sanguíneas y estancia hospitalaria preoperatoria (>3 días).
Como variables resultado consideramos:
- -
Incidencia de IHQ global, y desglosada en precoz (primeros 3 meses) y tardía (más de 3 meses).
- -
Agente causal de la infección.
- -
Factores predictivos de infección de herida quirúrgica.
- -
Supervivencia libre de amputación (fallecimiento o amputación mayor).
Diagnosticamos la infección de manera clínica, junto con recogida de cultivo en heridas con exudado, y complementamos con prueba de imagen en caso de sospecha de infección profunda.
Definimos el diagnóstico y clasificación de infección según los criterios publicados por el CDC en 1992 (tabla 1).
Clasificación de infección según los criterios publicados por el Center Disease Control
| Superficial | Comprende piel y tejido subcutáneo Se cumple al menos uno de los criterios siguientes: - Drenaje purulento con comprobación microbiológica o sin ella - Organismos aislados de un cultivo - Al menos uno de los siguientes: dolor, tumefacción, calor local - El médico que atiende al paciente diagnostica infección |
| Profunda | Comprende plano fascial y muscular Se cumple al menos uno de los criterios siguientes: - Drenaje purulento - Dehiscencia de incisión profunda y alguno de estos signos: fiebre >38°C, dolor localizado, absceso - El médico que atiende al paciente diagnostica infección |
| Órgano (injerto) | Compromete al injerto Se cumple uno de los criterios siguientes: - Drenaje purulento - Cultivo positivo de zona de injerto - Absceso que afecta al injerto - El médico que atiende al paciente diagnostica infección |
El seguimiento de los pacientes se realizó de forma ambulatoria al mes, 3 y 6 meses y posteriormente de forma anual de manera clínica, y mediante control con ecodoppler en el caso de revascularización mediante bypass.
Respecto el análisis estadístico, para variables cualitativas se utilizó el test Chi cuadrado y test exacto de Fisher, y para variables cuantitativas el test no paramétrico de Kruskal-Wallis. Las variables con una p<0,1, identificadas en el análisis univariante, se incluyeron en un modelo de regresión logística multivariante mediante estrategia de modelización por adición. El análisis de supervivencia se realizó mediante curvas de Kaplan-Meier y el análisis multivariante mediante regresión de Cox. El programa estadístico utilizado fue el SPSS 22.0.
ResultadosDesde enero de 2011 hasta diciembre de 2014, fueron intervenidos de cirugía arterial de extremidades inferiores en nuestro servicio de cirugía vascular, 652 pacientes. Del total de pacientes estudiados en este período, 94 desarrollaron IHQ (14,5%). El tipo de infección presentado por los pacientes, clasificadas según los criterios de CDC, fue 63 (9,7%) infecciones superficiales, 18 (2,8%) profundas y 13 (2%) infecciones de injerto.
Respecto las infecciones de injerto 10 (76,9%) fueron precoces y 3(23,1%) tardías. En el resto de los casos, todas las infecciones fueron precoces.
En un 6,4% (6 casos) fueron infecciones secundarias (safenectomía) y en un 93,6% (88 casos) infecciones primarias (herida de abordaje arterial). Respecto a estas últimas, la localización predominante fue a nivel inguinal (72,7%, 70 casos), seguida del abordaje infragenicular en un 18,2% (16 casos) y del muslo en un 9,1% (8 casos).
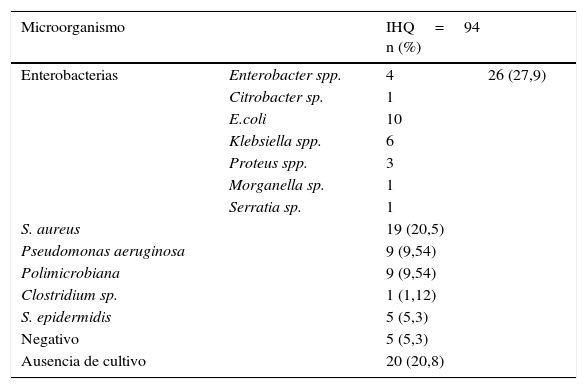
Los principales microorganismos aislados causantes de infección fueron enterobacterias (27,9%) y Staphylococcus aureus (S. aureus) (20,5%), seguidos de Pseudomonas aeruginosa (P. aeruginosa) (9,5%) (tabla 2). En un 5,3% fueron negativos y en un 20,8% no hubo cultivo.
Microorganismos aislados en heridas quirúrgicas infectadas (N=94)
| Microorganismo | IHQ=94 n (%) | ||
|---|---|---|---|
| Enterobacterias | Enterobacter spp. | 4 | 26 (27,9) |
| Citrobacter sp. | 1 | ||
| E.coli | 10 | ||
| Klebsiella spp. | 6 | ||
| Proteus spp. | 3 | ||
| Morganella sp. | 1 | ||
| Serratia sp. | 1 | ||
| S. aureus | 19 (20,5) | ||
| Pseudomonas aeruginosa | 9 (9,54) | ||
| Polimicrobiana | 9 (9,54) | ||
| Clostridium sp. | 1 (1,12) | ||
| S. epidermidis | 5 (5,3) | ||
| Negativo | 5 (5,3) | ||
| Ausencia de cultivo | 20 (20,8) | ||
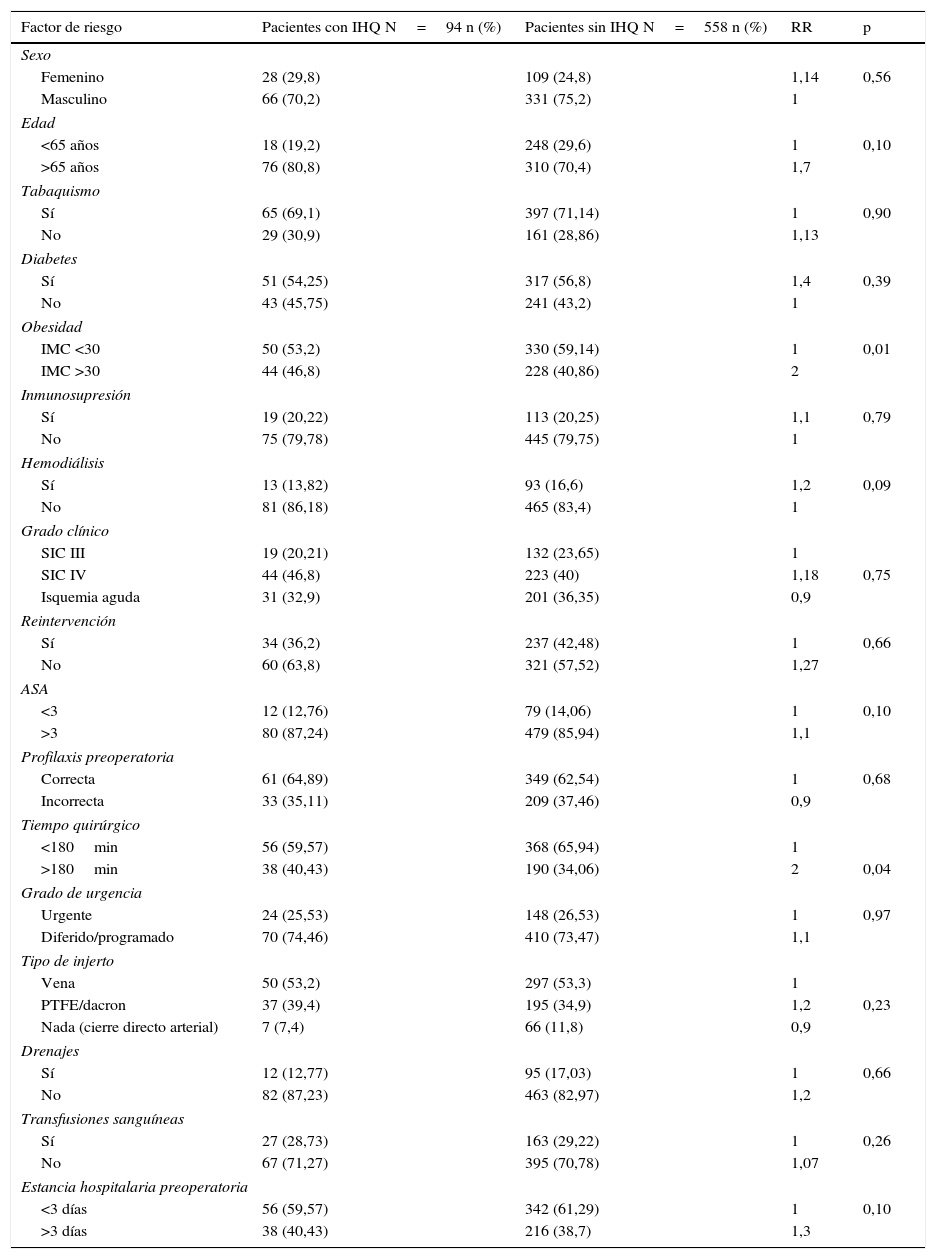
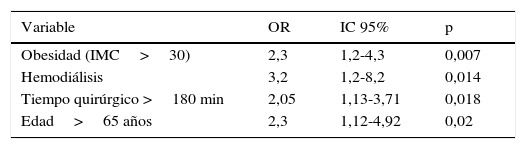
En el análisis univariante de los factores de riesgo de infección quirúrgica, la obesidad y un tiempo quirúrgico mayor de 180 min fueron más prevalentes en pacientes con infección quirúrgica (tabla 3). Tras el análisis multivariante, los factores predictivos de infección con significación estadística fueron la hemodiálisis, tiempo quirúrgico>180 min, obesidad, y edad>65 años (tabla 4).
Análisis univariante de potenciales factores de riesgo de infección de herida quirúrgica
| Factor de riesgo | Pacientes con IHQ N=94 n (%) | Pacientes sin IHQ N=558 n (%) | RR | p |
|---|---|---|---|---|
| Sexo | ||||
| Femenino | 28 (29,8) | 109 (24,8) | 1,14 | 0,56 |
| Masculino | 66 (70,2) | 331 (75,2) | 1 | |
| Edad | ||||
| <65 años | 18 (19,2) | 248 (29,6) | 1 | 0,10 |
| >65 años | 76 (80,8) | 310 (70,4) | 1,7 | |
| Tabaquismo | ||||
| Sí | 65 (69,1) | 397 (71,14) | 1 | 0,90 |
| No | 29 (30,9) | 161 (28,86) | 1,13 | |
| Diabetes | ||||
| Sí | 51 (54,25) | 317 (56,8) | 1,4 | 0,39 |
| No | 43 (45,75) | 241 (43,2) | 1 | |
| Obesidad | ||||
| IMC <30 | 50 (53,2) | 330 (59,14) | 1 | 0,01 |
| IMC >30 | 44 (46,8) | 228 (40,86) | 2 | |
| Inmunosupresión | ||||
| Sí | 19 (20,22) | 113 (20,25) | 1,1 | 0,79 |
| No | 75 (79,78) | 445 (79,75) | 1 | |
| Hemodiálisis | ||||
| Sí | 13 (13,82) | 93 (16,6) | 1,2 | 0,09 |
| No | 81 (86,18) | 465 (83,4) | 1 | |
| Grado clínico | ||||
| SIC III | 19 (20,21) | 132 (23,65) | 1 | |
| SIC IV | 44 (46,8) | 223 (40) | 1,18 | 0,75 |
| Isquemia aguda | 31 (32,9) | 201 (36,35) | 0,9 | |
| Reintervención | ||||
| Sí | 34 (36,2) | 237 (42,48) | 1 | 0,66 |
| No | 60 (63,8) | 321 (57,52) | 1,27 | |
| ASA | ||||
| <3 | 12 (12,76) | 79 (14,06) | 1 | 0,10 |
| >3 | 80 (87,24) | 479 (85,94) | 1,1 | |
| Profilaxis preoperatoria | ||||
| Correcta | 61 (64,89) | 349 (62,54) | 1 | 0,68 |
| Incorrecta | 33 (35,11) | 209 (37,46) | 0,9 | |
| Tiempo quirúrgico | ||||
| <180min | 56 (59,57) | 368 (65,94) | 1 | |
| >180min | 38 (40,43) | 190 (34,06) | 2 | 0,04 |
| Grado de urgencia | ||||
| Urgente | 24 (25,53) | 148 (26,53) | 1 | 0,97 |
| Diferido/programado | 70 (74,46) | 410 (73,47) | 1,1 | |
| Tipo de injerto | ||||
| Vena | 50 (53,2) | 297 (53,3) | 1 | |
| PTFE/dacron | 37 (39,4) | 195 (34,9) | 1,2 | 0,23 |
| Nada (cierre directo arterial) | 7 (7,4) | 66 (11,8) | 0,9 | |
| Drenajes | ||||
| Sí | 12 (12,77) | 95 (17,03) | 1 | 0,66 |
| No | 82 (87,23) | 463 (82,97) | 1,2 | |
| Transfusiones sanguíneas | ||||
| Sí | 27 (28,73) | 163 (29,22) | 1 | 0,26 |
| No | 67 (71,27) | 395 (70,78) | 1,07 | |
| Estancia hospitalaria preoperatoria | ||||
| <3 días | 56 (59,57) | 342 (61,29) | 1 | 0,10 |
| >3 días | 38 (40,43) | 216 (38,7) | 1,3 | |
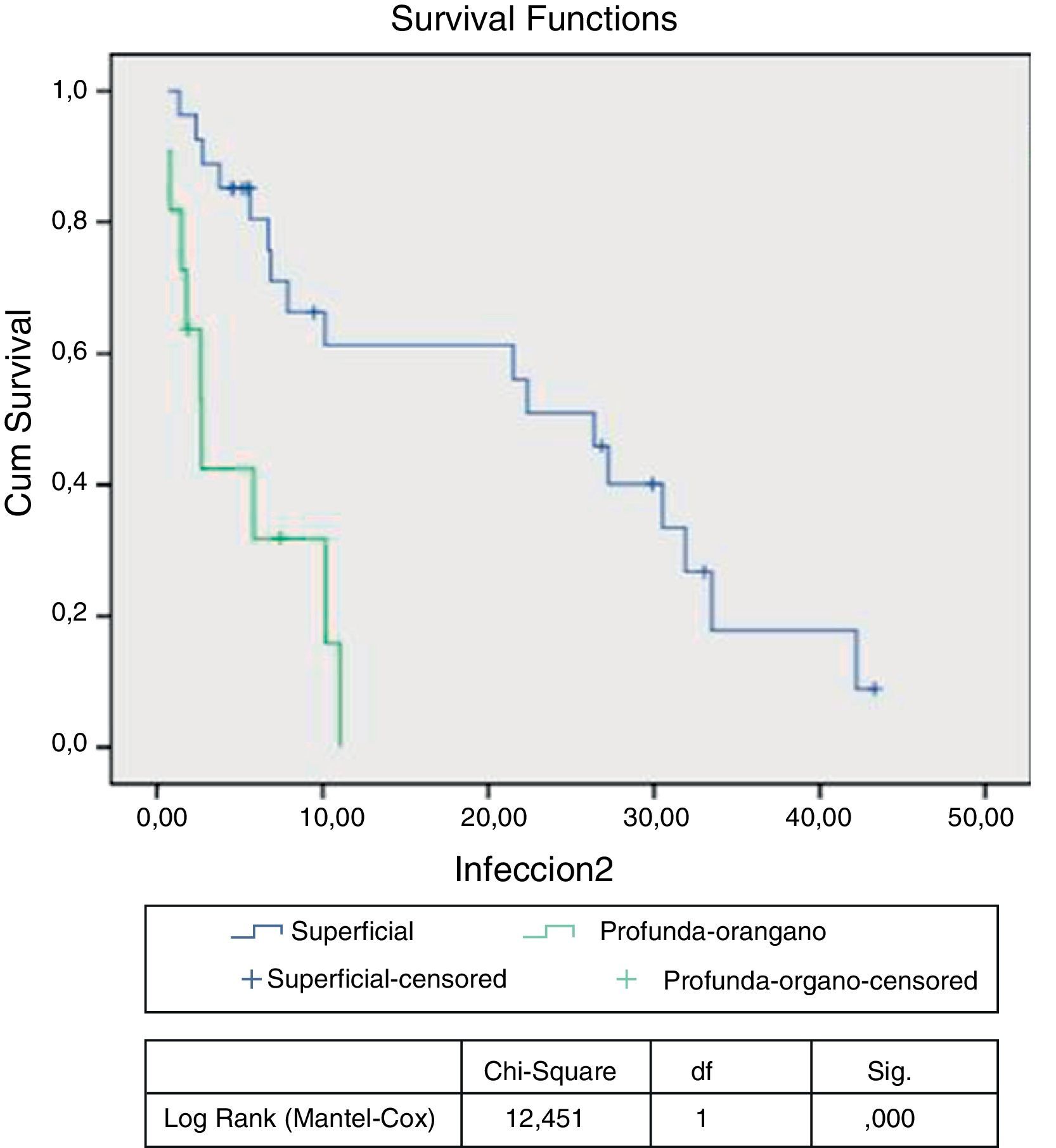
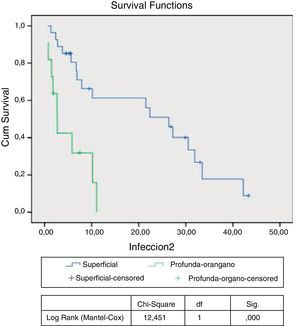
El análisis multivariante de supervivencia indica una asociación entre IHQ y una menor supervivencia libre de amputación, con 1,5 veces mayor riesgo de amputación mayor o fallecimiento en el grupo de pacientes con infección, pero sin alcanzar la significación estadística (HR: 1,521; IC: 0,930-2,487; p=0,095). Realizando un subanálisis en función del tipo de IHQ, y mediante la comparación de las curvas de Kaplan-Meier, observamos una menor supervivencia libre de amputación en pacientes con infección profunda/injerto respecto a infección superficial, que es estadísticamente significativa (p<0,0001) (fig. 1).
DiscusiónLa IHQ es una complicación grave de la cirugía reconstructiva arterial periférica que genera un gran coste hospitalario. Se calcula que en Estados Unidos la IHQ genera un coste extra de 1,6 billones de dólares8. Su incidencia global oscila desde el 17 al 44%3. En nuestra serie es del 14,5%, por tanto, en consonancia con los datos publicados en otros artículos. Si desglosamos la incidencia según el tipo de infección, encontramos una tasa de infección protésica del 2%, semejante, por tanto, a la de otros autores que oscilan del 2 al 6%9.
Respecto al agente causal de infección, y centrándonos en heridas limpias, la mayoría de los artículos describen una mayor frecuencia de gérmenes grampositivos, siendo el S. aureus el patógeno principal8. En nuestro caso, las enterobacterias fueron los microorganismos más frecuentes (27,9%), de los cuales el 19,2% fueron productoras de betalactamasas de espectro extendido. S. aureus fue el segundo germen aislado más frecuente (20,5%), siendo en el 26,3% de los casos meticilin resistentes. Destaca una relevante presencia de bacilos gramnegativos no fermentadores, concretamente de P. aeruginosa (9,57%). Esta diferencia de resultados respecto a la literatura descrita nos ha llevado a iniciar recientemente una revisión específica de la flora bacteriana del paciente vascular de nuestra población para plantear, en función de los resultados, un reajuste de la profilaxis preoperatoria y de la antibioterapia empírica utilizada en nuestro hospital.
El análisis de los factores de riesgo pone de manifiesto un mayor riesgo de desarrollar IHQ en los pacientes mayores de 65 años, correlacionándose con los resultados de diversos autores, como Kent et al.10 que concluyeron que la edad avanzada y la obesidad eran factores de riesgo independientes para infección en cirugía vascular.
La hemodiálisis es otro factor de riesgo identificado en nuestro estudio y que se correlaciona con los resultados de algunos autores, como Greenblatt et al.11, para los que la hemodiálisis fue uno de los factores de riesgo que se asociaron de manera significativa a un mayor riesgo de infección. La uremia está demostrado que deprime el sistema inmunitario, y los pacientes en diálisis presentan una mayor tasa de colonización por microorganismos patógenos como S. aureus meticilin resistentes12.
Adicionalmente, la obesidad (IMC > 30) es otro factor de riesgo descrito en la literatura e identificado en nuestro estudio. Lee et al.3 reportaron una serie de 1.000 bypasses infrainguinales, en los que solamente la obesidad (OR 2,6) y el hematoma postoperatorio (OR 6,4) estaban asociados con un aumento de la IHQ de manera significativa. Por otro lado, otras series de menor tamaño por Chang et al.4 (335 bypasses infrainguinales) y Nam et al.5 (250 bypasses infrainguinales) no encontraron la obesidad como factor predictivo de infección. Existen varios argumentos para justificar el efecto adverso de la obesidad. Por un lado, existe una mayor flora bacteriana en pacientes con mayor panículo adiposo, junto con niveles alterados de moléculas proinflamatorias como la leptina o la adiponectina, que contribuyen a una mayor predisposición a la infección. Adicionalmente, está demostrado que en los pacientes obesos, con la dosis estándar de antibiótico profiláctico preoperatorio, no se alcanzan los niveles adecuados a nivel tisular, a no ser que se aumente la dosis utilizada.
La asociación entre el tiempo quirúrgico y la IHQ está siendo analizada en los últimos estudios. Tan et al.6 registraron en su estudio 2.644 bypasses femoropoplíteos y concluyeron que un tiempo mayor de 260 min de intervención quirúrgica aumentaba el riesgo de infección un 50% en comparación con un tiempo quirúrgico de 150 min. Cruse et al.13 resaltaban que se doblaba la tasa de infección con cada hora que se pasaba en quirófano, mientras que Culver et al.14 encontraron que 3 h era el punto de inflexión para aumentar el riesgo de IHQ en cirugía vascular, correlacionándose con los resultados de nuestro estudio, donde encontramos un mayor riesgo de infección a partir de 180 min.
A diferencia de otros autores10,11,15, no encontramos la diabetes, el sexo femenino ni las transfusiones sanguíneas como factores de riesgo de infección.
La IHQ en cirugía vascular está asociada a un aumento de la morbimortalidad quirúrgica. Vogel et al.7 encontraron que en los pacientes con IHQ, la mortalidad aumentaba del 0,52 al 3,09% en aquellos revascularizados mediante bypass arterial periférico, de un 1,49 a 6,78% en aquellos revascularizados mediante bypass en sector aorto-ilíaco-femoral y del 1,26 al 8,83% en aquellos pacientes tratados mediante embolectomía/trombectomía infragenicular. En nuestro estudio, pese que los pacientes con IHQ tienen un mayor riesgo de amputación mayor o fallecimiento (HR 1,5) no se alcanza la significación estadística, probablemente por una necesidad de mayor muestra poblacional. Por otro lado, sí que encontramos una menor supervivencia libre de amputación que alcanza la significación en los pacientes con infección de injerto/profunda respecto a los pacientes con infección superficial, que se correlaciona con lo descrito en la literatura16.
Este estudio tiene ciertas limitaciones, ya que es un estudio de un único centro con un área poblacional determinada y con una muestra relativamente pequeña, por lo que hay que tener precaución a la hora de generalizar los resultados para el resto de la población.
ConclusionesEn nuestra serie, la incidencia global de IHQ estuvo dentro de los estándares descritos en la literatura, destacando una predominancia de enterobacterias como agente causal. La supervivencia libre de amputación fue menor en los pacientes con infección profunda o injerto que en aquellos con infecciones superficiales. Encontramos 4 factores predictivos de IHQ, lo que permite, por tanto, tras una correcta identificación, establecer estrategias para prevenir la IHQ en cirugía arterial, y evitar así, sus consecuencias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al II curso Cómo escribir y publicar un artículo científico, organizado por la SEACV y a la tutora Dra. Estrella Blanco.
Estudio presentado en el congreso nacional de la SEACV en Castellón en junio de 2015, y en el congreso de la SCACVE en Sitges en mayo de 2015.