El diseño de stent autoexpandible para la implantación de estos dispositivos en la arteria carótida (SAC) ha evolucionado en su morfología desde los no cónicos (SNC) hasta los cónicos (SC); sin embargo, se desconoce la influencia de este cambio. Revisamos los desenlaces de la SAC con estas dos amplias categorías de stents en una revisión retrospectiva de 308 procedimientos de SAC, efectuados desde mayo de 2001 a julio de 2007 en un solo centro. Para tratar la estenosis carotídea extracraneal se usaron SNC o SC autoexpandibles de nitinol asociados a dispositivos de protección embólica cerebral. El análisis de los datos incluyó la demografía, historias clínicas del procedimiento, examen mediante eco-Doppler y arteriografía convencional. El seguimiento medio fue de 18 meses (límites 1-69). La reestenosis se definió como una estenosis de la arteria carótida ≥ 80% en el lugar de implantación del stent, detectada mediante angiografía. La edad media de toda la cohorte era de 71,3 años (75% de hombres y 25% de mujeres). De los 308 casos, 233 eran lesiones de novo y 75 se habían sometido previamente a endarterectomía carotídea homolateral (n = 44) o radioterapia de haz externo (n = 31). El 30% de los pacientes había presentado síntomas neurológicos previos al procedimiento. Se usaron SC en 156 procedimientos y SNC en 152. Las tasas de ictus homolateral y de mortalidad a 30 días fueron del 1,3% y 0,3%, respectivamente. Se produjeron tres (1,0%) ictus adicionales de la circulación posterior. No se observaron diferencias estadísticamente significativas en las tasas totales de ictus a 30 días entre el grupo SC (3,2%, n = 5) y SNC (1,3%, n = 2) (p = 0,5). En el seguimiento a medio plazo, se detectó estenosis u oclusión asintomática en ocho casos (2,6%). Todas afectaron a arterias tratadas con SNC, lo que fue significativamente diferente comparado con las tratadas mediante SC (p = 0,03). Además, en un análisis post hoc de subgrupo se observó una correlación significativa (Chi2 = 0,02) para la reestenosis en “cuellos hostiles” cuando se compararon los SC frente a SNC. Los desenlaces precoces de la SAC entre SC y SNC son comparables. En cambio, los SC autoexpandibles de nitinol pueden asociarse a una menor incidencia de reestenosis significativa u oclusión asintomática comparado con los SNC.
El desenlace de la implantación de un stent en la arteria carótida (SAC) depende en alto grado de la experiencia, criterio e instrumental, al igual que de los factores de riesgo del paciente y de las características de la placa1-5. En particular, la configuración de un stent autoexpandible se reconoce cada vez más como un posible factor pronóstico de los desenlaces precoces y tardíos después de este procedimiento1-3. Una parte de la ecuación es la estructura de las celdas, la extensión del dispositivo y su composición, aunque los cambios desde una morfología cilíndrica hasta otra cónica para adaptarse a la anatomía de la bifurcación carotídea también podrían tener consecuencias clínicas. Esto es importante ya que, en la mayoría de los casos, el stent cruza el origen de la arteria carótida externa (ACE) y requiere una aposición adecuada tanto en la arteria carótida común (ACC) como en la arteria carótida interna (ACI). Muchos stents no cónicos (SNC) se promocionan con el término de ‘autoestrechables’ (self-tapering), aunque, debido al desajuste natural del calibre entre la ACI y la ACC, después de la SAC, es frecuente el sobredimensionado extremo en la primera. Sus efectos desfavorables son un aumento de la fuerza radial externa y una disminución del área de celda libre en la ACI. Los sistemas de diseño de stents cónicos (SC) tratan de reducir a un mínimo estos factores. Aunque su desarrollo es atractivo desde un punto de vista estético, la influencia clínica de este cambio sigue siendo desconocida. El objetivo del presente estudio consistió en analizar retrospectivamente los desenlaces de la SAC utilizando SC y SNC con respecto a los acontecimientos neurológicos y reestenosis.
MétodosPacientesDesde mayo de 2001 a julio de 2007, se efectuaron en el Northwestern Memorial Hospital, Jesse Brown Hospital y Lakeside Veteran Administration Medical Center 308 SAC primarias en un total de 295 pacientes. Todos los datos se revisaron retrospectivamente según los protocolos del comité de investigación de estas instituciones. La revascularización carotídea se efectuó en pacientes que se presentaron con estenosis carotídea asintomática ≥ 80% o sintomática ≥ 50%, según lo determinado mediante angiografía convencional. En todos los pacientes se efectuó un examen preoperatorio con eco-Doppler. En la mayoría también se efectuó una exploración adicional, como angiografía por tomografía computarizada (ATC) o angiografía por resonancia magnética (ARM).
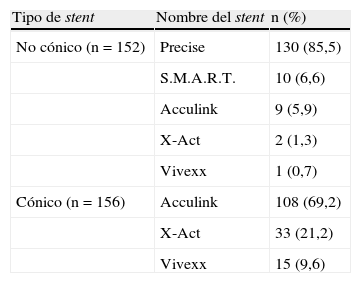
Procedimiento de SACTodos los procedimientos se efectuaron en el quirófano del área de cirugía vascular con una unidad de fluoroscopia fija (V5000; Philips, Eindhoven, Holanda) o portátil (9800 OEC; General Electric, Milwaukee, WI). Previamente se han descrito los detalles completos del procedimiento6,7. En todos los pacientes se utilizó anestesia local antes de realizar un abordaje percutáneo de la arteria femoral. Todos los pacientes recibieron aspirina y clopidogrel como mínimo 24 h antes del procedimiento y continuaron hasta el día 30 postoperatorio. El grado de estenosis se confirmó durante el procedimiento, de acuerdo con los criterios del North American Carotid Endarterectomy Trial8 (NASCET). Antes de cruzar la lesión objetivo, se administró heparinización sistémica para obtener un tiempo de coagulación activado (TCA) de 250-350 s. Se utilizaron dispositivos de protección embólica cerebral (DPE) en el 95% (292/308) de los casos. No se usaron en el 5% de los casos debido a la falta de disponibilidad al principio de nuestra experiencia o a la imposibilidad de introducirlo sin riesgos en los casos posteriores. Los tipos de DPE usados incluyeron el PercuSurge Guardwire (Medtronic Vascular, Santa Rosa, CA), Angioguard (Cordis, Warren, NJ), AccuNet (Guidant, Santa Clara, CA), Filterwire (Boston Scientific, Maple Grove, MN), Emboshield (Abbott Vascular, Redwood City, CA), y Gore Neuro Protection System (W. L. Gore, Flagstaff, AZ). Se efectuó angioplastia predilatación y post-stent con un balón de 4,0 mm y 5,0 mm hinchado hasta la presión nominal, respectivamente (Gazelle, Boston Scientific). En la tabla I se refieren los stents autoexpandibles utilizados. La elección de los dispositivos en la población de pacientes estuvo dictada en gran parte por el estudio de investigación en el que se reclutó al paciente más que por su anatomía arterial. No obstante, en la población tratada en los Veteran Administration Medical Centers, donde los pacientes no se incluyeron en ensayos clínicos, su elección estuvo dictada por la preferencia del cirujano vascular.
SeguimientoEn la mayoría de los casos, un neurólogo de la unidad de ictus efectuó una evaluación neurológica antes y después del procedimiento. Se registraron la mortalidad o los acontecimientos adversos mayores que se produjeron en los 30 días posteriores al procedimiento. Un ictus mayor se definió como un nuevo déficit neurológico descubierto en el período postoperatorio que persistía más allá de 24 h y/o un aumento de 3 puntos en la National Institutes of Health Stroke Scale (NIHSS), mientras que un ictus menor se definió como un déficit después de 24 h sin un aumento en más de 3 puntos en la NIHSS. En todos los pacientes con un supuesto acontecimiento se practicó una tomografía computarizada (TC) y/o resonancia magnética. Un episodio isquémico transitorio (AIT) se definió como cualquier déficit neurológico que se resolvió al cabo de 24 h después de la presentación. También se investigaron los déficits neurológicos permanentes y se confirmaron con una resonancia magnética de perfusión y/o una TC cerebral. Al cabo de un mes del procedimiento y a los 6 meses, 12 meses y, a continuación, a intervalos anuales, se practicó eco-Doppler de control. Se han descrito los criterios ecográficos de nuestro hospital para redefinir una estenosis significativa6. En todos los pacientes con hallazgos eco-Doppler compatibles con reestenosis ≥ 80%, se practicó angiografía para su confirmación y una nueva intervención. El seguimiento medio fue de 18 meses (límites 1-69): 24 meses para el grupo SNC y 12 meses para el grupo SC, respectivamente. Se perdieron para el seguimiento un total de 22 pacientes.
Análisis estadísticoPara comparar la demografía basal se utilizó una prueba t de Student. Para analizar diferencias en las tasas de acontecimientos adversos mayores, mortalidad, ictus y AIT a los 30 días, se usó una prueba exacta de Fisher. Para evaluar la significación estadística de la incidencia de reestenosis u oclusión entre pacientes que recibieron SNC y SC se usó la prueba de Breslow (Wilcoxon). Esta prueba favoreció la incidencia precoz de reestenosis y, por lo tanto, fue más apropiada para examinar los datos con los diferentes períodos de seguimiento. Para evaluar variables diferentes del tipo de stent que podrían haber contribuido a la incidencia de reestenosis se efectuó un análisis de regresión de Cox. Tras analizar los datos, se obtuvo una tabla de residuales de Martingale-Schoenfeld y se efectuó una prueba global del riesgo proporcional para determinar si se violó o no la asunción del cociente de riesgos proporcionales. Para todas las pruebas se consideró estadísticamente significativo un valor de p ≤ 0,05. Todos los análisis estadísticos se efectuaron utilizando el programa STATA 9.2 (StataCorp, College Station, Estados Unidos).
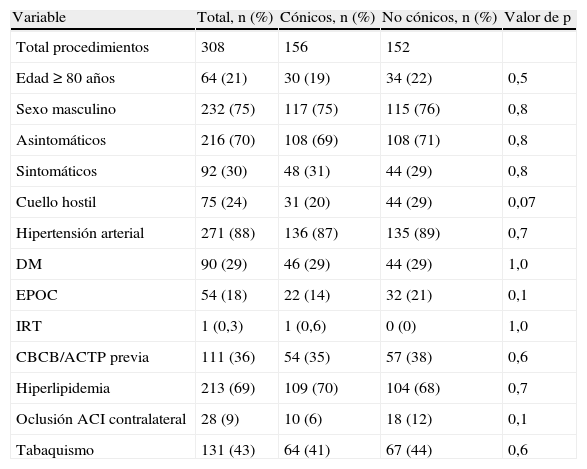
ResultadosPacientesDurante un período de 6 años aproximadamente, un total de 295 pacientes fueron tratados con 308 procedimientos de SAC, 92 (30%) de ellos por patología oclusiva carotídea sintomática. La edad media de todo el grupo fue de 71,3 años (± 9). Un total de 64 pacientes (21%) tenían ≥ 80 años de edad. El 75% de los pacientes eran hombres. En la tabla II se detallan las características basales de los pacientes. Del total de casos, en 156 pacientes se implantaron SC y en 152, SNC. En conjunto, las comorbilidades de ambas cohortes se distribuyeron por igual. La única característica demográfica que se acercó a la significación estadística fue el número de pacientes tratados con “cuellos hostiles” comparado con lesiones de novo. El grupo con cuello hostil incluyó a pacientes que se habían sometido previamente a endarterectomía carotídea (EAC) homolateral o radioterapia de haz externo (SC 20% [n = 31] comparado con SNC 29% [n = 44], p = 0,07) (tabla III).
Demografía
| Variable | Total, n (%) | Cónicos, n (%) | No cónicos, n (%) | Valor de p |
| Total procedimientos | 308 | 156 | 152 | |
| Edad ≥ 80 años | 64 (21) | 30 (19) | 34 (22) | 0,5 |
| Sexo masculino | 232 (75) | 117 (75) | 115 (76) | 0,8 |
| Asintomáticos | 216 (70) | 108 (69) | 108 (71) | 0,8 |
| Sintomáticos | 92 (30) | 48 (31) | 44 (29) | 0,8 |
| Cuello hostil | 75 (24) | 31 (20) | 44 (29) | 0,07 |
| Hipertensión arterial | 271 (88) | 136 (87) | 135 (89) | 0,7 |
| DM | 90 (29) | 46 (29) | 44 (29) | 1,0 |
| EPOC | 54 (18) | 22 (14) | 32 (21) | 0,1 |
| IRT | 1 (0,3) | 1 (0,6) | 0 (0) | 1,0 |
| CBCB/ACTP previa | 111 (36) | 54 (35) | 57 (38) | 0,6 |
| Hiperlipidemia | 213 (69) | 109 (70) | 104 (68) | 0,7 |
| Oclusión ACI contralateral | 28 (9) | 10 (6) | 18 (12) | 0,1 |
| Tabaquismo | 131 (43) | 64 (41) | 67 (44) | 0,6 |
ACI: arteria carótida interna; CBCB/ACTP: cirugía de bypass coronario/angioplastia transluminal percutánea; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IRT: insuficiencia renal terminal.
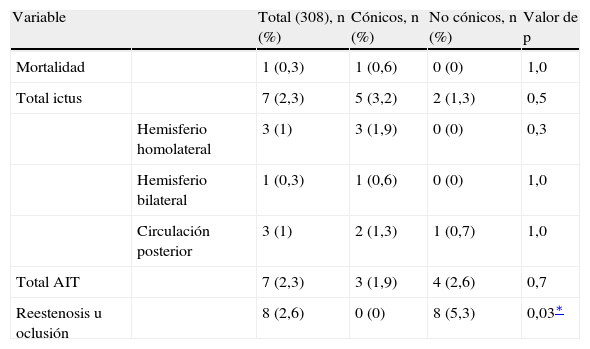
Efectos adversos mayores
| Variable | Total (308), n (%) | Cónicos, n (%) | No cónicos, n (%) | Valor de p | |
| Mortalidad | 1 (0,3) | 1 (0,6) | 0 (0) | 1,0 | |
| Total ictus | 7 (2,3) | 5 (3,2) | 2 (1,3) | 0,5 | |
| Hemisferio homolateral | 3 (1) | 3 (1,9) | 0 (0) | 0,3 | |
| Hemisferio bilateral | 1 (0,3) | 1 (0,6) | 0 (0) | 1,0 | |
| Circulación posterior | 3 (1) | 2 (1,3) | 1 (0,7) | 1,0 | |
| Total AIT | 7 (2,3) | 3 (1,9) | 4 (2,6) | 0,7 | |
| Reestenosis u oclusión | 8 (2,6) | 0 (0) | 8 (5,3) | 0,03∗ |
AIT: episodio isquémico transitorio.
Las tasas de ictus homolateral y de mortalidad a los 30 días fueron del 1,3% y 0,32%, respectivamente. En estas cifras se incluye un paciente que experimentó ictus hemisféricos bilaterales. Se produjeron tres ictus adicionales (1,0%) de la circulación posterior. No hubo una diferencia estadísticamente significativa en las tasas de ictus a 30 días entre el grupo SC (3,2%, n = 5) y SNC (1,3%, n = 2) (p = 0,5). Del total de ictus acontecidos, cuatro se clasificaron como mayores y tres, como menores.
Reestenosis u oclusión en el lugar de implantación del stentEl seguimiento medio para todos los pacientes fue de 18 meses. El seguimiento medio para los grupos SNC y SC fue de 24 meses y 12 meses, respectivamente. La tasa de reestenosis total u oclusión del stent fue del 2,6% (n = 8); todos estos acontecimientos afectaron a pacientes portadores de SNC (p = 0,03). No se violó la asunción de una proporción del riesgo constante, con una p = 0,276 (prueba de la Chi2). El tiempo medio hasta la reestenosis u oclusión fue de 17,6 meses. Al cabo de 6 meses del procedimiento SAC original, se produjeron dos casos de oclusión asintomática; ambos pacientes fueron tratados originalmente para lesiones carotídeas de novo. Durante el seguimiento, seis pacientes desarrollaron estenosis ≥ 80% en el lugar de implantación del stent; uno se encontraba sintomático con AIT. De los seis pacientes, cuatro se habían clasificado como “pacientes con cuello hostil” (EAC homolateral [n = 1], irradiación del cuello [n = 2], bypass de vena safena ACC a ACI tras EAC previa [n = 1]). En los cinco pacientes se efectuaron intervenciones repetidas (angioplastia carotídea sola [n = 3], angioplastia con implantación de un stent [n = 3]), sin que se produjeran complicaciones. Estos pacientes no presentaron signos de reestenosis durante el seguimiento9. Además, un análisis post hoc de subgrupo reveló una correlación significativa (Chi2 = 0,02) para la reestenosis en cuellos hostiles cuando se separaron por SC frente a SNC. Sin embargo, cuando se examinaron las lesiones de novo, no se evidenció una correlación con la reestenosis según el tipo de stent.
Estenosis en los límites del stentDos pacientes desarrollaron una estenosis separada, proximal o distal al stent original implantado en la ACI; ambos tenían antecedentes de radioterapia del cuello. En una paciente se detectó en el eco-Doppler de seguimiento al año una estenosis asintomática del 90%, proximal al SNC original. Esta paciente se sometió a una angioplastia repetida y la extensión del stent proximal sin complicaciones. En el otro paciente se detectó una estenosis sintomática del 99% distal al SC original a los 18 meses; presentaba oclusión conocida de la ACI contralateral y experimentó episodios de síncope. En las imágenes de la ATC se identificaron pruebas de carcinoma de células escamosas recurrente que cubría la ACI distal y daba lugar a una importante estenosis inmediatamente distal al stent previo. Este paciente se sometió a angioplastia e implantación de stent repetidas con un buen resultado angiográfico y la resolución del síncope10. Falleció 7 meses más tarde de un carcinoma metastásico.
DiscusiónLa configuración de los stents autoexpandibles se reconoce cada vez más como un posible factor pronóstico del desenlace tanto precoz como tardío después de SAC1-3. Aunque en otros estudios se han abordado aspectos como la estructura de las celdas, extensión del dispositivo portador y composición de los stents, los efectos del estrechamiento para acomodar la bifurcación carotídea natural no se han analizado1-5 con anterioridad. La presente revisión retrospectiva de SAC practicada con SC y SNC demuestra que las tasas precoces de acontecimientos neurológicos son prácticamente equivalentes en ambos grupos, aunque la incidencia de reestenosis u oclusión es más baja tras la implantación de un stent cónico, en particular entre pacientes sometidos previamente a EAC o radioterapia de haz externo del cuello.
Están disponibles dos configuraciones primarias de stents cónicos liberadores de nitinol: 1) cónico, representado por el Acculink y X-Act (Abbott Vascular) y 2) con zona de transición, representado por el stent Protégé (ev3, Plymouth, MM). En los stents cónicos hay un aumento gradual del diámetro de la endoprótesis desde la zona distal a la proximal, mientras que en los cónicos con zona de transición hay un punto de transición corto en el segmento central. Por otra parte, se dice que las configuraciones de los stents no cónicos son “autoestrechables” en la zona de transición entre la ACI y la ACC. Hasta la fecha, se desconoce cuál es el más apropiado para la bifurcación carotídea natural.
Todavía no se ha determinado la incidencia real de reestenosis en el lugar de implantación del stent después de SAC. Parte de la dificultad de una mejor comprensión del proceso desencadenante de la reestenosis es la ausencia de una definición consensuada de este término. Algunos autores sugieren una denominación de una estenosis ≥ 50%, otros de ≥ 80% e incluso otros cualquier lesión que requiere una reintervención de la lesión diana5,9,11. En el presente estudio usamos como definición una nueva estenosis con reducción del diámetro arterial ≥ 80%. Cuando tuvimos en cuenta esta definición, junto con las oclusiones asintomáticas, descubrimos una tasa de reestenosis del 2,6% en la cohorte íntegra del estudio, que afectó a pacientes a los que se implantaron SNC. En los estudios previos se ha tratado de identificar los factores de riesgo clínico y técnico que aumentan la posibilidad de desarrollo de reestenosis después de SAC. Los pacientes con oclusión arterial inducida por radioterapia o EAC homolateral previa parecen correr un mayor riesgo después de la implantación de un stent en la carótida5,12,13. Previamente, hemos comparado a pacientes con cuello hostil con pacientes cuyas lesiones son de novo y no hemos encontrado diferencias significativas en las tasas de estenosis durante el seguimiento a medio plazo9. Dentro de la cohorte de pacientes del presente estudio, el modelo de regresión de Cox no reveló ninguna variable pronóstica que, combinada con el tipo de stent, se correlacionara con una mayor incidencia de reestenosis. De hecho, la única variable significativa en relación con su incidencia o la de oclusión fue el tipo de dispositivo utilizado. Recientemente, Lal et al14 describieron una mayor incidencia de reestenosis entre pacientes diabéticos tratados con stents carotídeos. Además, este grupo proporcionó un sistema de clasificación de la reestenosis de la SAC que se correlaciona con el pronóstico a largo plazo de estenosis recurrente. El patrón de reestenosis en el lugar de implantación del stent puede contribuir a predecir los pacientes que requerirán intervenciones repetidas.
En arterias coronarias humanas se ha investigado extensamente el mecanismo desencadenante de la reestenosis después de angioplastia coronaria6,15. Se postula que el factor desencadenante de la hiperplasia intimal es secundario a la lesión intimal por distensión de la misma durante las maniobras de angioplastia al igual que la lesión de la lámina elástica interna a partir de los struts del stent y durante su implantación16,17.
En modelos animales donde se usaron stents sobredimensionados para la arteria o stents con diferentes diseños del strut se encontró que el mecanismo responsable de la respuesta hiperplásica no era el sobredimensionado sino, más bien, la lesión de la pared del vaso durante la implantación15-20. Los estudios actuales en seres humanos no han dilucidado si los SNC pueden causar más lesión intimal debido a la fractura de la lámina elástica interna en la porción más estenótica y su relación con un eventual sobredimensionado. Para garantizar una aposición más adecuada a la pared de la ACC, los SNC están en su mayor parte sobredimensionados respecto al diámetro normal de la ACI. Hay una disminución de casi el 50% del diámetro luminal a partir del estrechamiento natural desde la ACC a la ACI. Por lo tanto, con la implantación de un SNC de 8 mm, habría una discrepancia significativa de tamaño en una ACI normal de 5 mm. Las fuerzas de cizallamiento originadas sobre la pared arterial se han estudiado en las arterias coronarias donde los diámetros arteriales pequeños requieren la sobreexpansión del stent y una angioplastia agresiva para prevenir la trombosis y una oclusión aguda en el lugar de implantación. Las arterias carótidas son de mayor diámetro y no sería tan esencial la sobreexpansión del stent después de la implantación. La necesidad de sobreexpansión arterial necesaria con los stents expandibles por balón se ha eliminado con el advenimiento de los stents autoexpandibles de nitinol. Durante la implantación de cualquier tipo de stent, sistemáticamente efectuamos una pre y postdilatación con balones de angioplastia hasta una presión nominal de alrededor de 6-8 atmósferas; una angioplastia post-stent puede causar una lesión intimal que contribuya a una mayor incidencia de reestenosis, y es otro factor que puede contribuir a la misma. No obstante, en la presente serie no se utilizó angioplastia agresiva después de la implantación, lo que sugiere que la sobreexpansión del stent puede ser un factor prominente del desencadenamiento de la proliferación neointimal tardía. En el contexto de la lesión e hiperplasia intimal secundaria se produce un proceso de remodelado de la pared arterial. Hay pruebas ecográficas de que los diámetros luminales aumentan con el tiempo tras la implantación de un stent de la carótida, en particular en el punto de carga de la placa21,22. Para prevenir la estenosis luminal con la SAC se requiere un balance adecuado entre los procesos de hiperplasia neointimal y el remodelado arterial secundario. Hallazgos similares de sobredimensionado del stent y su efecto sobre el diámetro luminal han revelado que éste permite minimizar la hiperplasia neointimal en las arterias de menor calibre20,23. El siguiente paso lógico es identificar qué tipo y forma del stent se utiliza mejor con ciertos tipos de placas ateroscleróticas. Para evaluar los resultados a largo plazo tras la implantación de un stent se requieren técnicas de imagen pre y postimplantación, una evaluación clínica y vigilancia ecográfica. Además, la correlación del patrón de la estenosis en el lugar de implantación del stent en relación con el diseño del dispositivo puede predecir qué morfología se adapta mejor a las lesiones de la carótida.
En la presente serie, la incidencia de estenosis del borde del stent sugiere que la implantación original no excluyó por completo la lesión aterosclerótica o aceleró la progresión de la enfermedad secundaria a los cambios de la tensión de la pared y velocidades del flujo24. Es interesante destacar que los dos casos de estas lesiones afectaron a pacientes con irradiación previa del cuello. Se sabe que la arteritis por radiación afecta a segmentos largos de la arteria y el progreso de la enfermedad afecta a los tejidos periadventiciales, dando lugar a fibrosis y estenosis que continúan progresando con el tiempo. En estos pacientes se desaconseja la EAC por la complejidad de la disección y la posibilidad de lesión nerviosa; sin embargo, pueden requerirse intervenciones endovasculares repetidas para el tratamiento de las lesiones adicionales o, según han sugerido algunos investigadores, para la reestenosis en el lugar de la implantación. Además, en las imágenes angiográficas, es posible que no esté clara la extensión de la enfermedad en la arteria o si se requieren múltiples dispositivos en el procedimiento inicial para tratar a esta población de pacientes.
Las principales limitaciones de esta revisión retrospectiva son la falta del seguimiento a largo plazo en el grupo SC, lo que da lugar a la posibilidad de un sesgo de adelanto en el tiempo de diagnóstico (lead time bias) y quizá la valoración de los pacientes con cuello hostil en el grupo SNC. Sin embargo, incluso con estas consideraciones, durante un período medio de seguimiento de 12 meses, en el grupo SC no se ha identificado reestenosis. Aunque puede parecer un tiempo breve, la mayor incidencia de reestenosis en la SAC en general acontece en los 12-18 primeros meses tras la implantación del stent. Además, cuando se analizan los datos de seguimiento en relación con la incidencia de reestenosis, encontramos una diferencia estadísticamente significativa entre SC y SNC. Con respecto a la valoración de pacientes con cuello hostil del grupo SNC, previamente hemos documentado la ausencia de reestenosis significativa entre las lesiones de novo y las hostiles9. A pesar de estas limitaciones, estos primeros hallazgos son lo suficientemente convincentes para justificar un examen más detenido de los efectos tardíos del diseño del stent por lo que respecta a un sobredimensionado extremo y reestenosis.
ConclusionesEn este grupo de pacientes, el uso de stents cónicos o no cónicos para implantación en la arteria carótida no dio lugar a diferencias en los acontecimientos neurológicos periprocedimiento pero plantea la pregunta de si diseños diferentes pueden condicionar la incidencia de reestenosis en el lugar de implantación. Este efecto se relaciona con el desarrollo de hiperplasia intimal secundaria a la lesión de la íntima arterial provocada durante la manipulación de las guías y las maniobras de angioplastia, y no necesariamente con el sobredimensionado del dispositivo, aunque puede haber otros factores asociados, como la configuración del stent y su adaptación a la morfología arterial. Durante el seguimiento, pueden desarrollarse lesiones en tándem y es probable que se deban a la progresión de la enfermedad aterosclerótica o a la falta de un tratamiento adecuado en el momento de la intervención inicial. Para detectar la aparición de reestenosis es necesaria una vigilancia ecográfica estricta. Los resultados de este estudio sugieren la conveniencia de investigaciones adicionales para determinar la permeabilidad a largo plazo de los diferentes diseños en cuanto a la morfología del stent usados en el tratamiento de la estenosis carotídea.
Presentado en la 31 Reunión Anual de la Midwestern Vascular Surgical Society, 7 de septiembre de 2007, Chicago, IL, EE. UU.
Mark K. Eskandari es asesor de Cook, Cordis, Abbott Vascular Devices, Medtronic, Boston Scientific, Terumo, y W. L. Gore & Associates, Inc.