Aunque en los estudios de publicación reciente se ha documentado un deterioro de las células progenitoras endoteliales (CPE) relacionado con la edad, sigue por dilucidar el papel detallado de un medio envejecido en estas células.
MétodosEn el presente estudio se usaron ratas hembra Sprague-Dawley de 2 meses y 20 meses de edad. Las CPE aisladas de ratas jóvenes (CPEJ) y añosas (CPEA) se cultivaron con suero joven o añoso. La migración y proliferación de las CPE se detectaron con una cámara de Boyden modificada y un análisis MTT, respectivamente. La diferenciación de las CPE se detectó mediante reacción en cadena de la polimerasa retrotranscriptasa (RCP-RT) o mediante clasificación de las células activadas por fluorescencia; la expresión de la proteína Akt y Akt fosforilada se detectó mediante inmunoelectrotransferencia. En modelos de lesión de la arteria carótida de rata se efectuó trasplante de CPE.
ResultadosEl suero joven favorece significativamente la migración, proliferación y diferenciación de las CPEA y aumenta la actividad de la fosfatidilinositol 3-cinasa (PI3-K), al igual que de la óxido nítrico sintasa endotelial comparado con el suero añoso; las expresiones de la proteína Akt total y Akt fosforilada en las CPEA también se regulan significativamente al alza por el suero joven. El número de CPEA trasplantadas en lugares de lesión vascular en el modelo de lesión de la arteria carótida en rata joven aumentó significativamente comparado con el de los modelos añosos. Estos efectos podrían ser atenuados por la wortmanina, un inhibidor específico de PI3-K.
ConclusiónUn medio joven restablece parcialmente la disminución de la actividad de la CPEA y favorece la migración de estas células a los lugares de lesión vascular; la activación de la vía de señalización PI3-K/Akt es, como mínimo en parte, responsable de este proceso.
El declive del potencial de regeneración de los tejidos es la característica distintiva del envejecimiento y, en parte, se debe a los cambios relacionados con la edad de las células madre (citoblastos) específicas de tejido1,2. En estudios recientes efectuados con ratas se ha revelado un deterioro sustancial dependiente de la edad de la angiogénesis3, que se asocia con factores que incluyen un cambio del número de células progenitoras endoteliales (CPE) en la médula ósea y sangre periférica y alteraciones de las propiedades de las CPE4,5. Se ha descrito que la transfusión de CPE derivadas de médula ósea de rata joven (CPEJ) a ratas añosas mejoró más rápidamente la función angiogénica del miocardio afectado que la transfusión de células derivadas de ratas añosas6 (CPEA), lo que sugiere que las CPEJ tienen mejores propiedades en relación con la angiogénesis que las CPEA. No obstante, aunque los tejidos seniles y las células madre derivadas de individuos seniles poseen un menor potencial regenerativo y se asocian a un deterioro de la actividad, comparadas con las derivadas de individuos jóvenes, estos estados pueden invertirse con un medio apropiado. Carlson et al7 demostraron que el músculo senil se regeneraba satisfactoriamente cuando se injertaba en el músculo de un huésped joven. Un estudio in vitro efectuado con ratones también sugirió que el suero de individuos jóvenes aumentaba significativamente la proliferación de células satélite asociadas a miofibras en cultivos seniles, comparado con el suero de ratones añosos, lo que sugiere adicionalmente que el suero joven restableció la regulación al alza del ligando Notch (Delta) y la activación de este ligando en células satélites seniles8. El microentorno es la base de la regulación de la proliferación, diferenciación y participación de la célula madre o citoblasto en la regeneración tisular; estos datos in vivo o in vitro demostraron que los componentes en un medio joven fueron capaces de mejorar los aspectos moleculares y celulares del declive en la activación de las células madre musculares derivadas de individuos seniles; no obstante, sigue por dilucidar el papel de un medio senil en la actividad de las CPE.
La fosfatidilinositol 3-cinasa (PI3-K), con su efector anterógrado directo Akt, desempeña un importante papel en la regulación de múltiples procesos celulares, como la migración, proliferación y diferenciación celular9,10. La activación de esta vía de señalización tiene implicaciones fisiopatológicas significativas en las CPE, como la facilitación de su proliferación, migración y capacidad formadora de colonias a través de la regulación al alza de la actividad de la óxido nítrico sintasa endotelial (eNOS). Dichos efectos podrían atenuarse farmacológicamente mediante el bloqueador específico de PI3-K, la wortmanina o LY29400211 y la inactivación del gen de la fosfoinosítido 3-cinasa gamma deterioraría la neovascularización postisquémica y las funciones de las CPE12. Sin embargo, también sigue por dilucidar el papel de la vía de la PI3-K en los cambios de la actividad de las CPE inducidos por el medio. En consecuencia, prestamos atención a los efectos de un medio senil sobre la actividad de las CPE y la responsabilidad de la vía de señalización PI3-K/Akt.
Materiales y métodosPreparación del suero y cultivo de CPEPara efectuar los experimentos, se usaron ratas hembra, sanas Sprague-Dawley (de 2 y 20 meses de edad, proporcionadas por el Institute of Zoology del Daping Hospital, Third Military Medical University, República Popular de China). Todos los procedimientos fueron aprobados por el comité de investigación con animales de la Third Military Medical University, y la investigación cumplió con la Guide for the Care and Use of Laboratory Animals, publicada por los US National Institutes of Health (NIH Publication 85-23, revisada en 1996). El suero de rata se preparó del modo siguiente: se anestesió a ratas hembra jóvenes (2 meses de edad) y añosas (20 meses de edad) con una inyección intraperitoneal de hidrocloruro de xilacina (4,6mg/kg de peso corporal; Sigma, St. Louis, MO) e hidrocloruro de ketamina (70mg/kg de peso corporal, Sigma); la sangre se obtuvo directamente del corazón con jeringas y se centrifugó a 3.000rpm durante 10min (centrífuga GPR; Beckman, Fullerton, CA); acto seguido, el plasma se incubó en un baño de agua termostática a 4°C durante toda la noche y se centrifugó de nuevo durante 30min; el suero se agrupó para la inactivación de los complementos a 65°C durante 30 minutos; tras filtración aséptica con membrana de filtro con un poro de 0,22 μm tres veces, el suero se recogió y mantuvo refrigerado a –20°C para experimentos adicionales.
Las CPE se cultivaron de acuerdo con las técnicas descritas previamente, que pueden reducir con eficacia y espectacularmente el número de monocitos contaminantes, incluidas las células endoteliales (CE) maduras13-16. En pocas palabras, las células mononucleares derivadas de la médula ósea total (CMN) se aislaron de los fémures y tibias de las ratas mediante centrifugación de gradiente de densidad con la solución de separación Ficoll (Amersham Biosciences, Arlington Heights, IL). Las CMN aisladas se mantuvieron en un medio de Eagle modificado por Dulbecco (DMEM)/medio modificado F12 de Ham (3:1, DMEM/F12; Sigma) suplementado con un 20% (v/v) de suero bovino fetal (SBF) o un 2% (v/v) de SBF combinado con un 20% (v/v) de suero de rata joven o añosa, respectivamente, factor de crecimiento endotelial vascular (VEGF, 20 ng/ml; Sigma), factor de crecimiento fibroblástico básico (bFGF, 5 ng/ml; R&D Systems, Mineápolis, MN), factor 1 de crecimiento similar a la insulina murino recombinante (IGF-1, 10 ng/ml; RD Systems), factor de crecimiento epidérmico humano recombinante (EGF, 5 ng/ml; Clonetics, Wakersville, MD), penicilina (100 U/ml), y estreptomicina (100 U/ml) y se cultivaron en placas (1 x 106 células/cm2) revestidas con fibronectina humana. Estas células no adherentes se translocaron 24h más tarde para ser cultivadas en frascos con medio fresco de cultivo revestidos con fibronectina humana (Sigma). Al cabo de 4 días, se lavaron extensamente las células adherentes para eliminar las células no fijadas y se remplazó el medio por uno fresco que se cambió cada 2 días.
Para un estudio adicional, después de 4 días de cultivo con suero joven o senil, las CPE se tripsinizaron con un 0,25% de tripsina, se lavaron con suero salino tamponado con fosfato (PBS) y se suspendieron en un medio suplementado con un 2% (v/v) de SBF combinado con un 20% (v/v) de suero de rata; se sembraron 5 x 104 células por pocillo en 96 o 6 pocillos (96 well plate/6 well plate) revestidos de fibronectina humana y, 24h más tarde, las células suspendidas se desecharon y se remplazaron por medio fresco con o sin el inhibidor de PI3-K wortmanina (10mg/ml) en dimetilsulfóxido (DMSO, Sigma) a una concentración de 20nM; el medio se cambió cada 2 días.
Tinción celularEl fenotipo CE de las CMN fijadas se confirmó mediante captación de lipoproteína de baja densidad acetilada, marcada con 1,1-dioctacedilo-3,3,3',3'-tetrametilindocarbocianina (Dil-ac-LDL; Invitrogen, Carlsbad; CA) y unión a BS1-lectina conjugada con FITC (Sigma), según lo descrito previamente, después de 4 días de cultivo; las células doble positivas se definieron como CPE en diferenciación17,18. Las células teñidas se identificaron con microscopio de fluorescencia invertida (Leika, Wetzler, Alemania) y su recuento se efectuó con una magnificación x 200.
Para la caracterización de los marcadores de superficie, la inmunofluorescencia se efectuó utilizando un anti-CD133 policlonal de carnero y anti-CD34 monoclonal murino (Santa Cruz Biotechnology, Santa Cruz, CA). En pocas palabras, las células se lavaron con PBS tres veces, se fijaron con metanol frío, se mantuvieron a –20°C durante 15min y se lavaron con PBS durante otros 5min. Se añadió albúmina de suero bovino (ASB, 3%) en PBS y se dejó durante 30min. Acto seguido, las células se incubaron durante una hora a temperatura ambiente con anti-CD133 y anti-CD34 diluidos 1:200 con un 3% de ASB en PBS. Después de un lavado con PBS, las células se expusieron a un anticuerpo secundario conjugado con isotiacianato de tetrarrodamina (TRITC) o isotiocianato de fluoresceína (FITC) (1:400) a 37°C durante una hora en la oscuridad. Como control negativo, se usó isotipo de inmunoglobulina G (IgG).
Análisis de la migración, proliferación y apoptosis de las célulasLa capacidad migratoria de las CPE se determinó en una cámara de Boyden modificada (Jiangshu Qilin Medical Equipment, Haimen, China), según lo descrito previamente19, con algunas modificaciones; los poros de la membrana medían 8 μm de diámetro. Después de 10 días de cultivo, las células se tripsinizaron con un 0,25% de tripsina y se lavaron con PBS tres veces. Se suspendieron 2,5 x 105 células en 50 μm de DMEM/F12 libre de suero y factores de crecimiento y se sembraron de nuevo en el compartimiento superior de la cámara de Boyden modificada. Se añadió VEGF a una concentración de 50 ng/ml al compartimiento superior de las cámaras. Después de 24h de cultivo, las caras inferiores de los filtros se lavaron con PBS y se fijaron con un 2% de paraformaldehído. Para la cuantificación, las células se tiñeron con solución de Giemsa. Las células de las caras inferiores de los filtros se contaron con una magnificación de x 200.
La actividad mitogénica se analizó según lo descrito previamente20. En pocas palabras, las CPE se obtuvieron después de 3 días de cultivo y se sembraron de nuevo en 96 pocillos (96 well plate) en un medio libre de rojo fenol suplementado con un 0,5% de ASB durante toda la noche; acto seguido, se desechó el medio y se añadió a los pocillos un medio fresco libre de rojo fenol suplementado con un 2% (v/v) de SBF combinado con un 20% (v/v) de suero de rata durante 4 días. Antes de efectuar la determinación de la densidad óptica (562nm) con un lector de placas de microcultivo (HT-7000 Plus; Perkin-Elmer Life Sciences, Shelton, CT), las células se suplementaron con 10μl de bromuro 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (MTT, 5g/l) durante 6h y 200μl de DMSO durante 10min.
La proporción de CPE apoptóticas se cuantificó mediante un recuento manual de los núcleos picnóticos y fragmentados después de tinción de Hochest 3342 (Sigma), según lo descrito previamente20,21. En pocas palabras, tras 5 días de cultivo con suero, las CPE (1 x 105 células/pocillo) se incubaron en un medio libre de rojo fenol que contenía factor alfa de necrosis tumoral (TNF-alfa) a una concentración de 10 ng/ml; después de 24h de cultivo, en cada pocillo, se efectuó un recuento de los núcleos picnóticos y fragmentados teñidos con Hochest 3342 como porcentaje de células.
Reacción de polimerasa en cadena con retrotranscripciónEl ARN total de 1 x 106 CPE se extrajo separadamente utilizando Tripure Isolation Reagent (Roche, Diagnostics, Basilea, Suiza), de acuerdo con las instrucciones de los fabricantes. El ADNc first-strand se sintetizó mediante retrotranscripción (RT) de 1,0 μg de ARN total utilizando el kit RT de dos pasos (Promega, Madison, WI). Los cebadores se diseñaron con el programa estadístico Primer Premier 5.0 (Premier Biosoft, Palo Alto, CA), basados en las secuencias publicadas. Todos los cebadores diseñados se posicionaron en sus secuencias de exones y se eligieron de acuerdo con las temperaturas de fusión (annealing), ya que podrían compartir el mismo Thermocycler Program. La singularidad y especificidad de cada cebador se verificaron utilizando el Basic Local Alignment Search Tool (http://www.ncbi.nlm.nih.gov/blast), con la devolución de los números de abordaje a Genbank: eNOS (NM_021838) sentido 5'-atacttgaggatgtggctgtctg-3' y antisentido 5'-atacaggatagtcgccttcacac-3', 450bp; factor de von Willebrand (vWF, XM_001066203) sentido 5'-aggctgggtactacaaactttcc-3' y antisentido 5'- tgacgcatgtacacaaagtcttc-3', 408bp; gliceraldehído-3-fosfato deshidrogenasa (GAPDH, NM_017008; utilizada como control interno) sentido 5'-cccttcattgacct-caactacat-3' y antisentido 5'-agggagttgtcatattt-ctcgtg-3', 326bp. La reacción en cadena de la polimerasa (RCP) se efectuó del modo siguiente: 95°C durante 10min; 38 ciclos de 94°C durante 30 s, 55°C durante 30 s, y 72°C durante un minuto; y, acto seguido, 72°C durante 10min. Los productos amplificados se sometieron a electroforesis en gel de agarosa a 1,5% en el tampón ácido tris-borato-etilenodiaminotetracético (EDTA) (tampón TBE) teñido con bromuro de etidio.
Análisis de la clasificación de células activadas por fluorescenciaLas CPE se incubaron con uno de los anticuerpos siguientes, anticuerpo CD31 monoclonal murino (IgG1 murina) y anti-KDR monoclonal murino (IgG1 murina), a una concentración de 2,5 μg/5 x 104 células en un 1% de ASB a 4°C durante 45min. Acto seguido, las células se incubaron con un anticuerpo secundario de burro conjugado con FITC a 37°C durante 30min (todos estos anticuerpos se adquirieron a partir de Santa Cruz Biotechnology). Después del tratamiento, las células se fijaron en un 1% de paraformaldehído y se efectuó un análisis cuantitativo utilizando el clasificador de células activadas por la fluorescencia (FACS) IV Becton-Dickson (Franklin Lakes, NJ).
Análisis de la actividad de PI3-K y eNOSLa actividad de PI3-K se detectó determinando la cantidad de PI(3,4,5)P3 extraído de las células por medio de un análisis de enzimoinmunosorbencia (ELISA) de formato estándar con el kit PIP3 Mass ELISA (Echelon Biosciences, Salt Lake City, UT). El PI(3,4,5)P3 se extrajo de acuerdo con el protocolo siguiente. Las células (5 x 106) se obtuvieron y centrifugaron (525 x g, 5min, 4°C). El pellet se resuspendió en una solución de un 5% de ácido tricloroacético (TCA)/1mM de EDTA y se centrifugó (525 x g, 5min). Se extrajeron los lípidos neutros añadiendo una solución de MeOH:CHCl3 (2:1); la suspensión se agitó tres veces durante 10min a temperatura ambiente y acto seguido se centrifugó (525 x g, 5min) y el paso se repitió una vez. Los lípidos ácidos se extrajeron añadiendo una solución de MeOH:CHCl3:12M de HCl (80:4:1); la suspensión se agitó cuatro veces durante 15min a temperatura ambiente y, acto seguido, se centrifugó (525 x g, 5min). El sobrenadante se mezcló con CHCl3 y HCl (0,1M), y esta suspensión se centrifugó (525 x g, 5min) para separar la fase orgánica y la acuosa. La fase orgánica se obtuvo y secó en un sistema de secado al vacío. Los lípidos secados se resuspendieron en el tampón PIP3 (50mM de ácido N-2-hidroxietilpiperacina-N'-2-etanosulfónico [HEPES], 150mM de NaCl, 1,5% de Na cholate, pH 7,4) sonicado en un baño de agua durante 5min y se dejaron toda la noche a 4°C. Después de esta extracción, se usó un ELISA de acuerdo con el procedimiento del fabricante (Echelson Biosciences).
La actividad eNOS se determinó evaluando la conversión de L-[guanidino-15N2] arginina a 15N-nitrito con espectrometría de masas/cromatografía de gases según lo descrito previamente22,23. Las CPE se incubaron durante 24h a 37°C con 5mM L-[guanidino-15N2] arginina. Después se calculó el cociente de 15N-nitrito/14N-nitrito formado. El óxido nítrico (NO) es inestable pero sus subproductos nitritos y nitratos son estables. Por lo tanto, el mejor índice de generación de NO es la suma de nitritos y nitratos. Se obtuvo el medio de cultivo de las CPE y se almacenó a –80°C hasta la detección. El nivel de nitrito/nitrato se determinó según lo descrito previamente24,25. En pocas palabras, el nitrato se convirtió en nitrito con nitrato reductasa y el nitrito total se determinó con un kit de reactivo de Griess (Promega). La absorbancia se determinó a 540nm con un espectrofotómetro.
Análisis de inmunoelectrotransferenciaLas proteínas celulares se prepararon y separaron con electroforesis en gel de poliacrilamida dodecilosulfato sódico (SDS-PAGE), según lo descrito previamente26, normalizada para la expresión de GAPDH. Tras separación, las proteínas se transfirieron a una membrana de nitrocelulosa (Amersham Biosciences). Las membranas se bloquearon mediante incubación en suero salino tris-tamponado (pH 7,5), que contenía un 0,1% (v/v) de Tween-20 y un 5% (v/v) de leche en polvo desnatada durante 2h, seguido de 2h de incubación a temperatura ambiente con anti-Akt1 policlonal de carnero (62v kDa), anti-fosfo-Akt1 policlonal de conejo (Ser 473, 70kDa) y anti-GAPDH monoclonal murino (37kDa) (Santa Cruz Biotechnology). Los filtros se lavaron extensamente en suero salino Tris tamponado que contenía un 0,1% (v/v) de Tween-20 antes de la incubación durante una hora con anticuerpo secundario conjugado con peroxidasa. Acto seguido, las membranas se lavaron y revelaron usando Super Signal® Chemiluminiscent Substrate (Pierce, Rockford, IL).
Modelo de lesión de la arteria carótida y trasplante de CPELas lesiones de desepitelización con balón se efectuaron en la arteria carótida de rata después del procedimiento descrito previamente27. En pocas palabras, se anestesió a las ratas mediante inyección intraperitoneal de hidrocloruro de ketamina (70mg/kg de peso corporal) e hidrocloruro de xilacina (4,6mg/kg de peso corporal). Se practicó un abordaje de línea media en el cuello para exponer la arteria carótida externa izquierda. Se introdujo un catéter de embolectomía montado sobre balón de Fogarty de 2F (Baxter Health Care, Irbvive, CA) en la arteria carótida externa izquierda y se hizo avanzar a través de la arteria carótida común hasta el cayado aórtico hinchando el balón con suero salino (alrededor de 0,02ml) hasta percibir una ligera resistencia y, acto seguido, se rotó al mismo tiempo que se tiraba de él hacia atrás a través de la arteria carótida común para eliminar el endotelio del vaso. Este procedimiento se repitió tres veces y, a continuación, se retiró el catéter. Se efectuó ligadura de la carótida externa y se suturó el abordaje. Las arterias carótidas de ratas que recibieron intervenciones simuladas sirvieron como controles. Todos los procedimientos se aprobaron y realizaron de acuerdo con las guías de nuestro centro.
El trasplante de CPE se efectuó en los modelos de lesión. Tras 4 días de cultivo, se tripsinizaron las CPE con un 0,25% de tripsina, se lavaron con PBS tres veces, se marcaron con 4,6-diamino-2-fenilindol (DAPI), se suspendieron en 1ml de suero salino y se trasplantaron (5 x 107 células/kg de peso corporal) poco después de la inducción mediante inyección en la vena de la cola de cada una de las ratas con lesión de la arteria carótida. En el grupo de intervención simulada se usaron los volúmenes de inyección de suero salino correspondientes a cada rata. La administración de wortmanina (10mg/ml en DMSO, diluido con suero salino hasta 10μmol/ml antes de la inyección) se procesó instantáneamente así mismo por la vena de la cola tras el trasplante de CPE; a cada rata de los otros grupos se le administró los correspondientes volúmenes de solvente. Las CPE cultivadas adicionales se marcaron con Dil-ac-LDL como se ha descrito previamente28,29 y se trasplantaron como una inyección de CPE marcadas con DAPI en modelos de lesión.
Acto seguido, las ratas se alojaron en un medio cuya luz, temperatura y humedad estaban controladas y se les proporcionó alimento y agua a voluntad después del trasplante de CPE. En los grupos de inyección de CPE marcada con Dil-ac-LDL, a las 0h, 1h, 3h, 6h, 12h, 1 día, 2 días y cuatro días más tarde, con jeringas, se obtuvieron 7ml de sangre directamente del corazón de ratas cuya carótida se había lesionado, y se calculó el número total de CMN aisladas de la sangre; se analizaron 5 x 104 CMN según lo descrito previamente28,29.
Las CPE marcadas con Dil-ac-LDL se clasificaron a partir de los otros tipos de células utilizando un clasificador de células FACS IV de Becton-Dickson (Franklin Lakes, NJ). Las CMN aisladas de los grupos de control se usaron como control negativo. La proporción de células Dil-ac-LDL positivas se usó para representar el número de CPE trasplantadas en la sangre de los modelos del presente estudio; los porcentajes se convirtieron en células/μl de sangre. En los grupos de trasplante de CPE marcadas con DAPI, 10 días más tarde, se obtuvieron los vasos, se cortaron y se analizaron histológicamente con microscopio de fluorescencia invertida tras inmunotinción con FvW; como control, se usó un isotipo de IgG. La circunferencia de la luz de cada sección se detectó con el programa estadístico Leica QWin y se calcularon las proporciones entre el número de células trasplantadas positivas a la tinción DAPI en el lado luminal de los lugares de lesión y la circunferencia de la luz.
Análisis estadísticoTodos los valores se expresan como media ± desviación estándar (DE). Las diferencias entre los datos se analizaron para la significación mediante un análisis de la varianza para comparaciones múltiples con el programa SPSS 11.0 (SPSS, Inc., Chicago, Estados Unidos). Se consideró estadísticamente significativo un valor de p<0,05.
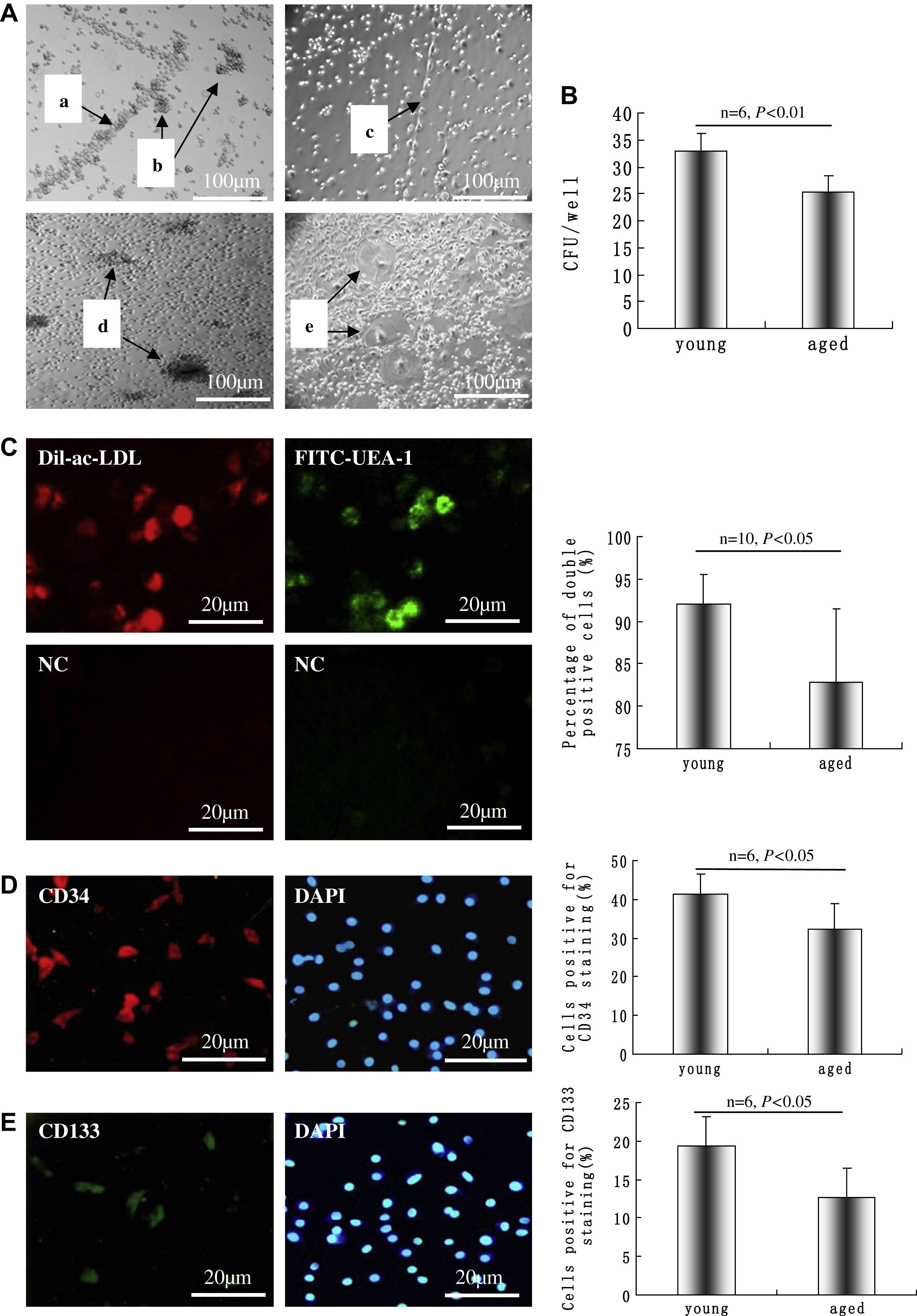
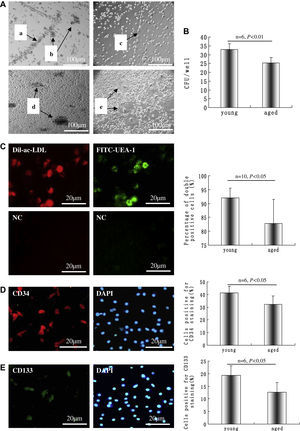
ResultadosCaracterización de las supuestas CPE de rataLas CMN derivadas de médula ósea de rata añosa y joven pueden diferenciarse en células con fenotipos CPE en un medio que contenga factor de crecimiento endotelial, sembradas en placas revestidas de fibronectina. Como se muestra en la figura 1A, algunas de las CMN se disponían en forma de cinturón (a) o en una estructura similar a un racimo (b) en el segundo día después de la inoculación. La células cultivadas mostraron una estructura similar a un cordón después de 3 días de cultivo (c), la formación de focos apareció al cabo de unas 2 semanas (d), y la estructura tubulorreticular apareció al cabo de unas 4 semanas (e). Aunque las CMN aisladas de ratas jóvenes tuvieron un aspecto mejor distribuido que las de grupos seniles, en ambos grupos las células unidas mostraron básicamente la misma morfología e indujeron el mismo patrón de diferenciación con el microscopio óptico. Tras 14 días de cultivo, se analizó la capacidad formadora de colonias; comparado con la del grupo senil, la capacidad del grupo joven aumentó significativamente (32,8±3,5/pocillo comparado con 24,1±4,2/pocillo, p<0,01) (fig. 1B).
Células mononucleares (CMN) derivadas de rata añosa diferenciadas en células con fenotipos de células progenitoras endoteliales (CPE) en un medio que contenía factor de crecimiento endotelial vascular (VEGA) en placas revestidas de fibronectina. A CMN dispuestas en forma de cinturón (a) y en una estructura de tipo racimo (b) en el segundo día tras la inoculación. Las células cultivadas mostraron una estructura de tipo cordón después de 3 días de inoculación (c), la formación de focos apareció al cabo de unas 2 semanas (d) y al cabo de otras 4 semanas apareció una estructura tubulorreticular (e). B Después de 14 días, se analizó el número de unidades formadoras de colonias (UFC) en el grupo joven y senil, n=6. C Los fenotipos CEP se caracterizaron por ser doble positivos a la tinción con lipoproteína de baja densidad acetilada, marcada con 1,1-dioctacedilo-3,3,3',3'-tetrametilindocarbocianina (Dil-ac-LDL) (rojo) y unión a lectina (verde); los dos dibujos en el pie de C son los controles negativos (CN) correspondientes a la captación de Dil-ac-LDL y unión a la lectina; se calcularon los porcentajes de células doble positivas, n=10. La inmunotinción sugirió que las CPE expresaban CD34 (D) y CD133 (E); la integridad celular se documentó mediante tinción nuclear con 4,6-diamino-2-feniliindol (DAPI) (azul), y se calcularon los porcentajes de células positivas, n=6. Los datos se expresaron como medias ± desviación estándar (DE). Se consideró estadísticamente significativo un valor de p<0,05. aged: añosa; Cells positive for CD133 staining (%): células positivas para tinción CD133 (%); Cells positive for CD34 staining (%): células positivas para tinción CD34 (%); CFU/well: UFC/pocillo; NC: CN; Percentage of double positive cells (%): porcentaje de células doble positivas (%); young: joven.
Los fenotipos CE se caracterizaron como doble positivos para la captación de Dil-ac-LDL (rojo) y la unión a lectina (verde) después de 4 días de cultivo (fig. 1C, izquierda). El recuento de 10 campos visuales (x 200) al azar con microscopio de fluorescencia invertida reveló que el porcentaje de células doble positivas en el grupo senil (82,8±8,7%) fue significativamente más bajo que en el grupo joven (92,1±3,4%) (p<0,05) (fig. 1C, derecha). La inmunotinción demostró que las CPE cultivadas ex presaron CD34 (41,2±5,4% y 32,3±6,6% en el grupo joven y senil, respectivamente) (fig. 1D) y CD133 (19,3±3,8% y 12,7±3,7% en el grupo joven y senil, respectivamente) (fig. 1E), lo que indicó los fenotipos de la célula madre/progenitora. En el grupo de isotipo de IgG no se detectó fluorescencia (datos no mostrados).
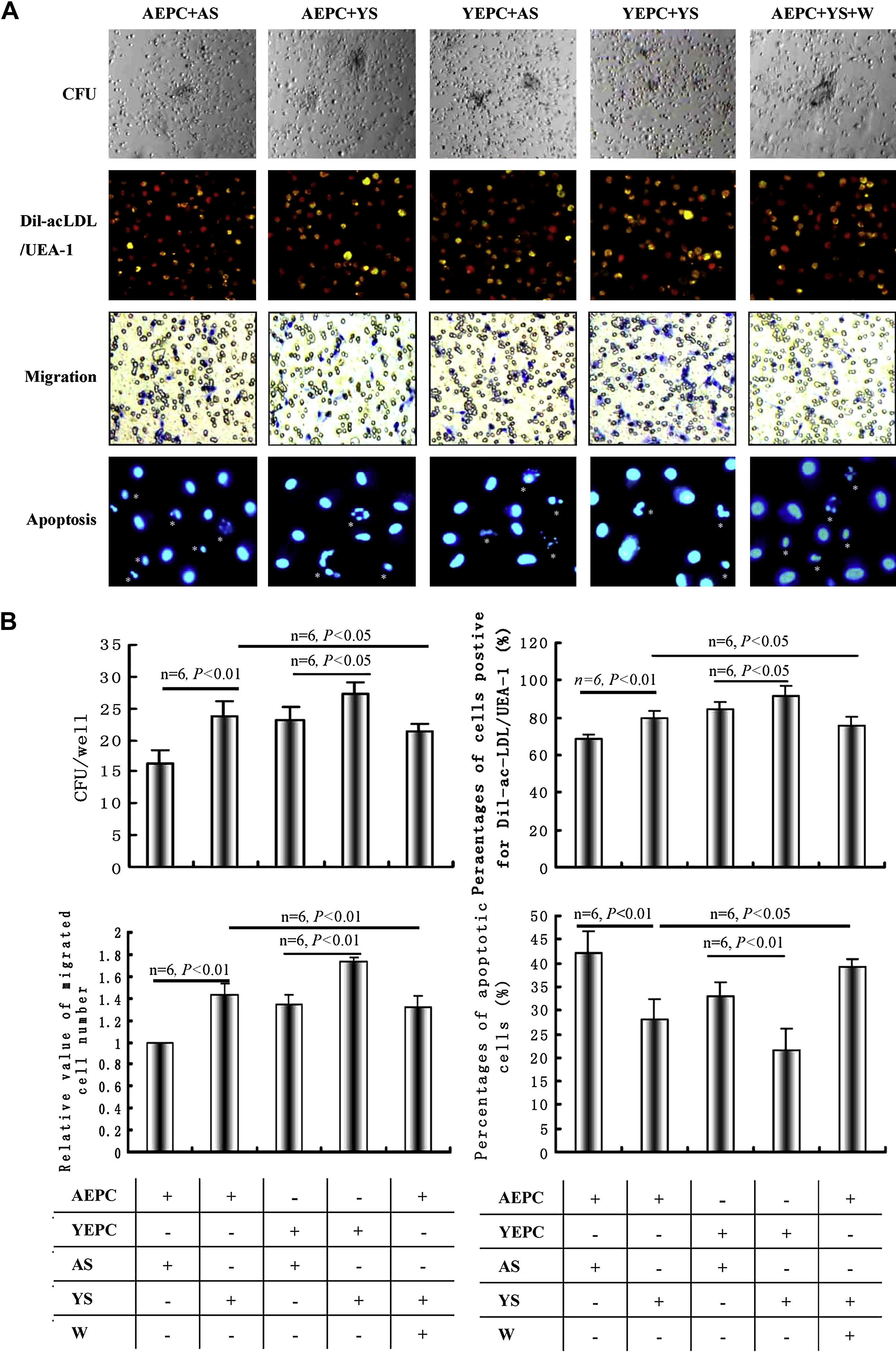
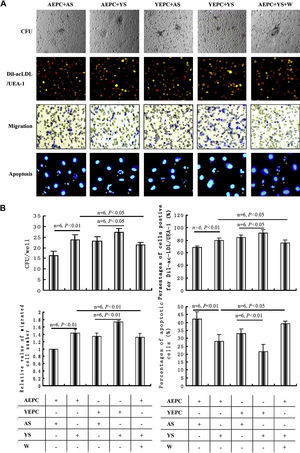
Efectos del suero joven y senil sobre la función y apoptosis de la CPELas unidades formadoras de colonias (UFC) de las CPE se evaluaron después de 2 semanas de cultivo; el porcentaje de CPE doble positivas para la captación de Dil-ac-LDL y unión a UEA-1 se detectó después de 4 días de cultivo; la migración y apoptosis de la CPE se verificaron según lo descrito en “Materiales y métodos” (fig. 2A). El número de UFC, número de células migradas y los porcentajes de CPE doble positivas para la captación de Dil-ac-LDL y UEA-1 en las CPEA cultivadas con suero joven aumentaron significativamente comparado con los de cultivadas con suero senil (UFC 23,7±2,3/pocillo frente a 16,4±2,1/pocillo, p<0,01; porcentaje de células doble positivas 79,8±3,9% frente a 68,9±2,8%, p<0,01; número relativo de células migradas 1,432±0,097 frente a 1,000±0,011, p<0,01). El bloqueador de PI3-K wortmanina redujo eficazmente los efectos (UFC 21,4±1,2/pocillo, p<0,05; porcentaje de células doble positivas 75,8±4,3%, p<0,05; número de células migradas 1,322±0,0096, p<0,01). No obstante, la función de las CPEJ cultivadas con suero senil disminuyó significativamente comparado con la de las cultivadas con suero joven (UFC 23,2±2,1/pocillo frente a 27,4±1,8/pocillo, p<0,05; porcentaje de células doble positivas 84,3±4,5% frente a 91,5±5,6%, p<0,05; número relativo de células migradas 1,348±0,089 frente a 1,739±0,035, p<0,01). El porcentaje de células apoptóticas en las CPEA cultivadas con suero joven disminuyó comparado con el de CPEA cultivadas con suero senil (28,2±4,3% frente a 42,3±4,5%, p<0,01), lo que también pudo bloquearse parcialmente mediante wortmanina (39,2±1,5%, p<0,05) (fig. 2B).
Efectos del suero joven y senil sobre la función y apoptosis de las células progenitoras endoteliales (CPE). A Representativas de unidades formadoras de colonias (UFC), células doble positivas a la tinción con lipoproteína de baja densidad acetilada, marcada con 1,1-dioctacedilo-3,3,3',3'-tetrametilindocarbocianina (Dil-ac-LDL) y unión a UEA-1, capacidad migratoria y apoptosis de CPE. B Análisis mediante histograma de la función y apoptosis de las CPE. Los datos se expresaron como medias ± desviación estándar (DE), n=6. Se consideró estadísticamente significativo un valor de p<0,05. AEPC: CPEA (CPE aisladas de ratas añosas); AS: SS (suero senil); CFU: UFC; CFU/well: UFC/pocillo; Migration: migración; Percentages of apoptotic cells (%): porcentajes de células apoptóticas; Percentages of cells positive for Dil-ac-LDL/UEA-1 (%): porcentajes de células para Dil-ac-LDL/UEA-1 positivas (%);Relative value of migrated cell number: valor relativo de número de células migradas; W: wortmanina; YEPC: CPEJ (CPE aisladas de ratas jóvenes); YS: SJ (suero joven).
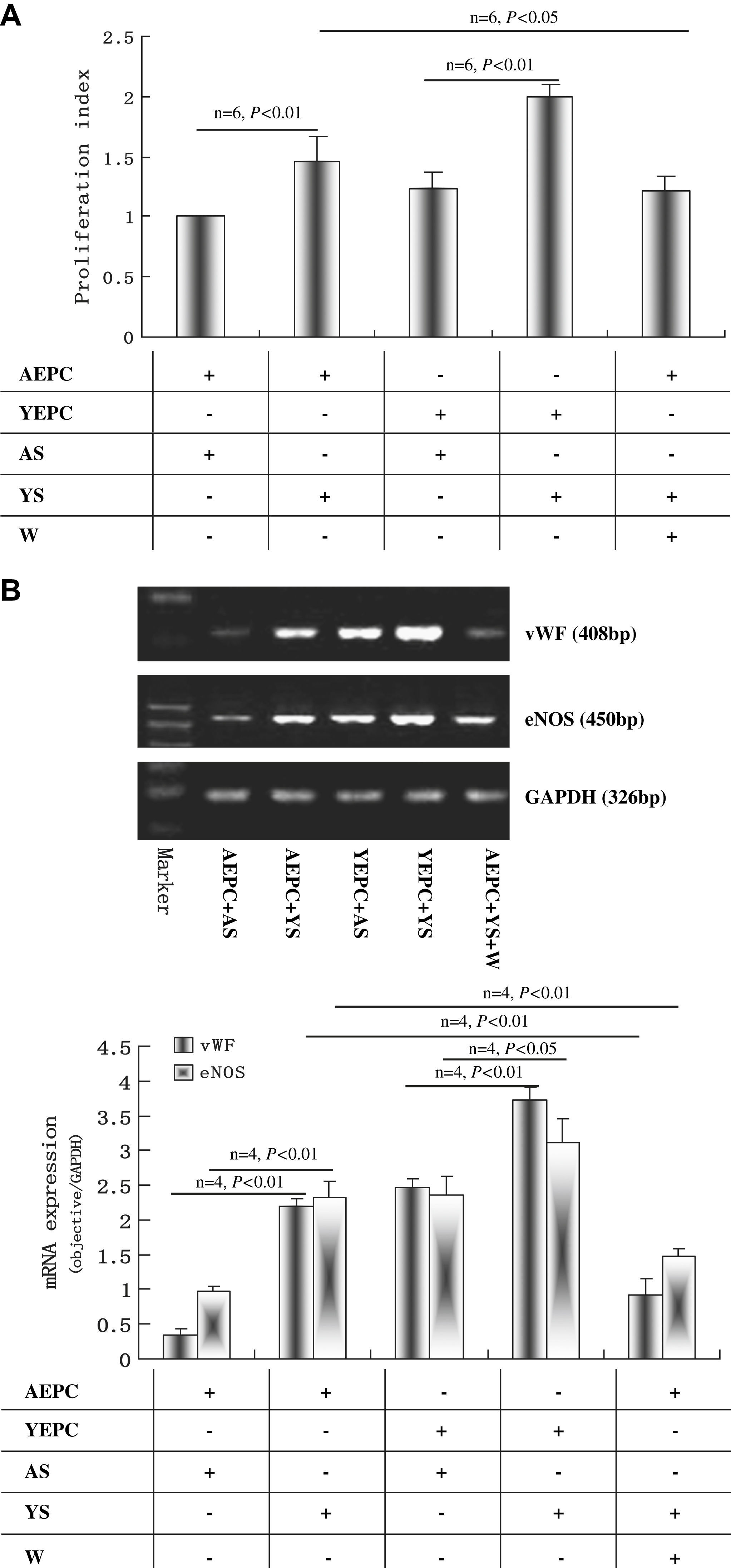
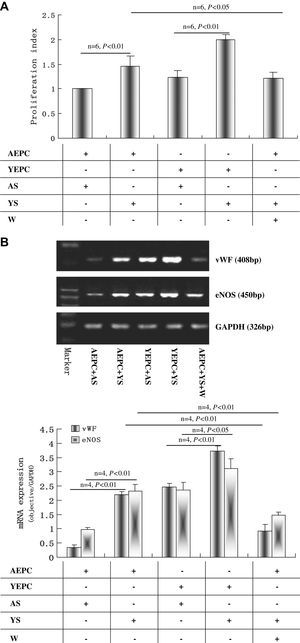
Como se muestra en la figura 3A, el índice de proliferación de CPEA cultivadas con suero joven aumentó significativamente comparado con el de CPEA cultivadas con suero senil (1,45±0,22 frente a 1,00±0,07, p<0,01), mientras que el índice de proliferación de CPEJ cultivadas con suero senil disminuyó significativamente comparado con el de CPEJ cultivadas con suero joven (1,23±0,15 frente a 1,99±0,11, p<0,01). La wortmanina disminuyó significativamente el índice de proliferación de CPEA cultivadas con suero joven (1,22±0,12 comparado con 1,45±0,22, p<0,05) (fig. 3A).
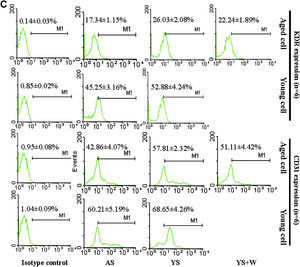
Efectos del suero joven y senil sobre la proliferación y diferenciación de las células progenitoras endoteliales (CPE). A Análisis mediante histograma de la proliferación y diferenciación de CPE, n=6. Los datos se normalizaron con respecto al grupo de CPE añosas (CPEA) cultivadas con suero senil. B Efectos del suero sobre la expresión de ARNm del factor de von Willebrand (FvW) y de óxido nítrico sintasa endotelial (eNOS) en las CPE después de 10 días de cultivo. Se muestra una imagen representativa de la reacción en cadena de la polimerasa retrotranscriptasa (RCP-RT), y se proporciona un análisis de la imagen de las bandas. Los resultados se repitieron 4 veces. C Análisis de células activadas por la fluorescencia (FACS) de la expresión de CD31 y KDR en CPE después de 10 días de cultivo. Los datos se expresaron como medias ± desviación estándar (DE), n=6. Se consideró estadísticamente significativo un valor de p<0,05. AEPC: CPEA; Aged cell: célula senil; AS: SS; CD31 expression (n=6): expresión de CD31; eNOS: óxido nítrico sintasa endotelial; Isotype control: control de isotipo; KDR expression (n=6): expresión de KDR (n=6); Marker: marcador; mRNA expression (objective/GAPDH): expresión de ARNm (objetivo/GAPDH); Proliferation index: índice de proliferación; vWF: FvW; W: wortmanina; YEPC: CPEJ; Young cell: célula joven; YS: SJ.
Después de 10 días de cultivo, los resultados de la RCP-RT demostraron que en CPEA cultivadas con suero joven la expresión de ARNm de FvW y eNOS se regularon marcadamente al alza comparado con las de CPEA cultivadas con suero joven (FvW 2,19±0,11 frente a 0,35±0,09 y eNOS 2,33±0,22 frente a 0,97±0,07, p<0,01, respectivamente); no obstante, las expresiones disminuyeron significativamente en CPEJ cultivadas con suero senil comparado con las de CPEJ cultivadas con suero joven (FvW 2,47±0,13 frente a 3,72±0,19 y eNOS 2,35±0,27 frente a 3,12±0,34, p<0,01, p<0,05, respectivamente). La expresión del ARNm tanto de FvW como de eNOS en CPEA cultivadas con suero joven pudo atenuarse con wortmanina (FvW 0,92±0,24 frente a 2,19±0,11 y eNOS 1,47±0,11 frente a 2,33±0,22, p<0,01, respectivamente) (fig. 3B). Mediante análisis FACS se obtuvieron resultados similares de la expresión de KDR y CD31. El suero joven aumentó significativamente su expresión en las CPEA comparado con el suero senil (KDR 26,03±2,08% frente a 17,34±1,15% y CD31 57,81±2,32% frente a 42,86±4,07%, p<0,01, respectivamente); estos efectos también disminuyeron con wortmanina (22,24±1,89% y 50,11±4,42%, p<0,05) (fig. 3C). Por el contrario, el suero senil disminuyó la expresión de KDR y CD31 en CPEJ comparado con el suero senil (45,25±3,16% frente a 52,88±4,24% y 60,21±5,19% frente a 68,65±4,26%, p<0,01 y p<0,05, respectivamente) (fig. 3C).
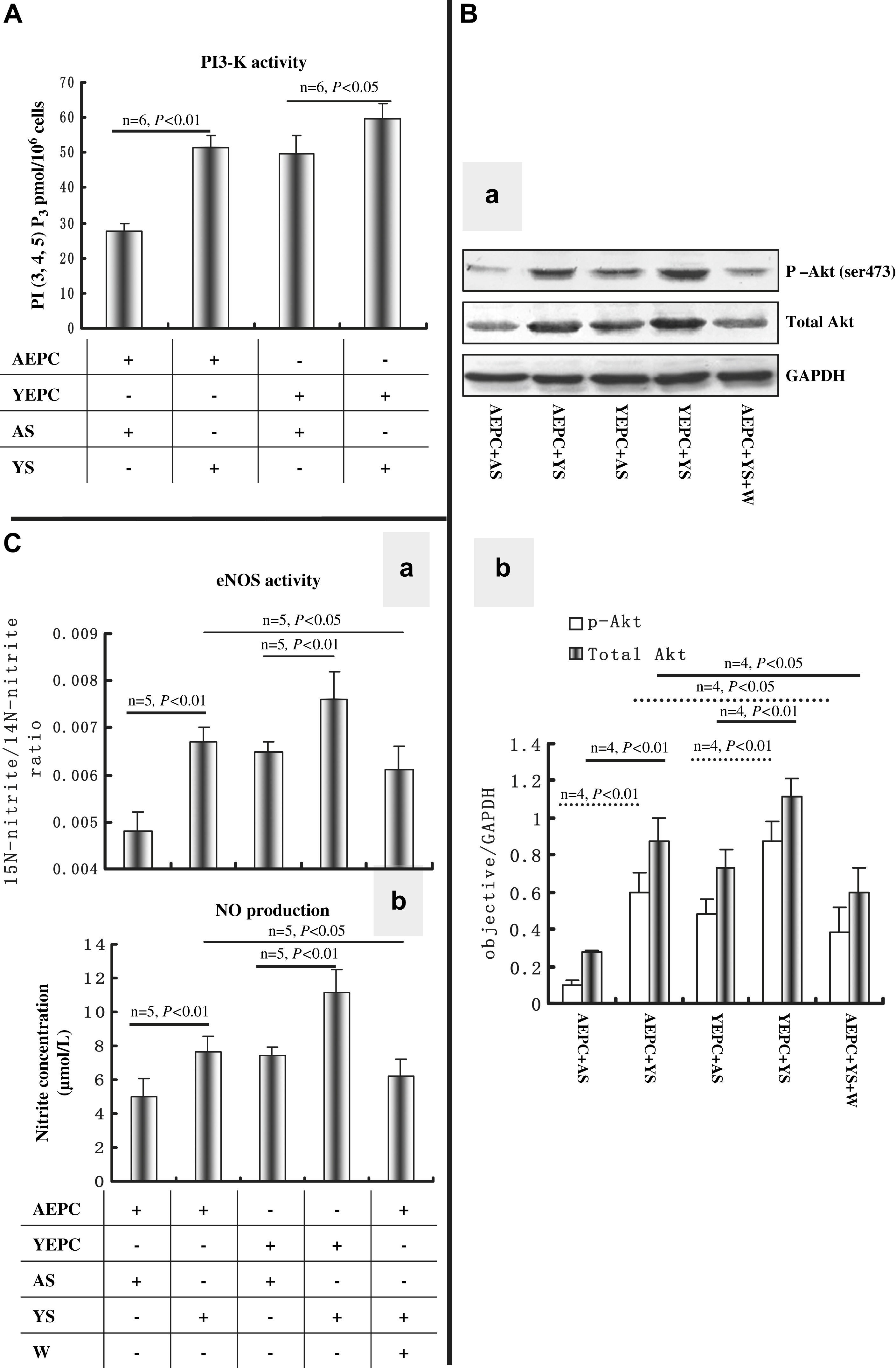
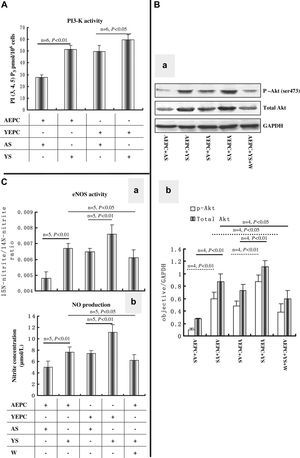
El suero joven aumenta la actividad de PI3-K y de eNOS y regula al alza la Akt y la fosforilación de la expresión de Akt en CPEADado que la función y la diferenciación de las CPE están, en parte, reguladas a través de la vía de señalización PI3-K/Akt30, y que en nuestros experimentos la wortmanina disminuyó, como mínimo en parte, los efectos inducidos por el suero joven en CPEA (figs. 2 y 3), examinamos si el suero derivado de ratas añosas y jóvenes podría influir en la actividad o expresión de PI3-K y Akt después de 10 días de cultivo. El suero joven aumentó significativamente la actividad de PI3-K en CPEA comparado con el suero senil (51,6±3,2 frente a 27,5±2,2, p<0,01); no obstante, la actividad de PI3-K en CPEJ cultivadas con suero senil disminuyó significativamente comparado con la de CPEJ cultivadas con suero joven (49,7±5,3 frente a 59,6±4,2, p<0,05) (fig. 4A). Como un efector retrógrado de PI3-K, la expresión de la proteína Akt y Akt fosforilada en las CPEA cultivadas con suero joven también estuvieron significativamente reguladas al alza comparadas con las de CPEA cultivadas con suero senil; al mismo tiempo, el suero senil disminuyó marcadamente las expresiones de proteína Akt total y Akt fosforilada en las CPEJ comparado con el suero joven (fig. 4B).
El suero joven y senil regula la actividad o expresión de proteína de PI3-K, Akt, y óxido nítrico sintasa endotelial (eNOS) en las CPE. A Efectos del suero sobre la actividad de PI3-K en las CPE, n=6. B Imagen representativa de inmunoelectrotransferencia de la expresión de Akt1 total (62kDa) y Akt1 fosforilado (Ser 473, 70kDa). Los resultados se repitieron, como mínimo, 4 veces (a). Análisis mediante histograma (b) de Akt1 total y Akt1 fosforilado. C Efectos del suero joven y senil sobre la actividad de eNOS (a) y producción de óxido nítrico (NO) (b), n=5. Todos los datos se expresaron como medias ± desviación estándar (DE). En todos los experimentos se consideró estadísticamente significativo un valor de p<0,05. 15N-nitrite/14N-nitrite ratio: ratio 15N-nitrito/14N-nitrito; AEPC: CPEA; AS: SS; eNOS activity: actividad eNOS; Nitrite concentration (μmol/L): concentración de nitrito (μmol/l); NO production: producción de NO (óxido nítrico); objective/GAPDH: objetivo/GAPDH; PI (3, 4, 5) P3 pmol/106 cells: células PI (3, 4, 5) P3 pmol/106; PI3-K activity: actividad PI3-K; W: wortmanina; YEPC: CPEJ; YS: SJ.
La función y diferenciación de las CPE podría estar regulada en parte a través de la vía de transducción de señales PI3-K/Akt/eNOS31 de modo que, en nuestro estudio, también se detectaron actividad de eNOS y producción de NO (fig. 4C, a). La actividad de eNOS en CPEA cultivadas con suero joven aumentó significativamente comparado con la de CPEA cultivadas con suero senil (0,0067±0,003 frente a 0,0048±0,0004, p<0,01) y esta activación pudo atenuarse eficazmente con wortmanina (0,0061±0,005, p<0,05). El suero senil también inhibió la actividad de eNOS en CPEJ comparado con el suero joven (0,0065±0,0002 frente a 0,0076±0,006, p<0,01). La producción de NO (fig. 4C, b) en CPEA cultivadas en suero joven también aumentó significativamente comparado con las cultivadas con suero senil (7,65±0,92 frente a 5,01±1,05, p<0,01), y también fue posible reducir este efecto con wortmanina (69,25±0,97, p<0,05). Al igual que para las CPEJ, en el grupo de suero senil también se identificó una disminución significativa de la concentración de NO (7,45±0,45 frente a 11,3±1,35, p<0,01).
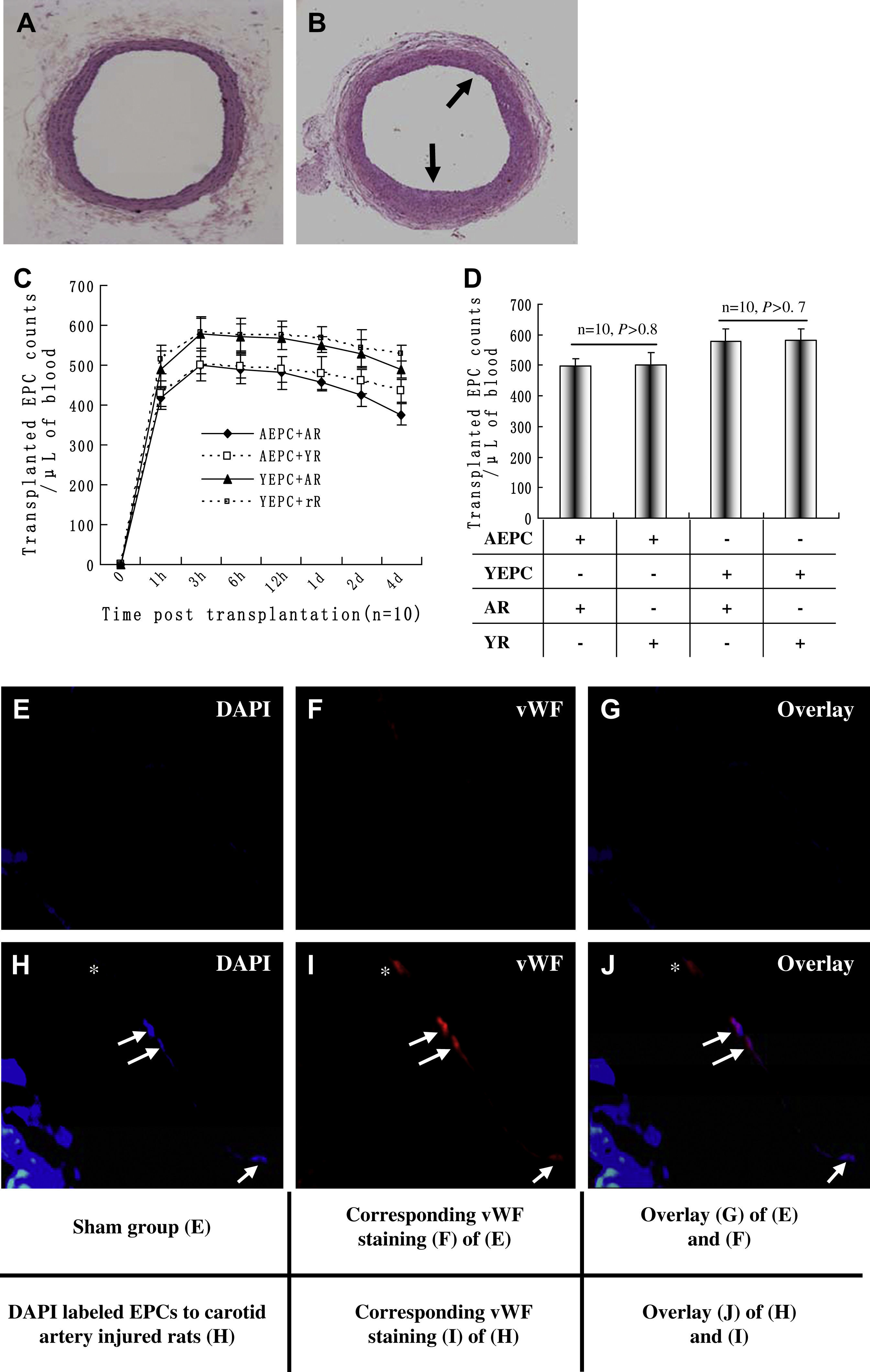
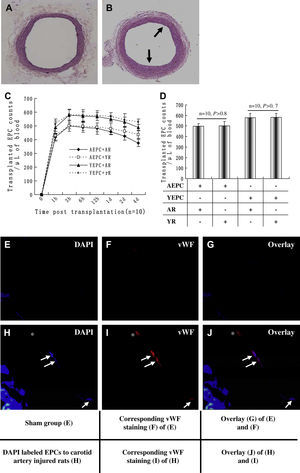
Aumento del número de CPEA que participan en la reendotelización de la pared vascular lesionada de ratas jóvenesPara obtener pruebas adicionales de que un medio senil podría modular la actividad de las CPE, efectuamos experimentos en modelos de lesión de arteria carótida de rata (fig. 5). A los 12 días de la lesión carotídea, se obtuvieron los vasos y se sometieron a análisis histológico. La figura 5B muestra un ejemplo representativo de formación neointimal altamente reproducible en una arteria tras la lesión, comparado con una arteria carótida no lesionada (fig. 5A). El trasplante de CPE se efectuó en modelos de lesión.
Efectos del medio de ratas jóvenes (2 meses de edad) y añosas (20 meses de edad) sobre la participación de las células progenitoras endoteliales (CPE) en la reendotelización de la pared vascular lesionada después del trasplante. A Arteria carótida no lesionada (intervención simulada). B Tinción con hematoxilina y eosina representativa de la formación neointimal (flecha) 12 días después de la lesión CE. En 20 ratas jóvenes y añosas no seleccionadas se repitió la formación neointimal, lo que demostró una formación neointimal altamente reproducible. Se usó el trasplante de CPE marcadas con 1,1-dioctacedilo-3,3,3',3'-tetrametilindocarbocianina (Dil-ac-LDL) para identificar la concentración de las CPE trasplantadas en las muestras de sangre de los modelos de lesión. Los valores máximos en sangre periférica aparecieron a las 3h, persistieron en niveles altos hasta un día después del trasplante y, acto seguido, disminuyeron (n=10). C No se identificaron cambios significativos entre los valores máximos de CPEA trasplantadas en el grupo joven y senil (n=10; p>0,8) o CPEJ trasplantadas en el grupo joven y senil 3h después del trasplante (n=10; p>0,7). D En los grupos de trasplante de CPE marcadas con DAPI, 10 días después del trasplante, se obtuvieron los vasos y se analizaron; pudo detectarse fluorescencia inespecífica en el grupo de trasplante, tanto simulado como de CPE; sin embargo, en el lado luminal del primer grupo (E-G) no se detectaron CPE DAPI-positivas. En el grupo de trasplante de CPE marcadas con DAPI, se encontraron células doble positivas para la tinción DAPI y FvW, lo que sugiere que las CPE trasplantadas fueron reclutadas a los lugares de la lesión y poseían fenotipos endoteliales (H-J). ∗CE que no mostró fluorescencia azul y podría no derivar de las CPE trasplantadas. Todos los datos se expresaron como medias ± desviación estándar (DE). Se consideró estadísticamente significativo un valor de p<0,05. AEPC+AR: CPE derivadas de ratas añosas trasplantadas en ratas añosas; AEPC+YR: CPE derivadas de ratas añosas trasplantadas en ratas jóvenes; AR: rata añosa; Corresponding vWF staining (F) of (E): tinción FvW correspondiente (F) de (E); Corresponding vWF staining (I) of (H): tinción FvW correspondiente (I) de (H); DAPI labeled EPCs to carotid artery injured rats (H): CPE marcadas con DAPI a ratas con lesión de arteria carótida (H); Overlay (G) of (E) and (F): superposición (G) de (E) y (F); Overlay (J) of (H) and (I): superposición (J) de (H) e (I); Overlay: superposición; Sham group (E): grupo simulado (E); Time post transplantation (n=10): tiempo postrasplante (n=10); Transplanted EPC counts/μL of blood: recuentos de CPE trasplantadas/μl de sangre; vWF: FvW; YEPC+AR: CPE derivadas de ratas jóvenes trasplantadas en ratas añosas; YEPC + rR: CPE derivadas de ratas jóvenes trasplantadas en ratas jóvenes; YR: rata joven.
Como se muestra en la figura 5C, el número de CPE trasplantadas en sangre periférica se encontró en un estado dinámico después del trasplante. La concentración de células Dil-ac-LDL positivas en sangre periférica aumentó considerablemente incluso al cabo de una hora del trasplante en todos los grupos; los valores máximos aparecieron a las 3h (CPEA + rata añosa 471,5±21,4, CPEA + rata joven 501,7±41,3, CPEJ + rata añosa 579,4±43,6 y CPEJ + rata joven 581,5±37,2; n=10), persistieron en niveles altos hasta un día después del trasplante y, acto seguido, disminuyeron. No se identificaron cambios significativos entre los valores máximos de CPEA trasplantadas en el grupo joven y senil (joven frente a senil 501,7±41,3 frente a 471,5±21,4, n=10; p>0,8) o CPEJ trasplantadas al grupo joven y senil (joven frente a senil 581,5±37,2 frente a 479,4±43,6, n=10; p>0,7) (fig. 5D).
El análisis histológico se efectuó en los grupos de trasplante de CPE marcadas con DAPI. Los resultados demostraron que podía identificarse fluorescencia inespecífica en el grupo tanto de trasplante de CPE como el simulado; sin embargo, en el lado luminal de este último no se detectaron CPE DAPI positivas (figs. 5E-G). En el grupo de trasplante de CPE marcadas con DAPI, se encontraron células doble positivas para la tinción DAPI y FvW (figs. 5H-J), lo que sugiere que las CPE trasplantadas se reclutaron hasta los lugares de la lesión y poseían fenotipos endoteliales.
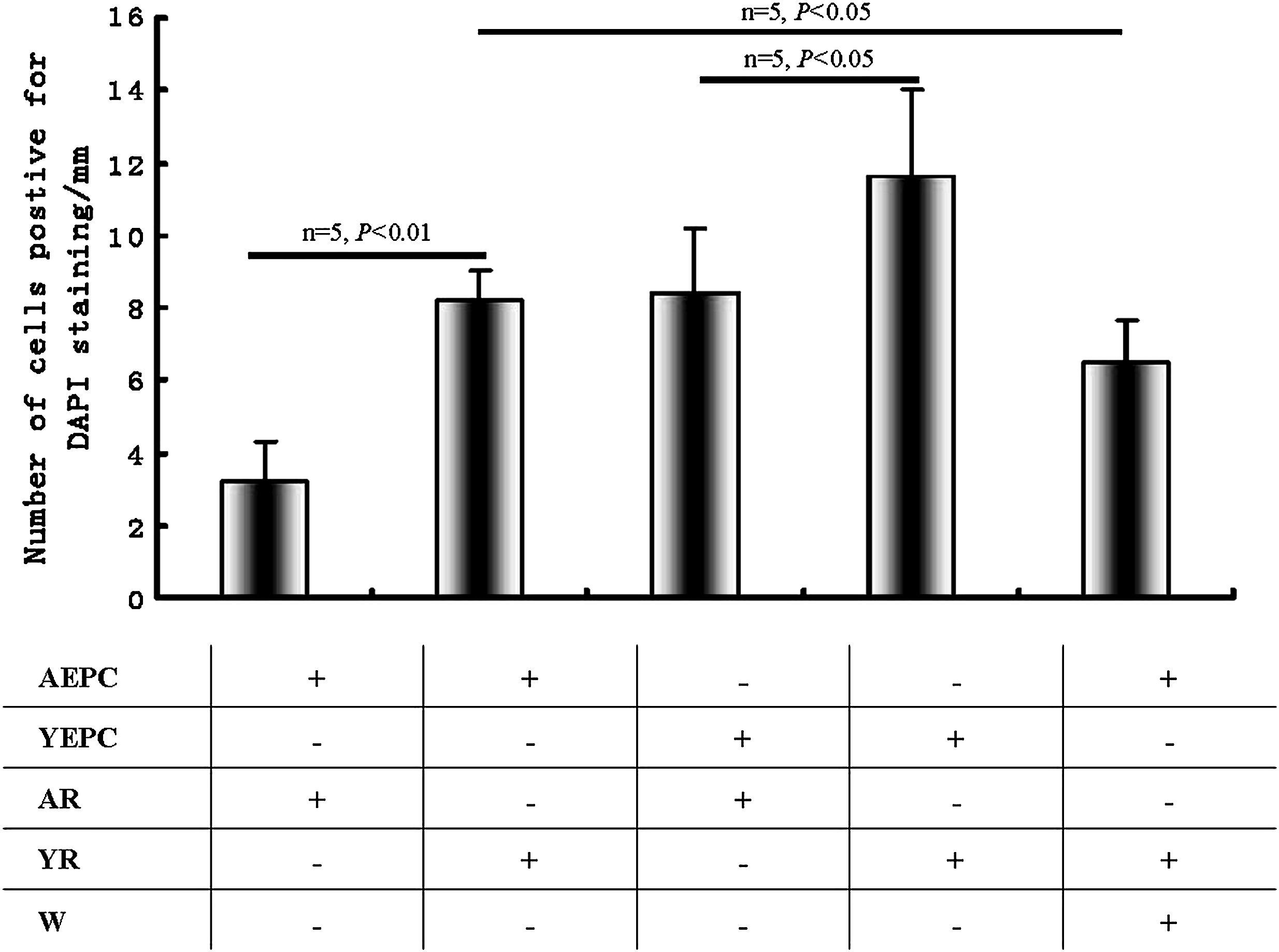
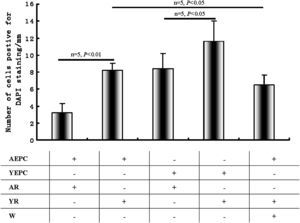
En el lugar de la lesión, la cuantificación de CPE teñidas con DAPI (fig. 6) demostró que las proporciones del número de CPEA trasplantadas y la circunferencia de la luz en ratas añosas disminuyeron significativamente comparado con las del grupo de ratas jóvenes (3,2±1,1 frente a 8,2±0,8, p<0,01); la wortmanina también redujo este efecto razonablemente (6,5±1,2, p<0,05). Cuando las CPEJ se trasplantaron en ratas añosas, las proporciones disminuyeron significativamente, comparado con las del grupo joven (1,4±1,8 frente a 11,6±2,4, p<0,05).
Análisis de la migración de células progenitoras endoteliales (CPE) al lugar de lesión vascular. Se calcularon los cocientes entre el número de células trasplantadas positivas para la tinción con 4,6-diamino-2-feniliindol (DAPI) en el lado luminal de los lugares de la lesión y la circunferencia de la luz de las secciones. El histograma es el sumario estadístico de las CPE positivas para la tinción DAPI. Los datos se expresaron como medias ± desviación estándar (DE), n=5. Se consideró estadísticamente significativo un valor de p<0,05. AEPC: CPEA; AR: rata añosa; Number of cells positive for DAPI staining/mm: número de células positivas para tinción DAPI/mm; W: wortmanina; YEPC: CPEJ; YR: rata joven.
El trasplante de CPE como estrategia terapéutica para las enfermedades vasculares se consideró tan pronto como se descubrió32,33. Sin embargo, la capacidad de estas células para la corrección del endotelio lesionado o el remodelado vascular después del trasplante está regulada por muchos factores, siendo el envejecimiento uno de los más importantes que regulan su actividad e influye en los resultados de las aplicaciones de estas células3,6,34. Las CPEA tienen un potencial significativamente reducido de proliferación, migración y formación de clonas comparado con las CPEJ. La transfusión de estas últimas a ratas añosas mejoró con más facilidad la función angiogénica del miocardio deteriorado que la de CPEA6. Por una parte, el envejecimiento puede influir directamente en las CPE como consecuencia del agotamiento de la actividad3,5. Por otra parte, el envejecimiento afecta indirectamente a las células madre, a través de acciones en su medio, lo que se traduce en cambios del perfil del factor de crecimiento angiogénico y un aumento de sustancias tóxicas en el microentorno. Ambos dan lugar a un deterioro de la respuesta vascular de estas células a los factores de crecimiento endotelial y a una disminución del potencial de estas células para la regeneración endotelial35,36. Aunque las células madre/progenitoras de tejidos o de individuos seniles se caracterizan por una disminución de la actividad y pueden dar lugar al fracaso de la regeneración tisular, la activación de estas células puede restablecerse en un medio apropiado1. El declive del potencial de regeneración de un tejido se debe hasta cierto punto a los cambios relacionados con la edad de las células madre específicas de tejido. No obstante, Carlson et al7 demostraron que el músculo senil se regeneraba satisfactoriamente cuando se injertaba en un huésped joven; la exposición de células satélite derivadas de ratas añosas a suero joven daba lugar a una mayor expresión del ligando Notch (Delta) y a un aumento de la proliferación8, lo que sugiere que la capacidad de regeneración intrínseca de las células madre permanece en buena parte intacta incluso cuando envejecen; después de un trasplante, la actividad de las células madre/progenitoras podría estar modulada por factores sistémicos en un medio relacionado con el envejecimiento.
En el presente estudio, demostramos que el suero joven favoreció significativamente la actividad funcional de las CPEA comparado con el suero senil; por el contrario, el suero senil inhibiría la actividad de las CPEJ, lo que sugiere que un medio envejecido podría modular las acciones fisiológicas de las CPE después de un trasplante. Un estudio efectuado in vivo en ratas demostró adicionalmente que un medio joven puede facilitar que las CPEA participen en la reendotelización de la pared vascular lesionada comparado con un medio envejecido; al mismo tiempo, el medio envejecido disminuiría la capacidad de las CPEJ trasplantadas para una corrección endotelial.
Se sabe que numerosas vías de señalización, como Wnt, raf-ERK (cinasa relacionada con la señal extracelular) y Notch, son responsables de la actividad celular37. PI3-K se expresa ampliamente y desempeña papeles decisivos en las respuestas biológicas de las células, incluida la supervivencia y la proliferación. PI3-K cataliza la conversión de fosfatidilinositol-3,4-bifosfato (PIP2) a fosfatidfilinositol-3,4,5-trifosfato (PIP3). Este último sirve para reclutar las proteínas contenidas en el dominio de homología de la plextrina (PH), como Akt, en la membrana plasmática. Esta última, también conocida como proteincinasa B, puede ser activada por diversos factores de crecimiento de un modo dependiente de PI3-K y sirve de regulador multifuncional de la biología celular. La vía de señalización PI3-K/Akt desempeña un importante papel en la regulación, migración, proliferación y diferenciación de las CPE9,38. En el presente estudio encontramos que el suero joven pudo aumentar significativamente la actividad de PI3-K en las CPEA y que el suero senil disminuyó significativamente su actividad en las CPEJ. También se confirmó una tendencia similar en la expresión de Akt y Akt fosforilado. El óxido nítrico puede ser secretado por las CPE y, a su vez, desempeña un importante papel en la actividad de estas células; puede regular la corrección endotelial y el desarrollo vascular a través de la regulación de la movilización y proliferación de estas células mediante activación de la vía de señalización PI3-K/Akt39. Los hallazgos del presente estudio demostraron que la actividad eNOS y la secreción de NO en las CPEA podrían aumentar significativamente mediante suero joven pero en las CPEJ eran inhibidas marcadamente por suero senil. Los efectos en las CPEA inducidos por un medio joven pudieron ser atenuados en parte por el bloqueador de PI3-K wortmanina, lo que sugiere que esta vía de señalización participó en los efectos del medio senil sobre las CPE. Sin embargo, puesto que la wortmanina no produjo la abolición completa de los efectos de las CPEA inducidos por el medio joven y debido a los complejos componentes del medio relacionado con el envejecimiento, sin duda, la vía de la PI3-K/Akt no es la única responsable de estos efectos; en experimentos adicionales, deben examinarse los papeles detallados de otras vías.
Los hallazgos del presente estudio indican que los factores sistémicos en el medio senil pueden modular en gran parte la vía de señalización molecular decisiva para la actividad de las CPE, y el medio sistémico de un animal joven favorecería una reendotelización más satisfactoria relacionada con estas células, comparada con el de animales seniles. Los estudios recientes han demostrado que algunos factores como VEGF, IGF-I40 y los estrógenos20 pueden aumentar la actividad de estas células en individuos jóvenes y seniles; se ha observado que los niveles de estos factores en sangre periférica disminuyen con el desarrollo del envejecimiento40-42. Por el contrario, el nivel de los productos finales de glucosilación avanzada (advanced glycation end products [AGE]) en sangre periférica aumentará con el envejecimiento y se ha observado que los AGE inducen disfunción de las CPE43. Otros factores, como el TNF-alfa, interleucina 1beta e interferón gamma, también cambian con el envejecimiento44; no obstante, los papeles de la mayoría de estos factores en la actividad de las CPE siguen siendo desconocidos. Deben emprenderse estudios adicionales para identificar sistémicamente los factores que en el envejecimiento tienen una influencia tan decisiva en las CPE y examinar su mecanismo correspondiente. Nuestros resultados sugieren que las CPEA conservan parte de su potencial intrínseco, pero que el medio sistémico senil les impide alcanzar una activación íntegra. Los hallazgos del presente estudio proporcionan una nueva comprensión del mecanismo de la corrección endotelial relacionada con las CPE.
El presente estudio se financió con becas de la National Natural Science Foundation de China (30470729 y 30700889), Military Eleven Plan (06J013), National Plan of New Technology Development (2006AA020902), y Natural Science Foundation of Postdoctoral Research, Xinqiao Hospital, Third Military Medical University (2005A0132). Deseamos expresar nuestro agradecimiento al Dr. Huali Kang por sus consejos técnicos.