El objetivo de este estudio fue determinar si existen diferencias significativas en la composición de las placas entre los vasos poplíteos y tibiales en pacientes con arteriopatía periférica (AP) grave. Cuarenta y cuatro pacientes con AP necesitaron una amputación supragenicular (n=38), infragenicular (n=5), o genicular (n=1) debido a una sepsis o gangrena del pie. Se obtuvieron 51 vasos (tibial anterior, n=9; tibial posterior, n=10; peroneo, n=3; poplíteo, n=29) y fueron sometidos a una evaluación mediante ecografía intravascular (IVUS) ex vivo a las 24h de la amputación. Se obtuvieron los datos de las IVUS secuenciales a intervalos conocidos a lo largo de todo el vaso y, posteriormente, se analizaron con técnicas de radiofrecuencia para cuantificar la composición de la placa, el volumen de la placa, y el volumen vascular total. La composición de la placa se clasificó como fibrosa, fibroadiposa, núcleo necrótico, y calcio denso. Se obtuvieron los datos clínicos a través de la revisión de las historias clínicas electrónicas en el momento de la amputación. Se realizaron pruebas estadísticas bilaterales para comparar los componentes en cada placa. Los resultados se expresan como porcentaje medio ± error estándar de la media. Los vasos tibiales presentaron más calcio denso dentro de estas placas que las arterias poplíteas (33,8±5,6 frente a 10,6±1,9%, p<0,001). Por consiguiente, los vasos distales tuvieron menos placas fibroadiposas y fibrosas que las arterias poplíteas (7,7±1,4 frente a 13,1±1,2%, p<0,005; 42,4±4,7 frente a 61,4±2,2%, p<0,001, respectivamente). La composición del núcleo necrótico de la placa fue similar entre las arterias tibiales y poplíteas (16,1 frente a 14,9%, p = no significativo). Los factores clínicos, como diabetes, hiperlipidemia, e insuficiencia renal crónica, no se asociaron con las diferencias en la composición de la placa en el análisis univariante. A medida que se avanza distalmente en el árbol arterial de los pacientes con AP, el contenido en calcio de la placa aumenta al disminuir el área de placa fibroadiposa. No se observó que los factores clínicos y demográficos, con la excepción del tabaquismo, estuviesen asociados con la composición de la placa aterosclerótica.
Se sabe que la calcificación vascular existe en varios lechos arteriales de todo el sistema circulatorio. Su presencia suele estar asociada con la aterosclerosis, una patología inflamatoria crónica, cuyo grado está relacionado con la cantidad global de aterosclerosis1. Se sabe que factores clínicos, como diabetes, influyen en la calcificación2, que es un marcador conocido de episodios cardiovasculares futuros3.
Si bien es ampliamente conocido que la calcificación y la aterosclerosis coexisten en varios vasos, no se conocen por completo las diferencias en la composición de la placa en el árbol arterial. Se ha valorado la hipótesis de que pueden existir diferencias notables entre las arterias situadas por encima y por debajo de la rodilla. Un trabajo publicado recientemente4 por nuestro grupo condujo a esta hipótesis a partir de la evaluación de numerosos cortes histológicos procedentes de las arterias poplíteas y tibiales.
La ecografía de superficie, la resonancia magnética (RMN), y la tomografía computerizada (TC) apenas determinan los componentes y la estructura de la pared vascular, como mínimo en su estado actual de evolución. La ecografía intravascular (IVUS) proporciona información estructural importante sobre la pared arterial. Durante los últimos años, los avances que incluyen la reconstrucción mediante imágenes tridimensionales y los métodos de análisis han hecho progresos significativos permitiendo estudios IVUS cuantitativos con uso clínico5. La IVUS puede proporcionar información sobre la composición de la placa aterosclerótica que se correlaciona bien con los resultados histológicos6,7.
MétodosDesde 2004 hasta 2007, 124 pacientes fueron sometidos a una amputación infragenicular alta o supragenicular por isquemia crítica de la extremidad inferior, pérdida tisular importante, gangrena ascendente, o sepsis del pie que imposibilitaba el salvamento de la extremidad. Durante este tiempo, más de 800 pacientes al año fueron sometidos a revascularización de la extremidad inferior. Además, un 4% de la población con arteriopatía periférica (AP) severa requirió amputación mayor.
Se examinó el tejido arterial disponible para determinar la extensión de la AP y las intervenciones quirúrgicas previas. Todos los pacientes de este estudio sufrían AP severa crónica. Los segmentos con una estenosis u oclusión severas que no permitían la colocación de un catéter IVUS (n=41), y aquellos con intervenciones quirúrgicas recientes (n=5) fueron excluidos del análisis. Treinta y tres pacientes fueron excluidos tras el examen IVUS debido al gran diámetro de los vasos, que situaba una porción de ellos fuera del campo visual de la IVUS, a la disponibilidad de segmentos vasculares cortos, y/o a cuestiones relacionadas con la obtención de datos. Con estos condicionantes se reunió una muestra de 45 pacientes, con 5 amputaciones infrageniculares, 1 genicular y 39 suprageniculares.
En el momento de la amputación, se realizó una revisión electrónica de las historias clínicas disponibles para obtener datos clínicos, como edad, sexo, diabetes, tabaquismo, y función renal.
Análisis de arterias humanasLas arterias procedentes de las amputaciones de las extremidades inferiores se extrajeron como parte de un estudio patrocinado por los National Institutes of Health, titulado ‘‘Implicaciones clínicas de la morfología de la placa periférica'’ (R01 HL075721). Estos estudios fueron autorizados por el comité de evaluación del centro.
Tras la amputación, las arterias se extrajeron en un período de 24h. Las arterias permeables tibial anterior, tibial posterior, y peronea se extrajeron a partir de amputaciones infrageniculares. Adicionalmente, las arterias permeables poplíteas se extrajeron a partir de amputaciones suprageniculares. Los segmentos arteriales con estenosis u oclusiones severas o intervenidos previamente fueron excluidos del análisis.
Las arterias se colocaron posteriormente en un sistema de perfusión controlado mediante ordenador similar al sistema descrito previamente para los vasos coronarios6. Este sistema simula las condiciones in vivo al perfundir los vasos con una solución salina tamponada con fosfato a 100 mmHg y calentada a 37°C. Las ramas laterales permeables se ligaron para mantener la presión. Un introductor 6F proporcionó abordaje a los vasos para los dispositivos endovasculares durante la experimentación.
Obtención de datosTodos los datos se obtuvieron utilizando la consola clínica In-Vision Gold IVUS de Volcano Corporation (Rancho Cordova, CA), el catéter phased array Eagle Eye 3,5F para IVUS, y el dispositivo motorizado de progresión y retirada Trak Back II. Durante la obtención de las imágenes de IVUS, el catéter se avanzó hacia el segmento distal más accesible del vaso, obteniéndose los datos de la IVUS de forma secuencial (1 cuadro/s) durante la retirada motorizada a una velocidad de 0,5mm/s.
Los datos de la IVUS radiofrecuencia (RF) se grabaron de la consola IVUS a un DVD y se transfirieron al PC para su análisis posterior. También se adquirieron imágenes en escala de grises que posteriormente sirvieron de ayuda en el proceso de definición del contorno de los vasos.
Análisis de los datosLas imágenes en escala de grises se reconstruyeron a partir de los datos de RF sin procesar de la IVUS en un PC Pentium IV utilizando el programa IVUS Lab8. Los contornos que definían la lámina elástica interna (LEI) y la lámina elástica externa (LEE) del vaso se identificaron de forma manual en cada imagen transversal en escala de grises. La composición de la placa aterosclerótica se calculó utilizando el último algoritmo de caracterización del tejido aterosclerótico VH-IVUS™ de Volcano, comercializado en forma de paquete de software bajo el nombre ‘‘PCVH'’, que proporciona un mapa tisular coloreado e información geométrica cuantitativa y de la composición de la placa para cada imagen correspondiente en escala de grises. El programa clasificó las placas ateroscleróticas en uno de 4 tipos: fibrosa, fibroadiposa, núcleo necrótico, o calcio denso.
La producción del software VH-IVUS proporcionó información de un área transversal (AT) expresada en milímetros cuadrados por cada placa durante la retirada. Los datos referentes al AT de la placa se presentaron para cada corte individual así como la media del AT de todo la retirada. El volumen expresado en milímetros cúbicos se obtuvo utilizando los datos del AT y las distancias conocidas entre los cortes transversales en función de la velocidad de la retirada motorizada. Además, en el análisis de los resultados se proporcionaron los datos de la IVUS en escala de grises, incluyendo el AT del vaso, la placa más la media, y el área de placa se calculó como el AT de la placa más la media dividido entre el AT del vaso.
Se calculó la velocidad media del cambio en el AT para cada uno de los 4 tipos de placa a lo largo de todo el vaso, hallando la diferencia entre cada corte transversal adyacente y dividiéndola entre la distancia entre cortes transversales. Luego se obtuvo la media de las diferencias y se expresaron en milímetros cuadrados por centímetro.
Análisis estadísticoDebido a las variaciones geométricas y de tamaño entre los vasos, no fue posible realizar una comparación directa utilizando dimensiones geométricas. Este aspecto se resolvió tomando el volumen total de la placa y calculando el porcentaje medio de la composición fibrosa, fibroadiposa, núcleo necrótico, y calcio denso a lo largo de todo el vaso. Además, se realizaron comparaciones por edad, estado diabético, cese del tabaquismo, insuficiencia renal crónica, e hiperlipidemia, comparando solamente las arterias poplíteas con las poplíteas y las arterias tibiales con las tibiales para eliminar el tipo de vaso como posible variable.
La distribución de los factores demográficos y clínicos de la cohorte se calculó utilizando pruebas bilaterales para determinar la asociación entre los factores demográficos y clínicos con la composición de la placa y la carga ateromatosa. Los resultados se muestran como la media ± desviación estándar. p<0,05 se consideró significativa.
ResultadosUna revisión electrónica de las historias clínicas disponibles de los 45 amputados mostró que la media de edad de la amputación fue de 67,0±13,5 años, con 29 hombres (64,4%) y 16 mujeres (35,6%). El grupo estuvo formado por 20 afroamericanos (44,4%) y 25 caucásicos (55,6%). En 27 pacientes (60,0%) se diagnosticó una diabetes mellitus no insulinodependiente (DMNID), y 18 (40,0%) presentaron una insuficiencia renal crónica, definida por una concentración de Cr sérica>1,5mg/dl. Los registros sobre tabaquismo mostraron que 13 individuos (28,9%) eran fumadores activos, 12 (26,7%) habían dejado de fumar, 14 (31,1%) nunca habían fumado, y no se disponía de datos respecto a 6 (13,3%).
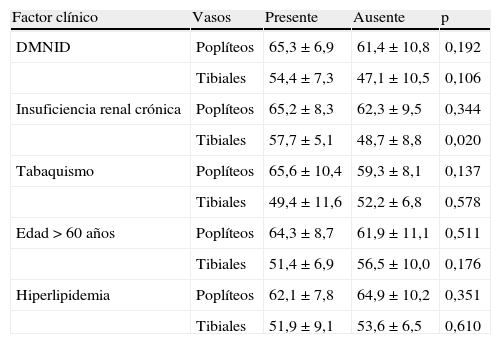
Se observó que las arterias poplíteas presentaban un aumento del área media de placa (tabla I) del 63,28±9,1% en comparación con las arterias tibiales con un 52,6±8,0% (p<0,001). Los factores clínicos y demográficos, con la excepción de la insuficiencia renal crónica, no mostraron ninguna asociación con el área de placa, si bien el tabaquismo, la DMNID, y la edad>60 años tendieron a estar asociados con un aumento del área de placa. Los pacientes con insuficiencia renal crónica presentaron una mayor área de placa en las arterias tibiales (57,7±5,1% frente a 48,7±8,8%, p=0,02) con una tendencia similar en las arterias poplíteas, aunque no significativa (NS) (65,2±8,3% frente a 62,3±9,5%, p=NS).
Comparación de la carga y composición de la placa entre las arterias poplíteas y tibiales (n=45)
| Tibiales | Poplíteas | p | |
| Área de placa | 52,6±7,9 | 63,3±9,1 | < 0,001 |
| Composición de la placa | |||
| Fibrosa | 46,3±19,7% | 59,3±12,0% | 0,002 |
| Fibroadiposa | 7,9±6,6% | 13,3±6,4% | 0,002 |
| Núcleo necrótico | 18,7±10,1% | 15,6±7,5% | NS |
| Calcio denso | 27,2±23,3% | 11,8±10,1% | < 0,001 |
NS: no significativo.
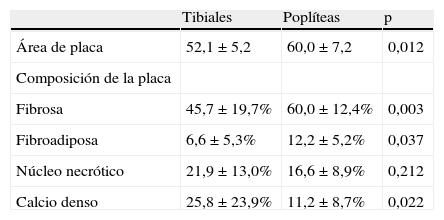
La composición de la placa aterosclerótica en las arterias tibiales (posterior, anterior, y peronea) contenía un mayor porcentaje de calcio denso que las arterias poplíteas. El calcio denso representó el 27,2±23,3% de la placa en las arterias tibiales en comparación con solamente el 11,8±10,1% de las arterias poplíteas (p<0,001). Además, la placa de la arteria tibial contenía un menor porcentaje de placa fibrosa (46,25±19,7% frente a 59,3±12,0%, p=0,002) y fibroadiposa (7,85±6,6% frente a 13,3±6,4%, p=0,002) que la de las arterias poplíteas. El porcentaje de placa con núcleo necrótico en los diferentes vasos no fue significativo (18,7±10,1 frente a 15,6±7,5, p=NS) (tabla I). En 10 de los 45 pacientes se obtuvieron datos de la IVUS tanto de la arteria poplítea como de las arterias tibiales, lo que permitió realizar la comparación directa de las arterias en cada paciente. Esto arrojó resultados similares a los de la totalidad del grupo (tabla Ia).
Comparación directa de la carga y composición de la placa en los pacientes con datos de la IVUS obtenidos de las arterias poplíteas y tibiales (n=10)
| Tibiales | Poplíteas | p | |
| Área de placa | 52,1±5,2 | 60,0±7,2 | 0,012 |
| Composición de la placa | |||
| Fibrosa | 45,7±19,7% | 60,0±12,4% | 0,003 |
| Fibroadiposa | 6,6±5,3% | 12,2±5,2% | 0,037 |
| Núcleo necrótico | 21,9±13,0% | 16,6±8,9% | 0,212 |
| Calcio denso | 25,8±23,9% | 11,2±8,7% | 0,022 |
El tabaquismo fue la única variable de los factores clínicos y demográficos obtenidos que estuvo asociada con diferencias en la composición de la placa aterosclerótica (tabla II, IIa, y IIb). Las arterias poplíteas de los fumadores presentaron un porcentaje menor de placas fibroadiposas (6,9±3,9% frente a 18,5±13,8%, p=0,019) y con núcleo necrótico (11,4±5,5 frente a 18,2±8,6, p=0,048). Se observó un mayor porcentaje de placas fibroadiposas tanto en las arterias poplíteas (15,8±5,5% frente a 9,0±6,0%, p=0,014) como en las tibiales (13,1±8,4% frente a 5,3±4,9%, p=0,044).
Relación entre los factores clínicos y el área de placa de las arterias poplíteas y tibiales (media % ± EE)
| Factor clínico | Vasos | Presente | Ausente | p |
| DMNID | Poplíteos | 65,3±6,9 | 61,4±10,8 | 0,192 |
| Tibiales | 54,4±7,3 | 47,1±10,5 | 0,106 | |
| Insuficiencia renal crónica | Poplíteos | 65,2±8,3 | 62,3±9,5 | 0,344 |
| Tibiales | 57,7±5,1 | 48,7±8,8 | 0,020 | |
| Tabaquismo | Poplíteos | 65,6±10,4 | 59,3±8,1 | 0,137 |
| Tibiales | 49,4±11,6 | 52,2±6,8 | 0,578 | |
| Edad>60 años | Poplíteos | 64,3±8,7 | 61,9±11,1 | 0,511 |
| Tibiales | 51,4±6,9 | 56,5±10,0 | 0,176 | |
| Hiperlipidemia | Poplíteos | 62,1±7,8 | 64,9±10,2 | 0,351 |
| Tibiales | 51,9±9,1 | 53,6±6,5 | 0,610 |
DMNID: diabetes mellitus no insulinodependiente.
Factores clínicos: asociaciones con la composición fibrosa y fibroadiposa de la placa
| Fibrosa | Fibroadiposa | ||||||
| Factor clínico | Presente | Ausente | p | Presente | Ausente | p | |
| DMNID | Poplíteos | 60,4±12,2 | 58,4±11,7 | 0,61 | 13,4±5,7 | 13,3±7,2 | 0,978 |
| Tibiales | 43,1±4,8 | 54,0±2,0 | 0,321 | 6,1±1,6 | 12,6±1,2 | 0,067 | |
| Insuficiencia renal crónica | Poplíteos | 55,1±12,3 | 62,3±10,9 | 0,067 | 14,0±6,8 | 13,0±6,2 | 0,659 |
| Tibiales | 42,6±22,2 | 48,3±20,1 | 0,567 | 5,2±3,6 | 9,7±8,1 | 0,165 | |
| Tabaquismo | Poplíteos | 65,8±4,8 | 54,4±16,8 | 0,052 | 15,8±5,5 | 9,0±6,0 | 0,014 |
| Tibiales | 55,2±11,1 | 35,2±20,1 | 0,036 | 13,1±8,4 | 5,3±4,9 | 0,044 | |
| Edad>60 años | Poplíteos | 61,6±9,9 | 57,9±11,4 | 0,346 | 13,6±6,4 | 13,9±6,2 | 0,898 |
| Tibiales | 47,5±20,2 | 42,6±20,3 | 0,612 | 7,9±6,1 | 7,6±8,5 | 0,932 | |
| Hiperlipidemia | Poplíteos | 59,6±12,2 | 59,7±12,0 | 0,97 | 13,3±5,6 | 13,5±7,2 | 0,95 |
| Tibiales | 45,1±17,1 | 47,6±23,7 | 0,76 | 8,4±6,6 | 7,2±6,9 | 0,666 | |
DMNID: diabetes mellitus no insulinodependiente.
Factores clínicos: asociaciones con la composición de calcio denso y núcleo necrótico de la placa
| Calcio denso | Núcleo necrótico | ||||||
| Factor clínico | Vasos | Presente | Ausente | p | Presente | Ausente | p |
| DMNID | Poplíteos | 11,5±6,3 | 11,9±10,0 | 0,905 | 14,7±6,3 | 16,4±8,7 | 0,5 |
| Tibiales | 29,8±19,5 | 21,6±23,8 | 0,54 | 21,0±4,0 | 11,8±11,0 | 0,106 | |
| Insuficiencia renal crónica | Poplíteos | 14,2±11,7 | 10,1±8,5 | 0,223 | 16,8±6,7 | 14,6±7,9 | 0,389 |
| Tibiales | 33,8±24,9 | 23,2±25,1 | 0,376 | 18,4±5,8 | 18,8±13,7 | 0,94 | |
| Tabaquismo | Poplíteos | 6,9±3,9 | 18,5±13,8 | 0,019 | 11,4±5,5 | 18,2±8,6 | 0,048 |
| Tibiales | 14,8±11,0 | 38,0±27,2 | 0,055 | 16,9±9,1 | 21,5±14,8 | 0,488 | |
| Edad>60 años | Poplíteos | 10,0±7,2 | 12,3±10,9 | 0,467 | 14,8±7,8 | 15,9±5,9 | 0,698 |
| Tibiales | 26,3±24,0 | 30,0±23,1 | 0,743 | 18,3±10,7 | 19,8±9,0 | 0,767 | |
| Hiperlipidemia | Poplíteos | 11,9±10,7 | 11,3±9,8 | 0,847 | 15,2±5,7 | 15,6±8,9 | 0,884 |
| Tibiales | 24,9±22,2 | 30,0±25,3 | 0,603 | 21,7±11,8 | 15,2±6,6 | 0,12 | |
DMNID: diabetes mellitus no insulinodependiente.
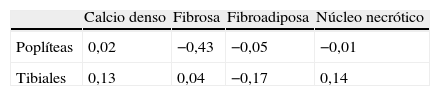
Se calculó la velocidad media de variación de cada placa avanzando distalmente (tabla III). Se observó que el calcio denso aumentó como promedio a una velocidad de 0,02mm2/cm en las arterias poplíteas y de 0,13mm2/cm en las arterias tibiales a medida que se avanzó distalmente. Las placas fibrosas, fibroadiposas, y de núcleo necrótico disminuyeron en la arteria poplítea en –0,43, –0,05, y –0,01mm2/cm, respectivamente. Las placas fibrosas y de núcleo necrótico aumentaron a una velocidad de 0,04 y 0,14mm2/cm en las arterias tibiales, respectivamente, mientras que la placa fibroadiposa disminuyó en –0,17mm2/cm. Existieron diferencias en la velocidad media de variación de cada placa, aunque no fueron significativas entre los tipos de vasos.
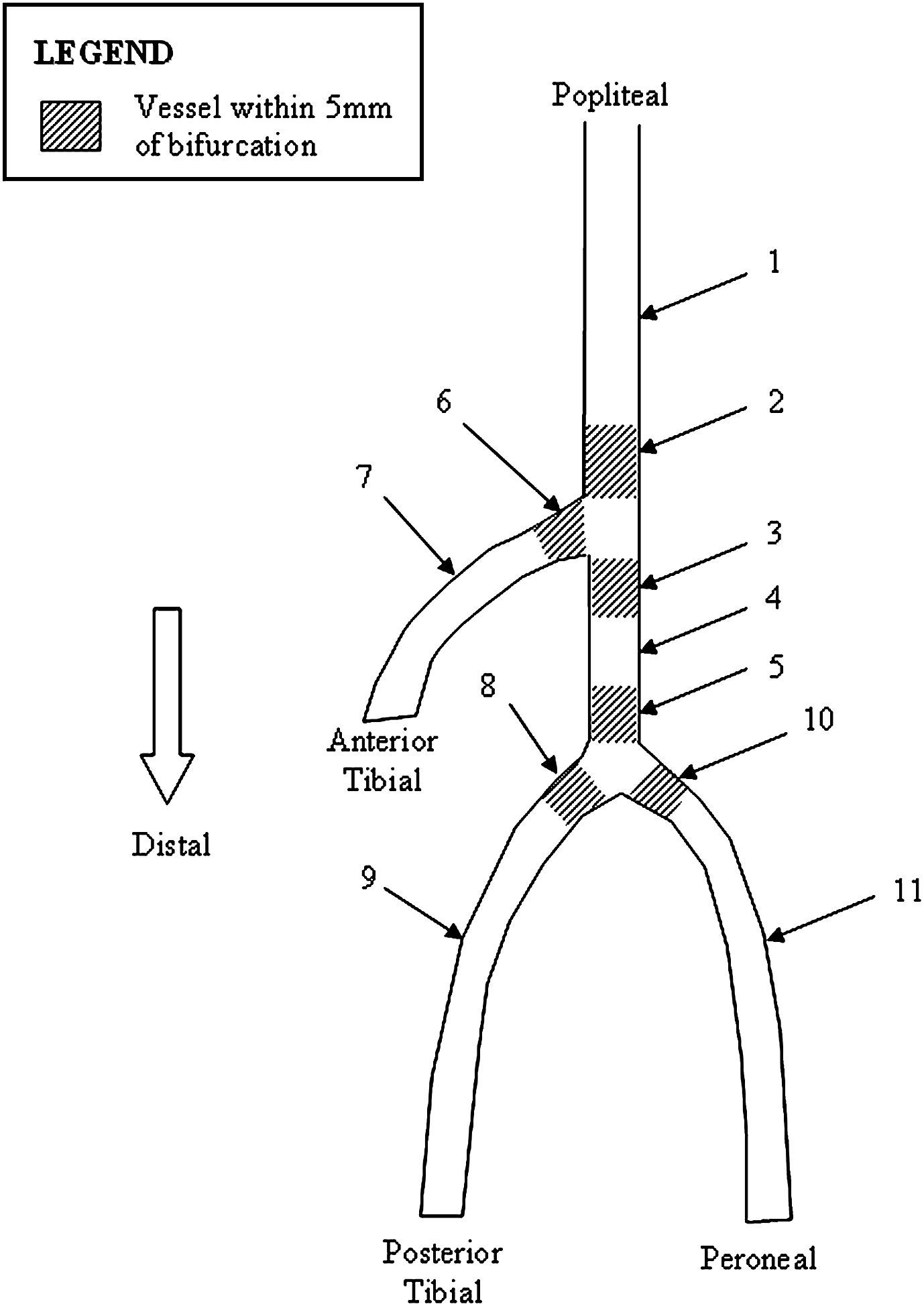
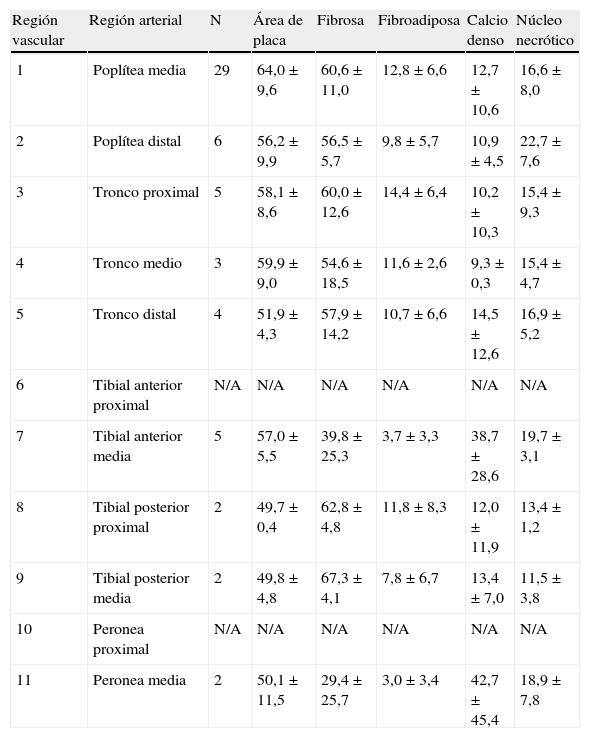
También se desglosó la composición de la placa para evaluar aquellas situadas a 5mm (proximal y distalmente) de las bifurcaciones (fig. 1 y tabla IV). La arteria poplítea distal mostró una reducción del área de placa en comparación con la poplítea media (56,2±9,9% frente a 64,0±9,6%). Se observó que el área de placa aumentó en el tronco proximal y medio hasta 58,1±8,6 y 9,9±9,0%, respectivamente.
Carga y composición de la placa según la localización arterial
| Región vascular | Región arterial | N | Área de placa | Fibrosa | Fibroadiposa | Calcio denso | Núcleo necrótico |
| 1 | Poplítea media | 29 | 64,0±9,6 | 60,6±11,0 | 12,8±6,6 | 12,7±10,6 | 16,6±8,0 |
| 2 | Poplítea distal | 6 | 56,2±9,9 | 56,5±5,7 | 9,8±5,7 | 10,9±4,5 | 22,7±7,6 |
| 3 | Tronco proximal | 5 | 58,1±8,6 | 60,0±12,6 | 14,4±6,4 | 10,2±10,3 | 15,4±9,3 |
| 4 | Tronco medio | 3 | 59,9±9,0 | 54,6±18,5 | 11,6±2,6 | 9,3±0,3 | 15,4±4,7 |
| 5 | Tronco distal | 4 | 51,9±4,3 | 57,9±14,2 | 10,7±6,6 | 14,5±12,6 | 16,9±5,2 |
| 6 | Tibial anterior proximal | N/A | N/A | N/A | N/A | N/A | N/A |
| 7 | Tibial anterior media | 5 | 57,0±5,5 | 39,8±25,3 | 3,7±3,3 | 38,7±28,6 | 19,7±3,1 |
| 8 | Tibial posterior proximal | 2 | 49,7±0,4 | 62,8±4,8 | 11,8±8,3 | 12,0±11,9 | 13,4±1,2 |
| 9 | Tibial posterior media | 2 | 49,8±4,8 | 67,3±4,1 | 7,8±6,7 | 13,4±7,0 | 11,5±3,8 |
| 10 | Peronea proximal | N/A | N/A | N/A | N/A | N/A | N/A |
| 11 | Peronea media | 2 | 50,1±11,5 | 29,4±25,7 | 3,0±3,4 | 42,7±45,4 | 18,9±7,8 |
N/A: no analizada.
Los datos cuantitativos de la IVUS en escala de grises se limitan a las mediciones geométricas que incluyeron el diámetro y las áreas que definieron los vasos. Estas mediciones se basan en los contornos vasculares identificados por el usuario que pueden ser detectados de forma automática o definidos de forma manual por un usuario experimentado.
La IVUS en escala de grises no proporciona información cuantitativa sobre la composición del tejido histológico9. Los usuarios que están muy familiarizados con la interpretación de la IVUS en escala de grises pueden realizar evaluaciones cualitativas generales de los componentes del tejido aterosclerótico del vaso que incluyen típicamente las placas blandas con infiltración lipídica difusa, las placas fibrosas, y las placas calcificadas sobre la base de la ecogenicidad del tejido. Las dificultades surgen debido al solapamiento de la ecogenicidad entre los diferentes tipos de tejidos, lo que puede dar lugar a errores en la clasificación. Los trombos complican aún más la interpretación dado que proporcionan una representación de las placas ateroscleróticas en escala de grises similar10, y su interpretación solamente debe considerarse presuntiva.
Las imágenes de la IVUS en escala de grises están formadas por solamente una fracción de los datos de la IVUS sin procesar. Los datos de las imágenes sin procesar sufren una amplificación, filtrado, compensación por ganancia de tiempo, y una serie de procesos para mostrar lo que en realidad es solamente la envoltura de la señal original del dominio de tiempo. Estos pasos en el procesado de la imagen se realizan para obtener una imagen óptima en escala de grises.
Los datos tisulares de la IVUS RF obtenidos de los datos de la IVUS-RF sin procesar proporcionan datos adicionales a la IVUS convencional en escala de grises. La VH-IVUS comienza con los datos de retrodispersión sin procesar de la IVUS a partir del tejido localizado en los contornos predefinidos LEI y LEE. Un método autorregresivo extrae información sobre la frecuencia espectral. Luego se evalúan los parámetros espectrales predefinidos utilizando un algoritmo para definir el tejido como uno de los 4 tipos de placas ateroscleróticas: fibrosa, fibroadiposa, núcleo necrótico, o calcio denso.
Si bien el algoritmo de caracterización de los tejidos se desarrolló originariamente para las arterias coronarias, el estudio Carotid Artery Plaque Virtual Histology Evaluation11 (CAPITAL) mostró una estrecha correlación entre el VH-IVUS y los resultados histopatológicos para las arterias carótidas. Además, nuestro grupo está en proceso de desarrollar una versión periférica de la caracterización tisular con una exactitud de los resultados preliminares no publicados similar a la referida por Nair et al6 La precisión encontrada en la aplicación de este algoritmo al territorio carotídeo combinada con nuestros resultados periféricos proporcionan suficiente confianza para su utilización en los vasos periféricos hasta que se disponga formalmente de una versión periférica.
Como habíamos hipotetizado, las placas ateroscleróticas de las arterias tibiales contienen un mayor porcentaje de calcio denso que las arterias poplíteas. La calcificación abrupta que comienza justo distal a la arteria poplítea se detectó durante la experimentación pero no se conoció de forma cuantitativa hasta que no se completaron los resultados de la VH-IVUS. Además, el AT con calcio denso aumentó, avanzando distalmente tanto en las arterias tibiales como en las poplíteas. Con la diferencia significativa en el calcio denso, fue lógico esperar variaciones en otros tipos de placas.
Muchos estudios han utilizado la TC de haz de electrones para investigar la calcificación y las asociaciones con los factores demográficos y clínicos. La enfermedad renal crónica ha demostrado influir en la calcificación cardiovascular7,12-14, estando ligada la gravedad de la enfermedad con la prevalencia e intensidad de la calcificación. Si bien los efectos se estudiaron principalmente en las arterias coronarias, los factores patológicos pueden ser sistémicos. Fuchs et al2 informaron que las calcificaciones moteadas y lineales tienen más tendencia a aparecer en las extremidades inferiores de los pacientes diabéticos. La edad avanzada, el aumento de las lipoproteínas de baja densidad, y el tabaquismo también han demostrado aumentar la calcificación15.
La ausencia de asociación entre los factores demográficos y clínicos observada en nuestro estudio fue inesperada. Se sospechó que la gravedad de la patología vascular que derivó en amputación pesó más que otros factores en la determinación de las características de la placa aterosclerótica. En nuestro estudio, la calcificación fue, en realidad, menor en los fumadores que en los no fumadores, lo que contrasta con los resultados descritos en otros estudios15. Fuchs et al2 informaron que las calcificaciones moteadas y lineales tienen más tendencia a aparecer en las extremidades inferiores de los pacientes diabéticos, y, aunque no son significativos, nuestros datos tendieron a mostrar un mayor nivel de calcificación en las arterias tibiales de los diabéticos.
La investigación coronaria proporciona muchos de los conocimientos de que disponemos en la actualidad sobre aterosclerosis y sus mecanismos conocidos, dado que la cantidad de datos procedentes directamente de las arterias periféricas es mínima. Los conocimientos coronarios se han extrapolado y aplicado a las arterias periféricas para mejorar nuestros conocimientos. Sin embargo, la relación entre aterosclerosis coronaria y periférica no se conoce por completo, y algunos indicios sugieren posibles diferencias en la progresión de la enfermedad16,17. Nuestros resultados pueden sugerir que, sobre la base de las variaciones bruscas entre los vasos poplíteos y tibiales, es probable que existan diferencias entre estos vasos y otros lechos arteriales del organismo. Esta información puede ser crítica a la hora de desarrollar tecnología endovascular arterioespecífica, como balones de angioplastia, diseños específicos de stent, y dispositivos de aterectomía. Nuestro objetivo es disponer de una herramienta de IVUS validada in vivo para ayudar al clínico en el tratamiento de la AP.
Nuestro estudio tiene limitaciones. Dado el tamaño limitado de la muestra, podemos tener errores de tipo II. Muestras adicionales ayudarán a confirmar las correlaciones observadas. A pesar de que la mayoría de las amputaciones se realizaron debido a sepsis del pie, las muestras arteriales proximales probablemente representan un proceso más virulento que otros tipos de AP.
Una limitación adicional está presente en la selección de los vasos debido a la gravedad de la AP. El abordaje para el catéter de la IVUS no pudo lograrse en muchos de los ejemplos extremos de AP para obtener los datos, de forma que estas muestras se excluyeron del análisis. Esto puede alterar nuestros resultados. Aunque es posible realizar una aterectomía para obtener un abordaje para el catéter, se desconocen los efectos que esto puede tener en la caracterización de la placa. Nair et al6 solamente utilizaron vasos sin intervenciones previas en su investigación sobre la caracterización de la placa.
Así pues, está justificada la caracterización de la placa in vivo durante la angiografía y en la actualidad se está trabajando para confirmar nuestros resultados en pacientes con AP que requieren intervención endovascular. Investigaciones adicionales, en que se analicen los mecanismos ateroscleróticos de la aterosclerosis en las extremidades inferiores, serían de utilidad para poder explicar las diferencias observadas en nuestra investigación con respecto a los resultados publicados anteriormente sobre el territorio coronario.
ConclusiónA medida que avanzamos distalmente en el árbol arterial de los pacientes con AP, el contenido en calcio de la placa aumenta al disminuir el área de placa fibroadiposa. Los factores clínicos y demográficos, con la excepción del tabaquismo y la insuficiencia renal crónica, no estuvieron asociados con la composición de la placa aterosclerótica o el área de placa.
Este trabajo fue financiado por el NIH/NHLBI (R01 HL075721).
Presentado en el 18th Annual Winter Meeting de la Peripheral Vascular Surgery Society's, Snowmass, CO, 1-3 de febrero de 2008.