Evaluamos el impacto del diámetro preoperatorio del conducto venoso en la tasa de reintervenciones y en el resultado tras cirugía de bypass infrainguinal con injerto venoso. Se revisaron las derivaciones infrainguinales venosas consecutivas realizadas entre enero de 2001 y diciembre de 2006. En todos los pacientes se midió de forma preoperatoria el diámetro del injerto venoso (DIV). Los injertos se clasificaron en aquellos con un DIV<3,5mm y aquellos con un DIV≥3,5mm. Todos los pacientes participaron en un programa de vigilancia mediante eco-Doppler. Se evaluó la asociación entre el DIV y la tasa de reintervenciones. Se compararon la permeabilidad del injerto y los porcentajes de amputación. Se realizó el seguimiento de 377 derivaciones durante una media de 23 meses (intervalo 8-67). El DIV fue<3,5mm en 139 injertos (36,9%) y≥3,5mm en 238 injertos (63,1%). Un elevado porcentaje de injertos venosos de pequeño calibre (32,3%) requirieron reintervención para mantener su permeabilidad, en comparación con los conductos de mayor tamaño (20,2%) (χ2 =7,7, p<0,001). El DIV (odds ratio [OR]=2,87, intervalo de confianza [IC] del 95%: 1,63-3,81; p<0,001), el tabaquismo (OR=1,83, IC 95%: 1,39-3,20; p=0,02), y el tipo de derivación (OR=1,86, IC 95%: 1,49-2,47; p=0,02) fueron variables asociadas con un índice elevado de reintervención. No existieron diferencias en la permeabilidad del injerto (p=0,13) o los porcentajes de amputación (p=0,35) entre ambos grupos. El uso de injertos venosos de menor tamaño estuvo asociado con un mayor índice de reintervenciones. Siempre que estos injertos sean supervisados y reparados cuando sea necesario, el uso de injertos venosos de menor calibre es satisfactorio y amplía la disponibilidad de los conductos autólogos para la reconstrucción arterial infrainguinal.
El bypass infrainguinal con vena autóloga está bien establecido en el tratamiento de la claudicación intermitente incapacitante o la isquemia crítica de la pierna1. Estos injertos venosos tienen tendencia a desarrollar estenosis, lo que puede precipitar el fracaso del bypass2-5. La estenosis puede originarse debido a un error técnico, persistencia de válvulas venosas, alteraciones venosas preexistentes, o hiperplasia de la mioíntima.
Se han hallado varios factores que influyen en el resultado de las derivaciones infrainguinales con vena autóloga4-7. Si bien muchos de estos factores son endógenos al paciente y están fuera del control directo por parte del cirujano, el tamaño y la calidad del conducto venoso disponible se han considerado como factores importantes que afectan al resultado de las derivaciones infrainguinales7. Aunque el uso de venas de menor calibre no tiene por qué resultar invariablemente en el fracaso del injerto8, varios autores han sugerido que los injertos con un diámetro<3,5mm tienen un mayor riesgo de fracaso9-11. En estas circunstancias se aconseja el uso de injertos venosos mixtos o injertos de venas del brazo en lugar de venas safenas largas de pequeño calibre e ininterrumpidas12.
El objetivo de este estudio fue evaluar la importancia de medir el diámetro venoso mínimo durante el mapeo venoso preoperatorio en los resultados preliminares y a medio plazo de las derivaciones infrainguinales venosas y determinar el grado de aumento de su diámetro durante el seguimiento.
MétodosA partir de una base de datos obtenida de forma prospectiva se identificaron pacientes consecutivos que fueron sometidos a bypass infrainguinal, utilizando venas autólogas, entre el 1 de enero de 2001 y el 31 de diciembre de 2006. El análisis de los resultados se completó con una revisión retrospectiva de las historias clínicas y mediante referencia cruzada con las bases de datos del laboratorio del hospital.
Todos los pacientes fueron sometidos a un mapeo venoso preoperatorio mediante eco-Doppler (Sequoia; Acuson, Redwood, CA) con un transductor lineal de 5MHz por parte de dos técnicos vasculares experimentados. El examen ecográfico utilizó un ángulo de insonación lo más cercano posible a 60° e incluyó el estudio bilateral de las venas safenas interna y externa; además, se examinaron las venas de los miembros superiores cuando no se disponía de venas safenas de calibre sufiente o eran de dudosa calidad. El conducto venoso fue examinado en toda su longitud con los pacientes en bipedestación. El diámetro interno máximo de la vena se registró a nivel del muslo proximal y distal, de la rodilla, y del tobillo. Los pacientes se clasificaron en 2 categorías en función del diámetro mínimo de la vena safena interna en bipedestación: <3,5 y≥3,5mm. Se extrajo la longitud apropiada de vena safena interna homolateral y se examinó intraoperatoriamente su distensibilidad y calidad. Si éstas no se consideraron adecuadas, se utilizó la vena safena interna contralateral. La vena safena externa y las venas del brazo se utilizaron en los pacientes en los que se había extraído con anterioridad vena safena interna o en los que ésta no se consideró adecuada para la cirugía de bypass en el mapeo venoso preoperatorio.
Posteriormente, todos los pacientes se incluyeron en un programa de seguimiento. Éste implicó la realización de eco-Doppler y determinaciones del índice de presión tobillo-brazo (IPTB) antes del alta hospitalaria y posteriormente a las 6 semanas, 3 meses, 6 meses, 1 año, y 2 años de la intervención. Por motivos clínicos, de forma ocasional, se realizó examen adicional con eco-Doppler fuera del programa de seguimiento.
El protocolo de eco-Doppler incluyó la evaluación del injerto en toda su longitud junto con el examen de los vasos eferentes y aferentes con respecto a la calidad del flujo sobre la base de la velocidad, onda de flujo, y características del espectro de color. La velocidad sistólica máxima (VSM) se determinó en los lugares de estenosis y en múltiples niveles en el injerto y en el vaso aferente. Se calculó el cociente de la velocidad entre el foco de estenosis y un registro adyacente. Se registraron los datos de cualquier complicación postoperatoria y posteriores intervenciones quirúrgicas y endovasculares. Además, se recogieron las complicaciones postoperatorias, los índices de permeabilidad acumulativa a los 30 meses, y los porcentajes de amputación en relación con el diámetro del injerto venoso (DIV) preoperatorio mínimo.
La estenosis crítica del injerto venoso se definió como una VSM>300cm/s o un aumento de 3,5 veces la VSM en el lugar de la estenosis en comparación con la VSM preestenósica, una VSM<40cm/s en sentido anterógrado desde la lesión estenósica, o una reducción>0,15 en las determinaciones postoperatorias del IPTB.
Los datos demográficos del paciente, el tipo de intervención, el conducto, y la información sobre el seguimiento se registraron en una base de datos informatizada (Access y Excel; Microsoft, Redmond, WA). El análisis de los datos se realizó de forma retrospectiva. El análisis estadístico se realizó utilizando el Statistical Package for Social Sciences, versión 12 (SPSS, Inc., Chicago, IL). Los resultados se analizaron y notificaron según los estándares de la Society for Vascular Surgery y el North American Chapter de la International Society for Cardiovascular Surgery12. Los grupos se compararon en términos de estenosis, necesidad de reintervención, permeabilidad del injerto, y amputación. La permeabilidad y el salvamento de la extremidad se determinaron utilizando el análisis de Kaplan-Meier. La asociación de la permeabilidad del injerto y el salvamento de la extremidad con los factores de riesgo de fracaso del injerto, establecida en función del lugar de la anastomosis distal, DIV mínimo, y otros factores de riesgo aterosclerótico, fue analizada utilizando el modelo de riesgo proporcional de Cox. La asociación entre la necesidad de reintervención debido al desarrollo de una estenosis y las variables anteriores se evaluó utilizando un análisis de regresión logística multivariante. Las diferencias entre grupos se evaluaron utilizando el test de rango logarítmico. La significancia se estableció en p<0,05.
ResultadosSe realizaron 377 derivaciones infrainguinales con injerto venoso en 351 pacientes durante el período de estudio; de ellas, 238 se realizaron en hombres (67,7%) y 113 en mujeres (32,3%). La media de edad de los pacientes fue de 73 años (límites 37-92). Ciento noventa y siete (56,1%) eran fumadores habituales, 150 (42,7%) eran diabéticos, y 33 (9,4%) presentaban insuficiencia renal crónica. La indicación de la cirugía fue la isquemia crítica de la extremidad en 330 casos (87,5%) y la claudicación intermitente incapacitante en 48 (12,5%). Trescientos cuarenta y seis derivaciones (92,1%) se originaron en la arteria femoral, 8 (2,1%) en la arteria ilíaca externa, y 23 (5,8%) se anastomosaron proximalmente en la arteria femoral superficial. Las anastomosis distales se localizaron en las arterias poplíteas suprageniculares en 125 derivaciones (33,2%), en las arterias poplíteas infrageniculares en 135 (35,8%), y en las arterias crurales en 117 (31,0%). Trescientos veintiséis derivaciones se realizaron con injertos de vena invertida y 51 con injerto venoso in situ. Utilizamos la vena safena interna homolateral o contralateral ininterrumpida como conducto venoso en 321 derivaciones (85,1%). En 29 bypass (7,7%) se utilizó un injerto mixto de vena safena interna, mientras que en 18 (4,8%) se utilizó la vena safena externa; en 9 casos (2,4%) se utilizaron las venas del brazo como conducto.
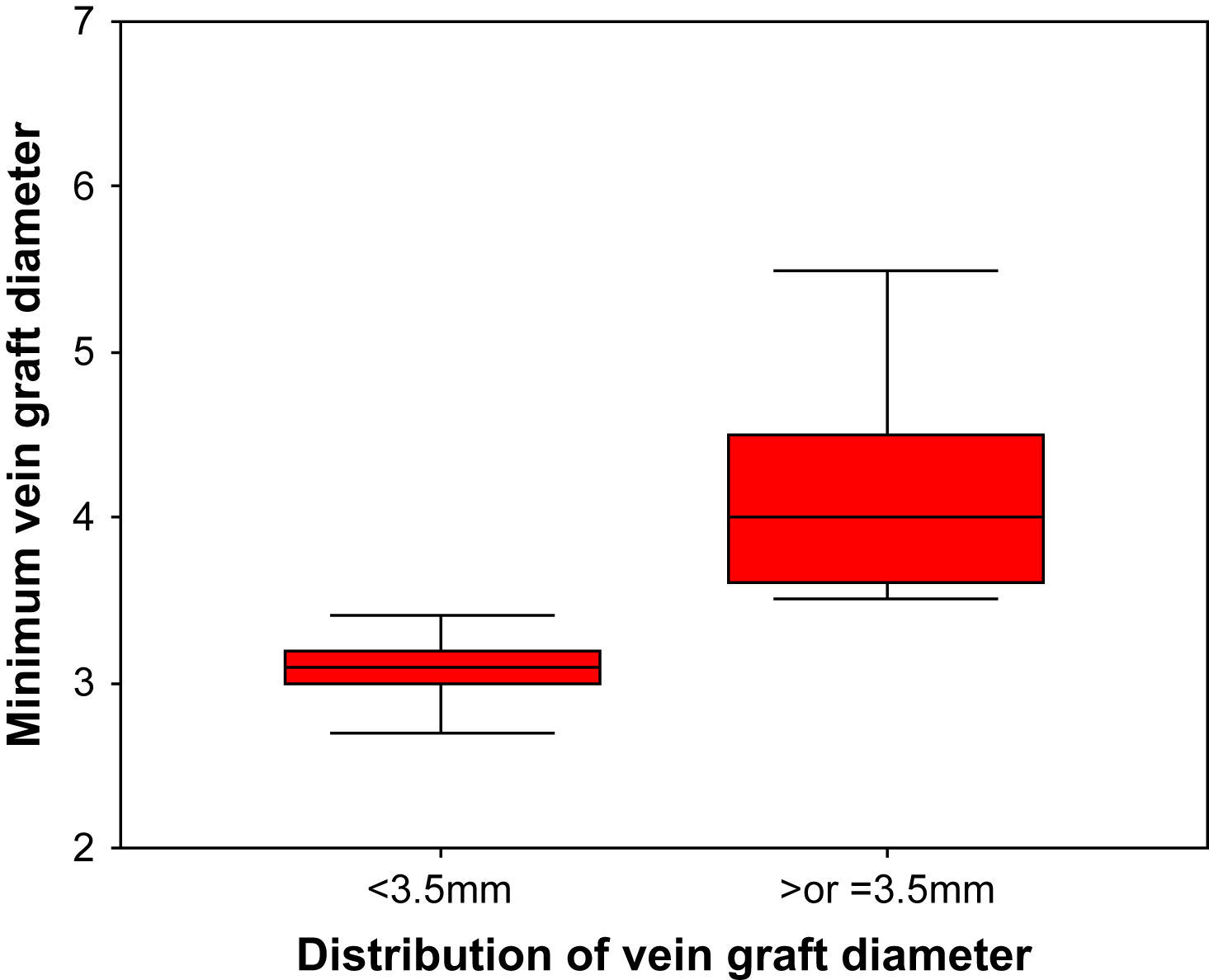
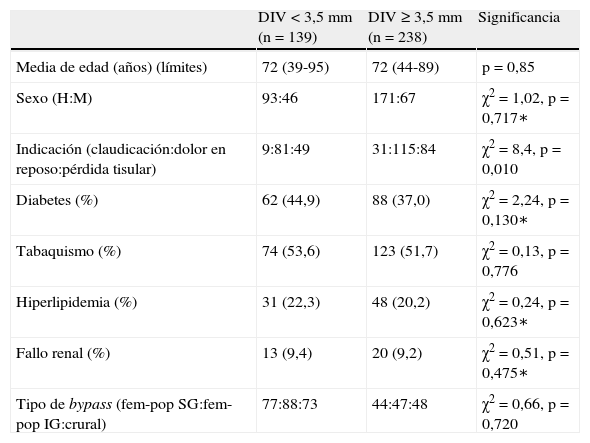
La media del diámetro interno preoperatorio de los injertos venosos utilizados fue de 3,9mm (intervalo 2,4-6,7). El diámetro interno preoperatorio mínimo del injerto venoso fue<3,5mm en 139 (36,9%) y≥3,5mm en 238 (63,1%). La distribución del DIV en cada grupo se muestra en la figura 1. La tabla I presenta la demografía de los pacientes con un DIV preoperatorio<3,5mm en comparación con la de los pacientes con un DIV preoperatorio≥3,5mm.
Demografía de los pacientes con DIV preoperatorios<3,5mm comparada con los de DIV≥3,5mm
| DIV<3,5mm (n=139) | DIV≥3,5mm (n=238) | Significancia | |
| Media de edad (años) (límites) | 72 (39-95) | 72 (44-89) | p=0,85 |
| Sexo (H:M) | 93:46 | 171:67 | χ2 =1,02, p=0,717∗ |
| Indicación (claudicación:dolor en reposo:pérdida tisular) | 9:81:49 | 31:115:84 | χ2 =8,4, p=0,010 |
| Diabetes (%) | 62 (44,9) | 88 (37,0) | χ2 =2,24, p=0,130∗ |
| Tabaquismo (%) | 74 (53,6) | 123 (51,7) | χ2 =0,13, p=0,776 |
| Hiperlipidemia (%) | 31 (22,3) | 48 (20,2) | χ2 =0,24, p=0,623∗ |
| Fallo renal (%) | 13 (9,4) | 20 (9,2) | χ2 =0,51, p=0,475∗ |
| Tipo de bypass (fem-pop SG:fem-pop IG:crural) | 77:88:73 | 44:47:48 | χ2 =0,66, p=0,720 |
La hiperlipidemia se definió como una ratio lipoproteínas de alta densidad/baja densidad>3,5 o concentraciones de colesterol en ayunas>5mmol/l, y la insuficiencia renal severa se definió como una tasa de filtración glomerular estimada<20ml/min o en diálisis permanente.
DIV: diámetro del injerto venoso; fem-pop: femoropoplítea; H: hombre; IG: infragenicular; M: mujer; SG: supragenicular.
∗Corrección de Yates.
La duración media del seguimiento fue de 23 meses (intervalo 8-67). Ochenta y cuatro pacientes (24%) fallecieron durante el seguimiento. Las estimaciones globales según el análisis de Kaplan-Meier de los índices de permeabilidad primaria, primaria asistida, y secundaria a los 40 meses fueron del 73, 79, y 83%, respectivamente.
Ocho injertos requirieron reintervenciones durante el inicio del postoperatorio debido a alteraciones críticas del flujo, que se identificaron al inicio del período postoperatorio. Siete de ellas se produjeron en los injertos venosos<3,5mm de diámetro. Ochenta y siete injertos desarrollaron una estenosis crítica (22,5%) durante el período de seguimiento. Doce pacientes (13,8%) presentaron síntomas recurrentes, y 27 (31%) una reducción significativa en las mediciones postoperatorias del IPTB. El resto de los pacientes permanecieron asintomáticos sin pruebas clínicas de estenosis del injerto venoso.
De los 87 pacientes que desarrollaron estenosis crítica, 9 se ocluyeron antes de la corrección programada, otro se ocluyó tras la angiografía diagnóstica, que reveló que la lesión identificada no podía tratarse mediante angioplastia, y otro no fue reparado. Trece injertos fueron sometidos a corrección abierta, y otros 63 a corrección endovascular mediante una combinación de angioplastia estándar y con cutting ballon.
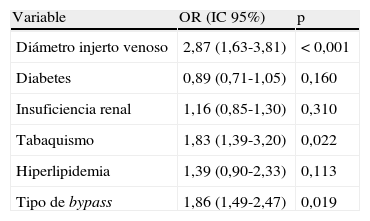
Un porcentaje significativamente elevado de injertos venosos que fueron confeccionados con venas con un DIV preoperatorio<3,5mm requirieron reintervención para mantener la permeabilidad en comparación con aquellos con un diámetro≥3,5mm (χ2 =7,7, p<0,001) (fig. 2). El DIV preoperatorio (odds ratio [OR]=2,87, intervalo de confianza del 95% [IC]: 1,63-3,81; p<0,001), tabaquismo (OR=1,83, IC 95%: 1,39-3,20; p=0,02), y tipo de bypass (OR=1.86, IC 95%: 1,49-2,47; p=0,02) fueron las únicas variables asociadas con un mayor riesgo de reintervención para mantener la permeabilidad del injerto (tabla II).
Comparación del porcentaje de injertos venosos que requirieron reintervención para mantener la permeabilidad, clasificada según el diámetro interno preoperatorio mínimo del injerto venoso. Number of grafts=Número de injertos. Minimum preoperative vein graft diameter=Diámetro preoperatorio mínimo del injerto venoso. No need for re-intervention=Ausencia de reintervención. Re-intervention required=Necesidad de reintervención. Less than 3.5=Menor de 3,5. Greater than or equal to 3.5=Mayor o igual a 3,5.
Factores que afectan a la tasa de reintervenciones tras bypass infrainguinal evaluada mediante regresión logística multivariante
| Variable | OR (IC 95%) | p |
| Diámetro injerto venoso | 2,87 (1,63-3,81) | < 0,001 |
| Diabetes | 0,89 (0,71-1,05) | 0,160 |
| Insuficiencia renal | 1,16 (0,85-1,30) | 0,310 |
| Tabaquismo | 1,83 (1,39-3,20) | 0,022 |
| Hiperlipidemia | 1,39 (0,90-2,33) | 0,113 |
| Tipo de bypass | 1,86 (1,49-2,47) | 0,019 |
IC: intervalo de confianza; OR: odds ratio.
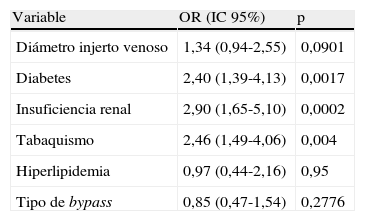
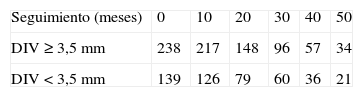
La diferencia en los índices de permeabilidad primaria asistida entre injertos con un DIV preoperatorio<3,5mm y aquellos con un DIV preoperatorio≥3,5mm no fue estadísticamente significativa (rango log=2,29, p=0,13) (fig. 3). Además, no existieron diferencias significativas en los porcentajes de amputación entre injertos venosos que fueron creados utilizando venas con un diámetro preoperatorio mínimo<3,5mm en comparación con los creados con venas de un diámetro preoperatorio mínimo≥3,5mm (rango log=1,69, p=0,35) (fig. 4). No existió ninguna asociación significativa entre el DIV preoperatorio mínimo y la reducción de la permeabilidad primaria asistida (tabla III) o los elevados porcentajes de amputación (tabla IV).
Gráfico de Kaplan-Meier de la permeabilidad primaria asistida de los injertos venosos en pacientes sometidos a bypass infrainguinal con injerto venoso, clasificado según el diámetro interno preoperatorio mínimo del injerto venoso. DIV: diámetro del injerto venoso. Primary assisted patency=Permeabilidad primaria asistida. Follow-up (months)=seguimiento (meses). Vein graft diameter=Diámetro del injerto venoso.
Gráfico de Kaplan-Meier de los porcentajes de amputación a lo largo del tiempo en pacientes sometidos a bypass infrainguinal con injerto venoso, clasificado según el diámetro interno preoperatorio mínimo del injerto venoso. DIV: diámetro del injerto venoso. Amputation rates=Porcentajes de amputación. Follow-up (months)=seguimiento (meses). Vein diameter=Diámetro de la vena.
Factores que afectan a la permeabilidad primaria asistida tras el bypass infrainguinal evaluado según el análisis de regresión multivarianza de Cox
| Variable | OR (IC 95%) | p |
| Diámetro injerto venoso | 1,34 (0,94-2,55) | 0,0901 |
| Diabetes | 2,40 (1,39-4,13) | 0,0017 |
| Insuficiencia renal | 2,90 (1,65-5,10) | 0,0002 |
| Tabaquismo | 2,46 (1,49-4,06) | 0,004 |
| Hiperlipidemia | 0,97 (0,44-2,16) | 0,95 |
| Tipo de bypass | 0,85 (0,47-1,54) | 0,2776 |
IC: intervalo de confianza; OR: odds ratio.
Factores que afectan a los porcentajes de amputación tras el bypass infrainguinal evaluado según el análisis de regresión multivarianza de Cox
| Variable | OR (IC 95%) | p |
| Diámetro injerto venoso | 1,33 (0,78-2,29) | 0,295 |
| Diabetes | 2,81 (1,62-4,88) | 0,002 |
| Insuficiencia renal | 3,93 (2,02-7,66) | < 0,001 |
| Tabaquismo | 2,29 (1,29-4,05) | 0,005 |
| Hiperlipidemia | 0,8339 (0,37-1,87) | 0,659 |
| Tipo de bypass | 0,5876 (0,29-1,19) | 0,138 |
IC: intervalo de confianza; OR: odds ratio.
Los injertos de vena autóloga son los conductos preferidos para la reconstrucción arterial infrainguinal2,3. En ausencia de venas autólogas, el uso de implantes protésicos, aunque necesarios, está asociado a una mayor incidencia de oclusión, lo que puede llevar a la pérdida de la extremidad afectada13. Sin embargo, un problema que aparece con frecuencia durante el mapeo venoso preoperatorio es la identificación de venas de pequeño calibre, que se consideran inadecuadas para la reconstrucción arterial infrainguinal. Otros autores han notificado anteriormente que el hallazgo de venas de pequeño calibre durante el mapeo venoso es relativamente elevado y, en estas circunstancias, se buscan las venas safenas internas contralaterales, safenas externas, o las venas de los brazos como conductos para la cirugía de bypass infrainguinal con injerto venoso14.
La modalidad principalmente utilizada durante el mapeo venoso preoperatorio es el examen con eco-Doppler en modo B. Las mediciones preoperatorias suelen hacerse con el paciente en bipedestación para aumentar el diámetro. Sin embargo, dado que estas mediciones se realizan mientras la vena está en el sistema venoso de baja presión, pueden reflejar el verdadero diámetro distendido de una vena una vez sea colocada en el sistema arterial11. Estudios previos con injertos venosos in situ han demostrado que existe un aumento significativo en el diámetro de la vena en la ecografía postoperatoria inicial11. Es interesante destacar que el porcentaje de aumento del diámetro venoso fue más pronunciado en las venas de pequeño calibre que en las venas de gran calibre11.
Fillinger et al15 investigaron la adaptación de las venas al entorno hemodinámico de los injertos infrainguinales e informaron que las venas de pequeño calibre responden más a la fuerza de cizallamiento, lo que provoca un mayor aumento del tamaño que en las venas de gran calibre. Es interesante destacar que las venas de gran calibre con una fuerza de cizallamiento inicial débil mostraron una disminución de su diámetro a lo largo del tiempo15. Sin embargo, un proceso similar de adaptación, pero competitivo, a la circulación arterial es responsable de la hiperplasia de la neoíntima, que puede dar lugar al desarrollo de estenosis del injerto venoso16. Otras características macroscópicas e histológicas del injerto venoso, como la reducción de la distensibilidad venosa, la hiperplasia de la musculatura lisa, y los infiltrados inflamatorios, se han asociado con el desarrollo de estenosis del injerto venoso17-19. Además, Westerband et al20 informaron de una relación estrecha entre la angiogénesis de la íntima y la subíntima y el grosor de la íntima en injertos venosos estenosados humanos.
En este estudio, el uso de conductos venosos con un diámetro preoperatorio mínimo<3,5mm estuvo asociado con índices satisfactorios de permeabilidad del injerto y de salvamento de la extremidad a los 40 meses21,22. El uso de venas con un diámetro preoperatorio pequeño significó que la mayoría (85%) de las intervenciones de bypass infrainguinal se realizaron con vena safena interna ininterrumpida, reduciendo considerablemente el tiempo de la intervención, así como la necesidad de injertos compuestos. La alternativa a esta estrategia es el uso de segmentos compuestos de vena safena interna o externa, vena cefálica, o vena basílica en lugar de vena safena interna ininterrumpida de pequeño calibre. Cuando se sigue esta última estrategia, la longitud del conducto requerido a menudo no puede obtenerse mediante un único segmento venoso, y deben utilizarse dos o más fragmentos. Esto constituye una preocupación, dado que dicha anastomosis puede ser un lugar de hiperplasia local de la íntima. A pesar de su complejidad, los índices de permeabilidad logrados con las venas de los brazos son similares a los obtenidos utilizando vena safena interna ininterrumpida23.
Un porcentaje significativo de bypass infrainguinales con injerto venoso desarrollan estenosis del injerto, que amenaza a la permeabilidad del mismo24. Varty et al8 informaron que el DIV preoperatorio es un factor de riesgo independiente del desarrollo de estenosis del injerto venoso. En este estudio existió un porcentaje significativamente elevado de reintervenciones por estenosis en derivaciones realizadas con venas de pequeño calibre. Sin embargo, a pesar del hecho de que el DIV fuera un factor de riesgo independiente para la reintervención, no existieron diferencias significativas en los índices de permeabilidad primaria asistida o de amputación entre los injertos creados con venas con un diámetro preoperatorio mínimo<3,5mm y los que utilizaron venas de un diámetro≥3,5mm. Esto subraya la importancia adicional de la vigilancia del injerto venoso y la corrección en el momento adecuado de la estenosis del injerto venoso en esta población de pacientes.
La vigilancia de los injertos venosos ha sido un tema controvertido. Si bien existe una amplia prueba de que un porcentaje significativo de ellos desarrollan estenosis y de que la evolución natural de la estenosis es su oclusión12-20, hasta la fecha no existe ninguna prueba definitiva que sugiera que la vigilancia con eco-Doppler es mejor que el seguimiento clínico a la hora de mejorar la permeabilidad del injerto o reducir los porcentajes de amputación. Ihlberg et al25 estudiaron 185 injertos venosos, que fueron distribuidos de forma aleatoria a vigilancia mediante eco-Doppler o seguimiento clínico. No observaron ninguna diferencia significativa entre ambos grupos en cuanto a la permeabilidad del injerto o el salvamento de la extremidad a 1 año. En un estudio de tamaño similar, Lundell et al26 informaron de una mejoría significativa en la permeabilidad del injerto en los pacientes que habían sido incluidos en un programa de vigilancia con eco-Doppler tras 3 años de seguimiento. Recientemente, el estudio Vein Graft Surveillance Randomised Trial (VGST) no destacó ninguna mejoría significativa en el resultado tras la vigilancia con eco-Doppler de los injertos venosos infrainguinales27. Todos los pacientes que participaron en el estudio VGST fueron sometidos a una eco-Doppler tras su inclusión, producida a las 6 semanas de la intervención de las derivaciones. Cada vez existen más pruebas de que muchos pacientes desarrollan una estenosis significativa del injerto venoso hacia las 6 semanas28,29. Por el contrario, el resultado en los injertos venosos que no presentan indicios de estenosis en la ecografía postoperatoria inicial es relativamente bueno, y estos pacientes posiblemente no se beneficien de una vigilancia intensiva29. La evolución natural de los injertos venosos que desarrollan una estenosis crítica, especialmente cuando se presentan de forma precoz, es el fracaso del injerto, que está asociado con un elevado porcentaje de pérdida de la extremidad29.
Si bien el DIV es uno de los factores asociados con el aumento del riesgo de estenosis del injerto venoso, existen otros factores asociados con el desarrollo de hiperplasia progresiva de la neoíntima y fracaso del injerto, como el tabaquismo continuado30,31, las concentraciones séricas de fibrinógeno31,32, y las concentraciones séricas de proteína C reactiva30,31. En este estudio, además del DIV, el tabaquismo continuado y la anastomosis distal de las derivaciones estuvieron asociados con un aumento de la incidencia de estenosis del injerto. Además, los antecedentes de diabetes, el tabaquismo, y la insuficiencia renal se realcionaron con una reducción de la permeabilidad del injerto y un aumento del riesgo de amputación. Si bien estas observaciones no son novedosas30-35, sirven como recordatorio de la importancia de la modificación de los factores de riesgo en el mantenimiento de la permeabilidad del injerto y el salvamento de la extremidad en los pacientes sometidos a derivaciones infrainguinales con injerto venoso. Las visitas de control durante el seguimiento constituyen una oportunidad ideal para la prevención secundaria de los factores de riesgo aterosclerótico, que tiene un impacto directo en la permeabilidad del injerto y en los índices de salvamento de la extremidad.
Los resultados de este estudio han demostrado que las venas de pequeño calibre pueden utilizarse con seguridad para la reconstrucción arterial infrainguinal, aunque con una tasa significativamente más elevada de reintervenciones para mantener la permeabilidad del injerto en comparación con las venas de mayor diámetro. Siempre que estos injertos entren en un programa de vigilancia de injertos venosos y se reparen cuando sea necesario, las derivaciones infrainguinales con injertos venosos de pequeño tamaño son satisfactorias y aumentan la disponibilidad de conductos autólogos para la reconstrucción arterial infrainguinal.
Los autores agradecen la ayuda significativa de los técnicos vasculares Rosie Levison, Rose Ross, y Scott Steedman, quienes realizaron el mapeo venoso preoperatorio y las ecografías de vigilancia de los injertos venosos.