El objetivo principal de este estudio fue comparar la eficacia de un implante de poliéster revestido de plata/colágeno, InterGard®, con un implante sellado con gelatina, Gelsoft™, ambos impregnados con rifampicina, en cuanto a su resistencia frente a la contaminación bacteriana directa en un modelo animal. El segundo objetivo fue confirmar la ausencia de inflamación por el acetato de plata. Prótesis vasculares de 6mm de diámetro se implantaron en la aorta infrarrenal de 28 perros. Todos los animales recibieron cefamandol (20mg/kg) por vía intravenosa. Los perros se dividieron en 3 grupos. El grupo I incluyó a 12 perros: 6 recibieron implantes de plata y 6 implantes sellados con gelatina, todos ellos impregnados con rifampicina. Las prótesis implantadas en el grupo I fueron infectadas directamente con Staphylococcus aureus resistente a la meticilina (SARM). El grupo II incluyó también 6 prótesis de plata y 6 prótesis selladas con gelatina, todas enlazadas con rifampicina. Los perros del grupo II fueron infectados directamente con Escherichia coli. El grupo III (grupo control) incluyó a 4 perros que recibieron prótesis no selladas con gelatina y fueron infectados directamente con SARM. Se realizó el seguimiento de todos los animales mediante exámenes clínicos periódicos, durante los que se practicaron hemocultivos. Las prótesis de los grupos I y III, y las del grupo II se extrajeron a los 30 y 10 días, respectivamente. Se realizaron análisis bacterianos en las prótesis explantadas. Se realizó el examen histológico tanto de las muestras tisulares como de los lugares de la anastomosis en las prótesis extraídas. En el grupo I, ninguna prótesis estuvo infectada con SARM, independientemente del tipo de implante. En el grupo II, ninguna prótesis revestida de plata estuvo infectada con E. coli, mientras que una de las 6 prótesis selladas con gelatina (16,6%) estuvo infectada (p=0,317). En el grupo III, 3 de las 4 prótesis (75%) estuvieron infectadas por SARM. La tasa de infección de los implantes revestidos de plata y de los implantes sellados con gelatina impregnada con rifampicina del grupo I fue estadísticamente significativa (p<0,05) en comparación con los implantes no sellados con gelatina del grupo III. No se observó ninguna diferencia estadísticamente significativa en la puntuación de la inflamación, obtenida mediante el examen histológico, entre los implantes de plata enlazados con rifampicina y los implantes Gelsoft en ninguno de los grupos I o II. Existieron signos de necrosis en las anastomosis en 3 implantes Gelsoft de 12 (25%) en los grupos I y II. No existieron signos clínicos o biológicos de inflamación con el uso de implantes revestidos de plata. Estos resultados indican que los implantes revestidos de colágeno/plata y los implantes sellados con gelatina, ambos impregnados con rifampicina, proporcionan una resistencia elevada frente a la infección por SARM y E. coli. Se observó una tendencia a una mayor resistencia, pero no estadísticamente significativa, frente a la infección por E. coli de los implantes de plata y rifampicina en comparación con el implante Gelsoft impregnado con rifampicina, sin prueba de signos de inflamación en los implantes de plata InterGard.
Las infecciones aórticas vasculares constituyen una de las complicaciones más graves tras cirugía arterial. A pesar de las mejoras en las medidas preventivas, como las técnicas quirúrgicas estériles y atraumáticas y la prevención rutinaria con antibióticos, la incidencia de infecciones de los implantes vasculares aórticos sigue siendo del 0,5-5%1. La infección del implante se asocia con una elevada mortalidad, 10-30%, y una tasa de amputación generalmente por encima del 25%, en función de la localización anatómica, el material del implante, y la virulencia de las bacterias2-4. Los estudios realizados in vitro han demostrado que la utilización de prótesis impregnadas con antibiótico puede ser eficaz a la hora de prevenir la infección. Se ha preferido la rifampicina debido a su elevada afinidad por los implantes revestidos de colágeno y gelatina que proporciona una impregnación estable5,6. Los estudios clínicos mostraron resultados prometedores en el caso de microorganismos con baja virulencia, especialmente frente a Staphylococcus epidermidis, pero una menor resistencia frente a otras bacterias, incluidos los Staphylococcus aureus resistentes a la meticilina7-10 (SARM). Informes recientes subrayan el aumento de la incidencia de infecciones por SARM y justifican la búsqueda de un antimicrobiano que sea activo frente a esta bacteria virulenta11,12. Los SARM podrían causar aproximadamente el 40% de las infecciones de los implantes vasculares. La plata es uno de estos antimicrobianos y sus propiedades se han utilizado durante muchos años en dispositivos médicos y medicaciones, como dispositivos implantables, pomadas antibióticas tópicas, medicación oftálmica, dermatología, apósitos para heridas, catéteres, e incluso suturas13,14.
InterGard Silver® (IGS; InterVascular, La Ciotat, Francia) es una prótesis revestida de colágeno a la que se le ha añadido acetato de plata, un eficaz antimicrobiano en su estado iónico, durante el proceso de fabricación, que se disuelve rápidamente sin residuos en una solución acuosa. Los iones de plata ejercen sus efectos antimicrobianos a través de diferentes mecanismos. Provocan un colapso gradual de la primera línea de defensa de las bacterias al desbaratar la permeabilidad de la membrana15,16 y la replicación del ADN impidiendo la división ceular17. Los iones de plata atacan a los ribosomas e interrumpen la transcripción del ARNm. Así mismo desnaturalizan las enzimas al adherirse a los grupos tiol, lo que provoca su inactivación y el cese de la producción de energía al interrumpir la síntesis de adenosina trifosfato (ATP) por la unión al grupo sulfhidrilo del citocromo B.
El estudio actual realizado en animales fue diseñado con el objetivo principal de comparar la eficacia del IGS impregnado con rifampicina, con un implante sellado con gelatina, Gelsoft™ (GST; Vascutek, Inchinnan, RU) impregnado con rifampicina, en la resistencia a la infección por SARM o Escherichia coli. El segundo objetivo fue evaluar la seguridad del implante IGS mediante criterios de valoración histológicos.
Materiales y MétodosEl estudio se realizó en un laboratorio experimental autorizado, La Fondation de l'Avenir (París, Francia), y fue autorizado por el comité de ética del centro. Fue financiado por una beca de InterVascular.
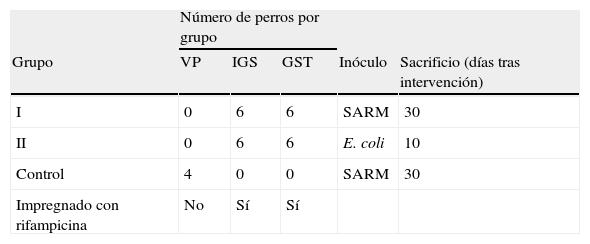
Diseño del estudioLas aortas infrarrenales de 28 perros fueron sustituidas por implantes vasculares. Los animales se distribuyeron en 3 grupos, como muestra la tabla I. El grupo I y el grupo II estuvieron formados cada uno por 12 animales; 6 perros de cada grupo recibieron un implante IGS y 6 recibieron un implante GST, ambos impregnados de rifampicina. Las prótesis implantadas en el grupo I fueron infectadas con una solución de SARM, y los animales fueron sacrificados a los 30 días. Las prótesis implantadas en el grupo II fueron infectadas con una solución de E. coli, y los animales fueron sacrificados a los 10 días. El tercer grupo actuó como control, las prótesis fueron infectadas con una solución de SARM y los animales fueron sacrificados a los 30 días. Las prótesis se extrajeron y se remitieron para realizar estudios bacteriológicos cuantitativos. Se obtuvo un segmento distal del implante incluyendo la anastomosis para su estudio anatomopatológico.
Esquema del estudio
| Número de perros por grupo | |||||
| Grupo | VP | IGS | GST | Inóculo | Sacrificio (días tras intervención) |
| I | 0 | 6 | 6 | SARM | 30 |
| II | 0 | 6 | 6 | E. coli | 10 |
| Control | 4 | 0 | 0 | SARM | 30 |
| Impregnado con rifampicina | No | Sí | Sí | ||
GST: Gelsoft™; IGS: InterGard Silver®; SARM: Staphylococcus aureus resistente a la meticilina; VP: prótesis vascular.
Los implantes IGS utilizados en los grupos I y II fueron de poliéster tejido revestidos con colágeno y acetato de plata. Los implantes GST utilizados en los grupos I y II fueron prótesis de poliéster tejido selladas con gelatina, mientras que el grupo control recibió una prótesis vascular de poliéster tejido no sellada (VP 1200K, Vascutek). El diámetro de todos los implantes fue de 6mm.
Impregnación con rifampicinaLa rifampicina (Rifadine; Aventis, París, Francia) se suministró en forma liofilizada y fue reconstituida con el disolvente suministrado. Las prótesis se introdujeron durante 15min en una solución de 60mg/ml de rifampicina inmediatamente antes de su implantación.
Animales de experimentaciónLos perros eran Beagles adultos con un peso de 15-20kg, que se aclimataron durante un período de 10 días anteriores al inicio del estudio, y estuvieron alojados individualmente en estabularios certificados y en condiciones de higiene adecuadas. Todas las intervenciones realizadas en los animales cumplieron con las pautas recomendadas sobre cuidado animal autorizadas por el comité de ética de La Fondation de l'Avenir.
Implantación de las prótesisAntes de la intervención, se administraron como preanestésicos glicopirrolato (0,01mg/kg), morfina (0,2mg/kg), y acepromazina (0,05mg/kg). La inducción anestésica se realizó por vía intravenosa con tiopental sódico (10mg/kg) y se mantuvo mediante intubación traqueal con oxígeno (100%) e isoflurano (1-2%). Los perros recibieron antibióticos de forma preventiva, 20mg/kg de cefamandol, por vía intravenosa 1h antes del abordaje y posteriormente cada 2h. Los perros se mantuvieron en decúbito dorsal y se les practicó una laparotomía en condiciones quirúrgicas asépticas. Se expuso la aorta abdominal desde las arterias renales hasta la bifurcación aórtica. Las arterias lumbares y mesentérica inferior se ligaron y se cortaron para facilitar la movilidad de la aorta. Tras la administración IV de 0,5mg/kg de heparina en bolo y de 125mg de ácido acetilsalicílico, la aorta se clampó justo por debajo de las arterias renales y por encima de la bifurcación aórtica y se extrajo el segmento aórtico. Se implantó una prótesis de 6mm de diámetro y 5-8cm de longitud con una anastomosis terminoterminal utilizando una sutura continua de polipropileno 5/0. Una vez colocada en su lugar, se vertieron directamente en el implante 2ml de una solución bacteriana de SARM en el grupo I y el grupo control y de E. coli en el grupo II, cada una conteniendo de 1 a 2 x 107 unidades formadoras de colonias (UFC)/ml. La prótesis se cubrió mediante el cierre directo del peritoneo y la pared abdominal se cerró por capas utilizando la técnica estándar.
SeguimientoLos perros recibieron 125mg de ácido acetilsalicílico tamponado por vía oral diariamente hasta su sacrificio y se examinaron diariamente para detectar complicaciones macroscópicas, como hemorragia, infección sistémica, embolización distal, o paraplejía. Se tomaron muestras de sangre antes y después de la implantación y semanalmente a lo largo de todo el estudio. También se realizaron hemocultivos pre y postimplantación hasta el sacrificio.
Cepas bacterianasLas cepas de SARM y E. coli se obtuvieron de pacientes infectados. El Centre National de Références del Toxémies à Staphylocoques (Laboratorio Central de Microbiología, Hospital Edovard Hensiot, Lyon, Francia) caracterizó y registró la resistencia y virulencia de las bacterias. La cepa clínica del SARM utilizada en este estudio era sensible a la rifampicina. Esta cepa y la de E. coli se aislaron de infecciones de zonas vasculares en un departamento de cirugía vascular. La cepa bacteriana se cultivó durante 18h y se introdujo en Trypticase™ Soy Agar (BD-Diagnostic Systems, Nueva Jersey, EE. UU.). Se preparó una suspensión de Mueller-Hinton (MH) con una densidad de 0,5 MacFarland (correspondiente a 108 UFC/ml) y se diluyó 1:10 para obtener la concentración final de 107 UFC/ml.
Explantación de las prótesisLos animales se sacrificaron en el momento que muestra la tabla I o antes si el fallecimiento parecía inminente. Las prótesis se extrajeron en condiciones quirúrgicas asépticas. Se extrajo un segmento de la aorta cercano a la línea de sutura, que incluía la anastomosis, y se obtuvieron muestras de los principales órganos, como hígado, riñones, pulmones, corazón y bazo, para realizar su estudio histológico.
Análisis bacteriológicoLa totalidad de las prótesis explantadas, a excepción de las anastomosis distales, fueron transferidas a tubos estériles conteniendo 10ml de caldo de MH y se centrifugaron, durante 3min. Se contaron las bacterias liberadas en el caldo de MH, y se realizó una dilución seriada. Las alícuotas se transfirieron mediante un asa calibrada (10ml) a agar-agar MH y se incubaron a 37°C durante 18h. Posteriormente se realizó el recuento bacteriano de cada dilución. Los recuentos de las colonias se estimaron en UFC, y la estimación cuantitativa final de contaminación en la superficie de la prótesis se expresó en UFC/cm2.
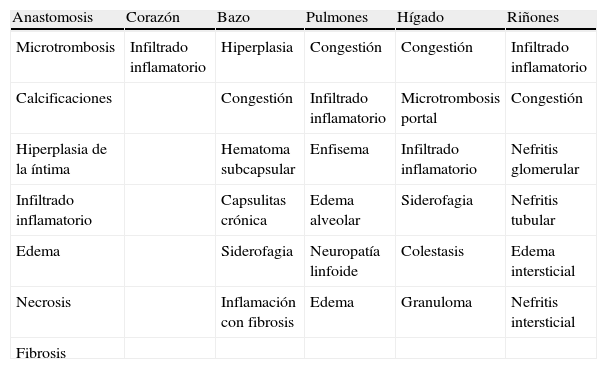
Examen histológicoLa interpretación de los resultados histológicos se basó en la puntuación inflamatoria dada a cada órgano y a la zona anastomótica en una escala de alteración clínica de 4 puntos: 0, ausencia de signos; 1, leves; 2, moderados; 3, graves. También se realizó una evaluación global de todos los órganos en cada animal sumando las puntuaciones para cada órgano. La tabla II muestra los episodios inflamatorios que fueron evaluados.
Aspectos histológicos de la inflamación examinada
| Anastomosis | Corazón | Bazo | Pulmones | Hígado | Riñones |
| Microtrombosis | Infiltrado inflamatorio | Hiperplasia | Congestión | Congestión | Infiltrado inflamatorio |
| Calcificaciones | Congestión | Infiltrado inflamatorio | Microtrombosis portal | Congestión | |
| Hiperplasia de la íntima | Hematoma subcapsular | Enfisema | Infiltrado inflamatorio | Nefritis glomerular | |
| Infiltrado inflamatorio | Capsulitas crónica | Edema alveolar | Siderofagia | Nefritis tubular | |
| Edema | Siderofagia | Neuropatía linfoide | Colestasis | Edema intersticial | |
| Necrosis | Inflamación con fibrosis | Edema | Granuloma | Nefritis intersticial | |
| Fibrosis |
Los 3 grupos fueron comparables en cuanto a características clínicas y UFC de bacterias inoculadas, con una media ± desviación estándar (DE) de 4,2±1,6 × 106 UFC/cm2 (los valores para los grupos I-III fueron, respectivamente, 4,1±1,2 × 106, 4,4±0,8 × 106, y 4,3±1,8 x 106).
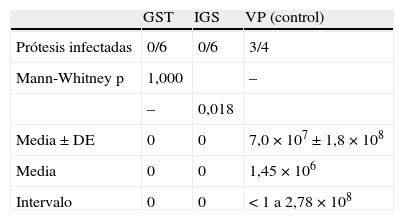
Grupo ITodos los implantes IGS y GST estuvieron libres de SARM al sacrificio. Los datos se muestran en la tabla III.
Evaluación bacteriológica de las prótesis en los grupos I y control
| GST | IGS | VP (control) | |
| Prótesis infectadas | 0/6 | 0/6 | 3/4 |
| Mann-Whitney p | 1,000 | – | |
| – | 0,018 | ||
| Media±DE | 0 | 0 | 7,0 × 107±1,8 × 108 |
| Media | 0 | 0 | 1,45 × 106 |
| Intervalo | 0 | 0 | < 1 a 2,78 × 108 |
DE: desviación estándar; GST: Gelsoft™; IGS: InterGard Silver®; VP: prótesis vascular.
Ambos grupos fueron infectados inicialmente por SARM. Los resultados se expresan en UFC por cm2.
Los exámenes histológicos no mostraron ninguna diferencia estadísticamente significativa entre las prótesis IGS y GST. Un animal del grupo GST presentó una pequeña bolsa séptica a lo largo de la sutura subcutánea de la prótesis explantada 4 semanas después de la cirugía.
Solamente se produjo una complicación clínica, en un animal con un implante IGS. Consistió en una infección de la herida, que requirió un drenaje abierto en la zona distal del abdomen y que se resolvió sin mayores secuelas tras 7 días. No existió ninguna otra complicación en el grupo I.
Grupo IITodos los implantes IGS estuvieron libres de E. coli al sacrificio. Esto no sucedió con los implantes GST, en los que 1 de 6 (16,6%) estuvo infectado por E. coli en ese momento, 2,56 x 103 UFC/cm2 que correspondieron a una reducción del 48,5%. Esta diferencia no fue estadísticamente significativa (Mann-Whitney, p=0,317). Estos resultados se muestran en la tabla IV.
Evaluación bacteriológica de las prótesis en el grupo II
| GST | IGS | |
| Prótesis infectadas | 1/6 | 0/6 |
| Mann-Whitney p | 0,317 | |
| Media±DE | 427,35 | 0 |
| Media | 0 | 0 |
| Intervalo | 0 a 2,56 × 103 | 0 |
DE: desviación estándar; GST: Gelsoft™; IGS: InterGard Silver®.
Las prótesis fueron infectadas por E. coli. Los resultados se expresan en UFC por cm2.
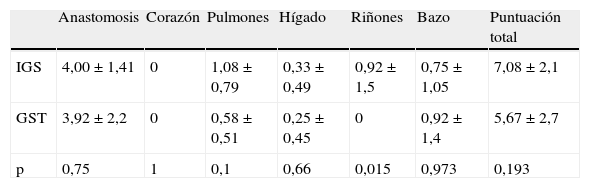
El examen histológico no mostró diferencias significativas, a excepción de la evaluación de los riñones (test exacto de Fischer, p=0,046), en la que un perro del grupo IGS presentó lesiones inflamatorias renales (tabla V). La evaluación del resto de los órganos fue normal en este perro, así como la función renal anterior a la explantación, con concentraciones de creatinina en los límites normales, lo que sugiere que esta observación no tuvo ningún significado clínico y no estuvo relacionada con el implante. La comparación de la puntuación global de cada órgano analizado confirma esta interpretación.
Resultados histológicos entre las prótesis IGS y GST
| Anastomosis | Corazón | Pulmones | Hígado | Riñones | Bazo | Puntuación total | |
| IGS | 4,00±1,41 | 0 | 1,08±0,79 | 0,33±0,49 | 0,92±1,5 | 0,75±1,05 | 7,08±2,1 |
| GST | 3,92±2,2 | 0 | 0,58±0,51 | 0,25±0,45 | 0 | 0,92±1,4 | 5,67±2,7 |
| p | 0,75 | 1 | 0,1 | 0,66 | 0,015 | 0,973 | 0,193 |
GST: Gelsoft™; IGS: InterGard Silver®.
Los resultados se expresan como la media±DE. Se sumaron las prótesis de los grupos I y II.
SARM estuvo presente en 3 de 4 implantes VP (75%) al sacrificio, como muestra la tabla III.
Comparaciones de los grupos I-IIINo se observaron diferencias significativas en los recuentos de SARM entre los implantes IGS y GST, ambos impregnados con rifampicina. El número de implantes infectados por SARM al sacrifico fue significativamente menor desde el punto de vista estadístico en los implantes IGS impregnados de rifampicina en el grupo I en comparación con los implantes VP del grupo control (Mann-Whitney, p=0,018). Existió una diferencia similar entre los implantes GST del grupo I y los VP del grupo control.
La histología de todos los implantes GST en los grupos I y II combinados mostró que 3 de 12 implantes (25%) presentaron una necrosis moderada, de grado 2. Ésta se definió como la presencia de tejido inflamatorio alrededor de células muertas. La necrosis no se debió a la colonización bacteriana. Un análisis similar no logró mostrar necrosis en ninguno de los 12 implantes IGS combinados del grupo I y II, pero esta diferencia no fue estadísticamente significativa.
DiscusiónEl objetivo principal de nuestro estudio fue analizar la resistencia a la infección de los implantes IGS y GST, ambos impregnados con rifampicina, frente a los patógenos SARM y E. coli. No pudimos demostrar diferencias entre los implantes IGS y GST con respecto a la resistencia a la infección.
La eficacia de la actividad bactericida de los implantes IGS frente a los organismos grampositivos, incluido el SARM, y los organismos gramnegativos se ha demostrado18in vitro al comparar la actividad antimicrobiana de los implantes IGS con los GST con y sin rifampicina. Las prótesis IGS y GST impregnadas con rifampicina fueron más eficaces que los implantes GST sin rifampicina. La presencia de antibiótico protegió más frente a las bacterias grampositivas, mientras que los implantes IGS fueron más eficaces frente a las bacterias gramnegativas. Estos resultados concuerdan con nuestros resultados actuales, que muestran que, 10 días después de la implantación, 1 de 6 prótesis GST impregnadas con rifampicina resultó infectada por E. coli, mientras que 0 de 6 prótesis IGS resultaron infectadas, lo que concuerda con un estudio experimental previo in vivo realizado en perros que demostró una baja eficacia de los implantes GST frente a E. coli19.
Si bien se puede argumentar que no existen diferencias estadísticamente significativas entre los implantes IGS y GST en nuestro estudio actual in vivo, el número reducido de animales estudiado probablemente es la explicación de esta falta de significancia estadística. Son necesarios estudios adicionales con un mayor número de animales para confirmar o rechazar la tendencia observada.
El estudio de Hardmann et al18 realizado in vitro mostró una superioridad de los implantes IGS frente a los GST impregnados con rifampicina frente a las bacterias gramnegativas, pero lo contrario frente a las bacterias grampositivas. Koshiko et al19 demostraron una falta de eficacia de los implantes GST con una baja concentración de rifampicina (1mg/ml) frente a SARM cuando el nivel de inóculo era muy alto, llegando a 108 UFC/ml. En seres humanos se ha demostrado que el fracaso de la sustitución in situ con implantes impregnados con rifampicina puede deberse a la presencia de cepas bacterianas virulentas, como SARM o Pseudomonas aeruginosa20. El uso clínico de este tipo de prótesis no está aceptado en todo el mundo. En nuestro centro, debido a un aumento de las cepas de S. aureus resistentes a la rifampicina, no está permitido utilizar rifampicina en la sala de intervenciones. Sin embargo, el implante impregnado con rifampicina se recomienda cuando se realiza un abordaje inguinal o un paciente presenta varios factores de riesgo de infección, como diabetes mellitus, insuficiencia renal, o isquemia crítica. Para la prevención, la dosis recomendada es de 60mg/ml. Queríamos examinar la resistencia bacteriana de estas prótesis en ‘‘condiciones clínicas estándar'’, de manera que realizamos un tratamiento antibiótico preventivo. La antibioterapia sistémica en nuestro estudio puede ser otra explicación de la ausencia de diferencias estadísticamente significativas a favor del IGS. La antibioterapia preventiva también es eficaz en casos de infección protésica diseminada por vía hematógena21. Estudios clínicos y experimentales22-24 han subrayado el papel crítico de la administración sistemática de antibióticos durante el tratamiento de la infección de los implantes vasculares. Estos estudios utilizaron cefalozina o vancomicina, solas o en combinación con temporina A, un antiséptico, para tratar directamente la contaminación del implante por S. epidermidis o SARM. Solamente la combinación de temporina A y la administración parenteral de vancomicina lograron la inhibición bacteriana total de ambas cepas bacterianas.
Un estudio anterior realizado en un modelo canino25 comparó el implante GST impregnado con rifampicina con el implante IGS para la prevención de la infección bacteriana de la prótesis por S. aureus. Un seguimiento muy corto, de 7 días, arrojó dudas sobre el significado de las conclusiones. La rifampicina alcanza el pico de actividad antimicrobiana a las pocas horas de su implantación, y el resto se va liberando a lo largo de varios días a una concentración bactericida submínima, creando así un entorno favorable al desarrollo de resistencia a este antibiótico. Además, la baja concentración de rifampicina lograda en unos pocos días podría explicar, en parte, la incapacidad del GST impregnado con rifampicina para combatir las bacterias virulentas, como P. aeruginosa, SARM, y bacterias gramnegativas.
El mecanismo de liberación de la plata de los implantes IGS podría suponer una ventaja dada su localización en el implante y la consiguiente disolución durante un período de hasta 30 días. Varios informes anteriores analizaron los implantes vasculares impregnados con rifampicina en el contexto de la infección de las prótesis vasculares. Algunos han logrado resultados favorables en la prevención de la infección de los implantes vasculares con el uso de GST impregnado26,27. Sin embargo, un ensayo europeo, multicéntrico, aleatorizado y comparativo desafió estos resultados optimistas. Si bien la tasa de infección fue significativamente baja 1 mes después de la intervención en el grupo de prótesis de gelatina impregnada con rifampicina28, no se apreció ninguna diferencia en comparación con un grupo control tras 2 años de seguimiento, incluso a pesar de que las tasas de infección superficial (grados I y II de la clasificación de Szilagyi) fueron menores en el grupo de implante impregnado con antibiótico tras la implantación de prótesis aortoiliofemorales29. Estos resultados se confirmaron en un estudio30 que notificó 5 casos de infección en pacientes con implantes impregnados (1,7%) comparado con 7 pacientes (2,3%) con implantes no impregnados a los 2 años de seguimiento. Estos resultados contradictorios subrayan la ausencia de prueba científica sólida sobre la reducción de la incidencia de infección con esta estrategia.
Un estudio experimental reciente sugirió el uso de implantes impregnados con doble antibiótico (rifampicina y tobramicina) para resistir la contaminación por S. aureus31. Otra técnica, sugerida por Hardmann et al18, es la combinación de un antimicrobiano revestido, como la plata, con una impregnación con antibiótico. Este concepto concuerda con los resultados de Cirioni et al32, quienes investigaron la temporina A, una amida peptídica antimicrobiana, y el péptido inhibidor del ARNIII (RIP), un antibiótico con una gran actividad frente a la virulencia y la adhesión de S. aureus y S. epidermidis. Éstos se estudiaron solos y en combinación en un modelo murino de infección protésica. La combinación de temporina A y RIP tuvo la mayor eficacia antiestafilocócica, eliminando por completo la infección por S. aureus y S. epidermidis.
La plata y la rifampicina combinadas podrían demostrar una acción sinérgica con eficacia frente a todas las bacterias grampositivas y gramnegativas. Los mecanismos de acción de la plata y la rifampicina trabajan al unísono para reducir el riesgo de infección a través del efecto dependiente de la concentración de la plata, siendo eficaz frente a las células en crecimiento y quiescentes a través de múltiples dianas en la estructura celular, y del efecto dependiente del tiempo de la rifampicina, que es eficaz frente a las células en crecimiento a través de una única diana en la célula. Nuestros resultados obtenidos con el implante IGS en combinación con rifampicina confirman esta hipótesis.
El segundo objetivo de nuestro estudio fue evaluar la inflamación secundaria al uso de acetato de plata. No existieron diferencias entre el grupo IGS y el grupo GST con respecto a los signos clínicos y parámetros biológicos. Los implantes IGS parecieron estar bien integrados en ambos grupos al sacrificio. No se produjeron signos de inflamación debido al acetato de plata. Durante la explantación, no se apreciaron signos de inflamación abdominal inusual, necrosis, o tinción de la aorta en el grupo IGS como consecuencia del proceso de fabricación de los implantes IGS y el consiguiente depósito de plata en su superficie así como en el colágeno. Esto contrasta claramente con algunos ensayos clínicos previos con productos revestidos con plata, agujas de fijación externa, y prótesis valvulares cardíacas, estas últimas revestidas mediante depósito en fase vapor asistido por plasma. Estos estudios finalizaron antes de tiempo debido a la elevada concentración de plata en suero y las tasas excesivas de dehiscencia perivalvular, respectivamente33,34, lo que puso en duda el proceso de fabricación de depósito de la plata en fase vapor. Los efectos sistémicos de la plata se han descrito a partir del uso extendido de fármacos orales conteniendo plata35. No monitorizamos las concentraciones sanguíneas de plata en nuestro estudio, pero no se produjeron casos de dehiscencia de los lugares de anastomosis en ninguno de los 12 implantes IGS en los grupos I y II.
Una limitación de este estudio es el tamaño reducido de cada grupo. La mayoría de los trabajos experimentales anteriores que han utilizado SARM han analizado la resistencia bacteriana a los 10 días. Tratamos de demostrar la eficiencia de las prótesis durante un período más largo. Ningún trabajo experimental anterior había utilizado E. coli, de manera que comprobamos la prótesis por un corto período de tiempo.
No utilizamos un grupo con IGS solo porque un trabajo anterior25 ya había demostrado la superioridad de los implantes GST impregnados con rifampicina en comparación con los implantes IGS.
Por último, los resultados clínicos preliminares obtenidos tras la revascularización in situ con implantes revestidos de plata para la infección aórtica (24 infecciones de prótesis y 3 infecciones aórticas primarias) son muy alentadores36. La mayoría de estas infecciones fueron causadas por bacterias de baja virulencia. Con un seguimiento medio de 16,5 meses, los autores describieron resultados favorables con respecto a las tasas de infección recurrente, supervivencia actuarial a los 24 meses, salvamento de la extremidad, y permeabilidad de la prótesis: 3,7, 85, 100, y 100%, respectivamente. Puede aducirse que el éxito de los implantes IGS en el entorno hostil de una infección de prótesis aórtica es un buen precedente para su uso en casos en lo que no haya una infección preexistente.
En conclusión, el aumento de la incidencia de infección por SARM puede desafiarse de forma óptima mediante la implantación de prótesis IGS impregnadas con rifampicina. Sin embargo, investigaciones adicionales, tanto in vitro como in vivo, deben confirmar nuestros resultados.