Se ha demostrado que el óxido nítrico (ON) previene la hiperplasia neointimal y disminuye la aterosclerosis en diversos modelos animales. Es un importante modulador de la homeostasia y produce efectos vasoprotectores frente a la aterosclerosis. Sin embargo, en el ámbito clínico no se ha utilizado ON con esta finalidad terapéutica. El objetivo del presente estudio consistió en combinar un elastómero de uso médico y un donante de ON, el aducto de ON dietilenotriamina (DETA/ON), para determinar si su administración perivascular podía atenuar la aterosclerosis y la lesión vascular. En 22 conejos machos sanos, New Zealand White, alimentados con una dieta rica en colesterol durante las 4 semanas previas, se produjo una lesión intimal aórtica usando un catéter pediátrico de valvuloplastia pulmonar. Localmente se aplicó una combinación del elastómero Silastic y DETA/ON para cubrir las aortas en el grupo experimental. Después de 6 semanas adicionales de alimentación con la dieta rica en colesterol, se obtuvieron las aortas y muestras sanguíneas para efectuar un análisis anatomopatológico y una comparación con el grupo de control. En el grupo experimental el área superficial media de aterosclerosis y de lesión vascular fue de 6,68 x 105 μm2 comparado con 3,44 x 10μ2 en el grupo de control. Sin embargo, no se detectaron diferencias estadísticamente significativas en el área superficial aterosclerótica entre ambos grupos. A la concentración utilizada, la aplicación perivascular del donante de ON DETA/ON no previno la aterosclerosis en conejos alimentados con una dieta rica en colesterol. Este hallazgo sugiere la necesidad de una evaluación más cuidadosa antes de su posible aplicación clínica.
La aterosclerosis es un problema frecuente que entraña una morbilidad y mortalidad considerables en la comunidad. Es la principal causa de vasculopatías oclusivas como la coronariopatía1. Los tratamientos de estas vasculopatías incluyen procedimientos como las intervenciones percutáneas y la cirugía cuando el tratamiento médico no da lugar a una respuesta adecuada2,3. Sin embargo, ambas intervenciones se asocian con una incidencia frecuente de reestenosis, que se debe principalmente a la hiperplasia intimal y la recidiva de la arterosclerosis4,5. Por ejemplo, la vena safena, el injerto más habitual usado en cirugía de bypass coronario, se ocluye en el 15-20% de los casos durante el primer año postoperatorio, la mitad de los cuales se produce en las 2 primeras semanas, y se atribuye a la producción reducida de óxido nítrico (ON) derivado del endotelio en los injertos6,7.
Se ha demostrado que el ON es un importante modulador de la homeostasia vascular y que produce efectos vasoprotectores frente a la aterosclerosis8. Inhibe la agregación plaquetaria, la migración de los leucocitos, y la adhesión al endotelio, y también atenúa la proliferación y migración de la célula muscular vascular, lo que, en conjunto, favorece la aterosclerosis y la reestenosis9-12.
El objetivo del presente estudio fue evaluar los efectos del aducto de ON dietilenotriamina (DETA/ON), un donante de ON de la especie diaceniodiolato, sobre el desarrollo de la aterosclerosis, cuando se aplica localmente en forma de suspensión en un elastómero alrededor de la aorta de conejos hipercolesterolémicos tras una lesión intimal creada quirúrgicamente.
MétodosPara el estudio se seleccionaron 22 conejos macho New Zealand White, que pesaban 2±0,2kg, con características muy similares. Todos los animales recibieron los cuidados de acuerdo con las recomendaciones del comité de cuidados en animales de la Tehran University of Medical Sciences, basado en la “Guide for the Care and Use of Laboratory Animals” (publicación 86-23 del US NIH, revisada en 1985). Se les aclimató en una sala de temperatura controlada (23±2°C) con un ciclo de luz/oscuridad de 12h y libre acceso al pienso estándar y al agua durante las 2 primeras semanas. Acto seguido, fueron alimentados con una dieta rica en colesterol utilizando colesterol en polvo (C3045; Sigma-Aldrich, Múnich, Alemania), mezclado con pienso de conejo (cada 100g de pienso contenían 2g de colesterol) durante 4 semanas13.
En el momento de la cirugía, los animales fueron asignados aleatoriamente a uno de dos grupos: no tratado (control, n=10), y tratado con DETA/ON (experimental, n=12). Los conejos fueron preanestesiados con ketamina intraperitoneal (50mg/kg) y xilacina (5mg/kg). La anestesia se mantuvo con una infusión intravenosa de ketamina en una solución salina al 0,9% (0,1mg/kg/min) a través de la vena marginal del lóbulo de la oreja cuando el cirujano lo consideró necesario. También recibieron una inyección de cefalotina en dosis de 50mg/kg. Acto seguido, fueron intubados y sometidos a respiración asistida, después de lo cual se abrió cavidad torácica a través de una esternotomía transversa en la segunda o tercera región intercostal. Después de la pericardiotomía se expuso la aorta y se aplicó una sutura en bolsa de tabaco en la porción media de la aorta ascendente. A continuación, a través de punción en la sutura en bolsa de tabaco se insertó un catéter de valvuloplastia pulmonar, y se dilató el balón hasta un grado un 20% mayor que el diámetro aórtico estimado. Acto seguido se hizo avanzar el balón dilatado 2-3cm distales a la porción proximal de la aorta descendente14. Después se retiró el catéter y se cerró el lugar de la punción; más tarde, se cubrieron las partes de la aorta ascendente, cayado aórtico y porción inicial de la descendente con un gel usado como transportador del donante de ON, el gel de elastómero, antes de cerrar el tórax (fig. 1). El gel se utilizó para contener el donante de ON en el área perivascular. Para producirlo, se mezclaron 2cm3 de la sustancia principal de elastómero de uso médico (Silastic MDX4-4210; Dow Corning Corporation, Midland, Míchigan, Estados Unidos) con 0,2cm3 del agente polimerizador a 37°C; acto seguido, se añadieron al gel 2ml de la solución de 500 μg/ml de DETA/ON (Alexis Corporation, Lausana, Suiza) en suero salino normal, y para el grupo de control, sólo 2ml de este último y se mezclaron completamente. Por lo tanto, para cada conejo del grupo experimental, el gel contenía un total de 1.000 μg de DETA/ON.
El Silastic MDX4-4210, un elastómero de calidad biomédica, es un producto poroso de dos componentes que, cuando se combinan, se polimeriza dando lugar a un compuesto de consistencia gomosa de silicona translúcida durante varias horas a temperatura ambiente. El componente elastómero consiste en un polímero de dimetilsiloxano, sílice de refuerzo y un catalito de platino. El agente de polimerización consiste en un polímero de dimetilsiloxano, un inhibidor y el formador de enlaces cruzados siloxano. Está destinado a usarse para los prototipos generales, moldeados y fabricación de dispositivos médicos pero también puede usarse como matriz de fármacos para los sistemas de distribución de fármacos de liberación controlada15.
Los conejos fueron alimentados con el mismo pienso rico en colesterol durante 6 semanas adicionales (10 semanas en total alimentados con dicha dieta). Después, se sometieron a un ayuno de toda la noche como preparación para la obtención de las muestras de sangre y la aorta. Fueron anestesiados con ketamina y xilacina. Se abrió el tórax, y se resecó el corazón con la aorta (aorta ascendente, cayado aórtico y aorta descendente) y se remitió para examen anatomopatológico en un baño de formol al 10% neutralizado.
En el examen anatomopatológico, se despojó por completo la adventicia y toda la grasa adherente de la aorta. También se eliminaron los restos de gel de elastómero. En este estadio, el anatomopatólogo prestó atención a la evaluación, tanto macroscópica como microscópica, de las aortas para inflamación y reacción adversa al gel de elastómero. Las aortas se dividieron en un segmento ascendente, cayado aórtico y descendente proximal. Después se obtuvieron tres cortes transversales de cada segmento. Las muestras se deshidrataron en una serie graduada de alcohol xileno y se fijaron en parafina para su examen en el microscopio óptico. A partir de cada bloque de parafina, se cortaron cuatro secciones de 4 μm2 (total de 36 muestras) que se tiñeron con hematoxilina y eosina.
Todas las secciones se evaluaron con el microscopio para la estría grasa, células espumosas, núcleo de lípidos extracelulares e integridad de la fibra elástica. El grado de lesión vascular y de aterosclerosis se determinó cuantitativamente en función del área de la lesión (en una escala de μ2) mediante el uso de un analizador de imágenes en color (E200; Nikon, Tokio, Japón). Tanto el cirujano como el anatomopatólogo permanecieron enmascarados para el grupo de control y al experimental.
Antes de iniciar el estudio principal, efectuamos un estudio piloto para demostrar que la administración perivascular de un gel portador de donante de ON puede dar lugar a un aumento de su concentración intraluminal. En el estudio piloto, se sacrificaron ocho conejos mediante inyección intravenosa de 60mg/kg/dosis de pentobarbital sódico, y sus aortas se obtuvieron y cortaron en segmentos de 2cm de longitud, de modo que, en conjunto, se dispuso de 24 segmentos. Los segmentos se llenaron de suero salino normal, y tanto los extremos como las ramas laterales se ligaron con suturas de seda. Después los segmentos se dividieron en dos grupos: el grupo del experimento (n=12), que se cubrió con 2cm3 del gel de elastómero, Silastic MDX4, mezclado con 1.000 μg de DETA/ON; y el grupo de control (n=12), que se cubrió con gel de elastómero solo. La solución salina dentro de los vasos se obtuvo después de una hora en la mitad de muestras de cada grupo (n=6) y después de 6h en el resto. Puesto que no podíamos determinar directamente la concentración de ON, se evaluó la concentración de su metabolito peroxinitrito usando la reacción de Griess y se asumió que era proporcional a la concentración de ON.
Los datos se analizaron con el programa SPSS versión 16. Para probar la distribución normal de los grupos se usó la prueba de Kolmogorov-Smirnov de una muestra. Para comparar los datos cuantitativos entre grupos con una distribución normal se usó la prueba t para muestras independientes, y para aquellos con una distribución no normal se usó la prueba de Mann-Whitney.
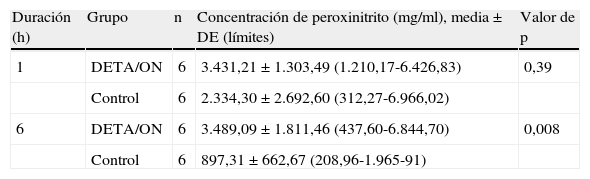
ResultadosComo se ha mencionado previamente, en el estudio piloto, dispusimos de 24 segmentos de aorta de conejo llenos de suero salino normal y cubiertos de gel de elastómero y donante de ON (grupo DETA/ON) o gel de elastómero solo (grupo de control) para verificar la difusión transmural de ON. En la tabla I se presentan los datos concernientes a la concentración intraluminal de peroxinitrito. Los análisis no revelaron diferencias significativas en la concentración de peroxinitrito entre ambos grupos después de una hora, aunque la concentración de ON fue significativamente mayor en el grupo DETA/ON después de 6h (p<0,01).
Concentración de peroxinitrito en los dos grupos del estudio piloto
| Duración (h) | Grupo | n | Concentración de peroxinitrito (mg/ml), media±DE (límites) | Valor de p |
| 1 | DETA/ON | 6 | 3.431,21±1.303,49 (1.210,17-6.426,83) | 0,39 |
| Control | 6 | 2.334,30±2.692,60 (312,27-6.966,02) | ||
| 6 | DETA/ON | 6 | 3.489,09±1.811,46 (437,60-6.844,70) | 0,008 |
| Control | 6 | 897,31±662,67 (208,96-1.965-91) |
DE: desviación estándar; DETA/ON: aducto de dietilenotriamina ON; n: número de segmentos.
Durante el estudio murieron dos conejos de 22 (9%), ambos del grupo experimental, y se excluyeron de un análisis adicional. Puesto que murieron poco después de la extubación y no estuvieron presentes otras causas de la muerte como hemorragia, fibrilación ventricular, etcétera, se pudo asumir que la causa de la muerte fue la hipotensión arterial debida a ON. Los datos de los otros animales se introdujeron en una base de datos informática para análisis adicionales.
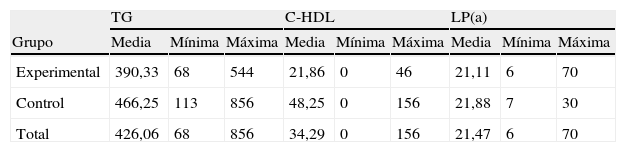
En la tabla II se muestran las concentraciones sanguíneas medias de colesterol, triglicéridos (TG), lipoproteína(a)[LP(a)], y de colesterol unido a lipoproteínas de alta densidad (HDL) en el grupo experimental y de control. Los datos revelaron la presencia de hipercolesterolemia e hipertrigliceridemia en los conejos del grupo experimental como era predecible. Los análisis no demostraron una diferencia significativa de la concentración sanguínea de colesterol, colesterol HDL, TG y LP(a) entre ambos grupos, lo que descartó el sesgo que podría haber causado el colesterol.
Concentraciones séricas de triglicéridos, de colesterol unido a lipoproteínas de alta densidad y lipoproteína(a) (mg/dl)
| TG | C-HDL | LP(a) | |||||||
| Grupo | Media | Mínima | Máxima | Media | Mínima | Máxima | Media | Mínima | Máxima |
| Experimental | 390,33 | 68 | 544 | 21,86 | 0 | 46 | 21,11 | 6 | 70 |
| Control | 466,25 | 113 | 856 | 48,25 | 0 | 156 | 21,88 | 7 | 30 |
| Total | 426,06 | 68 | 856 | 34,29 | 0 | 156 | 21,47 | 6 | 70 |
HDL: colesterol de lipoproteínas de alta densidad; LP(a): lipoproteína (a); TG: triglicéridos.
El área superficial de aterosclerosis en el grupo experimental (n=10) varió desde 0,4 x 105 μm2 hasta 2,1 x 106 μm2, con una media de 6,68 x 105 μm2 (fig. 2), mientras que en el grupo de control (n=10) varió desde 0 (cuatro conejos de este grupo no habían desarrollado aterosclerosis de acuerdo con el informe anatomopatológico) hasta 1,18 x 105 μm2 con una media de 3,44 x 105 μm2. Puesto que el área superficial no tenía una distribución normal según la prueba de Kolmogorov-Smirnov (p<0,04), usamos la prueba de Mann-Whitney, que demostró que no había diferencias significativas en el área de superficie aterosclerótica entre el grupo de control y el experimental. Sólo se observó una placa aterosclerótica complicada (calcificación y hemorragia) en un caso de este último grupo.
DiscusiónLa aterosclerosis es la causa principal de coronariopatía y reestenosis después de cirugía e intervenciones percutáneas. Recientemente, se ha demostrado que la inflamación desempeña un importante papel en la formación de la placa e incluso en las complicaciones, como su rotura16. La migración de monocitos y macrófagos, la adhesión leucocitaria, la agregación plaquetaria, migración y proliferación de la célula muscular lisa y la formación neointimal son supuestamente los cambios anatomopatológicos principales en la reestenosis y la aterogénesis17,18.
El NO endógeno difunde a través de la membrana endotelial en todas las células musculares lisas e induce vasodilatación. Además de ser un potente vasodilatador, también actúa como factor antiaterosclerótico. Sin embargo, todavía no se conoce claramente el mecanismo exacto mediante el que esta molécula desempeña los papeles antiaterogénicos y vasculoprotectores. El proceso clave podría ser su función antiinflamatoria. Los estudios in vitro respaldan principalmente esta hipótesis19. También se ha descrito que debilita la expresión de mediadores proinflamatorios, como la molécula 1 de adhesión de la célula vascular (VCAM-1) y la proteína 1 quimiotáctica monocítica20,21 (MCP-1), suprime la adhesión de los monocitos al endotelio, inhibe la agregación plaquetaria22, e induce la apoptosis de macrófagos y células musculares lisas23. Todas estas investigaciones son una prueba de los papeles beneficiosos innegables del ON en las vías que causan aterogénesis y un remodelado vascular anormal. En numerosos estudios también se ha demostrado que su administración exógena puede reducir la aterosclerosis y reestenosis, como en el estudio de Harnek et al1, que demostraron que si, en el lugar de la lesión debida a una intervención percutánea, se agrega el donante de ON SIN-1, la reestenosis se reduce significativamente, y en el estudio de Kapadia et al24, que llegaron a la conclusión de que la aplicación perivascular de un gel de nanofibras autoensambladas de liberación de ON es un tratamiento eficaz y simple para prevenir la hiperplasia neointimal tras una lesión arterial.
En el presente estudio, usamos el donante de ON exógeno DETA/ON en concentraciones de 500 μg/ml en 2cm3 de gel de elastómero. No obstante, no pudimos determinar la tasa exacta de liberación por parte del gel, aunque pudo estimarse por las características de los datos DETA/ON. La semivida de éste es de 20h a 37°C25. Libera 2 moles de ON por mol de la sustancia original, más del 99% de los cuales se liberan durante las seis primeras semividas. Puesto que el peso molecular de DETA/ON es de 163,2 y utilizamos 1.000 μg, durante los 5 primeros días, se liberó un total de unos 6μmol de ON alrededor de la aorta. Kapadia et al24 demostraron que la administración extraluminal de donantes de ON da lugar a un aumento de sus niveles intraluminales, y en nuestro estudio piloto in vitro se confirmó la difusión transmural del ON después de la administración extraluminal del gel de elastómero portador del donante de ON.
Los resultados del presente estudio demuestran que si el donante de ON DETA/ON se distribuye perivascularmente en el lugar de la lesión vascular inducida quirúrgicamente, el área de las lesiones ateroscleróticas provocadas por la dieta rica en colesterol no mostrará un cambio significativo. No obstante, el área superficial media de aterosclerosis en el grupo experimental fue casi dos veces mayor que la del grupo de control, en el que hubo cuatro casos sin área aterosclerótica.
La difusión es el método principal de propagación del ON en el sistema vascular, y se basa en el gradiente de la concentración de ON entre un generador (la superficie del endotelio) y un objetivo (la pared vascular). En el endotelio disfuncional el bajo gradiente de ON disminuye su tasa de difusión, lo que se traduce en un tiempo más prolongado para alcanzar su objetivo, al igual que una disminución de su concentración final en él debido a su breve semivida26. Por lo tanto, en la hipertensión arterial y en la hipercolesterolemia hay un grave deterioro de la eficiencia de la señalización de ON27,28. En el presente estudio, tanto la hipercolesterolemia como la lesión endotelial inducida por el balón podrían dar lugar a un deterioro de su difusión. No obstante, Kapadia et al24 confirmaron que la administración extraluminal de donantes de ON produce un aumento intraluminal, y en nuestro estudio piloto in vitro se demostró su difusión transmural en una situación fisiológica, sin hipercolesterolemia ni lesión intimal.
También deberíamos considerar que, en la aterosclerosis, el ON y los aniones superóxido generados por las células inflamatorias reaccionan formando radicales peroxinitrito citodestructivo, lo que potencialmente causa una lesión del endotelio y los miocitos, que podría ser un factor en la apoptosis de las células que daría lugar a la rotura de la placa29. El ON puede atenuar la hiperplasia de la célula endotelial, que se obtiene a través de la inducción de apoptosis en los macrófagos y las células endoteliales27,30. Por una parte, dicha apoptosis puede reducir la reestenosis, pero, por otra, puede destruir un elevado número de células endoteliales y dar lugar a una disminución futura de la producción de ON derivado del endotelio.
Puesto que la semivida biológica de esta molécula es inferior a un segundo in vivo, para unos mejores resultados, es necesaria una aplicación local31. Por lo tanto, seleccionamos un gel de elastómero como agente reservorio de la liberación de DETA/ON. Un nuevo resultado del presente estudio fue la prueba fehaciente de la utilización sin riesgos del elastómero de calidad médica Silastic para la aplicación perivascular de fármacos. De acuerdo con el anatomopatólogo y el cirujano, no se observó una reacción adversa en el tejido donde se administró el gel al mismo tiempo que casi garantizó la distribución local y lenta de DETA/ON. Esto abre un nuevo horizonte para la distribución de fármacos en injertos y conductos vasculares humanos.
También es preciso añadir que los conejos son modelos animales excelentes de aterosclerosis, inducida por la dieta, en un período breve de 10 semanas. No se dispone de un modelo animal perfecto de aterosclerosis, ya que los requisitos que debe reunir son múltiples, incluyendo su similitud con la anatomía y fisiología humanas; la reproducibilidad de lesiones con respecto a la patogenia, morfología y distribución; una disponibilidad inmediata; tamaño (tanto para el calibre arterial como para la facilidad de manipulación); y el coste. Ningún modelo animal satisface todas estas necesidades32. Se ha demostrado que los conejos son una de las especies más investigadas que desarrollan aterosclerosis tanto espontánea como inducida por la dieta. Las lesiones espontáneas en el conejo New Zealand White se detectan típicamente en el cayado aórtico y aorta ascendente32. En el presente estudio, una dieta rica en colesterol provocó un aumento considerable de su concentración y de la de fosfolípidos en el suero de los animales y la consiguiente aterosclerosis aórtica. Este hallazgo fue contrario a la conclusión alcanzada por Ahmad-Raus et al33, que encontraron que, a pesar de la dieta rica en colesterol con la que alimentaron a los animales, no se produjo el aumento correspondiente de la concentración sérica de colesterol y fosfolípidos.
El presente estudio adolece de algunas limitaciones, incluida la incapacidad para determinar la concentración intraluminal de ON en todos los casos antes y después de la administración del fármaco. Podría ser beneficioso usar diversas concentraciones diferentes de ON en varios grupos y compararlas porque el ajuste de la dosis es un punto clave de su administración. También podría ser útil determinar la presión arterial sistémica de los individuos antes y después de la administración del fármaco.
Sus resultados sugieren que, aunque el ON reduce la aterosclerosis y mejora la curación vascular, se requieren estudios y análisis adicionales antes de que pueda utilizarse clínicamente sin riesgos. El presente estudio introdujo el Silastic MDX4 como un elastómero biocompatible que puede utilizarse sin riesgo en sistemas de distribución controlada de fármacos en el sistema vascular. Se sugiere firmemente la necesidad de futuros estudios que consideren las posibles reacciones adversas a este elastómero.
La presente investigación fue financiada por el Clinical Research Department, Tehran Heart Centre, afiliado a la Tehran University of Medical Sciences, y se efectuó en dicho centro. Agradecemos las contribuciones de todo el personal del servicio y de investigación clínica en la sala de cirugía. También damos las gracias al Prof. Ali Borhan de la Pennsylvania State University por sus comentarios de utilidad y a los Dres. P. Yazdanifard, N. Moshtaghi, y B. Aalinejad por su ayuda en la búsqueda de estudios publicados. Deseamos expresar nuestro agradecimiento a Dow Corning Company por la provisión del elastómero Silastic.