Valorar los resultados de control local y complicaciones en el tratamiento del schwannoma vestibular tratado con radiaciones.
MétodosEstudio retrospectivo de 194 pacientes diagnosticados de schwannoma vestibular, tratados de manera consecutiva bien con observación o bien con radiaciones (bien radiocirugía o radioterapia esterotáctica fraccionada) de 1997 a 2012. Analizamos el control local de los tumores, así como de las complicaciones secundarias al tratamiento con radiocirugía.
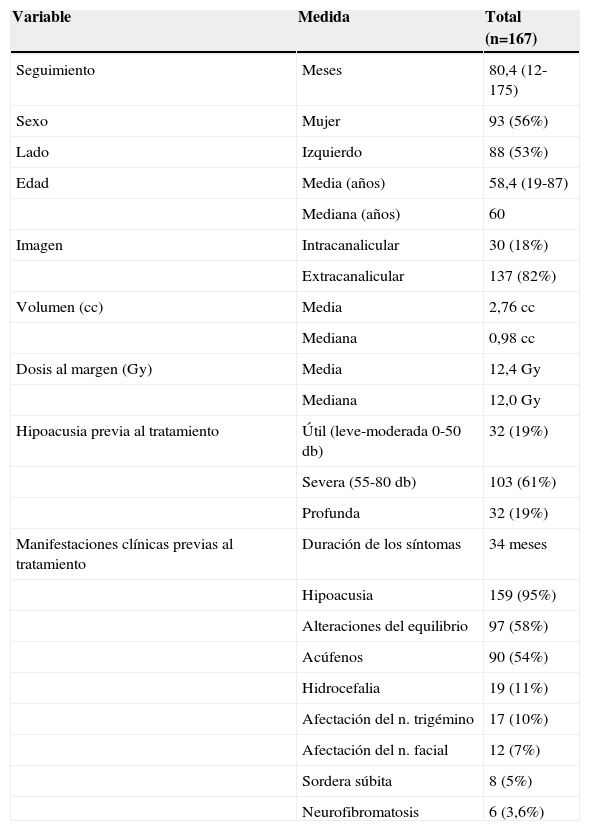
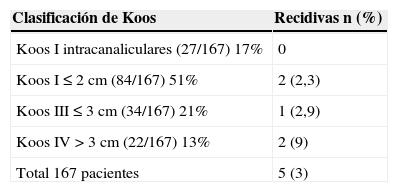
ResultadosEl 68% (132 tumores) son inferiores a 2 cm es decir grado I-II de la clasificación de Koos, 22 pacientes (13%) con tumores grandes grado IV, el resto (40 pacientes) son grado III. Los tumores relacionados con la neurofibromatosis (NF2) representan el 3,6% (6 tumores en 4 pacientes). El control tumoral para los pacientes tratados con radiaciones es del 97% a 5 años, con un seguimiento mediano de 80,4 meses. Para los tumores grandes el control local es del 91% a 5 años. La supervivencia libre de complicaciones crónicas es del 89% a 5 años. De los 50 tumores a los que se realizó seguimiento, 28 (58%) continúan en seguimiento al no haberse objetivado crecimiento alguno.
ConclusionesLa radiación y el seguimiento con RM, dentro de un enfoque multidisciplinar, es una alternativa a la cirugía en el tratamiento del schwannoma vestibular, con un bajo nivel de complicaciones.
To evaluate the results of local control and complications in the treatment of vestibular schwannoma treated with radiation.
MethodsA retrospective study of 194 patients diagnosed with vestibular schwannoma, treated consecutively with radiation (either stereotactic radiosurgery or fractionated radiotherapy) from 1997 to 2012. We analyze the local control of tumors, as well as secondary complications to treatment with radiation.
ResultsA total of 132 (68%) tumors 68% are grade I-II tumors of the Koos classification, 40 (19%) are grade III, and 22 (13%) are grade IV. The tumors associated with neurofibromatosis (NF2), are 3.6% (6 tumors in 4 patients). The tumor control for the overall serie is 97% at 5 years, with a median follow-up of 80.4 months. For large tumors the local control is 91% at 5 years. Free survival of chronic complications is 89% at 5 years. Aditionally, 50 tumors were subjected to regular follow-up with MRI without treatment, and 28 (58%) did not experienced tumor growth.
ConclusionsRadiation and follow up with MRI, are an alternative to surgery in the treatment of vestibular schwannoma, with a low level of complications inside of multidisciplinary approach.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora