Las asincronías, que se caracterizan por la falta de sincronización entre los momentos en que el paciente realiza inspiraciones neurales y los programados en el ventilador, son comunes en aquellos pacientes que requieren asistencia ventilatoria. A pesar de que la monitorización esofágica se considera la forma más precisa para la detección, el diagnóstico, la intervención, resulta poco práctica en el contexto de la evaluación clínica. La monitorización a través de diversas curvas y bucles, sin embargo, facilita la identificación de asincronías y permite la evaluación de la respuesta a las intervenciones establecidas. Esta revisión se centra en diferenciar los estímulos al centro respiratorio y las respuestas mecánicas, lo cual facilita el diagnóstico y las intervenciones necesarias para su control.
Asynchronies, characterized by the lack of synchronization between the moments when the patient performs neural inspirations and those programmed in the ventilator, are common in patients requiring ventilatory support. Although esophageal monitoring is considered the most accurate method for detection, diagnosis, and intervention, it proves impractical in the clinical evaluation context. Monitoring through various curves and loops, however, facilitates the identification of asynchronies and allows for the assessment of the response to established interventions. This review focuses on differentiating stimuli to the respiratory center and mechanical responses, thereby easing the diagnosis and interventions necessary for their control.
El soporte ventilatorio invasivo tiene como objetivo la optimización del trabajo respiratorio garantizando el intercambio gaseoso mientras se resuelve la alteración en la permeabilidad alveolocapilar en respuesta a una lesión pulmonar, como neumonía grave, trauma o sepsis, entre otras causas que generaron la necesidad de utilizar el soporte ventilatorio1,2. Sin embargo, al instaurar este soporte es de vital importancia buscar una óptima interacción (sincronía) paciente-ventilador disminuyendo o evitando la aparición de las asincronías2,3.
Las asincronías son generalmente secundarias a la ausencia de balance entre el aporte y el consumo de oxígeno y sus manifestaciones clínicas son diversas como la ansiedad, incomodidad, sudoración, alteraciones cognitivas o asociadas a la misma condición o gravedad de la enfermedad1–3. Como consecuencia de las asincronías se puede generar un mayor tiempo con necesidad de soporte ventilatorio, estancias hospitalarias prolongadas, aparición de delirium e impacto en la mortalidad1–3.
La identificación temprana, abordaje y en el enfoque del control de las asincronías es uno de los principales retos que debe enfrentar el grupo de atención de las unidades de cuidado intensivo1,3–5. Las estrategias de sedación, incluyendo el grupo de pacientes que puedan requerir bloqueo neuromuscular, los diferentes modos ventilatorios y las intervenciones en el proceso de rehabilitación física y pulmonar deben ser utilizadas para mejorar la interacción paciente ventilador1,2,5. Por lo cual, este documento plantea una estrategia sencilla y práctica para la aproximación diagnóstica y terapéutica de pacientes con asincronía.
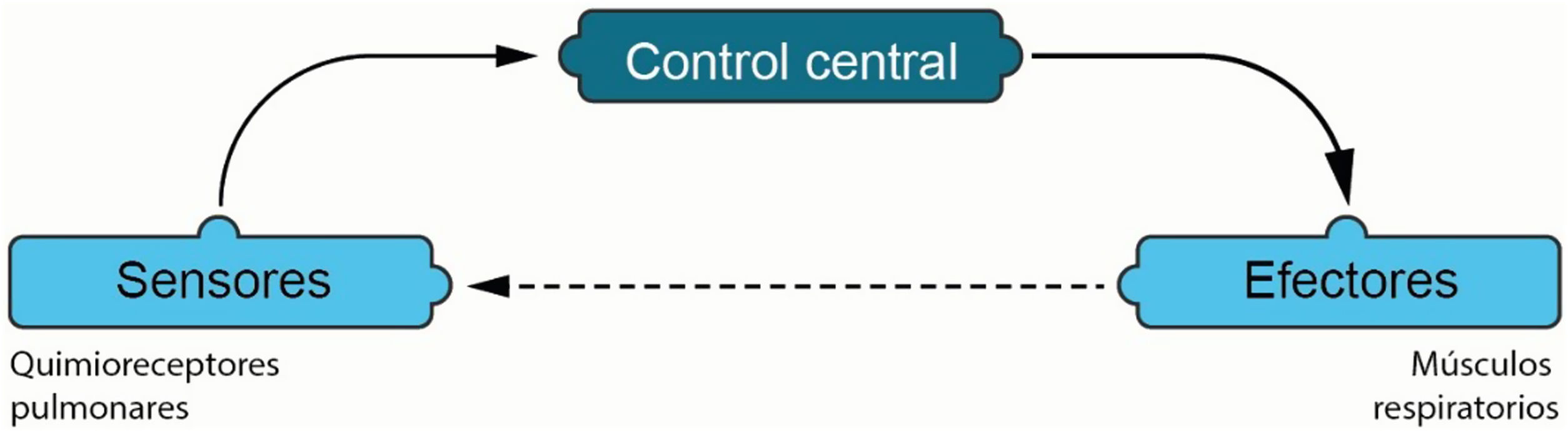
Control de la respiraciónEl centro respiratorio es el comando a nivel central que determina la intensidad del esfuerzo, la frecuencia y el patrón respiratorio (fig. 1). Sin embargo, este puede sufrir alteraciones en enfermedades respiratorias crónicas o en enfermedades críticas agudas. Estas alteraciones se dan específicamente en las vías de retroalimentación a nivel cortical, metabólicas o bioquímicas, siendo estas últimas las de mayor relevancia y frecuencia2,3.
La relevancia de la alteración en el centro respiratorio de los pacientes críticamente enfermos radica en las consecuencias derivadas de un esfuerzo respiratorio excesivo o, por el contrario, insuficiente1,3,4,6. En la literatura médica, estos se reconocen como pacientes con alto o bajo drive respiratorio, términos que utilizaremos en este texto para facilitar la comprensión. Es esencial identificar los factores que provocan cada tipo de drive, con el fin de dirigir las intervenciones hacia objetivos correctivos específicos1,2,5.
Drive respiratorioEl control de la respiración en el sistema nervioso central se segmenta en 2 áreas fundamentales: el tronco encefálico, responsable del control involuntario, y la corteza cerebral, que garantiza el control voluntario1,4. En particular, las estructuras encargadas del control automático residen en la médula y el puente. Un grupo relevante en este proceso es el grupo respiratorio dorsal, situado en el núcleo del tracto solitario, cuya función primordial implica el procesamiento de información proveniente de receptores pulmonares y de la pared torácica. Además, retroalimenta al diafragma, activa el grupo respiratorio ventrolateral (GRV), determina el ritmo respiratorio y modula los cambios en el diámetro de las vías respiratorias aéreas1,4,5.
El GRV, localizado en el núcleo ambiguo y núcleo retroambiguo, emite señales a través del nervio frénico y eferencias hacia los músculos intercostales. En el puente, se encuentra el grupo respiratorio pontino (GRP), que controla la transición entre inspiración y espiración3,4. Un daño en esta área resulta en incrementos del tiempo inspiratorio y aumento del volumen corriente2,3. Por último, la corteza desempeña un papel temporal crucial en el control del mecanismo respiratorio durante eventos como la tos, hablar, apneas conscientes y las variaciones del ciclo respiratorio asociadas al dolor.
El drive respiratorio funciona mediante la recepción constante de señales, aunque los efectos varían según la fase del ciclo en que se reciban1,3,4. Además, la emisión de señales del centro respiratorio controla tres fases del ciclo respiratorio (inspiración, postinspiración y espiración) de la siguiente manera3–5:
- -
Se genera una señal eferente a nivel espinal C3-C5 con estímulo del nervio frénico, lo que induce la contracción diafragmática y cambios en el volumen pulmonar derivados del flujo inspiratorio generado2,3.
- -
Inicia la fase post inspiratoria, en la que no se observa actividad en el centro respiratorio en individuos sanos1,4.
Estas 2 fases determinan el tiempo inspiratorio y la frecuencia respiratoria. La intensidad de la eferencia del estímulo se denomina «drive o esfuerzo respiratorio», y es en esta base que se construye el concepto de alto o bajo drive respiratorio, reflejando un esfuerzo inspiratorio elevado o reducido1,4,5. Es crucial tener en cuenta que la diferencia entre la fase inspiratoria y postinspiratoria, junto con la intensidad de la eferencia, puede dar lugar a variaciones en el esfuerzo respiratorio sin afectar necesariamente la frecuencia respiratoria, y viceversa2,3.
Determinantes del drive respiratorioLas principales señales aferentes que afectan el drive respiratorio son1–3:
- -
La tasa metabólica.
- -
La corteza cerebral.
- -
La retroalimentación química.
La corteza desempeña un papel crucial en el alertamiento, siendo ejemplos clásicos de estas funciones los momentos en que individuos sanos realizan una apnea voluntaria o cuando sujetos críticamente enfermos experimentan estímulos como el dolor o la ansiedad, generando así un estímulo aferente que provoca un cambio en el patrón respiratorio1,5. Es importante señalar que este escenario se asocia con desenlaces clínicos menos favorables1–3.
Por otro lado, la tasa metabólica, estrechamente vinculada a la producción y eliminación de CO2, desempeña un papel fundamental en la estimulación del centro respiratorio5–7. En este contexto, es esencial reconocer que la retroalimentación química, específicamente los cambios en el estado ácido-base y, en particular, los niveles de CO2, emerge como el principal determinante del centro respiratorio en pacientes críticamente enfermos1–3.
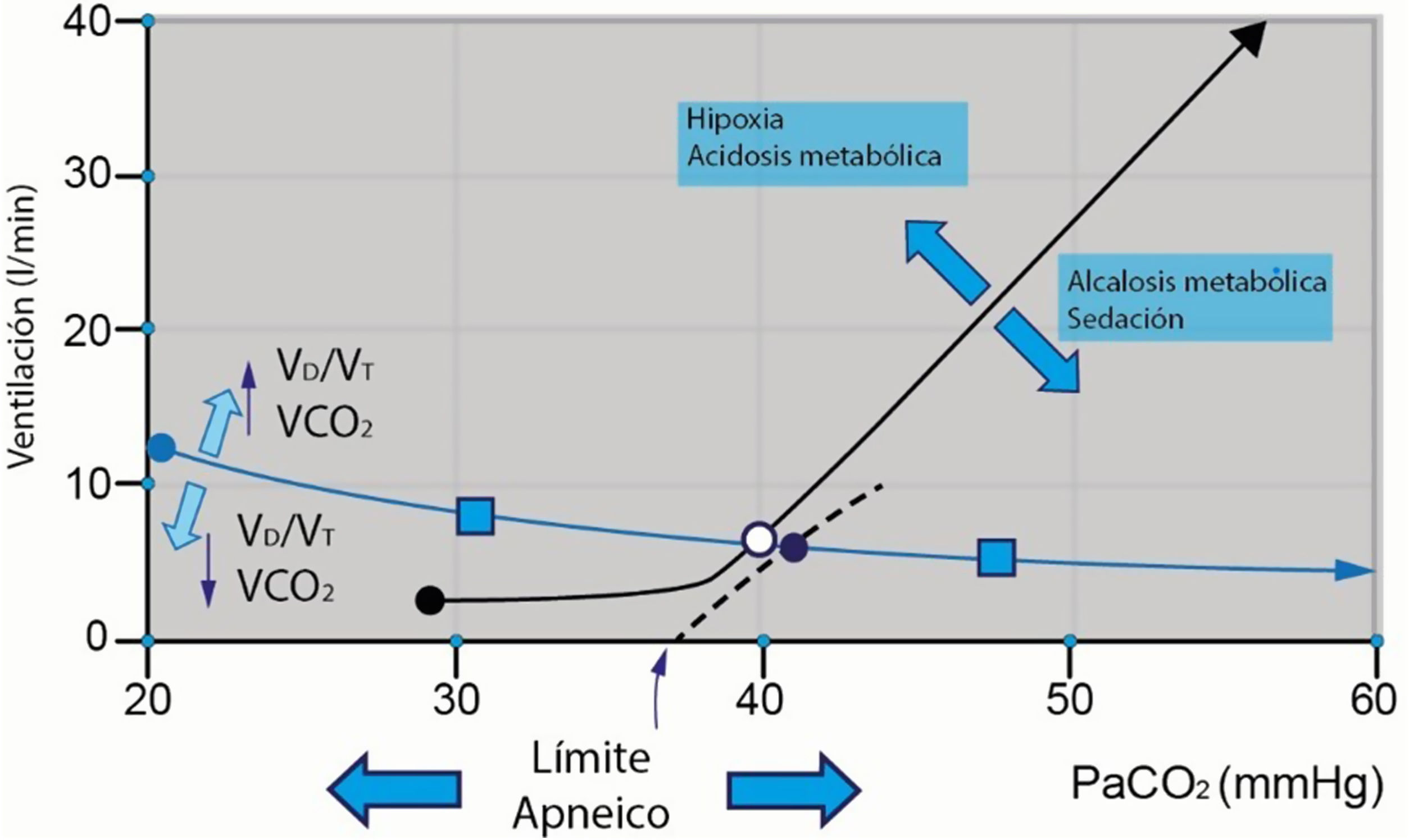
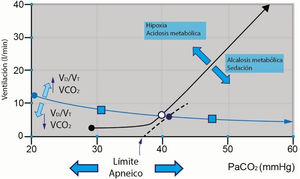
Retroalimentación químicaLos quimiorreceptores a nivel central y periférico registran cambios en la presión arterial de CO2 (PaCO2) y el pH. La PaCO2 se mantiene en un estado de equilibrio determinado por la intersección entre la hipérbola metabólica (que describe la PaCO2 en función del volumen minuto [VE], basada en la ecuación del gas alveolar) y la curva de respuesta a la ventilación (que describe el VE en función de la PaCO2)1,3,4. En situaciones de hipercapnia, la respuesta esperada es un aumento lineal en la ventilación. Sin embargo, en personas sanas, se observa una alta variabilidad en el VE por unidad de incremento de la PaCO2 (2-3 y 0,6-8l/min/mmHg)1,3. Las variaciones de PaO2, y en especial su disminución, producen una retroalimentación química, los principales quimiorreceptores en respuesta a la hipoxemia están localizados en cuerpos carotídeos (fig. 2). Cuando se presenta un estado de hipoxemia la respuesta de los centros de control respiratorio incrementa la frecuencia respiratoria y el VE.
Las variaciones de PaO2 y retroalimentación química en los cuerpos carotídeos. VCO2: producción de dióxido de carbono; VD/VT: fracción de espacio muerto.
Fuente: adaptado de Vaporidi et al.3.
En casos de hipocapnia, la respuesta depende del grado de alerta o sedación del paciente. En individuos alerta y con hipocapnia, la pendiente se vuelve casi horizontal, dando lugar a una ventilación mínima, fenómeno conocido como «impulso al respirar en vigilia» (influenciado por PaO2 y pH)1,5. Si el paciente está bajo medicamentos sedantes, la pendiente permanece lineal, resultando en una hipocapnia progresiva que puede llevar a la apnea. Este límite se denomina «límite de apnea» y varía entre individuos, pudiendo ser modulado por el estado ácido-base y la PaO2. Es crucial destacar que la PaO2 tiene un efecto modulador débil sobre el drive respiratorio en comparación con los niveles de PaCO21,5.
Impacto en el centro respiratorio de pacientes críticamente enfermosEn el contexto de un paciente críticamente enfermo, se observa una disociación entre el centro respiratorio y la ventilación esperada para la condición patológica. Mientras que en una persona sana los estímulos en el centro respiratorio se traducen en cambios en la ventilación minuto mediante la vía neuronal, generando alteraciones en el flujo inspiratorio, estos cambios no se manifiestan de la misma manera en los pacientes críticos1,3.
La interacción entre el centro respiratorio y la ventilación se puede ilustrar gráficamente a través de la relación entre la hipérbola metabólica y la curva cerebro/ventilación. En condiciones normales, estas curvas están completamente alineadas1,2. La curva cerebro/ventilación refleja las variaciones en el flujo en respuesta a cambios en la PaCO21,3.
Variaciones en el esfuerzo respiratorioLos signos clínicos que indican un alto impulso en el sistema nervioso central sugieren que el centro respiratorio demanda un volumen minuto relativamente elevado para los niveles de PaCO21,3,5. Clínicamente, esto se manifiesta como un patrón respiratorio superficial, el uso de músculos accesorios inspiratorios, activación de músculos espiratorios, taquicardia, hipertensión y presencia de diaforesis. Esta alteración se presenta principalmente en condiciones como acidosis metabólica y/o hipoxemia, así como en enfermedades parenquimatosas pulmonares o de la pared torácica que estimulan los receptores a este nivel1,3,4. Por otro lado, un bajo impulso en el sistema nervioso central indica que el centro respiratorio demanda un volumen minuto relativamente bajo para mantener la PaCO2, manifestándose como una baja frecuencia respiratoria y la presencia de apneas1,3. Las posibles consecuencias de un impulso respiratorio bajo incluyen la atrofia diafragmática, la asincronía entre el paciente y el ventilador, así como la alteración del patrón de sueño4.
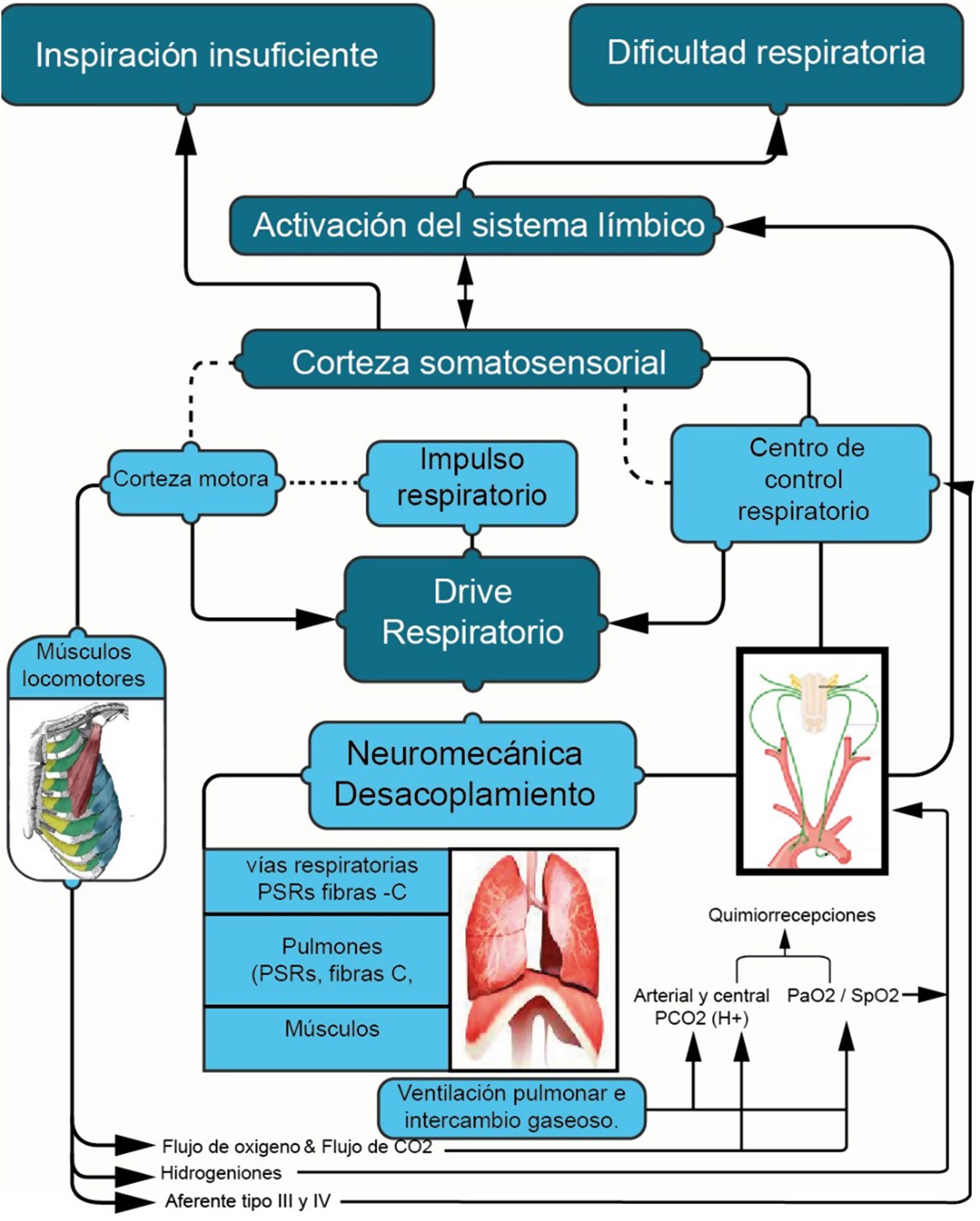
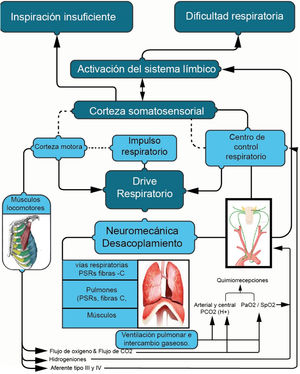
La regulación del impulso respiratorio tiene su origen a nivel central, donde convergen aferencias de señales químicas (quimiorreceptores centrales y periféricos) y fuentes no químicas (fig. 3)1–4. Esta convergencia desencadena la activación de motoneuronas espinales, resultando en la estimulación de los músculos respiratorios con una determinada intensidad (Pmus) y frecuencia1,3,4. A nivel periférico, los músculos respiratorios ajustan la frecuencia e intensidad en función de la resistencia y elasticidad del sistema respiratorio. Estos ajustes determinan el volumen y el tiempo que el sistema pulmonar movilizará en cada ciclo respiratorio3. Finalmente, las propiedades del pulmón influyen en los valores gasométricos, los cuales, a su vez, retroalimentan a través de quimiorreceptores centrales y periféricos para mantener un equilibrio tanto en situaciones de reposo como durante la actividad física y en estados patológicos1,4.
Control del impulso respiratorio a nivel central.
Fuente: adaptado de Neder et al.4.
Cuando se inicia un soporte ventilatorio invasivo, la entrega de la respiración se compone de 2 elementos3,4. El primero, relacionado con el volumen/tiempo, implica la interacción de diversos factores que conforman la ecuación del movimiento y afectan tanto el volumen total suministrado como el tiempo necesario para lograr dicha entrega4. El segundo componente es el tiempo inspiratorio del ventilador, definido como la duración del flujo inspiratorio en relación con el tiempo total del ciclo («duty cycle»)3,4.
A partir de estos conceptos, los pacientes bajo soporte ventilatorio invasivo experimentan variaciones no fisiológicas que resultan en los siguientes cambios1,3,4:
- -
Modificación en la relación entre la fuerza, la longitud y la velocidad de los músculos respiratorios.
- -
Alteración en la respuesta a la retroalimentación química.
- -
Cambios en la retroalimentación refleja, con receptores localizados en el tracto respiratorio, pulmones y pared torácica.
- -
Alteraciones en el patrón respiratorio debido a las variaciones en los tiempos inspiratorios.
La magnitud de estos cambios y su manifestación dependen de la gravedad de la enfermedad, el modo ventilatorio, el tipo de sedación y, especialmente, de la configuración del ventilador3,4,6.
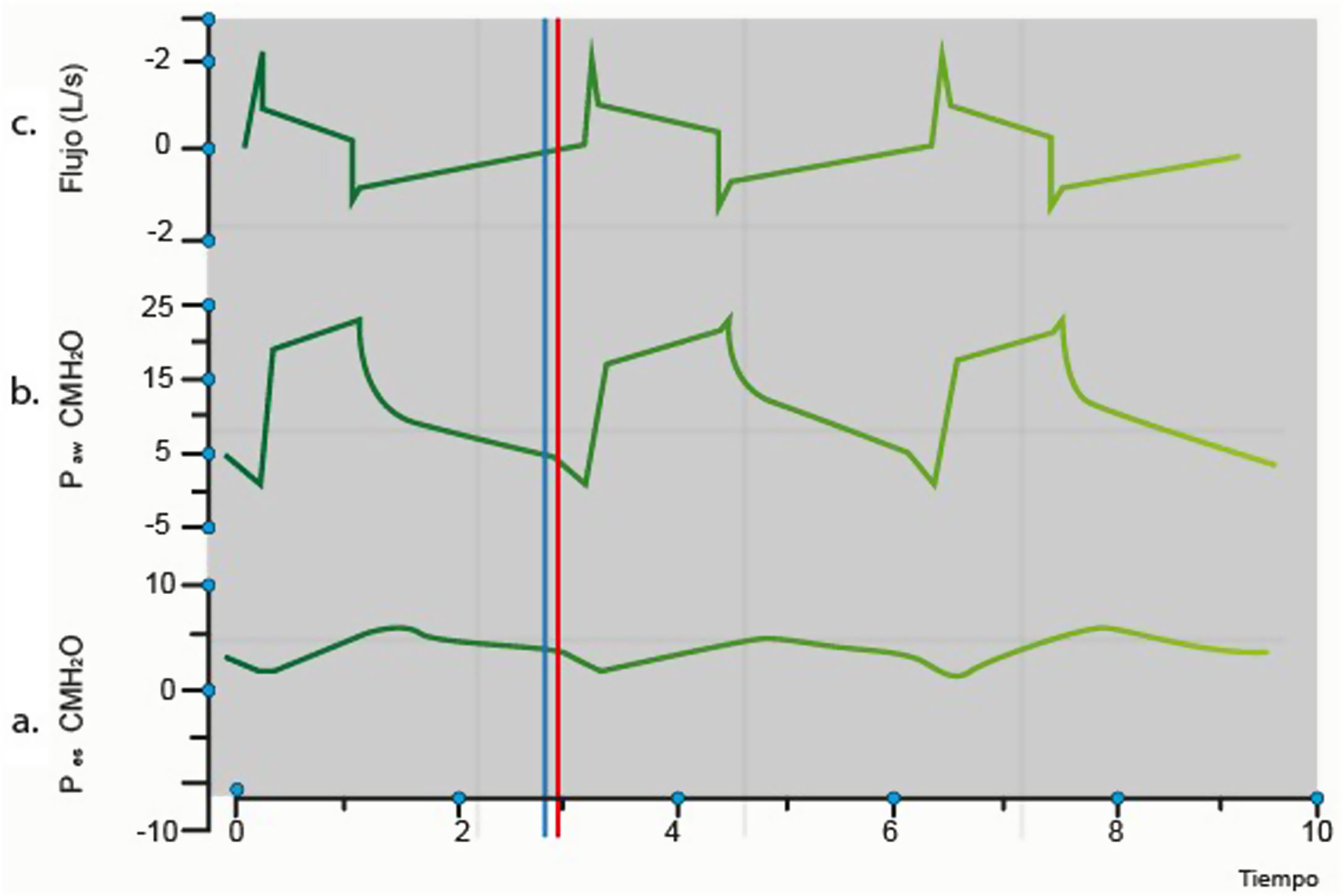
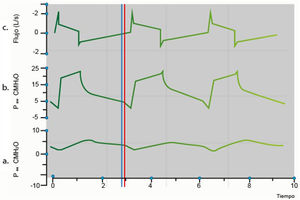
Asincronía paciente-ventiladorLa asincronía paciente-ventilador se define como la presencia de un tiempo inspiratorio diferente entre el paciente y el programado o generado por el ventilador. Estas discrepancias pueden surgir al iniciar, mantener o finalizar la fase inspiratoria. En esencia, este concepto implica un desequilibrio entre la respiración del paciente (fase neural-tiempo inspiratorio) y la respiración mecánica (fase mecánica), originado por la incapacidad del flujo del ventilador mecánico para satisfacer las demandas del paciente (fig. 4)5,7,8.
Gráfica de sincronía paciente ventilador. a: Presión esofágica/tiempo: línea azul representa el inicio de la contracción diafragmática, lo que se traduce en la presencia de una inflexión negativa; b: Presión/tiempo: el inicio de la contracción diafragmática genera un cambio en las presiones de la vía aérea, generando aumento de estas; c: Flujo/tiempo: la contracción diafragmática, con consecuente cambio de presiones en vía aérea, conlleva a apertura de válvula inspiratorio y movilización de volumen, que se representa en esta gráfica como ascenso del flujo durante inspiración. Paw: presión de las vías respiratorias; Pes: presión esofágica; línea azul: inicio de la inspiración neural; línea roja: el inicio de la inspiración del ventilador.
Cuando condiciones o alteraciones patológicas modifican el equilibrio entre el aporte y el consumo de oxígeno, se activan mecanismos compensatorios para garantizar el suministro necesario5,8. Este fenómeno, conocido como ventilación eficiente, se refiere a la capacidad del individuo para ajustar su capacidad inspiratoria, incrementando el volumen corriente en respuesta a estímulos del centro respiratorio, influenciados por cambios bioquímicos previamente descritos4,5. Sin embargo, en ocasiones, la gravedad de la enfermedad o las comorbilidades del paciente impiden alcanzar este equilibrio5,6,8. El esfuerzo muscular resulta insuficiente, llevando al paciente a no mantener condiciones aeróbicas y superar su umbral anaeróbico, manifestándose clínicamente como insuficiencia respiratoria aguda. Al instaurar el soporte ventilatorio, el objetivo es restaurar la ventilación eficiente. No obstante, en ciertos casos clínicos, esta restauración no es factible, y se recurre a la programación del ventilador con parámetros no fisiológicos o se asocia con la administración de medicamentos para inducir niveles profundos de sedación o bloqueo neuromuscular4,8,9.
La incapacidad de recuperar la ventilación eficiente lleva al paciente a activar mecanismos compensatorios en el sistema nervioso central y el sistema respiratorio, desencadenando la asincronía paciente-ventilador5–8. Además, las estrategias ventilatorias para prevenir lesiones inducidas por el ventilador limitan la capacidad de ajustar la programación del ventilador a las condiciones fisiológicas de cada paciente, facilitando también la aparición de la asincronía paciente-ventilador. Esta condición conlleva esfuerzos inspiratorios vigorosos, ansiedad, percepción de disnea, delirium, y afecta la mecánica pulmonar, aumentando el riesgo de lesiones pulmonares por estrés, distensión, lesiones diafragmáticas, entre otro6–8.
El reconocimiento de las asincronías es crucial para determinar su frecuencia, tipo y la necesidad de intervenciones para su control8,9. El índice de asincronía se ha establecido como un marcador de severidad, definiéndose como el número de eventos asincrónicos dividido por la frecuencia respiratoria total multiplicado por 100%, considerándose asincronía severa cuando es >10%8,9. Sin embargo, en los últimos años, se han descrito nuevas y más complejas asincronías, lo que requiere una evaluación más allá del porcentaje o índice de asincronía.
Aunque la monitorización diafragmática puede ser fundamental para mejorar el diagnóstico de las asincronías, su utilidad en la práctica clínica es limitada5,6,8. Similarmente, la monitorización de las presiones de la vía aérea y, especialmente, la presión esofágica podría ser la herramienta con mejores características operativas para identificar la presencia y tipo de asincronía. Sin embargo, la disponibilidad de esta tecnología y las dificultades en su uso limitan su utilidad en la práctica habitual5,6,8,9.
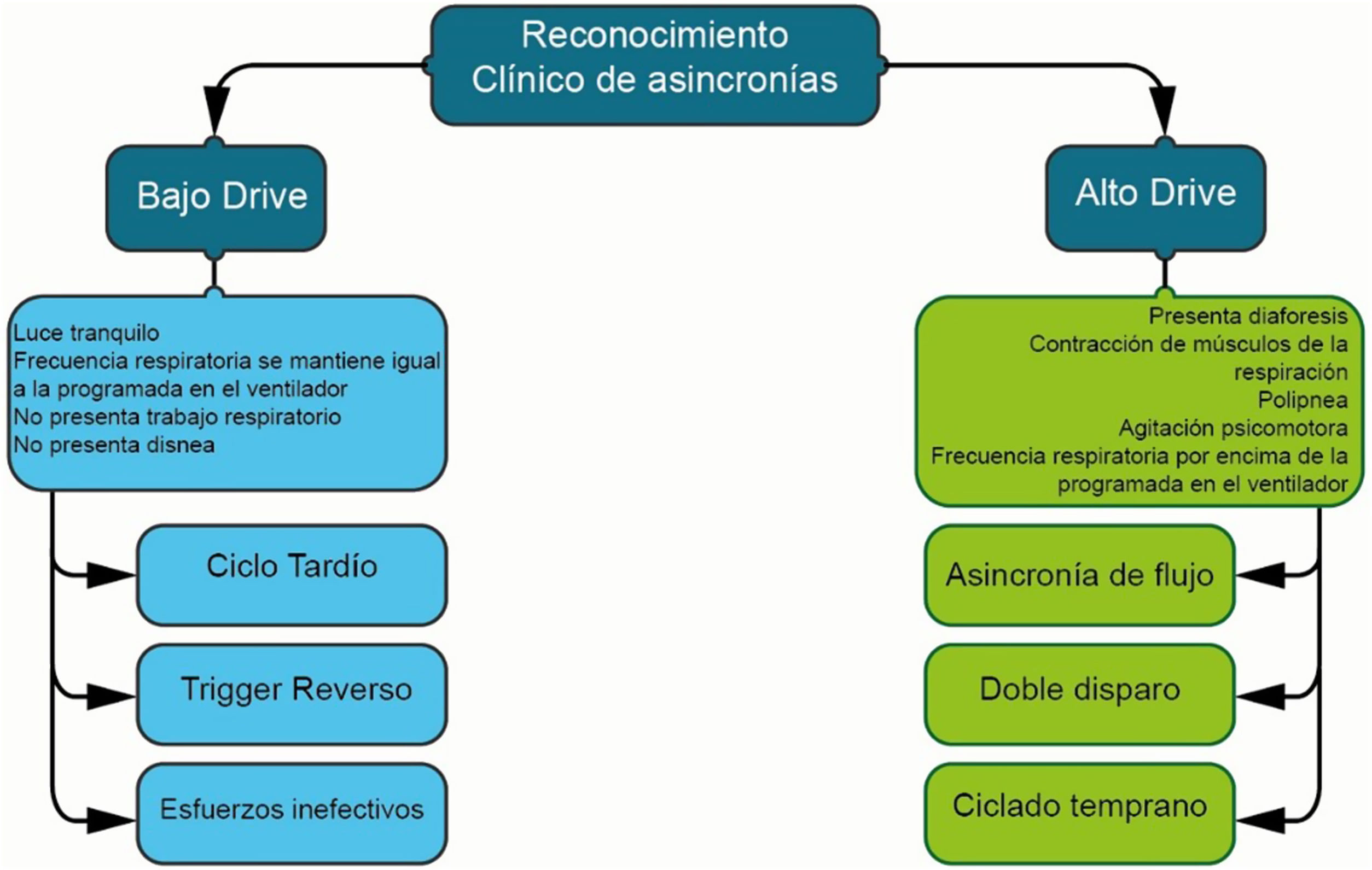
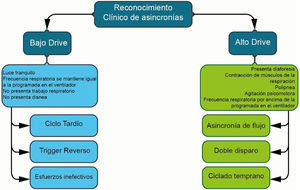
Diversas clasificaciones han sido propuestas para identificar asincronías, muchas de las cuales son dispendiosas, complejas y poco prácticas5,9. La propuesta actual para el abordaje de las asincronías se resume en la figura 59,10:
- 1.
Evaluar la condición clínica del paciente.
- 2.
Identificar el comportamiento del paciente (agitado, sedado).
- 3.
Revisar la intensidad del soporte ventilatorio (alto, bajo).
- 4.
Observar el patrón respiratorio (presencia de signos de trabajo ventilatorio, polipnea, alto esfuerzo inspiratorio, etc.).
- 5.
Establecer el tipo de sedantes, las cantidades requeridas, el tiempo de administración, la necesidad de bloqueantes neuromusculares, etc.
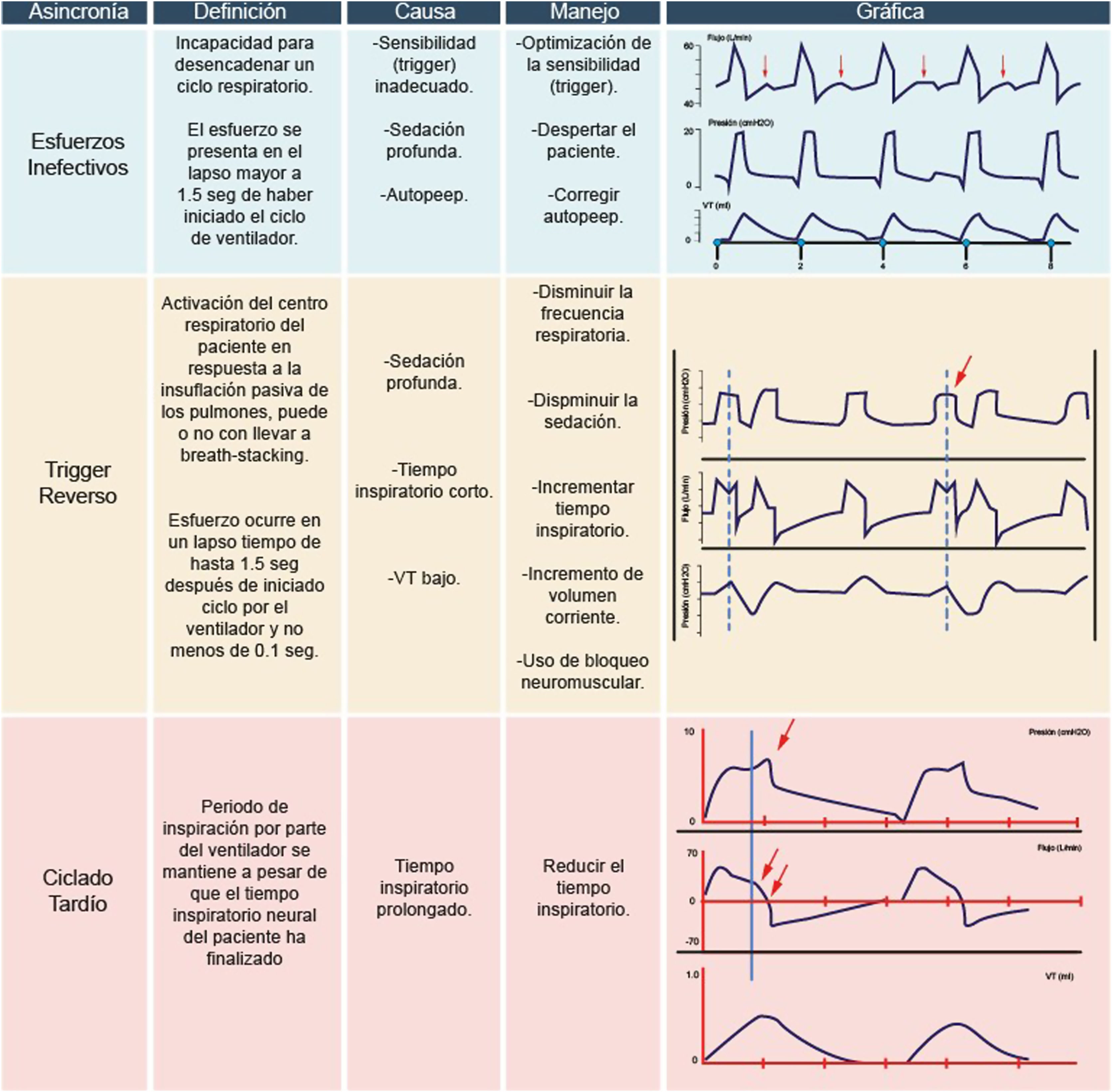
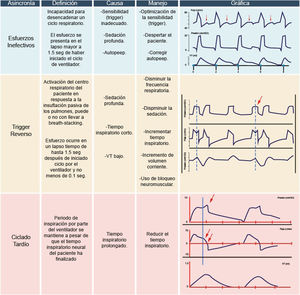
Este fenómeno se manifiesta cuando el esfuerzo inspiratorio del paciente no logra abrir la válvula inspiratoria11. Desde una perspectiva fisiológica, esta asincronía se sustenta en el aumento de las presiones de la vía aérea, sincronizado con la variación de la presión pleural, sin que esto permita la apertura de la válvula inspiratoria. En otras palabras, genera un incremento de la presión transdiafragmática11–13.
La causa de los esfuerzos inefectivos radica en que el esfuerzo del paciente no alcanza el límite necesario para iniciar el disparo («trigger»)11,13. Esto puede deberse a que el esfuerzo del paciente es débil y no genera una variación de presión suficiente o porque el límite de disparo establecido es inadecuado12,13.
Gráficamente, se identifica como una curva presión-tiempo con una deflexión (onda negativa), y simultáneamente en la curva flujo-tiempo se observa un ascenso del flujo sin desencadenar un nuevo ciclo respiratorio11,14. Esta asincronía se puede identificar tanto en la fase I (periodo de inspiración) como en la fase IV (espiración), siendo más frecuente en esta última.
La estrategia para corregir esta asincronía implica ajustar la sensibilidad del disparo («trigger») según la condición del paciente, reducir la sedación para un mejor control del centro respiratorio (si la condición clínica lo permite), evaluar la presencia de auto presión positiva al final de la expiración (PEEP) y corregirla para disminuir el esfuerzo respiratorio necesario para abrir la válvula inspiratoria8,13.
Trigger reversoSe refiere a la contracción generada en los músculos respiratorios como resultado del volumen entregado por el ventilador15,16. En otras palabras, es la activación del centro respiratorio del paciente en respuesta a la insuflación pulmonar pasiva por actividad diafragmática espontánea (conocido como «entrainment»)16. Esta contracción puede ser tan intensa que desencadena un segundo ciclo respiratorio, dando lugar a la reaceleración de flujo («breath-stacking»). Esto se traduce en un aumento del volumen corriente hasta el doble del programado, a veces con una fase espiratoria corta o inexistente9,12,16–18.
La causa fisiológica de esta asincronía se describe en estudios con animales y humanos, evidenciando la persistencia de un patrón respiratorio después de la vagotomía cervical, lo que activa reflejos pulmonares derivados de la insuflación pasiva de los pulmones y el volumen entregado por el ventilador15. La programación de tiempos inspiratorios cortos o bajos volúmenes corrientes, comunes en el manejo del distrés respiratorio agudo (SDRA) o con sedación inadecuada, es la causa más frecuente9,19,20.
Gráficamente, en un modo controlado por volumen, se reconoce por la ausencia de una deflexión al inicio del ciclo ventilatorio y un descenso de la presión de la vía aérea, incluyendo la presión meseta, como consecuencia de la activación de los músculos inspiratorios19,20. Visiblemente, se observan ciclos con morfología de ondas diferente (fig. 5).
La estrategia para corregir esta asincronía depende del estado clínico del paciente. Si lo permite, se reduce la frecuencia respiratoria, se incrementa el volumen corriente y/o se disminuye la sedación. Si el paciente requiere ventilación protectora, se puede aumentar el tiempo inspiratorio, el nivel de sedación o considerar el uso de relajantes neuromusculares19,20.
Ciclado tardíoEsta asincronía se manifiesta cuando el periodo de inspiración del ventilador persiste a pesar de que el tiempo inspiratorio neural del paciente ha concluido1,17. Fisiológicamente, esto ocurre cuando el tiempo inspiratorio programado excede el tiempo neural del paciente17, activando los músculos espiratorios contra una válvula cerrada17,18.
Gráficamente, se observa un aumento de presión en la curva presión-tiempo, clínicamente palpable como la contracción excesiva de los músculos espiratorios (fig. 6)1. En la curva flujo-tiempo, se observa una concavidad al final de la onda de flujo inspiratorio. La causa más común de esta asincronía es la programación de un tiempo de ciclado prolongado. La estrategia para corregirla implica acortar el tiempo inspiratorio o, en modos espontáneos, incrementar la sensibilidad o rango de umbral espiratorio1,17.
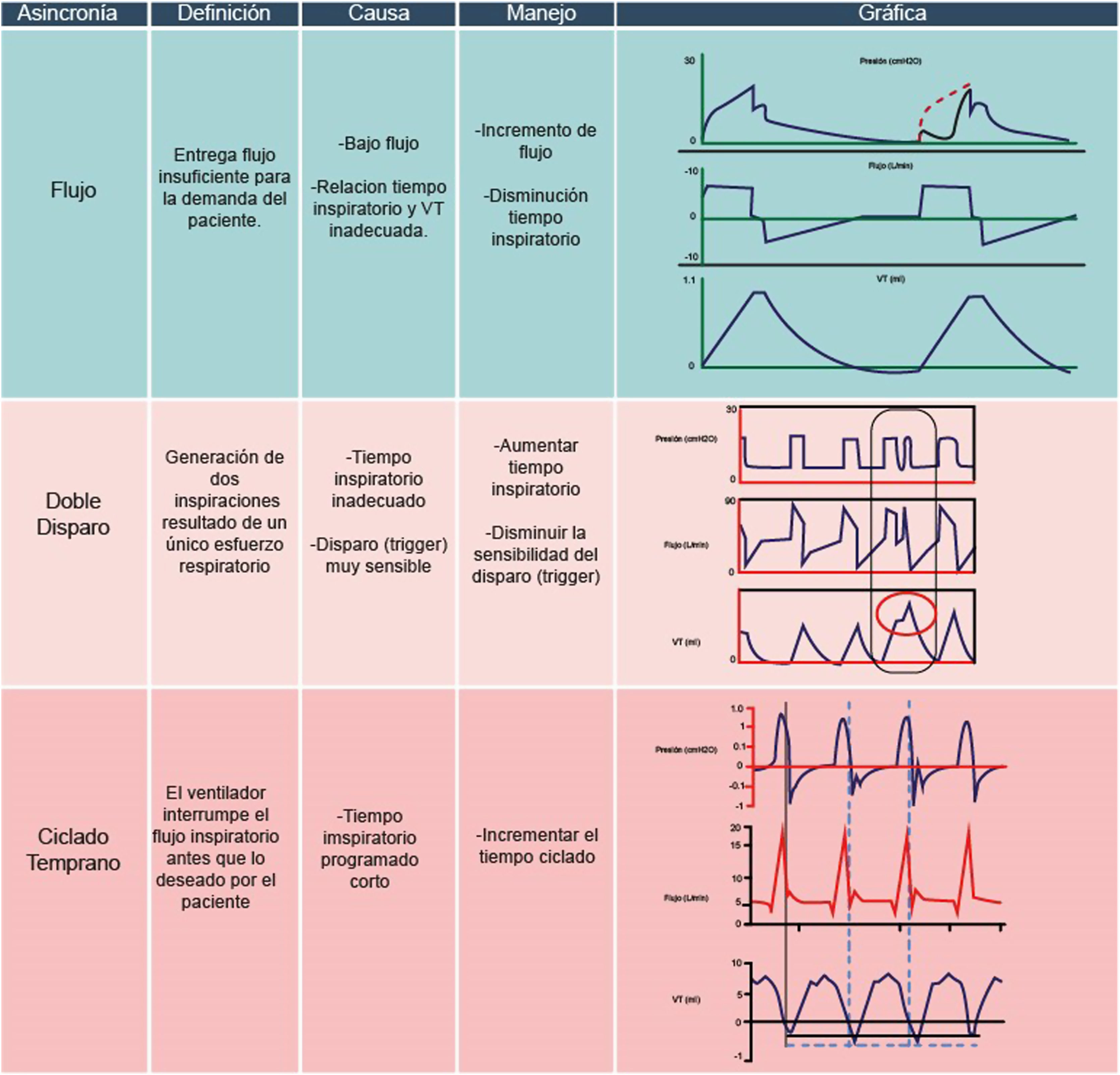
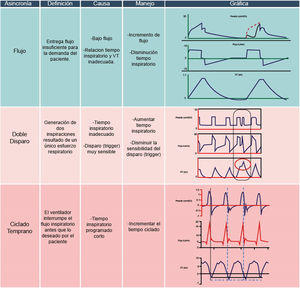
Asincronías de alto driveLa asincronía de flujo se define como una entrega insuficiente de flujo por parte del ventilador, que no satisface la demanda del paciente 13,17. Desde un punto de vista fisiológico, esta asincronía resulta de una programación incorrecta del flujo o de una programación inadecuada del tiempo inspiratorio y el volumen corriente, lo que conduce a una entrega lenta de flujo20–23.
Este tipo de asincronía es común en modos ventilatorios que no permiten la modificación del flujo inspiratorio20,24. Gráficamente, se evidencia en la curva presión/tiempo mediante la presencia de una concavidad en la fase inspiratoria, que representa el esfuerzo vigoroso del paciente ante una entrega insuficiente de flujo por parte del ventilador17. La intensidad del esfuerzo del paciente es tal que al final del esfuerzo inspiratorio se observa un rápido incremento de presión24.
Para corregir esta asincronía en modo controlado por volumen, se puede aumentar la velocidad de entrega del flujo, ajustando el flujo programado a alrededor de 50-60l/min, disminuir el tiempo inspiratorio o incrementar el volumen corriente, especialmente durante la fase de retiro del ventilador13,24. Si el paciente está asistiendo al ventilador, se puede considerar pasar a un modo ventilatorio espontáneo, o si el paciente no está listo para despertar, se debe incrementar el nivel de sedación13,24.
El doble disparo, por otro lado, se refiere a un esfuerzo inspiratorio que persiste más allá del tiempo inspiratorio programado25, generando dos inspiraciones consecutivas, con o sin un tiempo de espiración «corto» entre cada inspiración12,26,27. Esta asincronía suele ocurrir cuando la demanda de flujo por parte del ventilador es insuficiente, resultando en un volumen corriente por debajo del histórico del paciente y provocando un nuevo ciclo respiratorio debido al esfuerzo del paciente12. Se presenta con mayor frecuencia en patologías que requieren estrategias de ventilación protectora18,28,29.
Fisiológicamente, el doble disparo conlleva un aumento de las presiones transpulmonares, incremento del estrés y la distensión alveolar, sobreinflación y un mayor riesgo de lesión inducida por el ventilador (LIV)18. Es importante señalar que tanto el doble disparo como el trigger reverso pueden presentarse en secuencias o «clústers» de asincronías10. Desde una perspectiva gráfica, el doble disparo se observa en la curva flujo-tiempo mediante dos ascensos consecutivos del flujo, separados por un tiempo espiratorio muy corto o incluso sin espiración, donde el flujo espiratorio pico está abolido13,20. En la curva volumen-tiempo, se evidencia un volumen mayor al programado, a veces el doble (reaceleración de flujo o breath-stacking)18.
La estrategia para corregir el doble disparo dependerá de la fase de la enfermedad del paciente. Si la enfermedad pulmonar permite la liberación de volumen corriente, se puede considerar el paso a un modo espontáneo12. En casos agudos, se puede incrementar el tiempo inspiratorio o el nivel de sedación, evaluando la posibilidad de utilizar relajantes neuromusculares si es necesario17.
Ciclado tempranoEste ocurre cuando el tiempo inspiratorio neural del paciente es mayor al tiempo inspiratorio programado en el ventilador1,13. Esto significa que el paciente mantiene el esfuerzo inspiratorio más allá del ciclo inspiratorio programado en el ventilador17, pudiendo desencadenar un doble ciclado si el esfuerzo es lo suficientemente fuerte1,12,17. La causa fisiológica de esta asincronía es la falta de coordinación entre el tiempo neural del paciente y el tiempo inspiratorio programado en el ventilador, lo que lleva a que los músculos inspiratorios se contraigan cuando el ventilador ya está en la fase espiratoria13.
Para identificar el ciclado temprano en las gráficas, se debe observar la presencia de una onda negativa o deflexión previa a la apertura de la válvula inspiratoria en la gráfica presión-tiempo, indicando que el paciente está desencadenando el ciclo del ventilador (fig. 7)17. Además, al final del ciclo inspiratorio, se observará un descenso de presión que no retorna a la línea base o PEEP, debido al esfuerzo inspiratorio del paciente12,20. La estrategia para corregir el ciclado temprano en modo ventilatorio controlado por volumen implica el incremento del volumen corriente o la consideración de prolongar el tiempo inspiratorio11.
Asincronías en modos espontáneosLa programación del ventilador en modos espontáneos aporta considerables beneficios a los pacientes, influyendo positivamente en la duración de la ventilación mecánica y la estancia en la unidad de cuidados intensivos12,20. Sin embargo, este escenario es propenso a la aparición frecuente de asincronías, las cuales se han detallado a lo largo del texto, aunque las estrategias para su gestión pueden variar12,20,21.
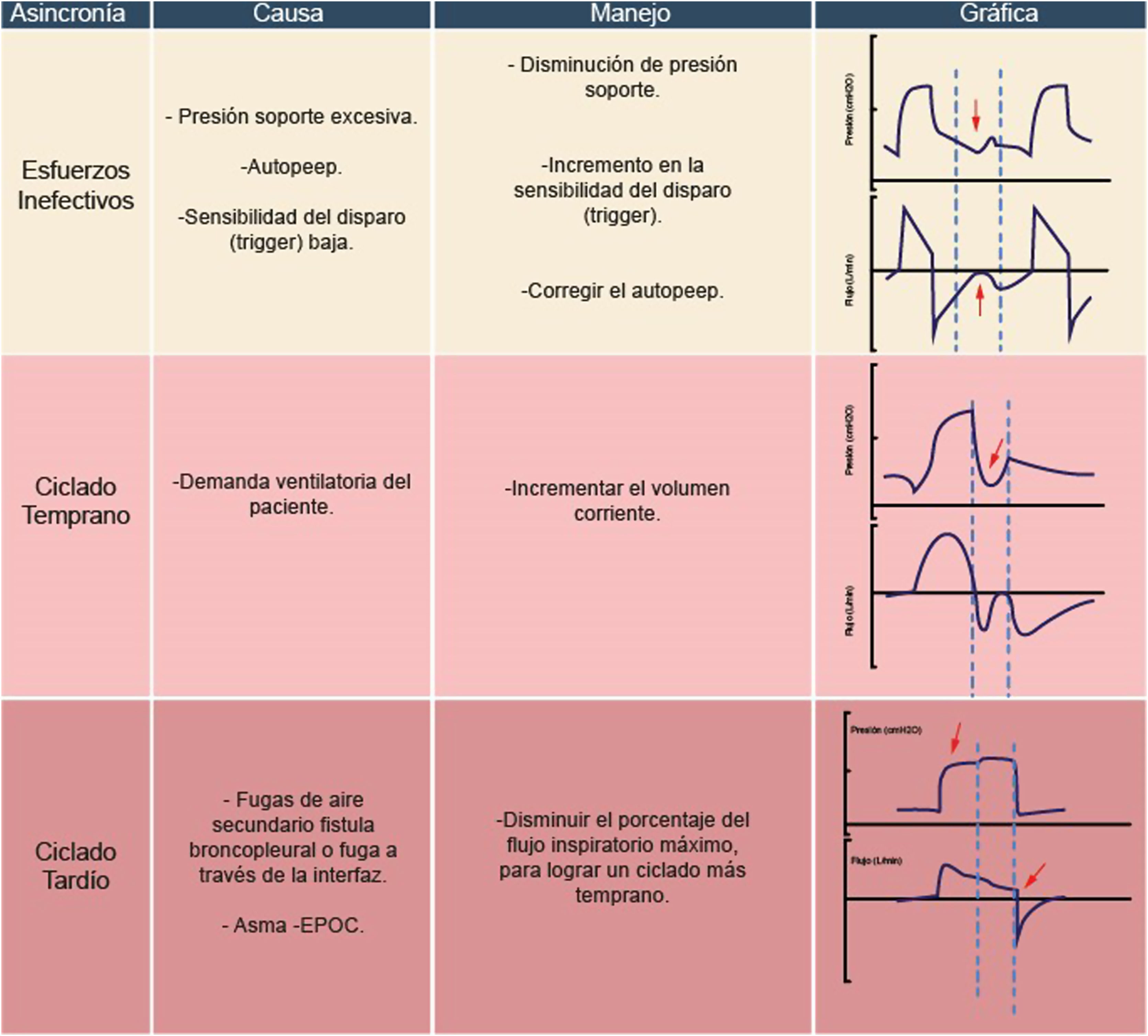
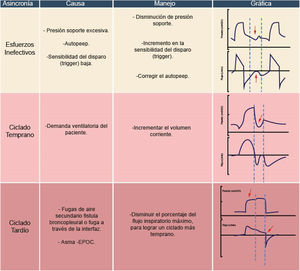
Esfuerzos inefectivosEstos se manifiestan cuando la programación del ventilador es excesiva, con frecuencia asociada a elevados valores de presión soporte que generan un tiempo inspiratorio prolongado, sin permitir la sincronización entre los tiempos neurales del paciente y los tiempos de inspiración/espiración del ventilador30–32. En ocasiones, este mecanismo fisiopatológico se acompaña de un retraso en el disparo (trigger). Condiciones como el auto PEEP son comunes en este tipo de asincronías31,32.
Para corregir este tipo de asincronía, una intervención efectiva es la disminución de la presión soporte y el ajuste del tiempo de presurización (rise time)33. Un escenario crucial involucra a pacientes con neumopatía obstructiva, quienes presentan elevadas resistencias y distensibilidad del sistema respiratorio, lo que resulta en constantes de tiempo espiratorias prolongadas. En este contexto, es esencial contar con una sensibilidad espiratoria adecuada (cycling-off)34. Además, cuando el paciente se encuentra en proceso de retirar el ventilador, suspender la sedación contribuye a que los esfuerzos respiratorios sean más efectivos35.
Ciclado tempranoLa definición y diagnóstico de esta asincronía son similares a los modos asistidos controlados30,36. En el caso de la presión soporte, se requiere ajustar la sensibilidad espiratoria o el rango de umbral espiratorio, es decir, disminuir el porcentaje del ciclado14. Esta asincronía también puede manifestarse en pacientes con PEEP elevado, afectando la distensibilidad del sistema respiratorio (fig. 8). En tales situaciones, se debe optimizar el PEEP necesario para la condición del paciente14,20.
Ciclado tardíoEsta asincronía surge cuando el tiempo inspiratorio del ventilador supera el tiempo inspiratorio neural del paciente1,14. Entre las causas principales de este tipo de asincronía en modos ventilatorios espontáneos destaca la presencia de fugas, siendo más común en el soporte ventilatorio no invasivo1,14. Las fugas de aire a través de la interfaz generan un tiempo inspiratorio prolongado. La estrategia clave para controlar esta asincronía es abordar y controlar la fuga de aire de manera adicional14.
Identificar asincronías en modos controlados, espontáneos y en ventilación mecánica no invasiva (VNI) es crucial para determinar la necesidad de intervenciones oportunas y prevenir lesiones pulmonares inducidas por el ventilador35,37. En este contexto, han surgido modos ventilatorios alternativos diseñados para minimizar la presencia de asincronías mediante el ajuste de parámetros ventilatorios según las demandas del paciente35,37. Esto resulta en un soporte ventilatorio que evita la sobre distensión y la sobre asistencia ventilatoria, previniendo la disfunción diafragmática inducida por el ventilador37.
Modos como la ventilación proporcional asistida (PAV/PAV+), asistencia ventilatoria de ajuste neuronal (NAVA) y ventilación de soporte adaptativo (ASV) son probablemente los modos ventilatorios respaldados por un mayor nivel de evidencia35,37.
Ventilación proporcional asistida (PAV+)La PAV+ evalúa el esfuerzo muscular del paciente mediante mediciones de flujo, presión utilizando la ecuación del movimiento del sistema respiratorio para calcular la presión total necesaria, proporcional al esfuerzo inspiratorio del paciente38. El operador ajusta el porcentaje de descarga, impactando en la disminución del trabajo respiratorio del paciente37.
Las mediciones de elastancia y resistencia se realizan generando oclusión al final de la inspiración, y se monitoriza la presión durante la inspiración basándose en el flujo y volumen corriente39,40. PAV+ ha demostrado disminuir la presencia de asincronías en comparación con el modo espontáneo de presión soporte41, con una proporción de volumen corriente mayor, adaptada a las condiciones fisiológicas pulmonares del paciente42. Estudios indican que los pacientes bajo PAV+ presentan una mayor tasa de liberación del soporte ventilatorio invasivo y menos asincronías de ciclado y espiratorias en comparación con presión soporte43,44.
Ventilación asistida ajustada neuronal (NAVA)La NAVA es un modo de asistencia ventilatoria parcial que se basa en la detección de la actividad eléctrica diafragmática45. Su objetivo es mantener la sincronía entre el tiempo neural inspiratorio y el tiempo inspiratorio del ventilador, utilizando la actividad eléctrica del diafragma del paciente para iniciar y ciclar el ciclo respiratorio 3, reduciendo la presencia de asincronías46,47. En comparación con presión soporte, se ha documentado que la NAVA reduce las asincronías de disparo en hasta un 50%48–50. La presión entregada por el ventilador es proporcional a la señal de electromiografía registrada48.
Ventilación de soporte adaptativo (ASV)El primer modo de ventilación mecánica adaptativa se desarrolló en el año 1994, conocida como «ventilación pulmonar adaptativa»51. Sin embargo, para lograr mejores resultados de la ventilación minuto clínicamente requerida y de la constante de tiempo espiratorio del sistema respiratorio del paciente, se perfecciono el método utilizado hasta convertirse en la ASV51,52. Este método de ventilación es controlado por presión de circuito cerrado, el cual se adapta dinámicamente al paciente en tiempo real, ajustando parámetros como la frecuencia respiratoria, el volumen tidal y el tiempo inspiratorio para logar la ventilación minuto clínicamente requerida52,53. Este tipo de ventilación es útil en pacientes con enfermedades pulmonares crónicas y trastornos neuromusculares, debido que proporciona un soporte respiratorio más efectivo y personalizado a los requerimientos del paciente. La mecánica utilizada en la ASV permite la administración de ciclos de presión que pueden ser tipo ventilación con presión de soporte o controlados.
ConclusiónLa monitorización continua de la mecánica pulmonar permite un diagnóstico oportuno y adecuado de las asincronías. La implementación de nuevos modos ventilatorios es una estrategia impactante que disminuye el porcentaje de asincronías, los días de ventilación mecánica invasiva, y previene el desarrollo de lesiones pulmonares inducidas por el ventilador y la lesión diafragmática.
FinanciaciónEste trabajo fue respaldado por la Fundación Cardio Infantil, Fundación Neumológica Colombiana y Universidad de La Sabana.
AutoríasFVV, SM, ETQ, CM, JP, SP y CD contribuyeron a la concepción y diseño del estudio.
FVV y ETQ supervisaron todo el proceso.
FVV, JP, SP y CD contribuyeron a la recopilación de datos.
FVV y ETQ redactaron partes significativas del manuscrito.
FVV, SM y ETQ revisaron el manuscrito.
Todos los autores leyeron y aprobaron la versión final del manuscrito.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Agradecemos a la Fundación Cardio Infantil, Fundación Neumológica Colombiana y Universidad de La Sabana.