O cloreto de cetilpiridínio tem demonstrado atividade antimicrobiana contra um largo espetro de bactérias da cavidade oral. Este agente pode interagir com a membrana celular bacteriana, resultando na perda de componentes celulares, perturbação do metabolismo e inibição do crescimento celular e consequente morte da célula. Quando usado em concentrações altas pode ocorrer formação de tártaro, bem como sensação de ardência.
O objetivo principal desta revisão é perceber o que foi estudado e publicado nos últimos 10 anos acerca do cloreto de cetilpiridínio para determinar se este composto é eficaz na diminuição de placa bacteriana e no controlo do grau de inflamação gengival. Para isso foi feita uma pesquisa de meta-análises e revisões sistemáticas nas bases primária Pubmed e secundária Cochrane, complementada com os ensaios clínicos randomizados publicados após a última revisão sistemática.
The cetylpyridinium chloride has demonstrated antimicrobial activity against a broad spectrum of oral bacteria. This agent can interact with the bacterial cell membrane, resulting in leakage of cellular components, disruption of cellular metabolism, inhibition of cell growth and cell death. When used at high concentrations can occur calculus formation and burning sensation.
The main objective of this review is to understand what has been studied and published in the last 10 years about cetylpyridinium chloride and if this compound is effective in reducing plaque and controlling the degree of gingival inflammation. A research was done to find meta-analysis and systematic reviews in Pubmed primary basis and Cochrane secondary basis, supplemented with randomized clinical trials published after the last systematic review.
A doença periodontal e a cárie dentária são as patologias com maior prevalência na cavidade oral e estão ambas associadas a microorganismos orais1. Nas últimas décadas muito se tem aprendido acerca da relação entre a placa bacteriana e a destruição periodontal2, visto que a compreensão dos mecanismos dos patogénios responsáveis por esta doença tem sofrido grandes avanços ao longo dos anos3.
A microflora residente no meio oral consiste numa enorme diversidade de microorganismos, incluindo vírus, bactérias, fungos, micoplasma e, em alguns casos, protozoários. As bactérias representam o componente predominante da microflora oral e podem incluir 300 a 500 espécies diferentes4,5. São elas que, juntamente com a saliva, formam a placa bacteriana. Algumas espécies bacterianas têm a capacidade de aderir às mucosas assim como às superfícies dentárias. Na sequência inicial de colonização, as bactérias multiplicam-se e formam microcolónias, desde que as condições ecológicas sejam adequadas. Se deixadas imperturbáveis, estas microcolónias continuam a proliferar e tornam-se confluentes. Isto resulta, eventualmente, no desenvolvimento de um biofilme, onde os microorganismos estão intimamente associados entre si, encaixados numa matriz de exopolímeros de bactérias e saliva6. À medida que aumenta a quantidade de placa, a composição bacteriana dentro do biofilme muda. As condições ambientais vão ditar a composição desta comunidade microbiana7. Nas superfícies proximais, e fissuras, a microbiota é composta predominantemente por bactérias Gram-positivas, anaeróbios facultativos e espécies ácido-tolerantes. No sulco gengival a composição da placa bacteriana muda para uma microflora muito mais complexa, predominantemente bactérias Gram-negativas anaeróbias estritas8.
A deficiente higiene oral e consequente acumulação de placa bacteriana leva ao aparecimento de gengivite, que é a forma mais prevalente de doenças do periodonto. Clinicamente, a gengivite tipifica inflamação dos tecidos moles do dente. O contorno normal, firme e regular da gengiva muda para um volume aumentado em vários graus de edema ou de fibrose, em muitos casos de longa duração ou, em certos casos, modificado por condições sistémicas9.
Quando a gengivite não é tratada pode desenvolver-se periodontite, que é uma inflamação que se estende para as estruturas periodontais mais profundas, produzindo uma perda de tecido de inserção do dente (tecido conjuntivo, ligamento periodontal e osso). A forma mais prevalente de periodontite tem o seu início de expressão na vida adulta, geralmente tendo significado clínico após os 30 anos de idade. A periodontite, indubitavelmente requer uma gengivite precursora, mas estudos em humanos e animais indicam que nem toda a gengivite progride para uma periodontite9.
O controlo do acúmulo de microorganismos sobre os dentes através de uma correta higiene oral é um dos mais difundidos métodos preventivos da cárie dentária e da doença periodontal, sendo que a motivação por parte do profissional e a consciencialização do paciente dos meios disponíveis para a prática de uma higiene oral cuidada, são de fundamental importância para a saúde dos tecidos orais10.
É objetivo da prevenção da doença periodontal manter o equilíbrio da microflora residente do hospedeiro. As estratégias de prevenção passam por reduzir a massa total de biofilme bacteriano e os níveis de grupos específicos de agentes patogénicos, para o fazer, as abordagens eficazes incluem remoção mecânica da placa bacteriana e uso de antimicrobianos11.
São vários os agentes antiplaca, tais como:A clorohexidina (CHX) está entre os compostos mais estudados e as suas propriedades antiplaca são bem conhecidas. As moléculas de CHX são adsorvidas à superfície do esmalte, inibindo a adesão bacteriana12. A CHX é também conhecida por ser bacteriostática contra a maioria das bactérias orais13. Num modelo de biofilme supragengival, mostrou-se que a CHX inibe o crescimento de bactérias e formação de biofilme14. Quando usada em altas concentrações, a CHX é bactericida e age como um detergente danificando a membrana celular bacteriana15.
O cloridrato de delmopinol é um agente surfatante com baixo poder antimicrobiano. In vitro o delmopinol tem o potencial de impedir a formação de placa e dissolver a placa já existente16. A curto e a longo prazo, este composto demonstrou ter eficácia moderada anti-placa e antigengivite17.
Os efeitos do flúor sobre as bactérias orais são bem conhecidos18. Há evidências de que o flúor pode interferir com a actividade enzimática e reduzir a produção de ácido pelas bactérias orais19, inibindo assim o enriquecimento de espécies cariogénicas dentro da placa bacteriana20. Alguns estudos sugerem que o flúor também tem propriedades antiplaca, embora os mecanismos não sejam bem compreendidos. É sabido que o fluoreto de amina21 e o fluoreto estanhoso22 possuem atividade bactericida contra bactérias orais. Além disso, o fluoreto de amina em forma de gel inibe o crescimento de populações bacterianas mistas encontradas na placa subgengival23.
In vitro, o triclosan reduz a carga microbiana total14. Vários ensaios clínicos mostraram que pastas dentífricas contendo triclosan e citrato de zinco diminuem significativamente os índices gengival e de placa24,25. Foi também demonstrado que o triclosan tem o poder de reduzir o número de bactérias anaeróbias Aggregatibacter actinomycetemcomitans26. Estudos mais recentes, in vivo, têm confirmado o efeito inibitório do triclosan no desenvolvimento de placa bacteriana27,28. Foram encontradas propriedades antibacterianas e de redução de placa na combinação de fluoreto de amina e triclosan29.
A hexetidina pertence ao grupo dos derivados da pirimidina. É um antisséptico de amplo espetro, activo in vitro e in vivo contra bactérias gram-positivas e gram-negativas, bem como leveduras (Candida albicans)30. A hexetidina é usada para o tratamento de infeções orais, tais como gengivite, estomatite, estomatite aftosa, úlceras e casos de halitose30,31.
As propriedades antibacterianas e de uso da povidona iodada estão bem estabelecidas. O elemento natural, iodo, já é usado na medicina hà mais de 150 anos, na anti-sepsia das mucosas e na terapia de infeções de pele, nomeadamente após queimaduras32. No entanto, apenas após a introdução da iodopovidona na década de 1960 foi possível utilizar este microbicida contra uma grande variedade de bactérias, fungos e infeções virais. In vitro, um contacto de curta duração da povidona iodada com bactérias periodontopatogénicas é suficiente para matá-las33. Não há relatos de microorganismos resistentes a este composto. Apesar das suas impressionantes propriedades antimicrobianas, a povidona iodada não é amplamente utilizada na prevenção e tratamento das infeções orais devido ao seu potencial de provocar hipertiroidismo32.
O cloreto de cetilpiridínio (CPC) é o composto de amónio quaternário mais estudado e já é utilizado nos Estados Unidos da América como colutório hà mais de 70 anos (34). O efeito inibitório de placa bacteriana do CPC foi descrito primeiramente por Schroeder et al. em 196235. Os agentes pertencentes a esta categoria são aniónicos na natureza. Ao serem carregados positivamente tornando-se catiónicos, ligam-se com facilidade aos tecidos orais34, no entanto a sua substantividade é inferior à da clorohexidina30. O CPC demonstrou actividade antimicrobiana contra um amplo espetro de bactérias orais36. Este agente pode interagir com a membrana celular bacteriana, resultando na perda de componentes celulares, perturbação do metabolismo e inibição do crescimento celular e consequente morte celular37. A sua incorporação em pastas dentífricas é difícil devido à sua má compatibilidade com os outros agentes do dentífrico e o seu uso prolongado resulta no aparecimento de manchas nos dentes. Quando usado em concentrações mais altas pode ocorrer também pigmentação dos dentes, bem como sensação de ardência38. O objetivo principal desta revisão foi perceber o que se sabe acerca do efeito antiplaca e antigengivite do CPC é o objetivo principal desta revisão. O objetivo secundário é saber como se comporta com os tecidos orais e quais os seus efeitos secundários. Para isso foi feita uma revisão bibliográfica das publicações dos últimos 10 anos.
MétodosA pesquisa foi feita na base primária Pubmed e na base secundária Cochrane em outubro de 2011.
- •
Utilizaram-se os termos MeSH: «Cetylpyridinium chloride» e «Cetylpyridinium»
- •
Na base primária Pubmed acionaram-se os «limits»:
- o
«Published: in the last 10 years;
- o
Type of article: Meta-Analysis, Review; Randomized controlled trial
- o
Species: Humans;
- o
Languages: English, French, Spanish, Portuguese;
- o
Subsets: Dental Journals».
- o
- •
Na base secundária Cochrane não se fez qualquer limitação.
A pesquisa resultou nas mesmas 56 (55 na Pubmed e 1 na Cochrane) referências com o termo «Cetylpyridinium chloride» e com o termo «Cetylpyridinium».
Critérios de inclusão: pacientes saudáveis com idade≥18 anos, estudos que avaliem o CPC como ingrediente ativo principal.
Critérios de exclusão: CPC utilizado em formas não líquidas (ex: chip, gel, vernizes, pastilhas); estudos in vitro, estudos com Follow-up inferior a 2 semanas ou que não avaliem o índice de placa bacteriana ou gengival.
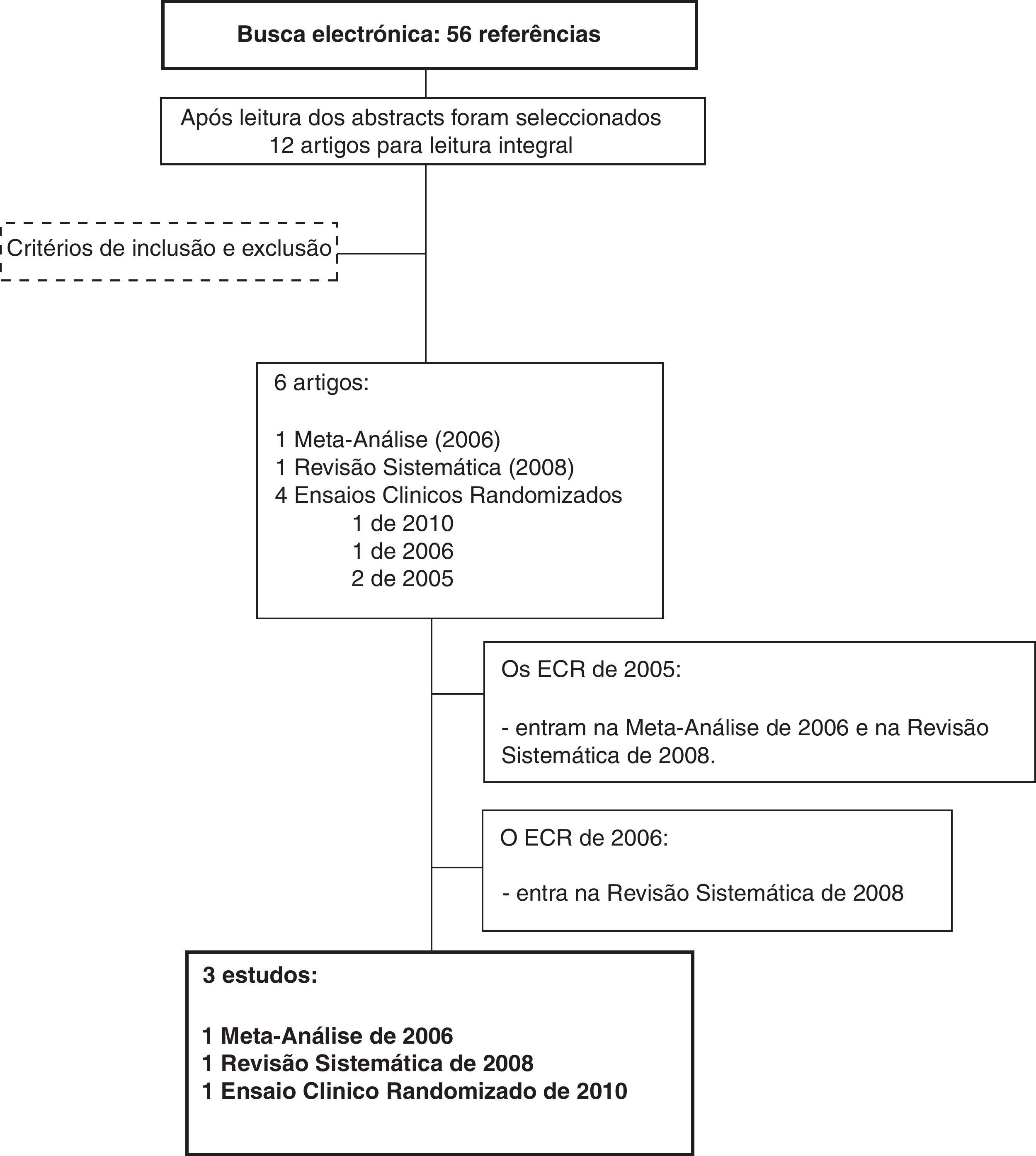
A seleção dos artigos para esta revisão obedeceu ao esquema da figura 1.
Apesar do CPC ser um composto conhecido hà várias décadas, não tem sido alvo de tantos estudos como a clorohexidina ou outros ingredientes usados em colutórios.
Além disso, a maior parte dos estudos apresentam «Follow-up» muito reduzido (3 a 7 dias), formas não líquidas de CPC ou CPC como complemento de outros agentes, como a CHX.
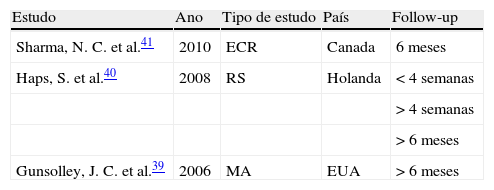
ResultadosA pesquisa anteriormente descrita conduziu-nos a uma meta-análise, a uma revisão sistemática e a um ensaio clínico randomizado (tabela 1).
Estudos incluídos nesta revisão.
| Estudo | Ano | Tipo de estudo | País | Follow-up |
| Sharma, N. C. et al.41 | 2010 | ECR | Canada | 6 meses |
| Haps, S. et al.40 | 2008 | RS | Holanda | <4 semanas |
| >4 semanas | ||||
| >6 meses | ||||
| Gunsolley, J. C. et al.39 | 2006 | MA | EUA | >6 meses |
ECR: ensaio clínico randomizado; EUA: Estados Unidos da América; RS: revisão sistemática; MA: meta-análise.
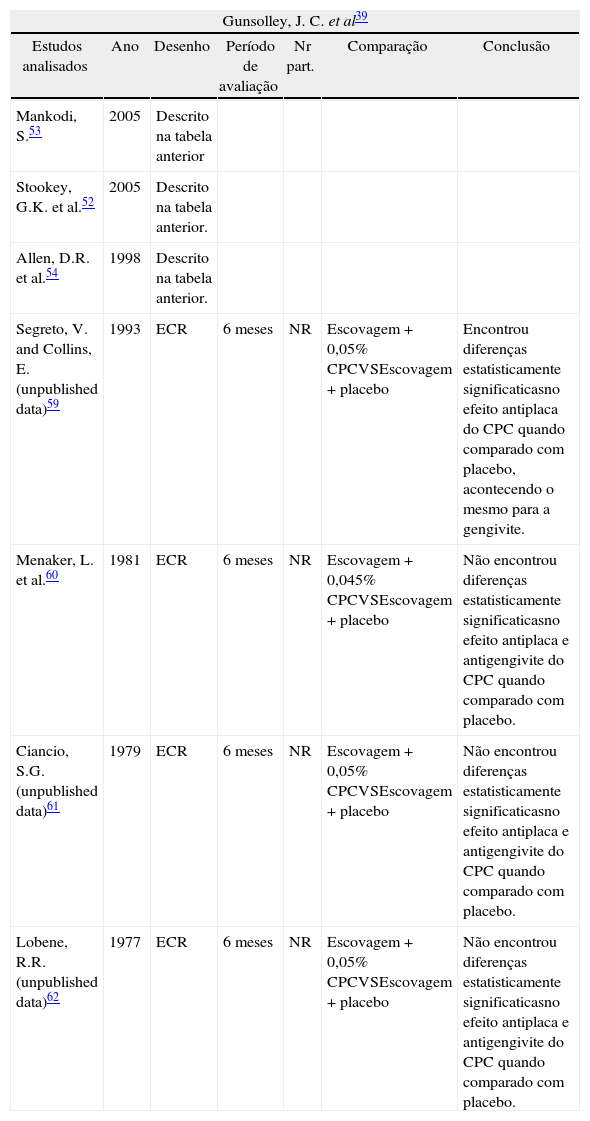
Em 2006, Gunsolley39 afirmava que colutórios contendo CPC com base não alcoólica tinham resultados promissores, apesar de ainda inconsistentes (tabela 2). Na sua revisão sistemática, alguns estudos apresentam diferenças estatisticamente significativas para o controlo da placa bacteriana e da gengivite favoráveis ao uso de CPC, enquanto outros estudos não apresentam estas diferenças, mostrando, assim, grande heterogeneidade nos resultados obtidos. Saliente-se que este acontecimento verificou-se em alguns casos para concentrações muito similares de CPC (0,05 %), são exemplo disso os estudos de Allen e Segretto que apresentaram diferenças estatisticamente significativas enquanto que Menaker, Ciancio e Lobene não encontraram estas diferenças.
Estudos avaliados na revisão sistemática de Gunsoley39
| Gunsolley, J. C. et al39 | ||||||
| Estudos analisados | Ano | Desenho | Período de avaliação | Nr part. | Comparação | Conclusão |
| Mankodi, S.53 | 2005 | Descrito na tabela anterior | ||||
| Stookey, G.K. et al.52 | 2005 | Descrito na tabela anterior. | ||||
| Allen, D.R. et al.54 | 1998 | Descrito na tabela anterior. | ||||
| Segreto, V. and Collins, E. (unpublished data)59 | 1993 | ECR | 6 meses | NR | Escovagem + 0,05% CPCVSEscovagem + placebo | Encontrou diferenças estatisticamente significaticasno efeito antiplaca do CPC quando comparado com placebo, acontecendo o mesmo para a gengivite. |
| Menaker, L. et al.60 | 1981 | ECR | 6 meses | NR | Escovagem + 0,045% CPCVSEscovagem + placebo | Não encontrou diferenças estatisticamente significaticasno efeito antiplaca e antigengivite do CPC quando comparado com placebo. |
| Ciancio, S.G. (unpublished data)61 | 1979 | ECR | 6 meses | NR | Escovagem + 0,05% CPCVSEscovagem + placebo | Não encontrou diferenças estatisticamente significaticasno efeito antiplaca e antigengivite do CPC quando comparado com placebo. |
| Lobene, R.R. (unpublished data)62 | 1977 | ECR | 6 meses | NR | Escovagem + 0,05% CPCVSEscovagem + placebo | Não encontrou diferenças estatisticamente significaticasno efeito antiplaca e antigengivite do CPC quando comparado com placebo. |
CPC: cloreto de cetilpiridínio; ECR: ensaio clínico randomizado; NR: não refere; Nr Part.: número de participantes.
Ao avaliarmos a revisão sistemática de Haps et al. de 200840 observamos resultados mais consistentes (tabela 3). Para este autor, o uso de colutórios contendo CPC em conjunto com a escovagem dentária parece ser efetivo no controlo da placa bacteriana e da gengivite a longo prazo (estudos a 6 meses) e a médio prazo (2 semanas a 2 meses) quando comparado com o uso de placebo. Sharma et al. apontam no mesmo sentido, apesar de não ser o objetivo principal do seu estudo, os autores demonstram que o CPC, usado como complemento à escovagem, é mais eficaz no controlo da placa bacteriana e da gengivite do que o uso de placebo, a longo prazo (3 e 6 meses)41.
Estudos avaliados na revisão sistemática de Haps40
| Haps, S. et al.40 | ||||||
| Estudos analisados | Ano | Desenho | Período de avaliação | Nr part. | Comparação | Conclusão |
| Zimmer, S. et al.51 | 2006 | ECRParaleloCego | 8 semanas | 78 | Escovagem + 0,1% CPCVSEscovagem | Bochechos com 0,1% de CPC em complemento à escovagem produz uma prevenção da acumulação de placa mais efectiva do que só a escovagem. |
| Stookey, G.K. et al.52 | 2005 | ECRParaleloDuplamente cego | 6 meses | 258 | Escovagem + 0,075% CPCVSEscovagem + 0,1% CPCVSEscovagem + placebo | Bochechos com 0,075% CPC ou 0,1% CPC em complemento à escovagem produz benefício estatisticamente significativo na prevenção da placa bacteriana e gengivite quando comparado com escovagem mais placebo. |
| Mankodi, S.53 | 2005 | ECRParaleloDuplamente cego | 6 meses | 119 | Escovagem + 0,075% CPCVSEscovagem + placebo | Bochechos com 0,075% CPC em complemento à escovagem produz uma redução significativa de placa bacteriana, índice gengival e sangramento quando comparado com escovagem mais placebo. |
| Allen, D.R. et al.54 | 1998 | ERCParaleloDuplamente cego | 6 meses | 111 | Escovagem + 0,05% CPCVSEscovagem + placebo | Bochechos de 0,05% CPC em complemento à escovagem produz uma redução estatisticamente significativa na da placa bacteriana supragengival e da gengivite quando comparado com escovagem mais placebo. |
| Nelson, R.F.55 | 1991 | ERCParaleloDuplamente cego | 6 semanas | 66 | Escovagem + 0,05% CPCVSEscovagem + placebo | Bochechos de 0,05% CPC em complemento à escovagem pode ter benefícios limitados no controlo da gengivite e não tem redução significativa do índice gengival quando comparado com escovagem mais placebo. |
| Moran, J. and Addy, M.56 | 1991 | ERCParaleloDuplamente cego | 6 semanas | 107 | Escovagem + 0,1% CPCVSEscovagem + placebo | Bochechos com 0,1% de CPC antes da escovagem mostra não ter benefícios adicionais no controlo de placa bacteriana nem na saúde gengival. |
| Finkelstein, P.57 | 1990 | ERCParalelo | 3 meses | 65 | Escovagem + 0,05% CPCVSEscovagem | Bochechos com 0,05% CPC e escovagem comparado com apenas escovagem não melhora significativamente a saúde gengival, exibe maior redução de placa bacteriana nas superfícies dentárias mas não penetra suficientemente entre os dentes para diminuir a placa bacteriana interdentária nem a inflamação interdentária. |
| Barnes, G.P.58 | 1976 | ECRParaleloCego | 4 semanas | 63 | Escovagem + 0,05% CPCVSEscovagem + placebo | O uso diário, dos colutórios com CPC testados, é parcialmente efectivo na redução de acumulação de placa bacteriana. |
CPC: cloreto de cetilpiridínio; ECR: ensaio clínico randomizado; NR: não refere; Nr Part.: número de participantes.
Gunsolley39, apesar da sua meta-análise avaliar apenas protocolos com mais de 6 meses de Follow-up, defende que para se investigar os efeitos anti-placa de um colutório se devem fazer estudos a curto prazo (4 dias a 2 semanas). Para este autor estudos a médio prazo são limitados por não refletirem o uso real do produto por parte do paciente.
Já os requisitos da American Dental Association (ADA) para um selo de aceitação requerem um período de estudo de 6 meses com uma avaliação intercalar aos 3 meses, como acontece no Ensaio Clínico Randomizado (ECR) de Sharma et al. (tabela 4), para avaliar tanto a eficácia quanto a segurança dos agentes químicos, bem como o cumprimento dos pacientes. No entanto, dado que os colutórios são também utilizados e prescritos por períodos curtos, a sua eficácia nesses períodos deve também ser avaliada.
Ensaio clínico randomizado de Sharma41
| Sharma, N. C. et al41 | |||||
| Ano | Desenho | Período de avaliação | Nr part. | Comparação | Conclusão |
| 2010 | ECRParaleloCego | 6 meses | 374 | Escovagem + 0,05% CPCVSEscovagem + Óleo essencialVSEscovagem + Placebo | O uso de colutório contendo óleos essenciais usado 2 vezes por dia como complemento à escovagem proporciona significativamente melhor controlo de placa bacteriana e gengivite que o uso de colutório contendo 0,05% CPC. O CPC quando comparado com placebo apresenta resultados melhores e com diferenças estatisticamente significativas, no que diz respeito ao controlo da placa bacteriana e gengivite. |
CPC: cloreto de cetilpiridínio; ECR: ensaio clínico randomizado; Nr Part.: número de participantes.
Outra questão referida por Haps et al. é que, os colutórios contendo CPC, são importantes quando usados como coadjuvantes à escovagem dentária, em pacientes com alta suscetibilidade à doença periodontal ou com falta de destreza manual. Mas os estudos que avaliam a eficácia do CPC na prevenção de placa bacteriana são geralmente efetuados em pacientes com saúde gengival, por isso são necessários mais estudos para estabelecer se colutórios contendo CPC são eficazes em pacientes periodontalmente comprometidos40. A realidade é que se sabe que pacientes que, através de formas mecânicas, têm um bom controlo da placa bacteriana beneficiam mais do uso destes produtos do que pacientes com fraco controlo mecânico da placa bacteriana40.
Efeitos secundários do CPCNos estudos pesquisados por Haps et al40 vários grupos relataram efeitos secundários objetivos específicos como manchas, ulcerações e coloração da língua e dos dentes. Também foram descritos efeitos secundários subjetivos como sensação de ardência, sensibilidade e mau paladar. Nestes estudos foi também assumido que o tabaco não teve influência no aparecimento de efeitos secundários.
Gunsolley39 não avaliou os efeitos secundários na sua meta-análise e Sharma et al.41 refere que os únicos acontecimentos relatados foram dores de cabeça e constipações e não tiveram qualquer relação com o composto em estudo. É curioso que este autor apesar de os ter avaliado não tenha encontrado nenhum dos efeitos secundários objetivos relatados por Haps et al.
Substantividade do CPCA coloração induzida pelo CPC tem a mesma etiologia que a induzida pela CHX, mas parece ser menos severa. Este fenómeno mostra menos substantividade do CPC, o que pode explicar a sua menor eficácia, comparando com a CHX40. Apesar da sua maior retenção inicial o CPC é eliminado da cavidade oral mais rapidamente. A duração do efeito terapêutico está presente até 90 minutos para o CPC e até 7h para a CHX.
Índices utilizados nos estudosDe todos os índices avaliados nestes estudos, o único que revela grande consenso entre autores é o Índice de Placa de Quigley e Hein modificado por Turesky et al.42 (tabela 5) daí que seja possível a execução de meta-análises desta variável. Outros exemplos de índices de placa utilizados nos estudos revistos são o índice modificado de placa interproximal43 e o ìndice de placa global44.
Índice de Placa de Quigley e Hein modificado por Turesky42
| 0 | ausência de placa bacteriana |
| 1 | estrias independentes de placa bacteriana na margem cervical |
| 2 | banda de placa fina e contínua (até 1mm) na margem cervical |
| 3 | banda de placa bacteriana maior que 1mm mas que cobre menos de 1/3da coroa |
| 4 | a placa bacteriana cobre entre 1/3 e 2/3da coroa |
| 5 | a placa bacteriana cobre 2/3 ou mais da coroa |
Os índices gengivais são mais diversificados, impossibilitando a redação de meta-análises. Os índices gengivais utilizados são: índice gengival de Silness e Loe (GI)45, índice de gravidade gengival46, índice gengival de Silness e Loe modificado47, índice de sangramento gengival48, índice de sangramento papilar (PBI)49 e índice de sangramento interdentário50.
ConclusãoApesar da evidência científica ser ainda escassa, a utilização de colutórios contendo CPC como complemento às formas mecânicas de higiene oral parece fornecer um pequeno, mas significativo, benefício na redução da placa bacteriana e da inflamação gengival, quando comparado com escovagem ou escovagem seguida de bochechos com placebo.
Conflito de interessesOs autores declaram não haver conflito de interesses.