Se presentan dos casos de neoplasias ampulares asociadas a sangrado de tubo digestivo alto. Ambos pacientes fueron estudiados con panendoscopía, tomografía computada (TC) y en el segundo caso, ultrasonido (US) endoscópico. El tratamiento quirúrgico en ambos casos fue pancreaticoduodenectomía con preservación de píloro, con adecuada evolución posoperatoria, y en los dos casos se corroboró en el estudio histopatológico "tumor de estroma gastrointestinal de bajo riesgo". En ambos casos, la resección fue con bordes libres de tumor, con adecuada evolución posoperatoria. A 30 meses de seguimiento sin evidencia de recidiva.
We present two cases of ampullary neoplasms presenting as upper gastrointestinal bleeding. Both patients were studied with panendoscopy, CT and in the second case, endoscopic ultrasound. Surgical treatment was pylorous-preserving pancreaticoduodenectomy in both cases, with adequate postoperative course. In both cases was confirmed on histopathology gastrointestinal stromal tumor of low risk. In both cases the resection was with tumor-free margins, with 30 months follow-up without evidence of recurrence.
Pagina nueva 2
¿ Introducción
Los tumores del estroma gastrointestinal (GIST, por sus siglas en inglés, gastrointestinal stromal tumors) son tumores infrecuentes de origen mesenquimatoso, provenientes de células pluripotenciales conocidas como células intersticiales de Cajal, encargadas de la motilidad intestinal, y corresponden aproximadamente al 0.2% de los tumores gastrointestinales.1
Son lesiones que se encuentran con mayor frecuencia en el estómago (60% a 70%), seguido del yeyuno y del íleon (20% a 30%), colon y recto (10%), esófago (5%) y, en menor proporción, en el duodeno (3% a 5%).2 A este nivel, representan del 10% al 33% de las neoplasias malignas duodenales. Afectan a hombres y mujeres en la misma proporción, y son más frecuentes entre los 55 y 65 años. En la mayoría de los casos, se ha identificado una mutación en el protooncogén c-kit (CD117), localizado en el brazo largo del cromosoma 4. Su presentación clínica depende de su localización, tamaño y grado de ulceración de la mucosa que los recubre, por lo que en etapas tempranas la mayoría de estos tumores son identificados de forma incidental en imágenes, laparotomía o laparoscopía. En estadios avanzados, sus manifestaciones más frecuentes son: sangrado (26%), dolor y dispepsia (14%), masa palpable o perforación (< 10%), obstrucción (3%), disfagia y alteraciones del hábito intestinal.3 La diseminación linfática es muy rara pero, desafortunadamente, su comportamiento clínico es impredecible y los tumores pequeños pueden presentar metástasis, por lo que se han diseñado diferentes escalas para predecir el riesgo de malignización, con base en la localización, el tamaño del tumor y el número de mitosis; considerándose de alto riesgo, aquellos de localización duodenal, mayores de 5 cm y con más de 5 mitosis por 50 campos de alta resolución4,5 (Tabla 1). La base del tratamiento es la resección quirúrgica sin que exista, hasta el momento, un consenso respecto al abordaje (endoscópico, laparoscópico o abierto) o a la extensión de la resección (radical o conservadora).6
¿ Presentación de casos
Caso 1
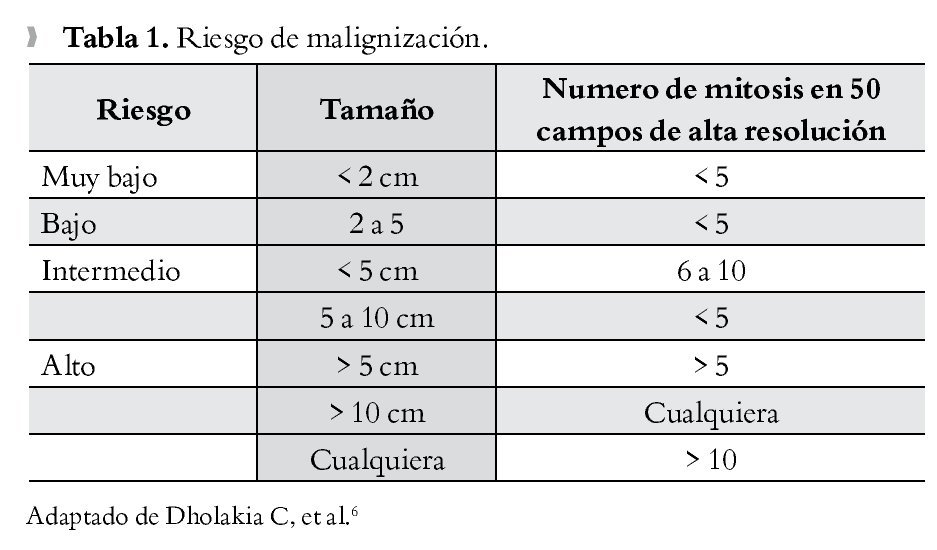
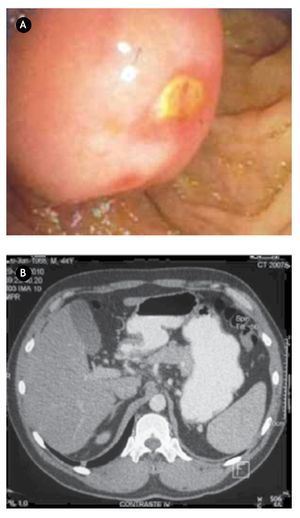
Paciente masculino de 26 años de edad, quien ingresó por sangrado de tubo digestivo alto, con hematemesis y melena, con síndrome anémico secundario, con Hb 5 g/dL ameritando en tres ocasiones transfusión de hemoderivados. Dentro del protocolo de estudio, se realizó panendoscopía que reportó lesión ulcerada de rodilla duodenal de 2.5 cm, elevada, de bordes regulares, excavada, con sangrado fácil sugerente de leiomioma duodenal, de la cual se tomaron biopsias que reportaron duodenitis crónica. Se realizó tomografía contrastada identificando aumento de las dimensiones del páncreas a nivel de cabeza y proceso uncinado, heterogéneo e irregular, que se extiende y comprime primera y segunda porción de duodeno sin plano de separación (Figura 1A). Los marcadores tumorales séricos se reportaron negativos. Se decidió laparotomía exploradora encontrando tumoración ampular de 5 x 3 cm, y se realizó pancreaticoduodenectomía con preservación de píloro (Figura 1B). Reporte histopatológico definitivo: tumor del estroma gastrointestinal fusocelular con diferenciación muscular lisa del ámpula duodenal de 5 cm, con cuatro mitosis en 50 campos de alta resolución, con inmunohistoquímica con CD117 positivo, corroborando diagnóstico de "tumor de estroma gastrointestinal". El paciente presentó adecuada evolución posoperatoria, egresado por mejoría al día 14 de posoperatorio, con seguimiento ambulatorio con tomografía por emisión de positrones (PET) sin evidencia de recidiva a 30 meses, y clínicamente asintomático.
¿Figura 1.A) Imagen tomográfica con aumento de dimensiones de cabeza de páncreas con compresión de primera y segunda porción de duodeno, estómago engrosado e irregular compatible con proceso inflamatorio crónico. B) Producto de pancreaticoduodenectomía, donde se aprecia lesión a nivel de ámpula de Váter correspondiente a GIST.
Caso 2
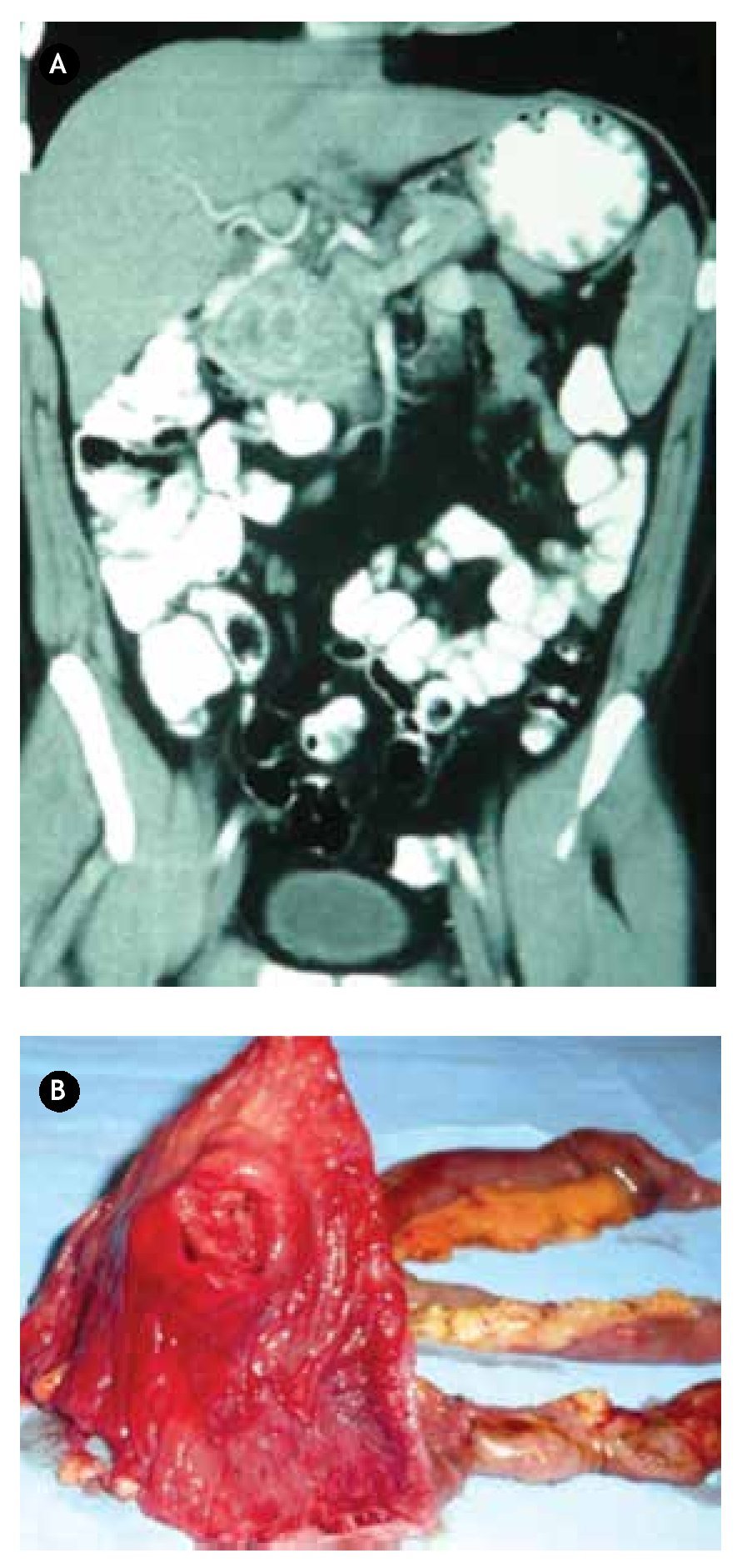
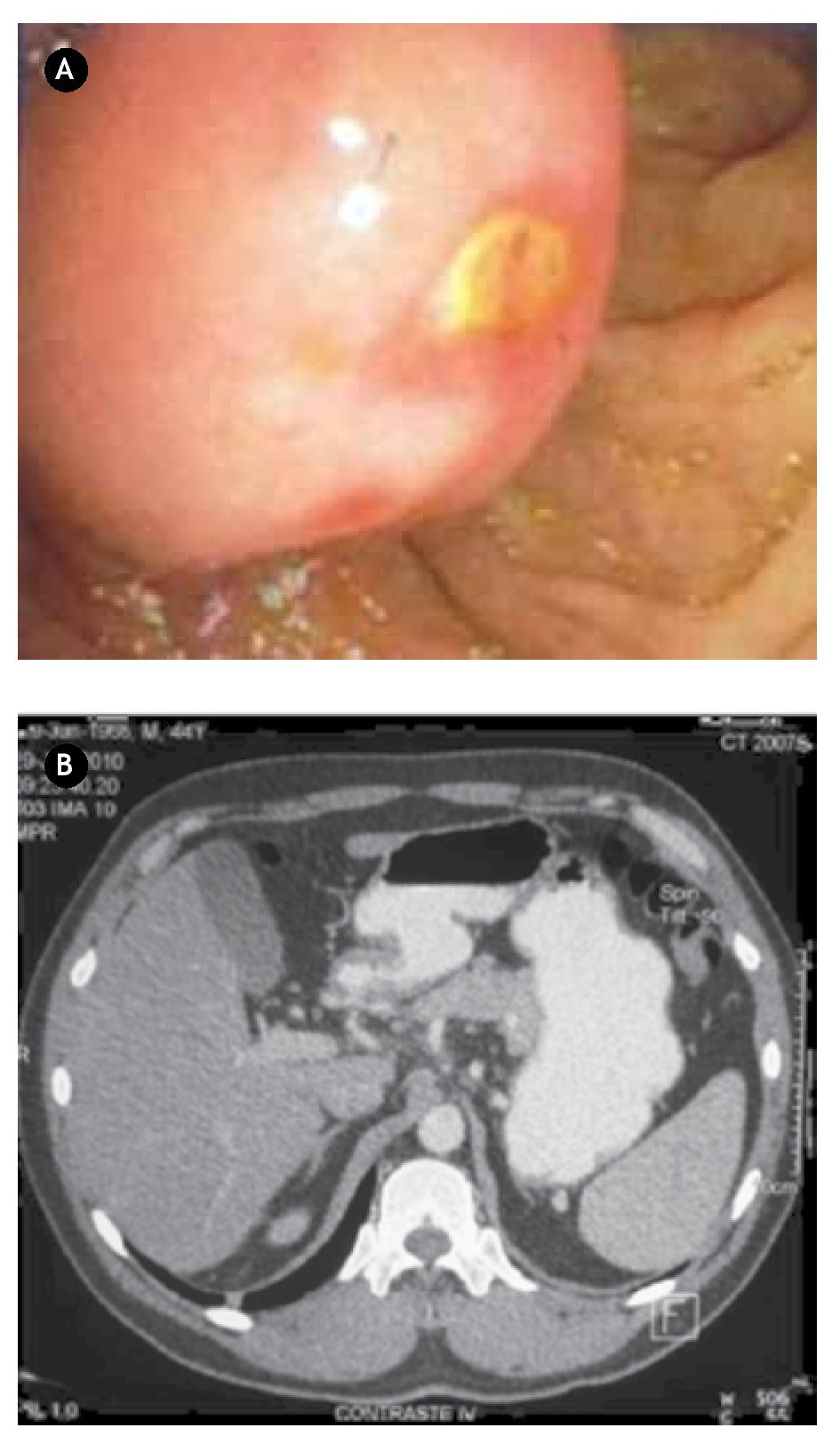
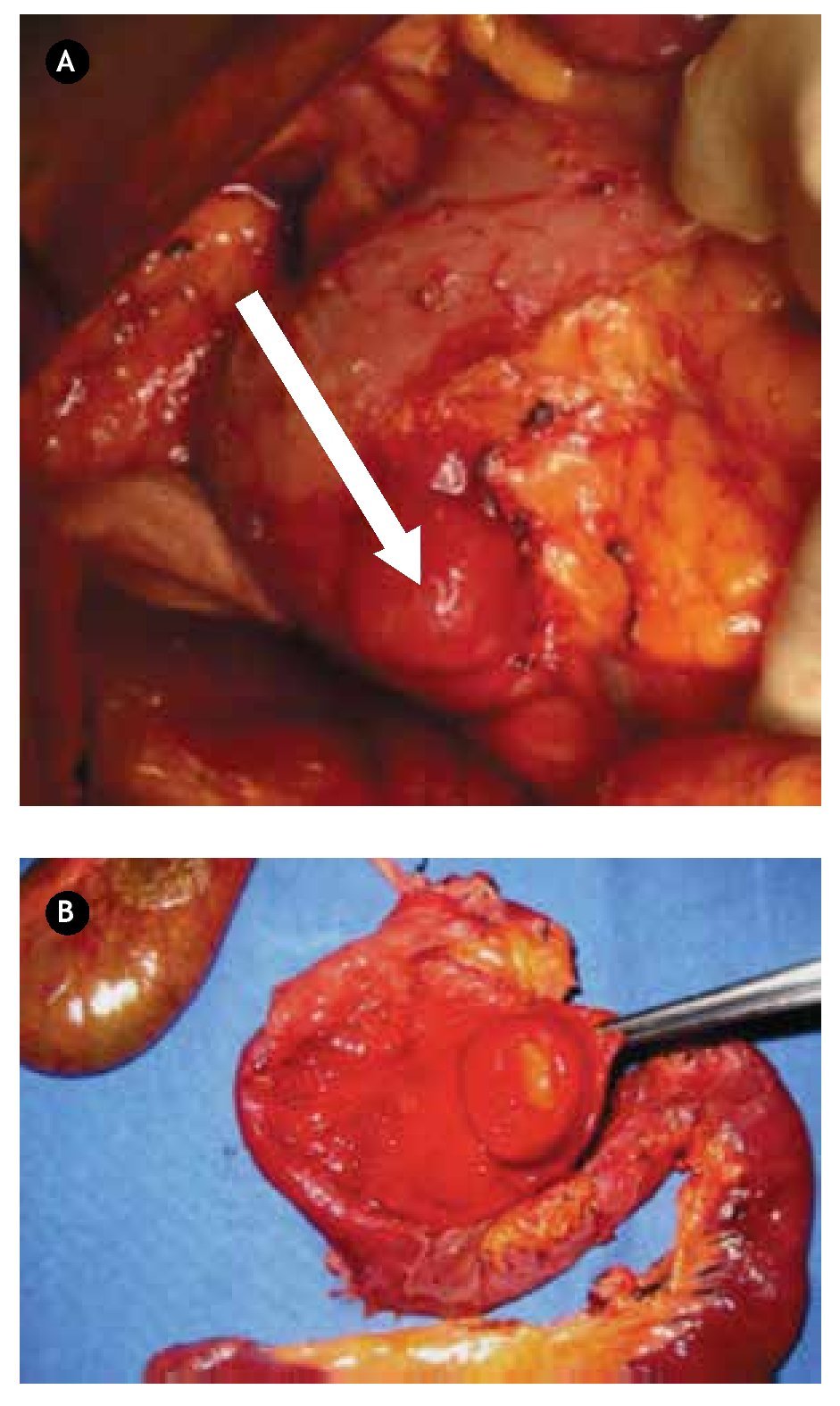
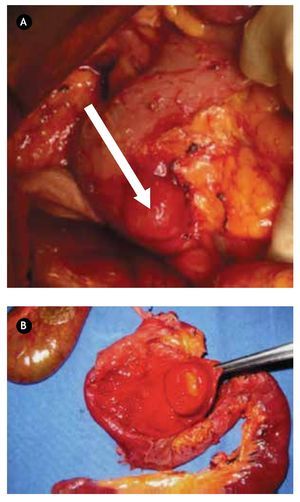
Paciente masculino de 44 años de edad, el cual debutó con hematemesis y síndrome anémico secundario, por lo que ingresó, documentándose Hb 7 g/ dL, ameritando hemotransfusión. Para su estudio se realizó panendoscopía que reportó lesión duodenal de 2.5 x 2.5 cm, ovoidea de base ancha, con resultado de biopsia de duodenitis crónica (Figura 2A). Se realizó ultrasonido endoscópico con lesión submucosa hipoecoica de 30 x 23 mm, sin identificar adenomegalias, sugerente de ampuloma. Tomografía abdominal con lesión hiponodular hipodensa, al parecer con origen en duodeno (Figura 2B). Con estos datos, se decidió laparotomía exploradora encontrándose lesión de 4 x 4 cm a nivel del ámpula, por lo que se realizó pancreaticoduodenectomía con preservación de píloro (Figura 3). Reporte histopatológico: "Tumor de estroma gastrointestinal de 2.6 x 2.3 cm, ampular, con cero mitosis por 50 campos de alta resolución, con inmunohistoquímica CD117 positivo". El paciente presentó adecuada evolución posoperatoria, egresado por mejoría al día 16 de posoperatorio, con seguimiento ambulatorio en consulta con PET sin evidencia de recidiva a 30 meses, clínicamente asintomático.
¿Figura 2.A) Imagen endoscópica con lesión duodenal. B) Tomografía computarizada contrastada con lesión hipodensa dependiente de duodeno.
¿Figura 3.A) Imagen transoperatoria de lesión tumoral localizado en segunda porción de duodeno. B) Producto de pancreaticoduodenectomía, donde se encuentra lesión dependiente de ámpula de Váter en la luz duodenal.
¿ Discusión
Los GIST son lesiones poco frecuentes que pueden encontrarse a cualquier nivel del tubo digestivo, siendo rara su localización en duodeno.1-3,9 Molecularmente, hasta un 90% presentan mutaciones en el gen c-kit.8 Clínicamente, la mayoría cursan asintomáticos; cuando se presentan síntomas, éstos pueden ser por efecto de masa del tumor, dolor, dispepsia o hemorragia gastrointestinal, por lo que es importante tener un alto grado de sospecha al iniciar el protocolo de estudio, ya que a pesar de ser poco frecuentes, deben considerarse dentro del diagnóstico diferencial del sangrado de tubo digestivo, así como de tumores ampulares.9,10 El abordaje diagnóstico sugerido debe incluir tomografía y endoscopía, sin olvidar que, en estos casos, el valor de la biopsia es muy limitado por tratarse de lesiones submucosas.7 En la tomografía suele tratarse de lesiones hiperdensas, muy vascularizadas, aunque también pueden presentarse como lesiones heterogéneas con zonas de hemorragia y necrosis.9
Se reportaron dos casos de localización ampular, debutando con sangrado de tubo digestivo alto, en ambos, se realizó como estudio inicial panendoscopía, identificándose en los dos casos una lesión periampular, elevada de tipo submucoso, sin poderse obtener material adecuado para establecer el diagnóstico de GIST mediante biopsia endoscópica. En estos casos, la biopsia percutánea está contraindicada por el riesgo de diseminación,7 por lo que no se intentó. Se realizaron como estudios de extensión tomografía computada y ultrasonido endoscópico, y finalmente se decidió exploración quirúrgica, realizando en ambos casos pancreaticoduodenectomía con preservación de píloro. En ambos casos, el reporte histopatológico definitivo fue compatible con tumores de bajo riesgo (por tamaño y número de mitosis), por lo que no se administró adyuvancia.10 Hasta el momento, los dos pacientes se encuentran en seguimiento con PET libres de enfermedad a 30 meses.
En estos casos, es de vital importancia individualizar el abordaje quirúrgico acorde a cada caso y, dado el comportamiento biológico de estos tumores, debe hacerse seguimiento a largo plazo, debido al riesgo de desarrollo de metástasis aún en tumores de bajo riesgo. No existe un consenso universal respecto de la extensión que debe tener la resección en estos casos; sin embargo, se considera que, en aquellos casos de enfermedad localizada y sin evidencia de metástasis, el tratamiento angular lo constituye la resección quirúrgica con bordes libres; lo anterior, debido a que no suelen tener infiltración microscópica extensa y la diseminación linfática no es característica. En consecuencia, no se considera necesaria la linfadenectomía, siempre y cuando se obtengan bordes libres de tumor, y que no exista ruptura del mismo en el transoperatorio, situación que puede condicionar diseminación transcelómica o implantes.1 En los casos en los que es poco probable realizar una resección con bordes libres, está indicado el tratamiento preoperatorio con imitanib durante seis a 12 meses, con lo que se busca realizar citorreducción del tumor. En el caso de tumores duodenales, está indicado cuando hay compromiso de la cabeza del páncreas y de la vena cava inferior.6 En aquellos casos en los que se presenta ruptura transoperatoria de tumor y contaminación peritoneal, también se sugiere tratamiento adyuvante con imitanib.1,7
Para pacientes con enfermedad local irresecable o con enfermedad metastásica, el tratamiento de elección es la terapéutica médica con imitanib, inhibidor de la tirosina cinasa, que también se utiliza para aquellos pacientes que presentan recurrencia de la enfermedad. En estos casos, el tratamiento suele ser por tiempo indefinido.10
¿ Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
¿ Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este estudio.
Correspondencia:
Dra. Vanessa Ortíz Higareda.
Hospital General de México "Dr. Eduardo Liceaga",
Unidad 305. Dr. Balmis N° 148, Colonia Doctores, Delegación Cuauhtémoc,
C.P. 06720, México D.F., México.
Teléfono: 2789 2000, ext. 1257.
Correo electrónico: higared@hotmail.com