Las drogas impactan en los circuitos de recompensa cerebrales y originan dependencia y adicción, lo que se define actualmente como trastornos por consumo de drogas. Los mecanismos de plasticidad sináptica en dichos circuitos son cruciales en el desarrollo de la conducta adictiva, y los endocannabinoides, entre los que destacan la anandamida y el 2-araquidonil-glicerol, participan en la normal neuroplasticidad. Se sabe que los trastornos por consumo de drogas se asocian, entre otros fenómenos, a disrupción de la plasticidad sináptica mediada por endocannabinoides. Estas moléculas median neuroplasticidad de corta duración y perdurable. Respecto a la de corta duración, destacan fenómenos de carácter «inhibidor», como la supresión de la inhibición inducida por despolarización y la supresión de la excitación inducida por despolarización; y otros «desinhibidores», como la desinhibición de la actividad neuronal, sobre todo en el núcleo estriado, y la supresión de la liberación GABA en el hipocampo. Por otra parte, las drogas pueden alterar la normal potenciación perdurable y la depresión perdurable mediadas por endocannabinoides. Los endocannabinoides también influyen en el desarrollo de hipofrontalismo y sensibilización causados por las drogas. En fin, el abuso de drogas origina una disrupción en la plasticidad sináptica de circuitos cerebrales involucrados en la adicción y en ello juega un destacado papel la alteración de la normal actividad endocannabinoide. Ello facilita los cambios anómalos cerebrales y el desarrollo de conductas adictivas que caracterizan a los trastornos por consumo de drogas.
Drugs impact brain reward circuits, causing dependence and addiction, in a condition currently described as substance use disorders. Mechanisms of synaptic plasticity in these circuits are crucial in the development of addictive behaviour, and endocannabinoids, particularly anandamide and 2-arachidonyl-glycerol, participate in normal neuroplasticity. Substance use disorders are known to be associated with disruption of endocannabinoid-mediated synaptic plasticity, among other phenomena. Endocannabinoids mediate neuroplasticity in the short and the long term. In the short term, we may stress «inhibitory» phenomena, such as depolarisation-induced suppression of inhibition and depolarisation-induced suppression of excitation, and such «disinhibitory» phenomena as long-lasting disinhibition of neuronal activity, particularly in the striatum, and suppression of hippocampal GABA release. Drugs of abuse can also disrupt normal endocannabinoid-mediated long-term potentiation and long-term depression. Endocannabinoids are also involved in the development of drug-induced hypofrontality and sensitisation. In summary, substance abuse causes a disruption in the synaptic plasticity of the brain circuits involved in addiction, with the alteration of normal endocannabinoid activity playing a prominent role. This facilitates abnormal changes in the brain and the development of the addictive behaviours that characterise substance use disorders.
Las drogas son adictivas, sin duda, pero el término «adictivo» es difícil de definir. Tradicionalmente se han aplicado varios términos para definir el efecto psicobiológico originado por las drogas de abuso, como adicción, dependencia, abuso (Diagnostic and Statistical Manual of Mental Disorders-IV) o uso dañino (ICD-10)1. La adicción se define como una enfermedad crónica y recurrente del cerebro que se caracteriza por la búsqueda y el consumo compulsivo de drogas, a pesar de sus consecuencias nocivas2. La dependencia sería un término más amplio que adicción, que abarca desde una necesidad leve (por ejemplo la dependencia a la cafeína) hasta una necesidad compulsiva (que sería adicción establecida), según 6criterios1. El abuso según el DSM-IV y el uso dañino según el ICD-10 se basan en una lista de consecuencias somáticas y psicológicas del abuso de una droga. Actualmente, el DSM-V3 ha abandonado estos términos y se refiere a «trastornos por consumo de drogas» o TCD (substance use disorders en inglés) según 11 criterios (ver tabla 1), desde leve (menos de 3 criterios presentes) hasta grave (más de 6 criterios presentes en el sujeto adicto).
Criterios para el diagnóstico de los trastornos por consumo de drogas
| 1. Tomar la droga en cantidades mayores o por más tiempo de lo que se debe |
| 2. Querer dejar de usar la droga, pero no lograrlo |
| 3. Pasar mucho tiempo buscando, consumiendo o recuperándose del consumo de la droga |
| 4. Deseos compulsivos de usar la droga |
| 5. No lograr hacer lo que debería en el trabajo, el hogar o la escuela debido al consumo de drogas |
| 6. Seguir usando, incluso cuando causa problemas en las relaciones personales |
| 7. Renunciar a actividades sociales, ocupacionales o recreativas importantes debido al consumo de drogas |
| 8. Usar sustancias una y otra vez, incluso cuando te pone en peligro |
| 9. Seguir usando, incluso cuando sabe que tiene un problema físico o psicológico que podría ser causado o agravado por la droga o drogas |
| 10. Desarrollo de tolerancia, o necesitar más droga para obtener el efecto deseado |
| 11. Desarrollo de síntomas de abstinencia, que pueden aliviarse tomando la droga |
Estos criterios se basan en el DSM-V (Diagnostic and Statistical Manual of Mental Disorders)3.
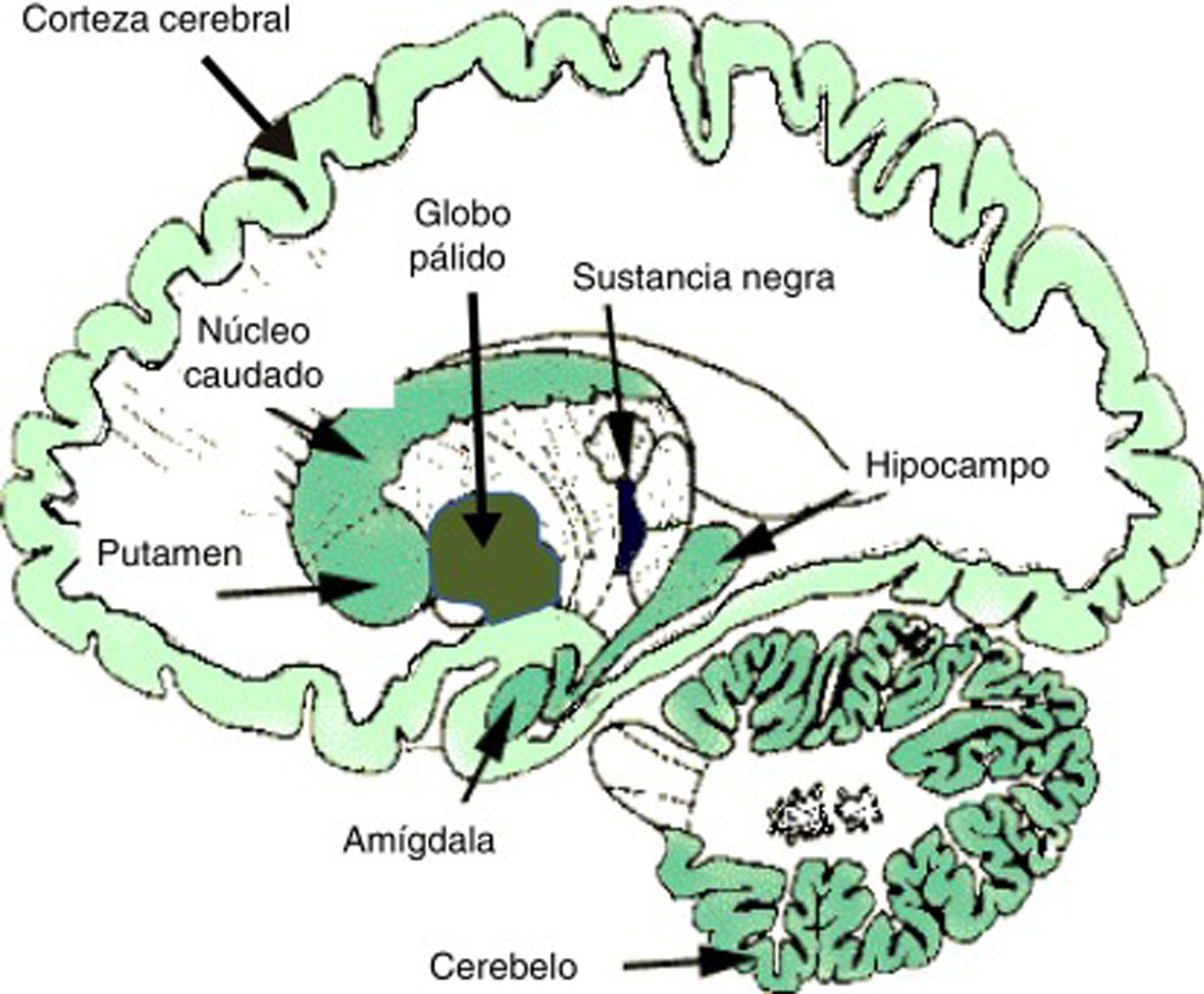
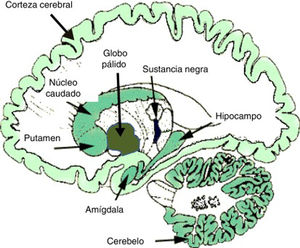
En el ámbito neurobiológico, las drogas o sustancias adictivas impactan en los circuitos de recompensa cerebrales que nacen en el área tegmental ventral (ATV), así como en regiones límbicas y mnésicas como la amígdala y el hipocampo. Los mecanismos de refuerzo cerebral y de plasticidad sináptica en dichos circuitos son cruciales en el desarrollo de la adicción y la conducta adictiva2,4-6. Los eventos neuroplásticos básicos tienen lugar en los circuitos de recompensa mesolímbicos, donde destacan el núcleo accumbens o estriado ventral, la corteza prefrontal y el área tegmental ventral mesencefálica, como se ha comentado. Estas estructuras límbicas consolidan la conducta anormal, asociando (condicionamiento) numerosos eventos internos y externos con la recompensa derivada de la droga. Estos efectos condicionados son críticos en el desarrollo de la adicción, tanto en su fase activa de consumo como en su fase de abstinencia7. Dentro de los efectos neurobiológicos, los neurotransmisores dopamina, GABA y glutamato son fundamentales en la neuroplasticidad mesolímbica y es de destacar la creciente importancia de otros neuromensajeros como son los endocannabinoides (eCB). Se sabe que los eCB modulan la señal sináptica de modo retrógrado, sobre todo en las sinapsis glutamatérgicas y GABAérgicas, y participan de modo crucial en los fenómenos de neuroplasticidad sináptica. Los TCD se asocian a una disrupción de la normal plasticidad mediada por eCB. La figura 1 muestra la densidad de localización de eCB en el cerebro humano.
Densidad de localización de endocannabinoides en el cerebro humano. Un mayor tono de color indica mayor densidad de receptores de eCB.
Fuente: Modificado de Licciardi y Manfredi54.
El primer eCB descubierto fue la anandamida (N-araquidonil-etanolamina, AEA) y 2años más tarde se descubrió el 2-araquidonil-glicerol (2-AG)8,9. Se han identificado posteriormente otras moléculas con acción cannabinoide como el éter 2-araquidonil-glicerol, la N-araquidonil-dopamina, la virodamina, la N-homo-g-linoenoiletanolamina y la N-docosatetraenoiletanolamina10-13. Los eCB son de naturaleza lipídica, de modo que su almacenamiento vesicular en las sinapsis es imposible debido a su alta liposolubilidad. Por ello, se sintetizan a demanda desde precursores de membrana. Una vez que actúan, son rápidamente degradados por medio de recaptación —tanto por neuronas como por células gliales— y posterior hidrólisis14,15.
Los eCB actúan sobre receptores específicos cannabinoides, de los que destacan los tipos 1 y 2 (CB1 y CB2). En 1988 se describió el primer receptor cannabinoide en el cerebro, denominado CB116, se clonó en el ser humano17 y se identificó como perteneciente a la superfamilia de receptores de neurotransmisores acoplados a la proteína G. Luego se identificó otro receptor cannabinoide a nivel periférico, el receptor CB218, también perteneciente a la familia de receptores de membrana acoplados a proteína G. Los receptores CB2, con una homología global con los CB1 del 44% (68% en las regiones transmembrana), se expresan en gran cantidad en linfocitos, lo que indica que este subtipo de receptores media la acción inmunomoduladora de los cannabinoides. Aunque se ha descrito la localización cerebral del receptor CB2 en células gliales19, podemos considerar que el principal receptor cannabinoide cerebral en las neuronas es el CB1. Las proteínas CB1 se expresan preferentemente sobre poblaciones neuronales del cerebro de mamíferos muy relacionadas con la adicción y los sistemas de recompensa. Los receptores cannabinoides CB1 se encuentran en una alta densidad en las neuronas del núcleo accumbens, estriado dorsal y cerebelo, lo que por otra parte explica las acciones tras su estimulación aguda (ataxia, dismetría e hipocinesia), así como en hipocampo y amígdala. En el resto de las áreas, como neocorteza, colículo superior y habénula, existe una cantidad moderada de estos receptores. Como se ha comentado, las drogas de abuso alteran la neuroplasticidad sináptica mediada por eCB tanto de corta duración como perdurable. En la tabla 2 se presenta un esquema de los fenómenos de plasticidad sináptica involucrados en los TCD donde participan los eCB.
Fenómenos de plasticidad sináptica involucrados en los trastornos por consumo de drogas en los que participan los endocannabinoides
| Plasticidad de corta duración |
|---|
| Supresión de la inhibición inducida por despolarización (DEE, siglas en inglés) |
| Supresión de la excitación inducida por despolarización (DEI, siglas en inglés) |
| Desinhibición perdurable de la actividad neuronal (DLL, siglas en inglés) |
| Supresión de la liberación GABA en el hipocampo |
| Plasticidad perdurable |
|---|
| Depresión perdurable (LDP, siglas en inglés) |
| Potenciación perdurable (LTP, siglas en inglés) |
| Hipofrontalismo |
| Sensibilización |
Los eCB median la plasticidad de corta duración. Hay fenómenos de plasticidad de corta duración de carácter inhibidor y otros de carácter desinhibidor. Entre los de carácter inhibidor mediados por eCB destacan la supresión de la inhibición inducida por despolarización (DSI, en inglés, depolarization-induced suppression of inhibition) y la supresión de la excitación inducida por despolarización (DSE, depolarization-induced suppression of excitation), fenómenos que reducen la liberación sináptica de glutamato, GABA o glicina20-22. Ambas se basan en que la liberación de eCB tras la actividad sináptica inhibe la posterior entrada de calcio presináptica y la liberación de neurotransmisor (excitador o inhibidor), como se pone de manifiesto en el cerebelo21, hipocampo20 o en los núcleos troncoencefálicos22. Los eCB inducen DSI y DSE a través de receptores CB1, pues los antagonistas y agonistas CB1 bloquean y estimulan, respectivamente, dichos fenómenos sinápticos20,23. Los DSI se relacionan con la dependencia, pues la cafeína produce una gran alteración de la DSI mediada por GABA24.
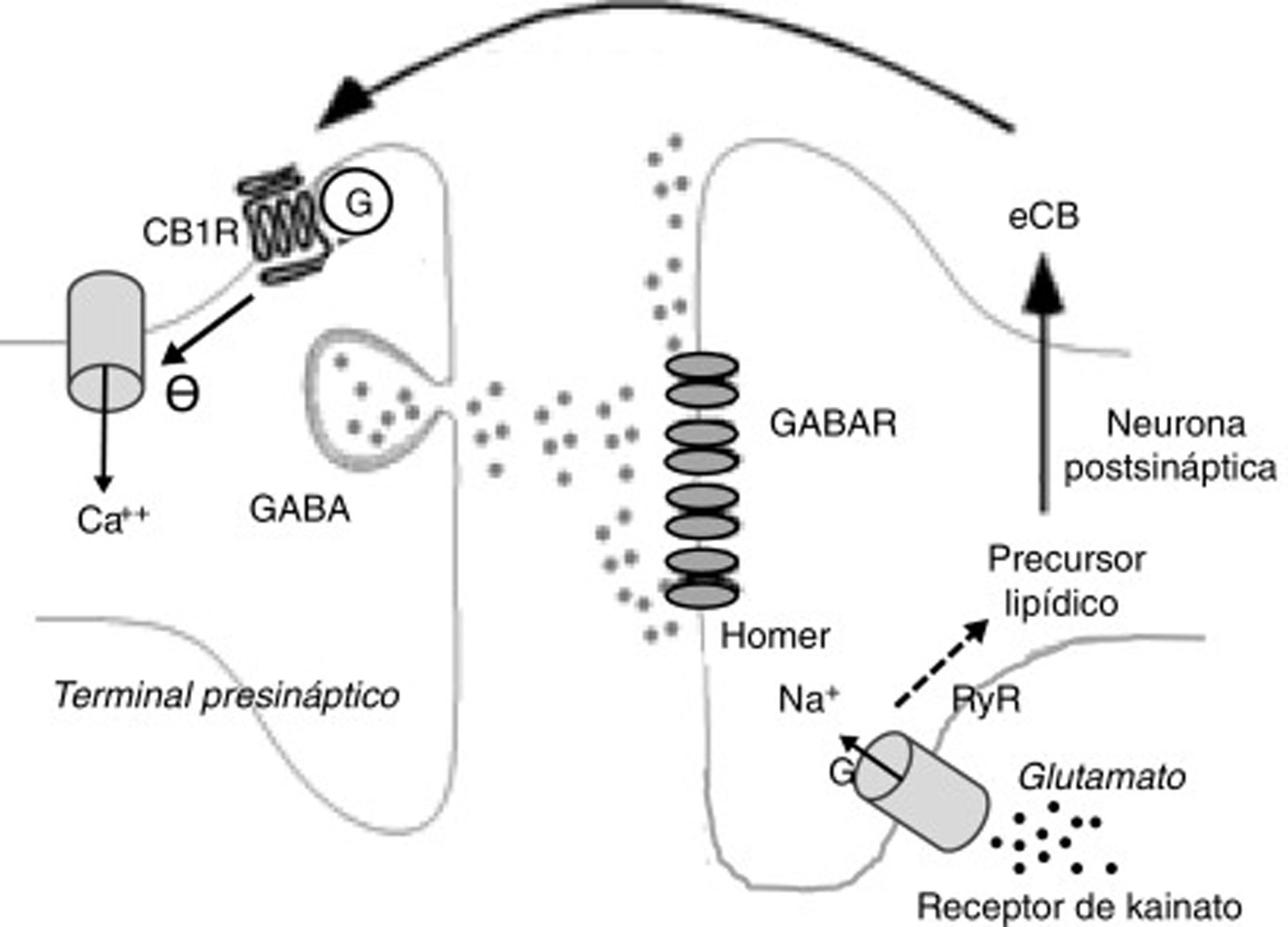
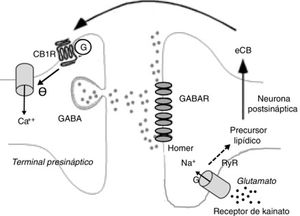
Entre los de carácter desinhibidor destacan la desinhibición de actividad neuronal, sobre todo en el núcleo estriado (DLL en inglés, long lasting disinhibition) mediada por eCB25 y la llamada supresión de la liberación GABA en el hipocampo26. Ambas están mediadas por receptores CB25. En el caso de la supresión de la liberación GABA en el hipocampo, la liberación de glutamato activa receptores de kainato que, a su vez, estimula la producción de eCB que suprimen la liberación presináptica de GABA26 (fig. 2).
Fenómenos bioquímicos que suceden durante la supresión de la liberación GABA en el hipocampo mediada por endocannabinoides. La liberación de glutamato activa receptores de kainato postsinápticos, que inducen la entrada de sodio y la producción de endocannabinoides. Los endocannabinoides son liberados al espacio sináptico y actúan sobre receptores CB1 unidos a proteínas G de terminales que liberan GABA. Ello induce la disminución de la entrada presináptica de calcio y una menor liberación de GABA.
Ca++: calcio; CB1R: receptor CB1; eCB: endocannabinoide; G: proteína G; GABAR: receptor de GABA; Na+: sodio.
Los cambios de corta duración parecen ser mediados principalmente por el 2-AG27. Los cambios sinápticos de corta duración duran pocos minutos, pero modifican la transmisión sináptica y pueden subyacer a cambios agudos hedónicos y motores causados por las drogas. Por ejemplo, el alcohol bloquea los fenómenos de DLL inducidos por eCB en el estriado dorsal, lo que se relaciona con la anormal respuesta motora28. El alcohol altera el delicado balance excitación-inhibición en el estriado, mediado por eCB28. Los fenómenos de DSI y DSE se alteran por las drogas en numerosas regiones relacionadas con la adicción, como el ATV, amígdala, estriado, hipocampo y neocorteza29-32.
Endocannabinoides y neuroplasticidad perdurableLos eCB participan en fenómenos de plasticidad perdurable, más duradera y estable en el engrama cerebral, como son la potenciación perdurable (LTP, en inglés, long term potentiation) y la depresión perdurable (LTD, en inglés, long term depression). La LTP y LTD son importantes para el establecimiento de la memoria y el aprendizaje, y las drogas modifican la neurofisiología normal de dichos procesos facilitando la consolidación de la adicción.
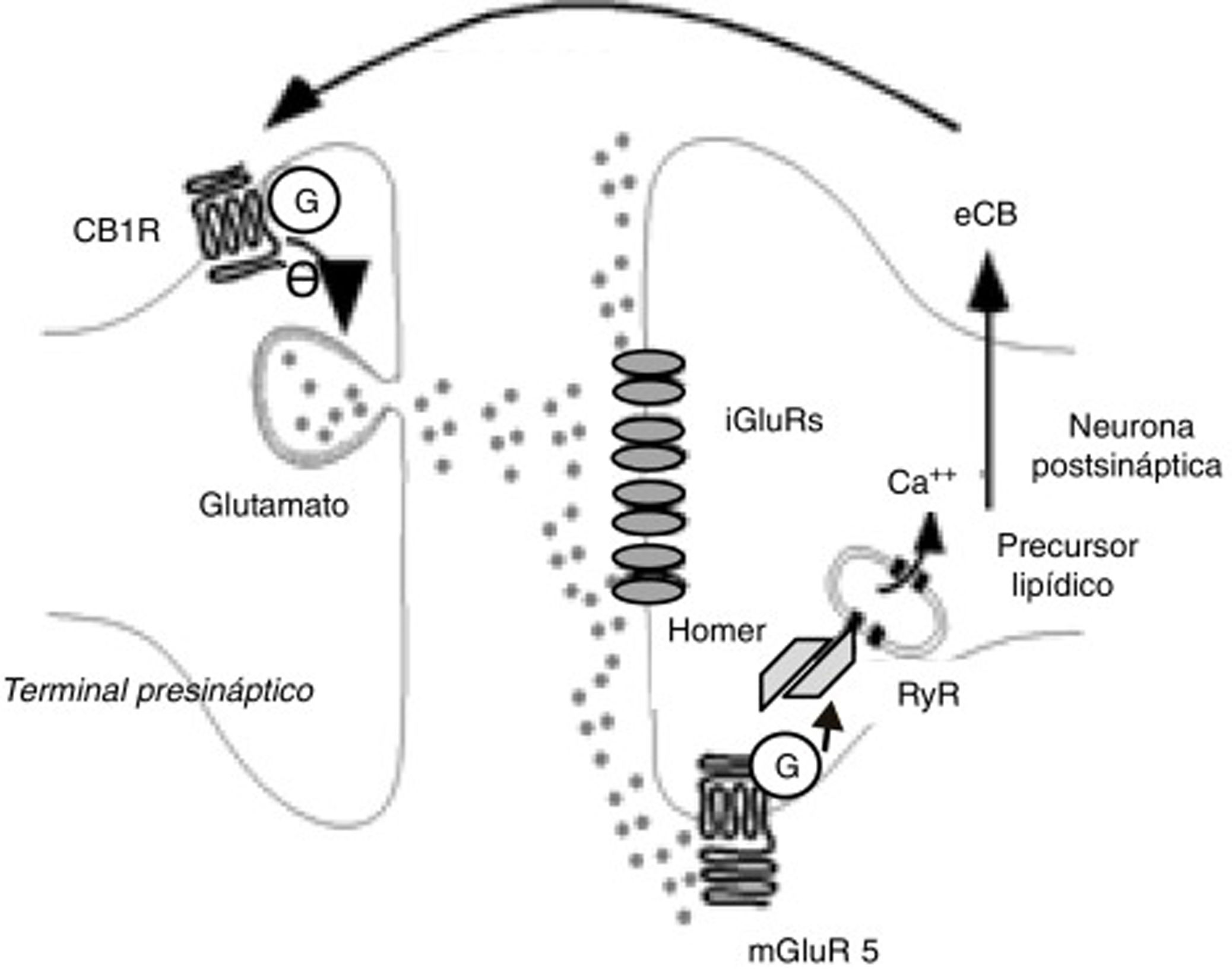
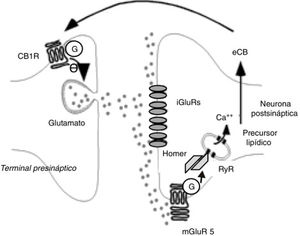
Los eCB participan principalmente en fenómenos de LTD. La LTD mediada por eCB tiene lugar tras un incremento transitorio de glutamato, que origina un aumento de la producción postsináptica de eCB que, a su vez, disminuye de modo prolongado la liberación de glutamato, como se observa en la figura 333. Este fenómeno se ha detectado en diversas estructuras relacionadas con la adicción, como el núcleo accumbens, estriado dorsal, corteza prefrontal, amígdala, hipocampo y ATV. El eCB mediador principal de LTD es la AEA34, pero en el hipocampo parece ser el 2-AG35. Drogas como el δ9-THC o la cocaína anulan la LTD inducida por eCB en el núcleo accumbens, al menos en modelos animales36,37. El alcohol también bloquea los fenómenos de LTD inducidos por eCB, en este caso en el estriado dorsal28. Las anfetaminas bloquean la LTD en la amígdala por medio de su acción endocannabinoide38.
Fenómenos bioquímicos que suceden durante la depresión perdurable o LTD mediada por endocannabinoides. La liberación de glutamato activa receptores ionotrópicos y metabotrópicos de tipo 5 de glutamato postsinápticos. Estos últimos inducen la producción de endocannabinoides a través de proteínas Homer y receptores de rianodina de las vesículas y retículo citoplásmico que almacenan calcio. Los endocannabinoides son liberados al espacio sináptico y actúan sobre receptores CB1 unidos a proteínas G de las terminales de glutamato. Ello induce una menor liberación de glutamato presináptico.
Ca++: calcio; CB1R: receptor CB1; eCB: endocannabinoide; G: proteína G; iGluR: receptores ionotrópicos de glutamato; mGluR5: receptores metabotrópicos de tipo 5 de glutamato; RyR: receptores de rianodina.
Otro fenómeno de plasticidad importante causado por las drogas es el hipofrontalismo. Así, en la corteza prefrontal hay que destacar la interacción entre dopamina (a través de receptores D2), los eCB, y diversas drogas de abuso que pueden originar hipoactividad dopaminérgica prefrontal39. Esta hipoactividad prefrontal de dopamina adquiere cada vez más importancia en el desarrollo de la adicción y es el fundamento del hipofrontalismo40. Cada vez hay más datos de que las áreas frontales, sobre todo en la zona prefrontal, preparan al sujeto para una adecuada respuesta al estrés agudo y la resiliencia al futuro estrés. Los eCB son mediadores clave en la actividad frontal, y su alteración por abuso de drogas modifica profundamente la respuesta y resiliencia del sujeto al estrés41.
Otro fenómeno de plasticidad de gran relevancia en el desarrollo de la adicción es la sensibilización adictiva, aunque en estos casos el papel de los eCB no es tan destacado42. La administración aguda de numerosas drogas incrementa la liberación de dopamina en las principales áreas del circuito mesolímbico, o sea, el ATV y el núcleo accumbens. Esta liberación se refuerza con el consumo crónico de la droga, lo que se denomina sensibilización dopaminérgica2,43,44. Esto representa un hecho crucial de las drogas adictivas y diferencial respecto a reforzadores naturales (comida, bebida, actividad sexual), con los que no hay sensibilización dopaminérgica2. La sensibilización se relaciona con LTP, y se sabe que diversas drogas como psicoestimulantes, opiáceos, etanol y nicotina originan fenómenos de LTP en el ATV45-47. Sin embargo, desde el punto de vista bioquímico, la sensibilización está mediada principalmente por aumento en la transmisión de glutamato, regulación al alza de receptores NMDA y de dopamina tipo D1, así como por hiperactividad de la vía de la proteína-cinasa A y el AMPc2. Por todo ello, los eCB no juegan un papel relevante, y solo se conoce un papel claro de eCB en la sensibilización por opiáceos48. De hecho, los eCB actúan sobre receptores tipo CB1 localizados en las neuronas dopaminérgicas del ATV y median la sensibilización opiácea. La sensibilización a cocaína también se ha relacionado recientemente con los receptores CB1 y, posiblemente, con eCB49,50.
Por último, los eCB y los receptores CB1 son importantes para los fenómenos de sensibilización incentivadora, que es la potenciación con el tiempo del papel reforzador de claves de lugar asociadas al consumo de la droga, tipo de condicionamiento que es también básico en el desarrollo de la adicción por abuso de drogas. Los eCB facilitan, por ejemplo, la asociación conductual a claves de lugar producida por cocaína51, nicotina52 y alcohol53.
ConclusionesEl abuso de drogas origina una disrupción en la plasticidad sináptica de los circuitos cerebrales involucrados en el desarrollo de la adicción y en ello juega un destacado papel la alteración de la normal actividad endocannabinoide. La alteración endocannabinoide facilita los cambios anómalos cerebrales y el desarrollo de conductas adictivas que caracterizan a los TCD. Sin duda, el correcto conocimiento de todos estos fenómenos facilitará el desarrollo de terapéuticas basadas en la modulación de los eCB cerebrales, con el fin de paliar los devastadores efectos de los trastornos por consumo de drogas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece la ayuda científica del doctor Fernando Rodríguez de Fonseca (IMABIS, Hospital Regional Universitario de Málaga). El trabajo se enmarca dentro de los estudios de la Red de Trastornos Adictivos (Subprograma RETICS, RD16/0001/0017, Instituto Carlos III).