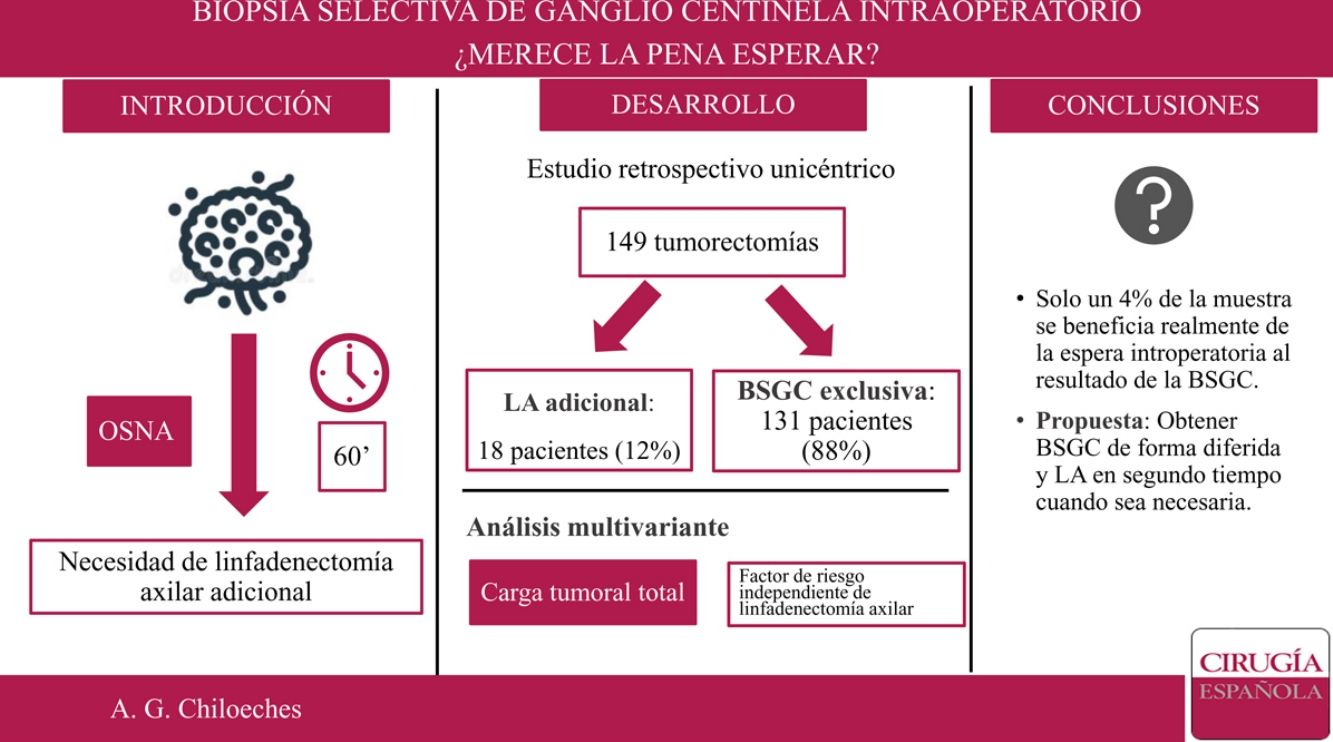
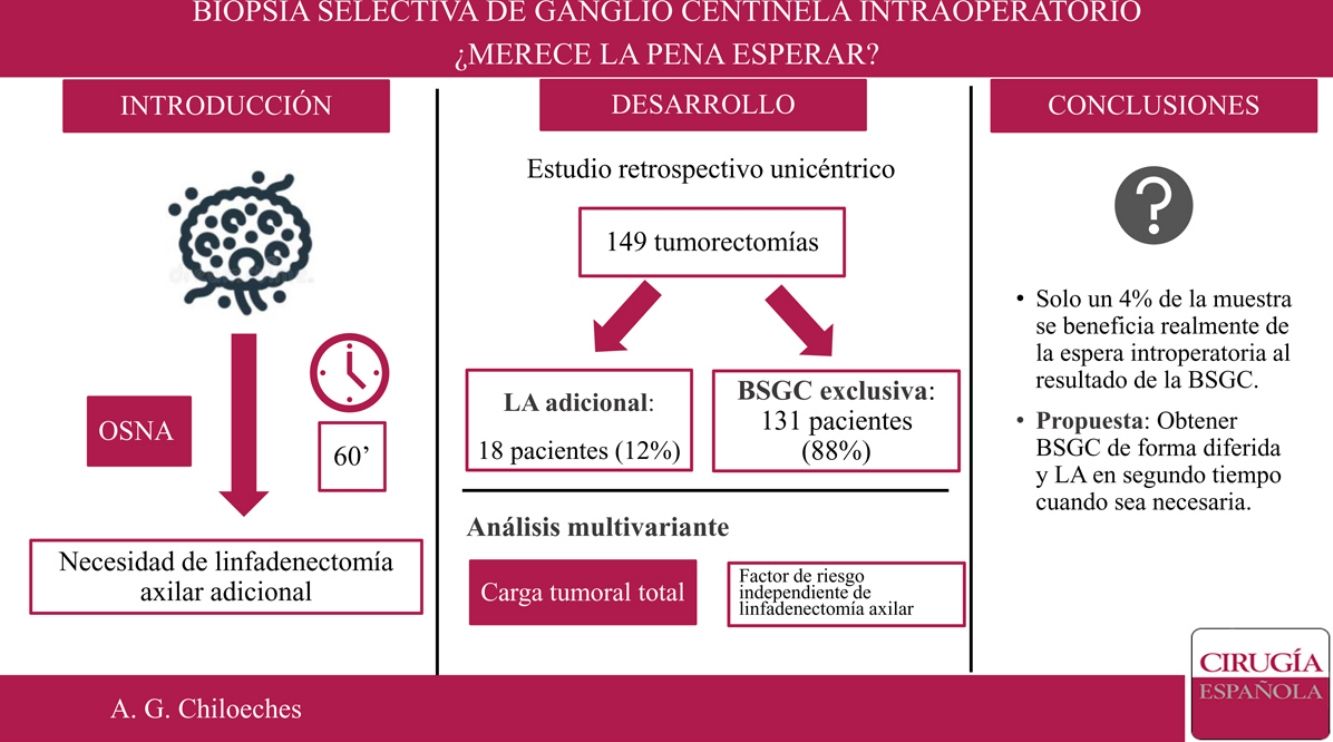
En nuestro centro, el estudio de la biopsia selectiva del ganglio centinela (BSGC) se realiza de forma intraoperatoria. El objetivo principal del presente trabajo es conocer qué proporción de pacientes se beneficia de la espera intraoperatoria al resultado de la BSGC.
Material y métodosSe ha realizado un análisis retrospectivo de pacientes intervenidas en nuestro centro entre el 1 de enero de 2018 y el 30 de junio de 2019. Se incluyeron mujeres con tumores T1-T2, tratadas mediante tumorectomía y BSGC estudiado mediante método one-step nucleic acid amplification (OSNA).
ResultadosSe incluyeron 149 mujeres en el estudio. No se encontraron diferencias estadísticamente significativas en cuestión de datos demográficos entre el grupo tratado mediante linfadenectomía axilar (LA) y el grupo tratado exclusivamente con BSGC. Se realizaron 18 LA tras el análisis del GC estudiado de forma intraoperatoria. Solo en seis de los casos se extrajeron tres o más GC. La localización por cuadrante de la lesión, permeación linfovascular y carga tumoral total muestran diferencias estadísticamente significativas entre los grupos. En el análisis multivariante, únicamente la carga tumoral total (TTL) se establece como variable independiente de necesidad de LA.
ConclusionesLa obtención del resultado de la BSGC de forma diferida permite disminuir el tiempo de anestesia de las pacientes y tiempo de ocupación de quirófano, ya que en el momento actual no se realiza ningún procedimiento adicional en un elevado porcentaje de casos.
In our institution, the study of selective sentinel node biopsy (SLNB) is performed intraoperatively. The main objective of our study is to know the proportion of patients who benefits from the waiting of the results of SLNB.
MethodsA retrospective analysis of patients operated on our center between January 1 st, 2018 and June 30, 2019 was carried out. We included women diagnosed with T1–T2 tumors, treated by lumpectomy and SLNB studied using OSNA method.
ResultsOur study included 149 women. There were not statistically significant differences in terms of demographic data between the group treated with axillary lymph node dissection (ALND) and exclusively SLNB group. After analysis of SLN intraoperatively, there were performed 18 axillary lymphadenectomies. Only in six of these 18 cases, three or more sentinel nodes were founded. The location of the tumor, the presence of lymphovascular permeation and the total tumor load (TTL) showed statistically significant differences between groups. Only the TTL was established as the independent factor of the need for ALND.
ConclusionsObtaining a deferred result of the SLNB allowed reducing the time of anesthesia and occupation of the operating room, since in a high percentage of cases an additional procedure is not performed.
La biopsia selectiva del ganglio centinela (BSGC) es el método de estadificación ganglionar óptimo en pacientes con cáncer de mama en estadio precoz y axila clínicamente negativa1–3 permitiendo evitar la morbilidad de la linfadenectomía axilar (LA)4. El primer ensayo clínico randomizado validando la técnica se publicó en 20034.
Desde entonces, numerosos estudios prospectivos randomizados demuestran que la LA no es necesaria en aquellas mujeres con ganglio centinela (GC) libre de enfermedad4–6. Los resultados de los estudios ACOSOG Z0011 e IBCSG 23-01 demostraron que la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG) de la BSGC es no inferior a la LA en mujeres con cáncer de mama diagnosticado en estadios iniciales y hasta dos ganglios centinelas metástasicos7–9.
Estas recomendaciones se encuentran adaptadas en las últimas guías de práctica clínica del tratamiento del cáncer de mama en estadio precoz1–3. En ellas se establece que no es necesaria la realización de LA en aquellas pacientes con diagnóstico precoz de cáncer de mama, tratadas con cirugía conservadora y BSGC, con uno o dos ganglios positivos que vayan a recibir radioterapia posterior. Un aspecto importante a tener en cuenta es que las recomendaciones de tratamiento se basan en criterios histológicos y no moleculares, si bien es cierto que actualmente, con el aumento de comprensión del cáncer de mama, la confianza en el estado de los ganglios linfáticos como factor determinante de estrategias terapéuticas adyuvantes está disminuyendo.
Existen dos métodos de estudio del GC. El método citohistológico que estudia el GC de forma microscópica10 y el método OSNA que analiza el número de copias de ARN mensajero de la citoqueratina 19 (CK 19). La carga tumoral total (TTL) se define como la suma de número de copias de este marcador. Peg et al. establecieron en 2013 que la TTL es un predictor independiente de ganglios no centinelas positivos en la LA. En su estudio objetivaron que una TTL por encima de 15.000 copias traducía una posibilidad de encontrar ganglios positivos en la LA más allá de los GC del 41%. Por el contrario, por debajo de 15.000 copias este porcentaje se reducía al 14,7%11. Existen estudios que evidencian que OSNA tiene una mayor sensibilidad para detectar más casos de micrometástasis12. Esto puede conllevar un aumento de disecciones axilares completas y, en consecuencia, un aumento de morbilidad de las pacientes sin que esto suponga necesariamente un aumento de la SLE y la SG.
ObjetivoEl objetivo principal de este estudio es conocer qué proporción de pacientes realmente se benefician de la espera intraoperatoria del resultado de la BSGC. El objetivo secundario es establecer un modelo predictor que indique qué pacientes van a requerir la realización de una LA adicional.
Material y métodosEste artículo sigue las recomendaciones Strengthening the reporting of observactional studies in epidemiology (STROBE) para estudios observacionales.
Diseño del estudioEstudio observacional retrospectivo unicéntrico.
ParticipantesSe incluyeron todas las pacientes mujeres diagnosticadas de cáncer de mama con axila clínicamente negativa, que fueron intervenidas mediante cirugía conservadora de la mama y BSGC (analizada mediante OSNA) en nuestro servicio entre el 1 de enero de 2018 y el 30 de junio de 2019. Todas las pacientes eran mayores de 18 años.
Se excluyeron a las pacientes tratadas mediante mastectomía, aquellas que habían recibido tratamiento neoadyuvante y aquellas con estudio del GC mediante histología o impronta.
VariablesSe extrajeron los datos mediante la revisión de la historia clínica electrónica.
Las variables preoperatorias fueron: edad, antecedentes personales o familiares de cáncer de mama, hipertensión, dislipemia y diabetes mellitus, tabaquismo, síntomas al diagnóstico, lateralidad de la mama afecta, localización por cuadrante, BIRADS y tamaño en milímetros en función de ecografía y/o RMN.
Los datos operatorios fueron: número de GC localizados en la cirugía, carga tumoral total intraoperatoria y realización o no de LA.
Se recogieron las siguientes variables en cuanto a la anatomía patológica de la lesión: tipo de carcinoma, perfil inmunohistoquímico, grado, presencia de invasión perineural o permeación linfovascular. En referencia a la LA se analizaron las siguientes variables: número de ganglios no centinelas, número de ganglios totales en la linfadenectomía y número de ganglios positivos en la linfadenectomía.
Análisis estadísticoLas variables categóricas fueron descritas como valor absoluto y porcentaje. Las variables cuantitativas fueron descritas con la media y la distribución estándar (SD) en caso de distribución normal, y con mediana y rango intercuartílico (IQR) si seguían una distribución no normal. Se comprobó la normalidad de las variables cuantitativas mediante el test de Shapiro-Wilks. Para el contraste de hipótesis, se empleó el test χ2 en las variables categóricas, la t de Student en las variables cuantitativas de distribución normal y la U de Mann Whitney en las variables cuantitativas de distribución no normal.
Para evaluar los factores de riesgo de realización de LA, se empleó un modelo de regresión logística multivariante, incluyendo inicialmente aquellas variables que habían mostrado relación significativa con la variable de interés.
La significación estadística se situó en < 0,05. Se utilizó el SPSS Statistics 23 (IMB Corp., Armonk NY, E.E. U.U.).
Criterios de linfadenectomíaEn nuestro centro, el protocolo de actuación en el quirófano consistía en la extirpación del GC (o de los GC) y posterior análisis intraoperatorio mediante OSNA. En caso de presentar una TTL superior a 15.000 copias (sumatoria de número de copias de todos los GC), se completaba la cirugía con LA. En caso de TTL inferior a 15.000 copias, no se llevaba a cabo LA.
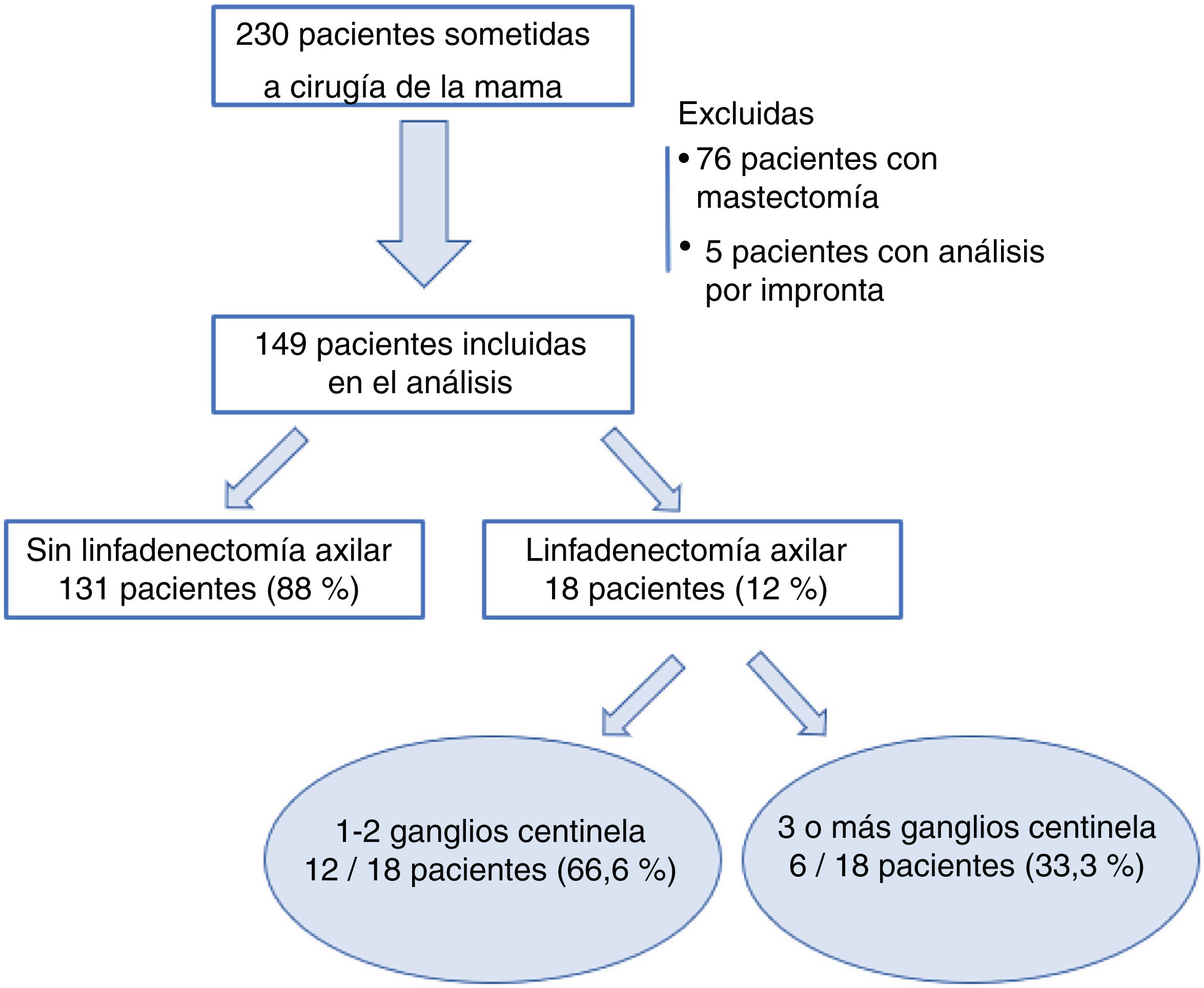
ResultadosDesde el 1 de enero de 2018 al 30 de junio de 2019, 230 pacientes fueron sometidas en nuestro centro a cirugía de la mama sin tratamiento neoadyuvante previo. Se excluyeron 76 pacientes sometidas a mastectomía y cinco casos de estudio del GC por impronta. Finalmente, 149 pacientes fueron incluidas en el análisis. De ellas, en 18 casos (18/149; 12%) se realizó una LA tras el análisis del GC de forma intraoperatoria, y solo en seis de los casos se extrajeron tres o más ganglios centinela (6/149; 4%) (fig. 1).
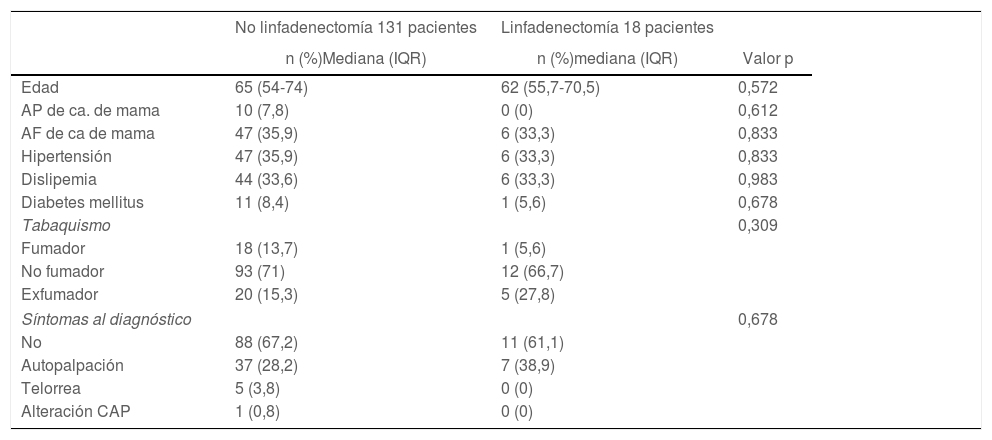
Datos preoperatoriosNo se encontraron diferencias entre los grupos sometidos a LA y no sometidos a LA en cuestión de edad, antecedentes familiares o personales de cáncer de mama, hábito tabáquico, factores de riesgo cardiovascular habituales o síntomas al diagnóstico (tabla 1).
Características basales de las pacientes
| No linfadenectomía 131 pacientes | Linfadenectomía 18 pacientes | ||
|---|---|---|---|
| n (%)Mediana (IQR) | n (%)mediana (IQR) | Valor p | |
| Edad | 65 (54-74) | 62 (55,7-70,5) | 0,572 |
| AP de ca. de mama | 10 (7,8) | 0 (0) | 0,612 |
| AF de ca de mama | 47 (35,9) | 6 (33,3) | 0,833 |
| Hipertensión | 47 (35,9) | 6 (33,3) | 0,833 |
| Dislipemia | 44 (33,6) | 6 (33,3) | 0,983 |
| Diabetes mellitus | 11 (8,4) | 1 (5,6) | 0,678 |
| Tabaquismo | 0,309 | ||
| Fumador | 18 (13,7) | 1 (5,6) | |
| No fumador | 93 (71) | 12 (66,7) | |
| Exfumador | 20 (15,3) | 5 (27,8) | |
| Síntomas al diagnóstico | 0,678 | ||
| No | 88 (67,2) | 11 (61,1) | |
| Autopalpación | 37 (28,2) | 7 (38,9) | |
| Telorrea | 5 (3,8) | 0 (0) | |
| Alteración CAP | 1 (0,8) | 0 (0) | |
Ca.: cáncer; AP: antecedentes personales; AF: antecedentes familiares; CAP: complejo areola-pezón; IQR: rango intercuartílico.
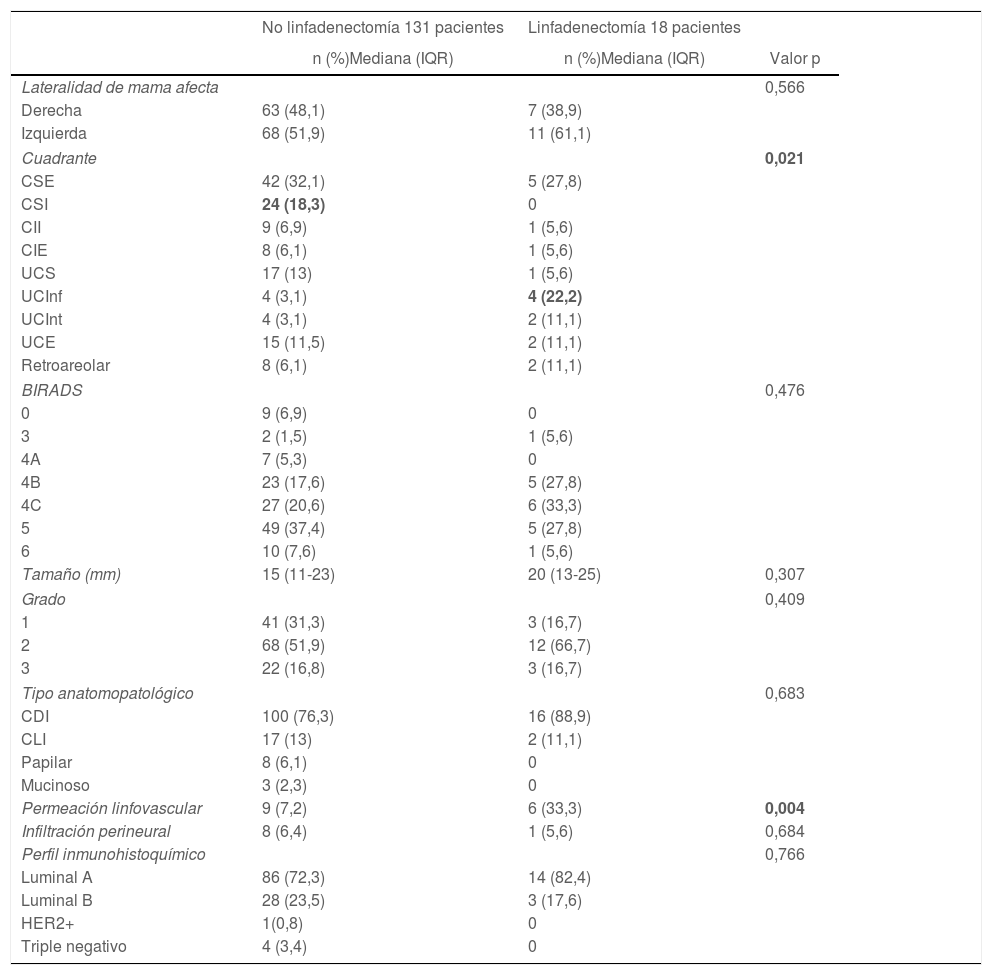
En relación con las características basales de la lesión mamaria, no se encontraron diferencias en el BIRADS o tamaño de la lesión. En cuanto a la localización por cuadrante de la lesión, hubo un mayor número de linfadenectomías en aquellas pacientes con una lesión localizada en unión de cuadrantes inferiores (3 vs. 22%; p = 0,021), con diferencias estadísticamente significativas. En relación con las características anatomopatológicas de la biopsia preoperatoria, no se encontraron diferencias estadísticamente significativas en cuestión de tipo de carcinoma o características inmunohistoquímicas, aunque sí resultó estadísticamente significativa la presencia de permeación linfovascular en las pacientes que fueron sometidas a linfadenectomía (7 vs. 33%; p = 0,004) (tabla 2).
Características basales de la lesión mamaria
| No linfadenectomía 131 pacientes | Linfadenectomía 18 pacientes | ||
|---|---|---|---|
| n (%)Mediana (IQR) | n (%)Mediana (IQR) | Valor p | |
| Lateralidad de mama afecta | 0,566 | ||
| Derecha | 63 (48,1) | 7 (38,9) | |
| Izquierda | 68 (51,9) | 11 (61,1) | |
| Cuadrante | 0,021 | ||
| CSE | 42 (32,1) | 5 (27,8) | |
| CSI | 24 (18,3) | 0 | |
| CII | 9 (6,9) | 1 (5,6) | |
| CIE | 8 (6,1) | 1 (5,6) | |
| UCS | 17 (13) | 1 (5,6) | |
| UCInf | 4 (3,1) | 4 (22,2) | |
| UCInt | 4 (3,1) | 2 (11,1) | |
| UCE | 15 (11,5) | 2 (11,1) | |
| Retroareolar | 8 (6,1) | 2 (11,1) | |
| BIRADS | 0,476 | ||
| 0 | 9 (6,9) | 0 | |
| 3 | 2 (1,5) | 1 (5,6) | |
| 4A | 7 (5,3) | 0 | |
| 4B | 23 (17,6) | 5 (27,8) | |
| 4C | 27 (20,6) | 6 (33,3) | |
| 5 | 49 (37,4) | 5 (27,8) | |
| 6 | 10 (7,6) | 1 (5,6) | |
| Tamaño (mm) | 15 (11-23) | 20 (13-25) | 0,307 |
| Grado | 0,409 | ||
| 1 | 41 (31,3) | 3 (16,7) | |
| 2 | 68 (51,9) | 12 (66,7) | |
| 3 | 22 (16,8) | 3 (16,7) | |
| Tipo anatomopatológico | 0,683 | ||
| CDI | 100 (76,3) | 16 (88,9) | |
| CLI | 17 (13) | 2 (11,1) | |
| Papilar | 8 (6,1) | 0 | |
| Mucinoso | 3 (2,3) | 0 | |
| Permeación linfovascular | 9 (7,2) | 6 (33,3) | 0,004 |
| Infiltración perineural | 8 (6,4) | 1 (5,6) | 0,684 |
| Perfil inmunohistoquímico | 0,766 | ||
| Luminal A | 86 (72,3) | 14 (82,4) | |
| Luminal B | 28 (23,5) | 3 (17,6) | |
| HER2+ | 1(0,8) | 0 | |
| Triple negativo | 4 (3,4) | 0 | |
CSE: cuadrante superoexterno; CSI: cuadrante superointero; CII: cuadrante inferointerno; CIE: cuadrante inferoexterno; UCS: unión cuadrantes superiores; UCInf: unión cuadrantes inferiores; UCInt: unión cuadrantes internos; UCE: unión de cuadrantes externos; CDI: carcinoma ductal infiltrante; CLI: carcinoma lobulillar infiltrante.
En negrita: valores estadísticamente significativos.
Los datos quirúrgicos se recogen en la tabla 3. No se encontraron diferencias estadísticamente significativas entre grupos en el número de ganglios centinelas localizados de forma intraoperatoria durante la intervención quirúrgica (mediana: 2 [IQR: 1-2]). En todas las pacientes intervenidas se llevó a cabo el análisis del ganglio centinela de forma intraoperatoria mediante OSNA, con una TTL superior en el grupo en el que se llevó a cabo la LA con 73.330 copias (IQR: 18.525-497.500) frente a una mediana de 0 en el grupo que no requirió linfadenectomía (p = 0,000).
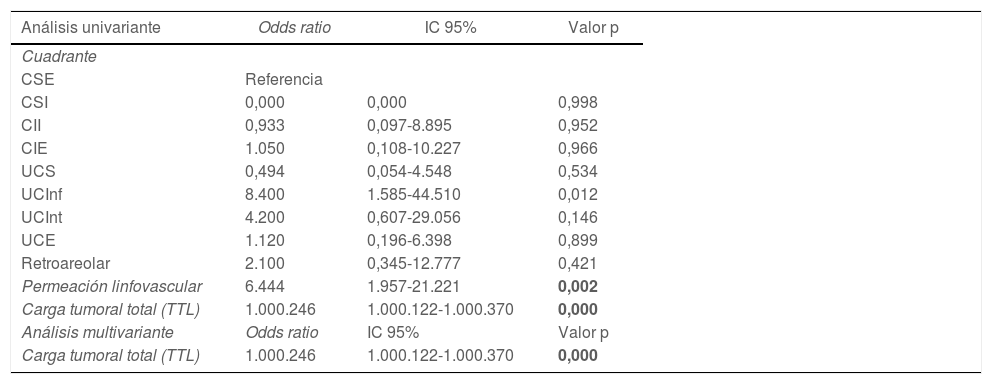
Se realizó un análisis univariante con las variables que demostraron diferencias significativas entre los grupos: localización por cuadrante de la lesión, permeación linfovascular y carga tumoral total (tabla 4). Una vez introducidas estas tres variables en el análisis multivariante, solamente la carga tumoral total demostró ser un factor predictor de la necesidad de linfadenectomía (odds ratio: 1.000.246; intervalo de confianza [IC] 95%: 1.000.122-1.000.370; p = 0,000).
Análisis univariante y análisis multivariante
| Análisis univariante | Odds ratio | IC 95% | Valor p |
|---|---|---|---|
| Cuadrante | |||
| CSE | Referencia | ||
| CSI | 0,000 | 0,000 | 0,998 |
| CII | 0,933 | 0,097-8.895 | 0,952 |
| CIE | 1.050 | 0,108-10.227 | 0,966 |
| UCS | 0,494 | 0,054-4.548 | 0,534 |
| UCInf | 8.400 | 1.585-44.510 | 0,012 |
| UCInt | 4.200 | 0,607-29.056 | 0,146 |
| UCE | 1.120 | 0,196-6.398 | 0,899 |
| Retroareolar | 2.100 | 0,345-12.777 | 0,421 |
| Permeación linfovascular | 6.444 | 1.957-21.221 | 0,002 |
| Carga tumoral total (TTL) | 1.000.246 | 1.000.122-1.000.370 | 0,000 |
| Análisis multivariante | Odds ratio | IC 95% | Valor p |
| Carga tumoral total (TTL) | 1.000.246 | 1.000.122-1.000.370 | 0,000 |
CSE: cuadrante superoexterno; CSI: cuadrante superointero; CII: cuadrante inferointerno; CIE: cuadrante inferoexterno; UCS: unión cuadrantes superiores; UCInf: unión cuadrantes inferiores; UCInt: unión cuadrantes internos; UCE: unión de cuadrantes externos.
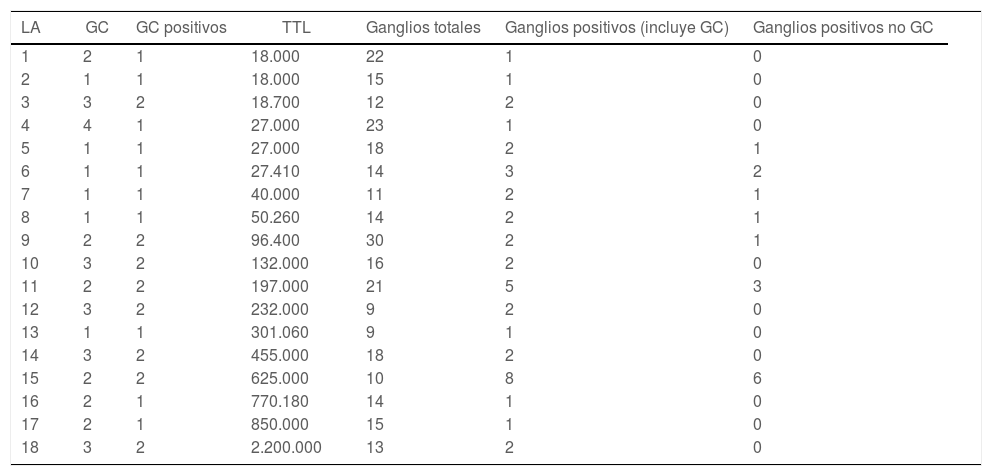
Si analizamos las 18 LA realizadas, la mediana de ganglios extraídos fue de 1511–18. La mediana de ganglios positivos fue 2 (1-2), mientras que la mediana de ganglios positivos no GC fue 0 (0-1). En 12 de las 18 linfadenectomías realizadas (67%) no se encontraron más ganglios positivos aparte de los GC. Ni la TTL ni el número de copias por cada GC positivo parece relacionarse con el número total de ganglios positivos en la linfadenectomía (tabla 5).
Análisis de linfadenectomías realizadas
| LA | GC | GC positivos | TTL | Ganglios totales | Ganglios positivos (incluye GC) | Ganglios positivos no GC |
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 18.000 | 22 | 1 | 0 |
| 2 | 1 | 1 | 18.000 | 15 | 1 | 0 |
| 3 | 3 | 2 | 18.700 | 12 | 2 | 0 |
| 4 | 4 | 1 | 27.000 | 23 | 1 | 0 |
| 5 | 1 | 1 | 27.000 | 18 | 2 | 1 |
| 6 | 1 | 1 | 27.410 | 14 | 3 | 2 |
| 7 | 1 | 1 | 40.000 | 11 | 2 | 1 |
| 8 | 1 | 1 | 50.260 | 14 | 2 | 1 |
| 9 | 2 | 2 | 96.400 | 30 | 2 | 1 |
| 10 | 3 | 2 | 132.000 | 16 | 2 | 0 |
| 11 | 2 | 2 | 197.000 | 21 | 5 | 3 |
| 12 | 3 | 2 | 232.000 | 9 | 2 | 0 |
| 13 | 1 | 1 | 301.060 | 9 | 1 | 0 |
| 14 | 3 | 2 | 455.000 | 18 | 2 | 0 |
| 15 | 2 | 2 | 625.000 | 10 | 8 | 6 |
| 16 | 2 | 1 | 770.180 | 14 | 1 | 0 |
| 17 | 2 | 1 | 850.000 | 15 | 1 | 0 |
| 18 | 3 | 2 | 2.200.000 | 13 | 2 | 0 |
LA: linfadenectomía axilar; GC: ganglio centinela; TTL: carga tumoral total.
En la actualidad, el cáncer de mama es diagnosticado de forma precoz gracias a la realización generalizada de screening mediante mamografía, reduciendo la incidencia de una enfermedad axilar extensa13. Desde los inicios de la BSGC se ha reducido el porcentaje de pacientes con GC positivo, desde el 35,5% evidenciado por Veronesi et al. en 20034 hasta un 23,3% en el estudio de Gupta en 202014.
Por otra parte, el GC es el único ganglio afecto en un 40 a 60% de las pacientes con axila clínicamente negativa15. Serían de nuevo Giuliano et al. los primeros en establecer que la BSGC en pacientes con GC positivo era no inferior a la LA. En el estudio ACOSOG Z0011 se expuso que no existían diferencias en términos de recurrencia locorregional, SLE y SG entre las pacientes con LA y las pacientes con extirpación de hasta tres ganglios axilares7,8. Galimberti et al. corroboraron estos resultados con un nuevo estudio de no inferioridad, multicéntrico y randomizado, en el que se establecía que la BSGC era una alternativa a la LA en las pacientes con cáncer de mama de diagnóstico precoz y GC afecto con escasa carga tumoral9. La radioterapia también juega un papel en el control de la enfermedad axilar gracias a los resultados del estudio AMAROS16. Este estudio demostró que en pacientes con tumores de pequeño tamaño (T1-T2), axila clínicamente negativa y BSGC positiva, la radioterapia axilar tras BSGC presentaba un control de la enfermedad equiparable a la LA, con menor incidencia de linfedema. Estos avances forman la base de las guías de práctica clínica actuales1–3 y han permitido una disminución de las LA realizadas y su morbilidad asociada17.
De este modo, la LA presenta unas indicaciones cada vez más reducidas. En nuestro estudio, solo se realizó LA en un 12% de la muestra (18 de 149 pacientes). Si aplicáramos los criterios establecidos por Giuliano7, este porcentaje sería incluso menor, pues solo en 6 de los 18 casos se encontraron tres o más GC durante la cirugía. Sería este 4% de la muestra el que realmente se beneficiaría de la espera intraoperatoria al resultado del GC, lo que corresponde a un número necesario de pacientes a tratar (NNT) de 25. Es importante tener en cuenta que con los avances técnicos y el conocimiento actual, el estado de los ganglios es cada vez menos determinante para las terapias sistémicas adyuvantes. La información biológica como los estrógenos, progesterona y receptores de HER2, así como el índice de proliferación Ki67 está influyendo cada vez más en la toma de decisiones. Además, no debemos olvidar la importante morbilidad y el impacto emocional que conlleva una disección axilar completa en las pacientes con cáncer de mama18.
En nuestra institución, la obtención del resultado del GC intraoperatorio supone una espera aproximada de 40 min, tiempo durante el cual se mantiene a la paciente bajo anestesia general. El circuito para la revisión de la pieza de tumorectomía mediante estudio radiológico y anatomopatológico es habitualmente mucho más reducido, de unos 15 min, por lo que la espera suele depender del resultado del GC. En nuestro estudio, con 149 pacientes intervenidas, se han realizado 131 estudios de GC por OSNA intraoperatorios, que no han llevado a la realización de una LA posterior. Se considera que el aprovechamiento óptimo de una jornada quirúrgica es del 80%, lo que corresponde a cinco horas y media en una jornada habitual de siete horas. La realización de 131 estudios de GC por OSNA intraoperatorio corresponde aproximadamente 87 h de ocupación de quirófano en espera de resultados, lo que corresponde a aproximadamente 15 jornadas quirúrgicas.
Por ello, consideramos más útil la obtención del resultado de forma diferida. La eliminación del tiempo de espera a los resultados del GC de forma intraoperatoria disminuye el tiempo en el que las pacientes se ven sometidas a una anestesia general tras la cual, en la mayoría de los casos, no se realiza un procedimiento adicional. Además, permite el aprovechamiento de este tiempo para la programación de un mayor número de pacientes por jornada de trabajo. Por otro lado, se permite plantear el caso en comité multidisciplinar para tomar una decisión conjunta sobre la necesidad individualizada de la realización de LA en un segundo tiempo, disminuyendo el número de LA innecesarias y la morbilidad global de las pacientes.
En relación con el objetivo secundario planteado por el estudio, únicamente la carga tumoral total se muestra como factor predictor independiente de necesidad de LA tras BSGC. Esto coincide con los resultados publicados por Peg et al. en el año 201311. Este equipo estableció que la TTL por OSNA era una herramienta útil y estandarizada para predecir el estado de los ganglios axilares, independientemente del número de GC presentes. Además, permitió establecer un punto de corte en 15.000 copias, a partir del cual, el número de ganglios axilares afectos aumentaba en un porcentaje importante, y por tanto, era recomendable realizar LA.
Uno de los puntos fuertes de este estudio es que no existió pérdida de pacientes en el seguimiento. Dado que la evaluación del GC se realizó de forma intraoperatoria y la decisión de realización de LA se tomó en ese mismo momento, se evitó así un posible sesgo de atrición.
Entre las limitaciones encontramos que los resultados no son aplicables a pacientes que hayan recibido neoadyuvancia, ya que en estos casos cualquier TTL es indicación de realización de LA. Además, no se han encontrado otras variables que puedan servir de modelo predictor de LA más allá de la TTL. Otra de las limitaciones encontradas en nuestro estudio es que se analiza un corto periodo de tiempo y no la evolución a medio y largo plazo de las pacientes. Este proyecto podría ser el punto de inicio para plantear nuevos estudios que analicen nuestros resultados a mediano y largo plazo, y de esta forma, plantear un proyecto de mejora continua de la calidad de nuestro servicio.
ConclusiónLa indicación de LA en cáncer de mama de diagnóstico precoz es cada día más reducida. Dado el escaso número de pacientes que precisan una LA tras la BSGC consideramos más útil el análisis del GC de forma diferida, lo que permite disminuir el tiempo de anestesia de las pacientes y optimizar el tiempo de ocupación de quirófano. En nuestro estudio, la TTL fue el único factor predictor de la necesidad de LA tras la BSGC.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.