A doença arterial periférica aterosclerótica é uma doença associada comum nos doentes com insuficiência renal crónica terminal e é caracterizada por um padrão de doença difuso, calcificado e com envolvimento preferencial das artérias infrapoplíteas. Apesar dos avanços na revascularização endovascular, esta apresenta uma eficácia limitada, com taxas de salvamento de membro reduzidas nestes doentes.
ObjetivoAvaliar o impacto da doença renal crónica terminal na doença arterial periférica e os resultados clínicos após a revascularização endovascular.
Material e métodosRealizámos uma análise retrospetiva dos doentes em diálise e que foram submetidos a revascularização endovascular, por isquemia crónica dos membros inferiores, durante o período entre janeiro de 2010 e dezembro de 2013. Os doentes foram divididos em 2 grupos: aqueles com função renal normal e com doença renal crónica em hemodiálise. Os endpoints primários foram: a taxa de salvamento de membro e mortalidade. Os endpoints secundários foram: sucesso técnico, taxa de cicatrização, tempo médio para cicatrização e complicações do procedimento.
ResultadosDe um total 217 doentes submetidos a revascularização endovascular, foram excluídos 32 doentes por ausência de dados de follow‐up e 9 doentes com doença renal crónica não terminal. Foram tratados 176 doentes (182 membros, idade média 65 anos, 78% sexo masculino). Quarenta e cinco doentes estavam a realizar hemodiálise. O follow‐up médio foi de 26,6 meses.
Nos doentes com isquemia crónica nas categorias 4, 5 e 6 de Rutherford, a taxa de salvamento de membro, aos 12 meses, foi de 90,4% nos doentes com função renal normal e 69,6% nos doentes em diálise. A sobrevida aos 12 meses foi inferior nos doentes em diálise (86 vs. 97,1%).
A taxa de cicatrização de ferida foi de 80 vs. 60% e tempo médio de cicatrização de 61 vs. 96 dias. Taxa de complicações do procedimento foi de 4,4 vs. 6,6%.
DiscussãoA presença de doença renal terminal está associada a uma maior taxa de perda de membro e a uma maior mortalidade aos 30 dias e um ano. Apesar dos resultados menos animadores, a estes doentes deve ser oferecido o tratamento endovascular, menos invasivo, e deve ser procurada uma referenciação mais precoce.
The peripheral vascular atherosclerotic disease is a characteristic complication in patients with end‐stage renal disease (ESRD) and shows a particular predilection for diffuse, calcifying and infra‐popliteal involvement. Despite the advances in endovascular revascularization, the clinical efficacy in these patients is limited and poor results are expected.
PurposeDetermine the clinical outcomes after endovascular revascularization for chronic limb ischemia in patients with ESRD on dialysis and compare the results with patients not on dialysis.
Material and methodsWe retrospectively evaluate the results of patients who underwent endovascular revascularization for chronic limb ischemia, between January 2010 and December 2013. The patients were divided into two groups: those with normal renal function and those with end stage renal disease on dialysis. The primary end points were: limb salvage and mortality and the secondary endopoints: technical success, wound healing rate, time for wound healing and complications.
ResultsOf the total of 217 patients, 32 patients were excluded due to absence of data and 9 patients with renal insuficiency but not end‐stage. 176 patients underwent endovascular revascularization (a total of 182 limbs, median age of 65 years old, 78% males). 45 patients were on dyalisis program. Median follow‐up was 26,6 months.
In patients with Rutherford categories 4, 5 and 6, the limb salvage rate, at 12 months, was 90,4% in patients not on dialysis, and 69,6% in patients on dialysis. The survival rate at 12 monts was lower in patients on dialysis (86% vs 97,1%)
The wound healing rate was also lower in patients on dialysis (60% vs 80%) and with longer median healing times (96 vs 61 days)
DiscussionThe presence of end stage renal disease is associated with a higher rate of limb loss and mortality. Despite the discouraging results, for these patients, it should be offered the less invasive endovascular revascularization treatment and an earlier referral.
Os doentes com insuficiência renal crónica (IRC) apresentam um risco mais elevado de desenvolver doença cardiovascular1 e que está associada a um pior prognóstico2. Isto deve‐se muito provavelmente à combinação de vários fatores de risco, como a diabetes, hipertensão, hiperlipidemia e tabagismo, bem como de outros fatores de risco menos tradicionais, como a uremia, inflamação e subnutrição. Contudo, a compreensão da influência destes fatores de risco no desenvolvimento da aterosclerose, assim como a sua rápida progressão nos insuficientes renais, ainda é limitada3.
A doença arterial periférica afeta cerca de 1/3 dos doentes em diálise4 e está associada a uma elevada taxa de morbilidade e mortalidade5. Comparativamente aos doentes sem insuficiência renal terminal, os doentes em diálise têm um risco aumentado de isquemia crítica e perda de membro6,7.
Está demonstrado que uma das principais causas de morte nestes doentes são as complicações que derivam da isquemia crítica8 e estes apresentam uma sobrevida muito baixa após a amputação major9. Assim, apesar da intenção em revascularizar o membro, privilegiando pelo menos um eixo arterial direto até ao pé, surge sempre a dúvida quando esta deve ser considerada. A esperança de vida inferior a 2 anos é o principal determinante para a escolha da modalidade de revascularização endovascular em detrimento da revascularização cirúrgica10. Mesmo com esta possibilidade menos invasiva, a revascularização não deve ser tentada nos doentes com lesões tróficas profundas no antepé ou calcanhar ou com infeção extensa11.
A revascularização cirúrgica é dificultada pela extensa calcificação dos vasos distais e está reportada uma baixa taxa de salvamento de membro após a revascularização com uma elevada morbilidade perioperatória12. De facto, a doença renal terminal é um fator de risco independente para amputação major após cirurgia e a presença de insuficiência renal é um preditor independente de maior mortalidade em doentes com isquemia crítica que são submetidos a revascularização12,13.
A revascularização endovascular é uma alternativa ao bypass com uma menor morbilidade e mortalidade periprocedimento associadas. É uma técnica que pode ser realizada sob anestesia local, com baixa perda sanguínea e com menor duração, comparativamente à cirurgia. Além disso, o envolvimento predominantemente distal dos vasos tíbioperoneais faz com que o tratamento endovascular seja muito atrativo para este grupo de doentes de alto risco. Habitualmente, as lesões obstrutivas infrapoplíteas tendem a ter mais de 10cm de comprimento e com atingimento das artérias de outflow do pé na maioria dos casos. Deve ser tentada a revascularização endovascular nestes casos, tendo especial atenção para recanalização das artérias tibiais que permitem a perfusão direta até ao pé, em relação à artéria peroneal que apenas dá suprimento ao pé por via de colaterais12.
Os resultados do tratamento endovascular da isquemia crónica e os dados relativos à eficácia do tratamento, permeabilidade dos vasos tratados e taxas de salvamento de membro mostram piores resultados neste subgrupo de doentes. Contudo, estes estudos apresentam amostras reduzidas e a maioria foram realizados em um único centro.
Assim, apresentamos a experiência da nossa instituição no tratamento dos doentes com isquemia crónica dos membros inferiores, e avaliámos o impacto da doença renal crónica terminal na doença arterial periférica e os resultados clínicos após a revascularização endovascular.
Material e métodosRealizamos um estudo retrospetivo dos doentes com isquemia crónica dos membros inferiores, com categoria 2 a 6 de Rutherford, e que foram submetidos a revascularização endovascular na nossa instituição, no período de 2010‐2013. Os doentes foram divididos em 2 grupos: aqueles que apresentavam função renal normal e os doentes com insuficiência renal terminal em programa de hemodiálise. Foram excluídos os doentes com alteração da função renal e que não estavam em programa de substituição renal.
Foram revistos os processos clínicos dos doentes e obtiveram‐se dados relativos a características demográficas, presença de fatores de risco, apresentação clínica da doença arterial periférica, tipo de procedimento endovascular efetuado (angioplastia com balão com ou sem stenting), artérias alvo e duração do internamento. Foram revistas todas as angiografias e a distribuição anatómica e gravidade das lesões vasculares foram classificadas segundo a classificação Trans‐Atlantic Inter‐Society Consensus (TASC II). Para as lesões do setor infrapoplíteo, e após a revisão das imagens de angiografia, foi aplicada a nova classificação TASC II para as artérias infrapoplíteas: TASC A, lesões focais únicas, <5cm de comprimento, na artéria tibial alvo com oclusão ou estenose de gravidade semelhante ou pior nas outras artérias tibiais; TASC B, múltiplas estenoses, cada uma com<5cm de comprimento ou um comprimento total<10cm ou oclusão única com<3cm, na artéria tibial alvo com oclusão ou estenose de gravidade semelhante ou pior nas outras artérias tibiais; TASC C, múltiplas estenoses na artéria tibial alvo e/ou oclusão única com comprimento>10cm com oclusão ou estenose de gravidade semelhante ou pior nas outras artérias tibiais; TASC D, múltiplas oclusões envolvendo a artéria tibial alvo com comprimento>10cm ou calcificação grave ou ausência de visualização de colaterais. Os outros vasos tibiais estão ocluídos ou apresentam calcificação extrema14.
A decisão relativamente à modalidade interventiva cirúrgica ou endovascular é baseada na apresentação clínica, condições gerais dos doentes, incluindo comorbilidades, bem como a distribuição anatómica e natureza morfológica das lesões vasculares e disponibilidade de veia autóloga. Assim, na nossa prática clínica habitual, são propostos para bypass infrainguinal os doentes com claudicação incapacitante e após falência do tratamento médico e os doentes em isquemia crítica e com Chronic Total Oclusions (CTO) e incapacidade de cruzar a lesão, em casos de reestenose e reoclusão, nas lesões muito calcificadas com elevado potencial para complicações como perfuração, embolização distal ou disseção, doentes com baixo risco cirúrgico e na presença de conduto venoso adequado (veia com>3mm em toda a sua extensão).
Relativamente a doença proximal, o tratamento cirúrgico é proposto, na maioria dos doentes, para as lesões TASC C e D, mas tendo em conta a apresentação clínica da doença e as condições do doente. Aos restantes doentes é proposta para revascularização endovascular.
O sucesso técnico da revascularização endovascular foi definido pela capacidade de cruzar a lesão e tratar os segmentos arteriais afetados com estenose residual<50% e ausência de complicações locais, como disseção, rotura ou trombose.
Durante o período de follow‐up, após o procedimento, foram pesquisadas informações relativas à cicatrização de feridas e tempo de cicatrização, amputação major (acima e abaixo do joelho) e óbitos.
Todos os dados foram analisados usando o Statistical package for the Social Sciences (SPSS), versão 17.0 (SPSS Inc., Chicago, IL, EUA). As variáveis contínuas e normalmente distribuídas são reportadas como médias+‐ desvio‐padrão e as variáveis categóricas, apresentadas como números (percentagens). As diferenças entre variáveis contínuas foram avaliadas pelo t‐test ou Mann‐Whitney test e para as variáveis categóricas o teste qui‐quadrado. A análise de sobrevida foi estimada pelo método Kaplan‐Meier e as diferenças testadas pelo teste log‐rank. O teste de regressão de Cox foi usado para identificar os fatores de risco e calcular hazard ratios (HR) com intervalos de confiança de 95%. Valor p<0,05 foi considerado estatisticamente significativo.
Descrição do procedimento endovascular:
Todos os doentes são internados na manhã do procedimento e é feita uma avaliação laboratorial geral; é realizado ecoDoppler e medição do índice de pressão sistólica dos membros inferiores. Nos doentes a realizar hemodiálise, é agendada a sessão de hemodiálise para o próprio dia, após a angiografia ou no primeiro turno da manhã seguinte.
Dependendo da idade do doente e status clínico, é feita uma investigação adicional com eletrocardiograma+‐ ecocardiograma, teleradiografia do tórax e referenciação às especialidades de cardiologia, medicina interna e pneumologia se necessário.
Foram realizados sob anestesia local e com punção da artéria femoral comum usando a técnica de Seldinger. Após colocação de uma bainha de 5‐7Fr procedia‐se a uma angiografia diagnóstica (na suspeita de lesões obstrutivas ilíacas, através do exame objetivo e ecoDoppler, inicia‐se procedimento com bainha de 7Fr). Todos os doentes eram heparinizados durante o procedimento com 70‐100U/kg. As lesões ilíacas foram tratadas via retrógrada após punção da artéria femoral comum homolateral. Para o tratamento da doença infrainguinal foi usada preferencialmente a via anterógrada após confirmação da permeabilidade da artéria femoral superficial proximal e na ausência de contraindicações anatómicas como a obesidade abdominal. Nestes casos optou‐se pela abordagem da artéria femoral comum contralateral.
Todas as lesões ilíacas foram tratadas com stenting primário e a maioria das lesões femoropoplíteas foram tratadas com angioplastia com balão e stent seletivo se necessário (estenose residual>30% ou dissecção com limitação do fluxo), e as lesões infrapoplíteas foram submetidas a angioplastia com balão simples. O tempo de insuflação para a angioplastia com balão simples é de cerca de 180 segundos.
Após o tratamento endovascular, todos os doentes recebem terapêutica antiagregante (ácido acetilsalicílico ad aeternum e clopidogrel durante 3 meses).
ResultadosDurante o período 2010‐2013 foram realizadas intervenções em 217 doentes. Foram excluídos 32 doentes por ausência de dados de follow‐up e outros 9 doentes com insuficiência renal não terminal. Do total de 176 doentes incluídos no estudo (182 membros), 45 doentes realizavam hemodiálise.
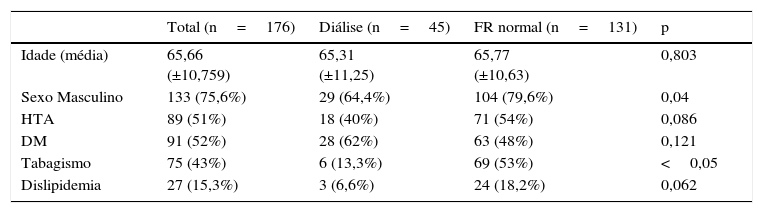
A idade média foi 65 anos e 75% dos doentes eram do sexo masculino. No grupo dos doentes em diálise, verificou‐se um maior número de doentes do sexo feminino 35,6 vs. 20,4% no grupo dos doentes com função renal normal, e um menor número de fumadores (13,3 vs. 53%). Os dados demográficos e comorbilidades estão detalhados na tabela 1.
Dados demográficos e comorbilidades
| Total (n=176) | Diálise (n=45) | FR normal (n=131) | p | |
|---|---|---|---|---|
| Idade (média) | 65,66 (±10,759) | 65,31 (±11,25) | 65,77 (±10,63) | 0,803 |
| Sexo Masculino | 133 (75,6%) | 29 (64,4%) | 104 (79,6%) | 0,04 |
| HTA | 89 (51%) | 18 (40%) | 71 (54%) | 0,086 |
| DM | 91 (52%) | 28 (62%) | 63 (48%) | 0,121 |
| Tabagismo | 75 (43%) | 6 (13,3%) | 69 (53%) | <0,05 |
| Dislipidemia | 27 (15,3%) | 3 (6,6%) | 24 (18,2%) | 0,062 |
DM: diabetes mellitus; FR: função renal; HTA: hipertensão arterial.
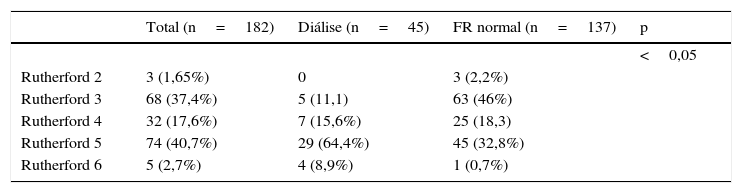
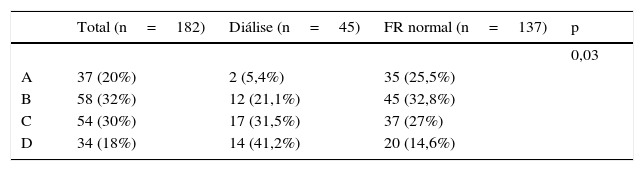
As indicações para a intervenção foi a claudicação (categoria de Rutherford 2 e 3) em 48,8% dos doentes com função renal normal e 11,1% dos doentes em hemodiálise. A lesão trófica (categoria Rutherford 5 e 6) foi a indicação em 33,5 vs. 73,3% para os doentes em hemodiálise (tabela 2). Nos doentes cuja indicação para tratamento foi a claudicação intermitente, a maioria apresentava lesões aorto‐ilíacas (82% dos doentes na categoria 2 ou 3). Nos doentes com dor em repouso, 65% apresentavam doença no setor femoropoplíteo. Em doentes com lesões tróficas (categoria 5 ou 6), 40,5% tinham doença no setor femoropoplíteo e 54,4% no setor infrapoplíteo.
Estádio clínico da isquemia crónica segundo classificação de Rutherford
| Total (n=182) | Diálise (n=45) | FR normal (n=137) | p | |
|---|---|---|---|---|
| <0,05 | ||||
| Rutherford 2 | 3 (1,65%) | 0 | 3 (2,2%) | |
| Rutherford 3 | 68 (37,4%) | 5 (11,1) | 63 (46%) | |
| Rutherford 4 | 32 (17,6%) | 7 (15,6%) | 25 (18,3) | |
| Rutherford 5 | 74 (40,7%) | 29 (64,4%) | 45 (32,8%) | |
| Rutherford 6 | 5 (2,7%) | 4 (8,9%) | 1 (0,7%) |
FR: função renal.
Relativamente à distribuição da doença, nos doentes em hemodiálise, 31,5% apresentavam lesões TASC C e 41,2% TASC D, enquanto nos doentes com função renal normal, 25% tinham lesões TACS C e 14,6% TASC D (tabela 3).
Foram tratados 2 ou mais níveis anatómicos em 55% dos doentes com função renal normal e em 86% dos doentes em hemodiálise. Nestes últimos, o envolvimento tíbioperonial estava presente em 50% dos casos. A presença de doença femoropoplítea foi mais comum nos doentes com função renal normal (26 vs. 18%), bem como o envolvimento aorto‐ilíaco (49 vs. 14%).
O sucesso técnico foi alcançado em 90,5% dos procedimentos realizados nos doentes com função renal normal e 84,4% doentes em hemodiálise (p=0,227).
A colocação de stent foi mais frequente nos doentes com função renal normal (51,1 vs. 35,6%).
Tendo em conta apenas o subgrupo de doentes com lesões tróficas, 44% dos doentes em diálise necessitaram de amputação minor e, nos doentes com função renal normal, em apenas 18% houve necessidade de cirurgia de amputação.
A taxa de cicatrização foi de 60% nos doentes em hemodiálise vs. 84% (p=0,03) e o tempo médio de cicatrização foi de 96 dias vs. 61 dias (p=0,02). O tempo de internamento também foi superior no grupo de diálise (12,98 vs. 8,76 dias).
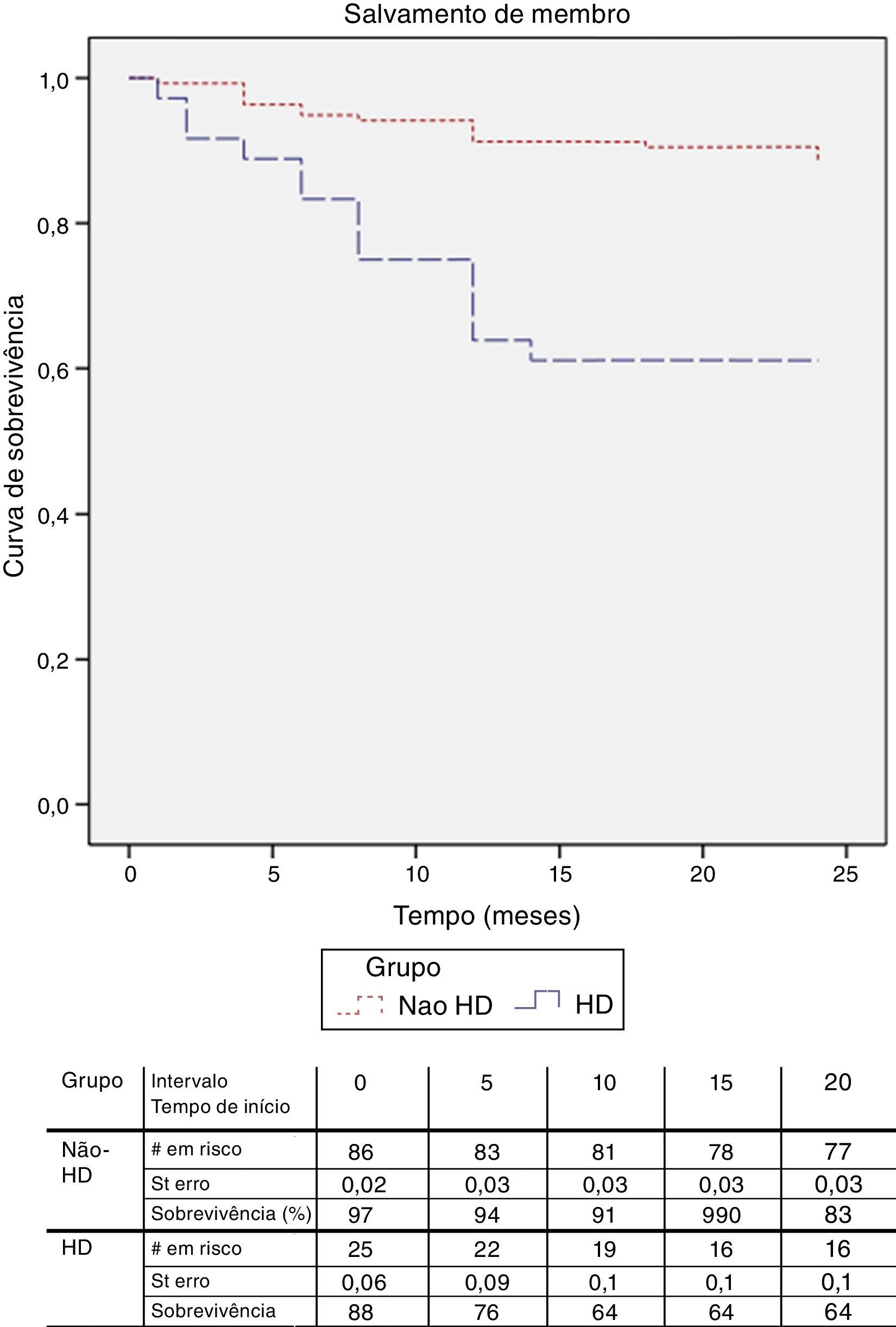
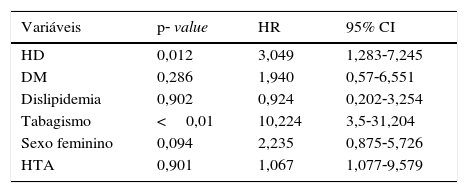
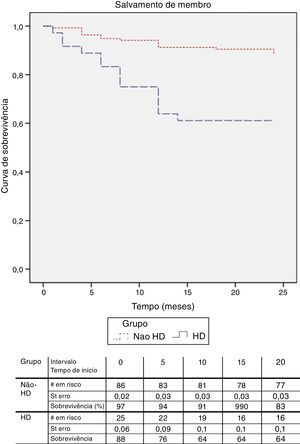
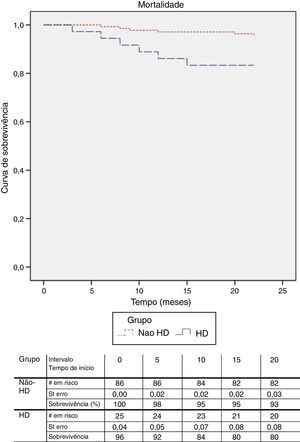
O follow‐up médio foi de 26,6 meses. Para a análise da taxa de salvamento de membro, bem como sobrevida, foram apenas considerados os doentes com isquemia crónica categoria 4, 5 e 6 de Rutherford. A taxa de salvamento de membro aos 12 meses, foi de 90,4% nos doentes com função renal normal e 69,6% no doentes em diálise, p<0,05 (fig. 1). Na análise multivariável dos fatores de risco (tabela 4) constatou‐se que a presença de insuficiência renal terminal em hemodiálise e o tabagismo são preditores independentes do risco de perda de membro.
Análise multivariável dos fatores de risco preditivos para amputação major
| Variáveis | p‐ value | HR | 95% CI |
|---|---|---|---|
| HD | 0,012 | 3,049 | 1,283‐7,245 |
| DM | 0,286 | 1,940 | 0,57‐6,551 |
| Dislipidemia | 0,902 | 0,924 | 0,202‐3,254 |
| Tabagismo | <0,01 | 10,224 | 3,5‐31,204 |
| Sexo feminino | 0,094 | 2,235 | 0,875‐5,726 |
| HTA | 0,901 | 1,067 | 1,077‐9,579 |
CI: confidence interval; DM: diabetes mellitus; HD: hemodiálise; HR: hazard‐ratio; HTA: hipertensão arterial.
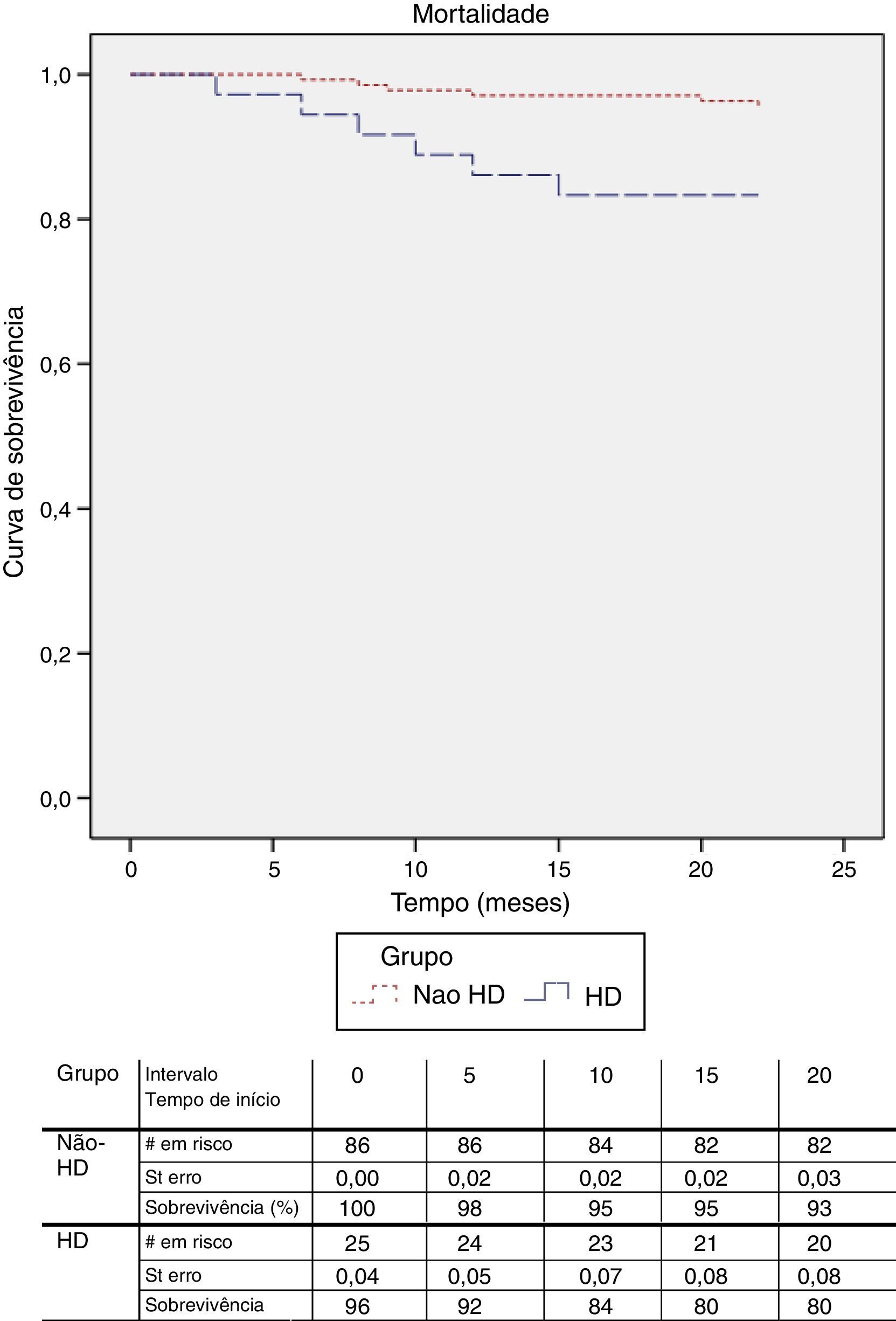
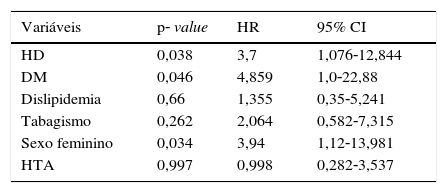
A sobrevida aos 12 meses foi superior nos doentes sem alterações da função renal (97,1 vs. 86%; p<0,05) (fig. 2). Foi realizada a análise com regressão de Cox para determinar os preditores de mortalidade e constatou‐se que, além da alteração da função renal com necessidade de hemodiálise, a diabetes mellitus e o sexo feminino são fatores de risco independentes para mortalidade (tabela 5).
Análise multivariável dos fatores de risco associados à mortalidade
| Variáveis | p‐ value | HR | 95% CI |
|---|---|---|---|
| HD | 0,038 | 3,7 | 1,076‐12,844 |
| DM | 0,046 | 4,859 | 1,0‐22,88 |
| Dislipidemia | 0,66 | 1,355 | 0,35‐5,241 |
| Tabagismo | 0,262 | 2,064 | 0,582‐7,315 |
| Sexo feminino | 0,034 | 3,94 | 1,12‐13,981 |
| HTA | 0,997 | 0,998 | 0,282‐3,537 |
CI: confidence interval; DM: diabetes mellitus; HD: hemodiálise; HR: hazard‐ratio; HTA: hipertensão arterial.
Os doentes em hemodiálise representam uma população peculiar com doença arterial periférica grave e, muitas vezes, com lesões teciduais extensas e com risco de perda de membro significativo. A presença da doença renal crónica, com necessidade de hemodiálise, tem sido identificada com um fator de risco associado a piores resultados na revascularização periférica: taxas de permeabilidade inferiores, maior taxa de perda de membro e menor sobrevida15,16,6,17,18.
Estes doentes apresentam uma doença arterial mais avançada, tanto na categoria de isquemia à entrada, bem como na distribuição anatómica da doença (p<0,05). A principal indicação para a revascularização nos doentes em diálise foi a ulceração isquémica ou gangrena, com 64,4% dos doentes em categoria 5 de Rutherford, ao invés de 32,8% dos doentes com função renal normal. Esta maior incidência de lesões tróficas nos doentes com insuficiência renal pode ser explicada através de vários mecanismos: a) alterações cutâneas com disfunção na sua estrutura de barreira e função19, causando inflamação contínua, o que pode contribuir para a ulceração local20; b) cicatrização das lesões dificultada pela condição geral do doente, como a má‐nutrição, inflamação e doença arterial periférica; c) alteração do fluxo sanguíneo cutâneo, tal como mostrado no estudo de Mistrík et al., que pode contribuir para a dificuldade de cicatrização21; d) alteração da imunidade celular, devido a diminuição na contagem de linfócitos‐T, aumentando a prevalência de infeções nesta população22.
Mas também foram incluídos doentes «selecionados» com claudicação intermitente, nomeadamente no grupo sem insuficiência renal. A maioria destes doentes apresentava sintomas incapacitantes, que não melhoraram após o tratamento médico otimizado, e com doença proximal acima do ligamento inguinal, onde os resultados são muitos favoráveis após angioplastia. Existem várias opções endovasculares para as lesões ilíacas, com a angioplastia por balão, colocação de stents autoexpansíveis ou expansíveis por balão e mesmo stents cobertos. A taxa de sucesso pós‐procedimento após a colocação de stent é superior a 95%23 e estão reportadas taxas de permeabilidade a longo prazo excelentes24.
A doença arterial periférica dos membros inferiores apresenta um padrão único nos doentes insuficientes renais, caracterizado por um envolvimento complexo e multissetorial. Cerca de 2/3 dos doentes apresentavam doença nas categorias TASC C e D, e mais de 50% têm envolvimento dos vasos distais tíbioperoneais. Apesar do padrão da doença ser caraterizado por artérias ocluídas extensamente calcificadas, o sucesso da técnica foi alto (84,4%), mas inferior à dos doentes com função renal normal. Este sucesso reflete a experiência obtida nos procedimentos infrainguinais, ao longo dos anos.
A taxa de salvamento de membro aos 12 meses foi de 69,6%. Este resultado não varia muito entre as diferentes séries publicadas: no estudo de Brosi et al.,27 que incluiu doentes com revascularização infragenicular, com ou sem procedimento de inflow, apresentou uma taxa de salvamento de membro de 73% aos 12 meses. Numa análise retrospetiva de doentes com isquemia crítica, que foram submetidos a revascularização endovascular, mostrou uma taxa de amputação de 25% mas que pode alcançar os 46% no subgrupo de doentes em diálise28. Albers et al. publicaram uma meta‐análise de 1.314 procedimentos em que 964 doentes eram diálise‐dependentes. A taxa de salvamento de membro neste grupo foi de 78% aos 12 meses29. Foi ainda identificado como fator de risco preditor de amputação, além da presença de hemodiálise, o tabagismo, que eleva o risco de amputação em cerca de 10 vezes (p<0,01).
Existem várias explicações possíveis para a baixa taxa de salvamento nestes doentes, sendo que a mais importante parece estar relacionada com o estádio clínico da doença na sua apresentação: a maioria dos doentes apresenta doença avançada com cerca de 2/3 dos doentes lesões tróficas ou gangrena. Estes doentes têm um maior risco de amputação do que aqueles com claudicação grave ou dor em repouso. Podemos, assim, aferir que a intervenção numa fase mais precoce da doença poderá levar a resultados mais favoráveis.
Existem poucos estudos que comparam as 2 técnicas de revascularização: cirúrgica e endovascular, mas sabe‐se que, apesar dos avanços nas técnicas cirúrgicas, não se consegue alcançar uma grande melhoria nos resultados destes doentes. Aliás, a taxa de sobrevida aos 2 anos após bypass periférico nesta população mantém‐se entre 23‐52%25–27.
Os maiores estudos descritos na literatura nesta subpopulação mostram resultados díspares entre a permeabilidade do enxerto e a sobrevida (60‐74% e 50‐85%, respetivamente, aos 2 anos). O contraste entre a baixa sobrevida e a permeabilidade aceitável do enxerto implica que muitos dos doentes vêm a falecer de outras causas que não relacionadas com o membro inferior30–32.
Além disso, a revascularização, endovascular ou cirúrgica, mostraram não ter impacto na sobrevida global destes doentes, tal como mostrado no estudo recente de Fallon et al. Nesta análise 689 doentes em hemodiálise, foram identificados 5 fatores de risco independentes e aditivos, para a mortalidade aos 12 meses: idade>80 anos, doença pulmonar obstrutiva crónica (DPOC), status de deambulação pré‐operatória, dor em repouso/perda tecidual. O conhecimento destes fatores pode ajudar na otimização da seleção dos doentes a serem submetidos a revascularização33.
Sabemos que o tratamento mais apropriado para a doença vascular periférica nos doentes em diálise ainda não é claro. Muitos estudos advogam estratégias de revascularização agressivas com base na melhoria verificada tanto na morbilidade, como mortalidade31,34. Contudo, existem muitos outros trabalhos que recomendam precaução neste grupo de doentes devido às menores taxas de sobrevida35,36.
Contudo, apesar do risco conhecido de amputação major, mesmo com a permeabilidade mantida das revascularizações, existem algumas séries de revisão que reportam taxas de salvamento de membro aos 12 meses de 7037 e 66% aos 5 anos29. Estes dados vêm apoiar a revascularização endovascular, quando possível, de forma a preservar o membro. Infelizmente, o sucesso da revascularização é contrariado pelas elevadas taxas de mortalidade.
Os nossos resultados mostram uma elevada mortalidade nos doentes em diálise e que até são mais favoráveis do que aqueles reportados na literatura. Willenberg et al. mostraram taxas de sobrevida aos 12 meses de 72%15. Estes dados indicam que a aterosclerose grave é um determinante major para a baixa sobrevida nestes doentes. Além disso, foi identificado um maior de risco de mortalidade para os doentes do sexo feminino (p=0,034) e a diabetes (p=0,046).
A evidência atual sugere que a estimativa da esperança de vida destes doentes deve ser escrutinada antes de se tomar qualquer decisão de revascularizar. A estratificação do risco perioperatório, com base em preditores de sobrevida livre de amputação, como a não deambulação, diabetes mellitus, hipoalbuminemia, fração de ejeção<0,48 e ausência de arco plantar patente, podem ser usados para se prever o prognóstico nestes doentes e auxiliar na decisão de tratamento38.
O nosso estudo tem várias limitações. Pelo facto de ser retrospetivo, faz com que os resultados estejam sujeitos a vários bias de seleção. A amostra é relativamente pequena, especialmente no grupo de estudo, de que podem resultar erros estatísticos tipo II. O elevado número de doente com perda de dados de follow‐up (14%) poderá ser explicado pois, tratando‐se de um hospital de referenciação, tal como a maioria dos hospitais com serviço de cirurgia vascular, há um seguimento dos doentes pelo hospital de origem, com perda de dados importantes de follow‐up.
ConclusõesApesar dos avanços dos procedimentos endovasculares e sua crescente utilização para revascularização dos membros inferiores, os seus resultados nos doentes com insuficiência renal terminal em diálise ainda são limitados e estão associados a elevada taxa de perda de membro, devido à gravidade da isquemia e envolvimento difuso das lesões obstrutivas, predominantemente distais.
Uma referenciação precoce e o tratamento adequado das lesões tróficas com realização de pensos por profissionais experientes e de forma regular, de forma a poder prevenir as infeções e promover a cicatrização, são essenciais na abordagem destes doentes. É concebível que o timing da intervenção numa fase mais inicial, antes do desenvolvimento de lesões com perda tecidual irreversível, possa produzir resultados mais favoráveis no que diz respeito à prevenção da amputação, contudo, sem benefício na sobrevida dos doentes.
Dadas as elevadas comorbilidades e baixa esperança de vida, a revascularização endovascular, sendo um procedimento pouco invasivo e com possibilidade de tratamento da doença difusa particularmente ao nível do setor infrapoplíteo, deve ser o tratamento de escolha nestes doentes.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.