La insuficiencia tricuspídea (IT) ha cobrado creciente relevancia en los últimos años como un determinante pronóstico clave en pacientes con insuficiencia cardíaca (IC). Hoy se reconoce que su prevalencia es significativa, afectando hasta al 7% de la población general y alcanzando cifras significativas en subgrupos con IC.
La evidencia emergente vincula la IT con deterioro clínico, mayor riesgo de hospitalización y mortalidad, lo que ha impulsado el desarrollo de nuevas herramientas diagnósticas y terapéuticas. Este artículo revisa la epidemiología, fisiopatología, implicancias pronósticas y abordajes actuales de tratamiento médico, quirúrgico y percutáneo de la IT en el contexto de la IC.
Tricuspid regurgitation (TR) has become increasingly relevant in recent years as a key prognostic determinant in patients with heart failure (HF). It is now recognized that its prevalence is significant, affecting up to 7% of the general population and reaching significant figures in subgroups with HF.
Emerging evidence links TI with clinical deterioration, increased risk of hospitalization and mortality, which has prompted the development of new diagnostic and therapeutic tools. This article reviews the epidemiology, pathophysiology, prognostic implications, and current approaches to medical, surgical, and percutaneous treatment of TR in the context of HF.
La insuficiencia tricuspídea (IT), históricamente relegada como la “válvula olvidada”, ha emergido en los últimos años como un factor pronóstico relevante en pacientes con insuficiencia cardíaca (IC) y otras enfermedades cardiovasculares. La IT significativa afecta aproximadamente al 5-7% de la población general (5,9% para la IT moderada y 1,8% para la IT severa)1 y su prevalencia aumenta en pacientes añosos, mujeres y aquellos con comorbilidades como fibrilación auricular e hipertensión pulmonar (HP)2.
En pacientes con IC, la prevalencia de IT moderada a severa alcanza hasta el 20%, independientemente de la fracción de eyección3. Hay datos que dan cuenta de hasta un 40% de prevalencia de IT severa en pacientes con insuficiencia cardíaca con fracción de eyección preservada (ICFEp)4.
Estudios recientes han demostrado que la presencia de IT moderada a severa se asocia con un mayor riesgo de eventos cardiovasculares y mortalidad, independientemente de otras variables clínicas. Asimismo, se ha observado que la progresión de IT en pacientes con IC con fracción de eyección reducida (ICFEr) está relacionada con disfunción del ventrículo derecho (VD), HP y remodelado auricular derecho, configurando un fenotipo complejo con implicancias pronósticas importantes5.
Existe evidencia también sobre el impacto pronóstico de la IT en distintos escenarios clínicos: valvulopatías izquierdas, HP, fibrilación auricular, trasplante cardíaco e incluso vinculado a dispositivos implantables endocavitarios6.
A pesar de los avances en las técnicas quirúrgicas, el reemplazo valvular tricuspídeo aislado no mostró mejores resultados que el tratamiento farmacológico aislado7; esto ha dado paso a un crecimiento exponencial de dispositivos y procedimientos percutáneos para la válvula tricúspide8.
El presente artículo pretende analizar el estado actual de la patología, haciendo foco en el diagnóstico y las alternativas terapéuticas actuales.
Definición y clasificaciónHistóricamente se la ha clasificado en dos grandes categorías, primaria y secundaria, según presencia o ausencia de compromiso de los velos valvares. La IT primaria representa aproximadamente el 10-15% de los casos y se debe a una alteración estructural intrínseca del aparato valvular (por ejemplo, prolapso, enfermedad reumática, endocarditis, displasias congénitas como la anomalía de Ebstein, trauma o degeneración mixomatosa). En cambio, la IT secundaria (o funcional), que es mucho más prevalente (alrededor del 85-90%), se origina por una disfunción del aparato de soporte valvular con velos estructuralmente normales, en el contexto de dilatación del anillo tricuspídeo y/o del ventrículo o aurícula derecha9.
Otra forma tradicional de categorizar la IT es según la clasificación de Carpentier, sin embargo, esta clasificación fue desarrollada para guiar la reparación quirúrgica o remplazo de la válvula mitral, y no hay una clara evidencia de la utilidad de esta clasificación respecto a la válvula tricúspide10.
Debemos tener en cuenta que existe un gran abanico de patologías que genera IT secundaría y que cada una de ellas genera distintos tipos de alteraciones estructurales y funcionales en las valvas que en última instancia impacta en la estrategia de tratamiento. Inclusive, el pronóstico varía en función de la causa que genera la IT secundaria. Estudios de ecocardiografía 3D han demostrado que la IT secundaria puede desarrollarse por dilatación y disfunción del VD, pero también por dilatación de la aurícula derecha y el anillo tricúspideo en ausencia de compromiso del VD11.
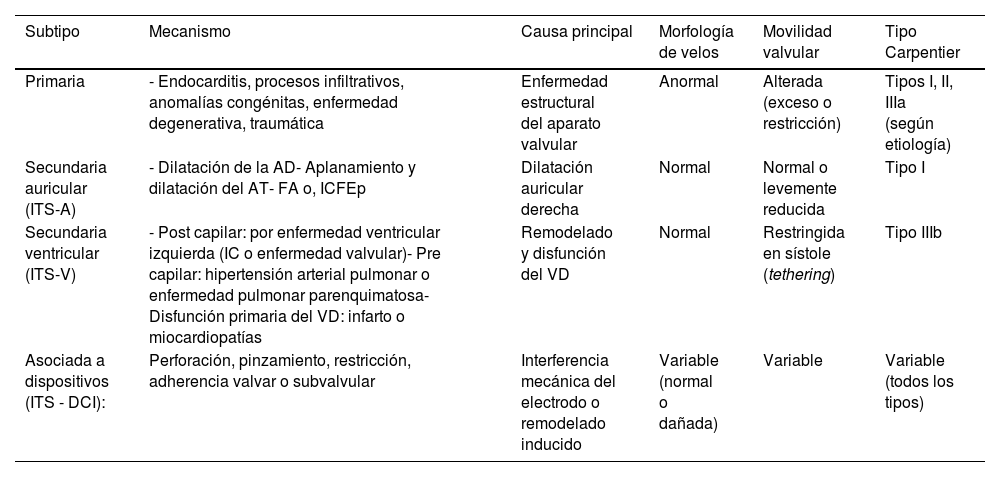
Es por eso, que en los últimos tiempos se ha propuesto una subclasificación que permita un diagnóstico etiológico claro y orientado al abordaje9 (tabla 1):
Clasificación de la insuficiencia tricuspídea
| Subtipo | Mecanismo | Causa principal | Morfología de velos | Movilidad valvular | Tipo Carpentier |
|---|---|---|---|---|---|
| Primaria | - Endocarditis, procesos infiltrativos, anomalías congénitas, enfermedad degenerativa, traumática | Enfermedad estructural del aparato valvular | Anormal | Alterada (exceso o restricción) | Tipos I, II, IIIa (según etiología) |
| Secundaria auricular (ITS-A) | - Dilatación de la AD- Aplanamiento y dilatación del AT- FA o, ICFEp | Dilatación auricular derecha | Normal | Normal o levemente reducida | Tipo I |
| Secundaria ventricular (ITS-V) | - Post capilar: por enfermedad ventricular izquierda (IC o enfermedad valvular)- Pre capilar: hipertensión arterial pulmonar o enfermedad pulmonar parenquimatosa- Disfunción primaria del VD: infarto o miocardiopatías | Remodelado y disfunción del VD | Normal | Restringida en sístole (tethering) | Tipo IIIb |
| Asociada a dispositivos (ITS - DCI): | Perforación, pinzamiento, restricción, adherencia valvar o subvalvular | Interferencia mecánica del electrodo o remodelado inducido | Variable (normal o dañada) | Variable | Variable (todos los tipos) |
Abreviaturas: AD:aurícula derecha; AT:anillo tricúspideo; AD:aurícula derecha; ICFEp: insuficiencia cardíaca con fracción de eyección preservada; IT: insuficiencia tricuspídea; ITS-A: IT secundaria auricular;ITS-V: IT secundaria ventricular; ITS - DCI: IT asociada a dispositivos electrónicos cardíacos; VD: ventrículo derecho.
- 1.
IT secundaria auricular (ITS-A): se caracteriza por dilatación del anillo tricúspideo (AT) secundario a dilatación de la aurícula derecha (AD), con nula o mínima dilatación de la base del VD, sin restricción en los velos de la VT. Suele asociarse con fibrilación o flutter auricular persistente, ICFEp, ausencia del HP significativa (<50mmHg) y ausencia de valvulopatías izquierdas. Además, se evidenció que incrementa su frecuencia con la edad y en las mujeres su presentación suele ser como ITa significativa. Esta correlaciona con la clasificación de Carpentier I.
- 2.
IT secundaria ventricular (ITS-V): ocurre como consecuencia de disfunción ventricular derecha, HP o enfermedad ventricular izquierda avanzada. Se observa dilatación del VD, “tethering” valvular significativo y alteración en coaptación valvar. Corresponde al tipo Carpentier IIIb.
- 3.
IT asociada a dispositivos electrónicos cardíacos (ITS - DCI): representa una categoría especial que puede ser causada por interferencia mecánica de un electrodo endocavitario sobre los velos o por remodelado secundario a estimulación ventricular crónica.
Esta clasificación más detallada ha sido adoptada por grupos internacionales como el Tricuspid Valve Academic Research Consortium (TVARC) y permite no sólo comprender mejor la fisiopatología de cada subtipo, sino también orientar el manejo diagnóstico y terapéutico12.
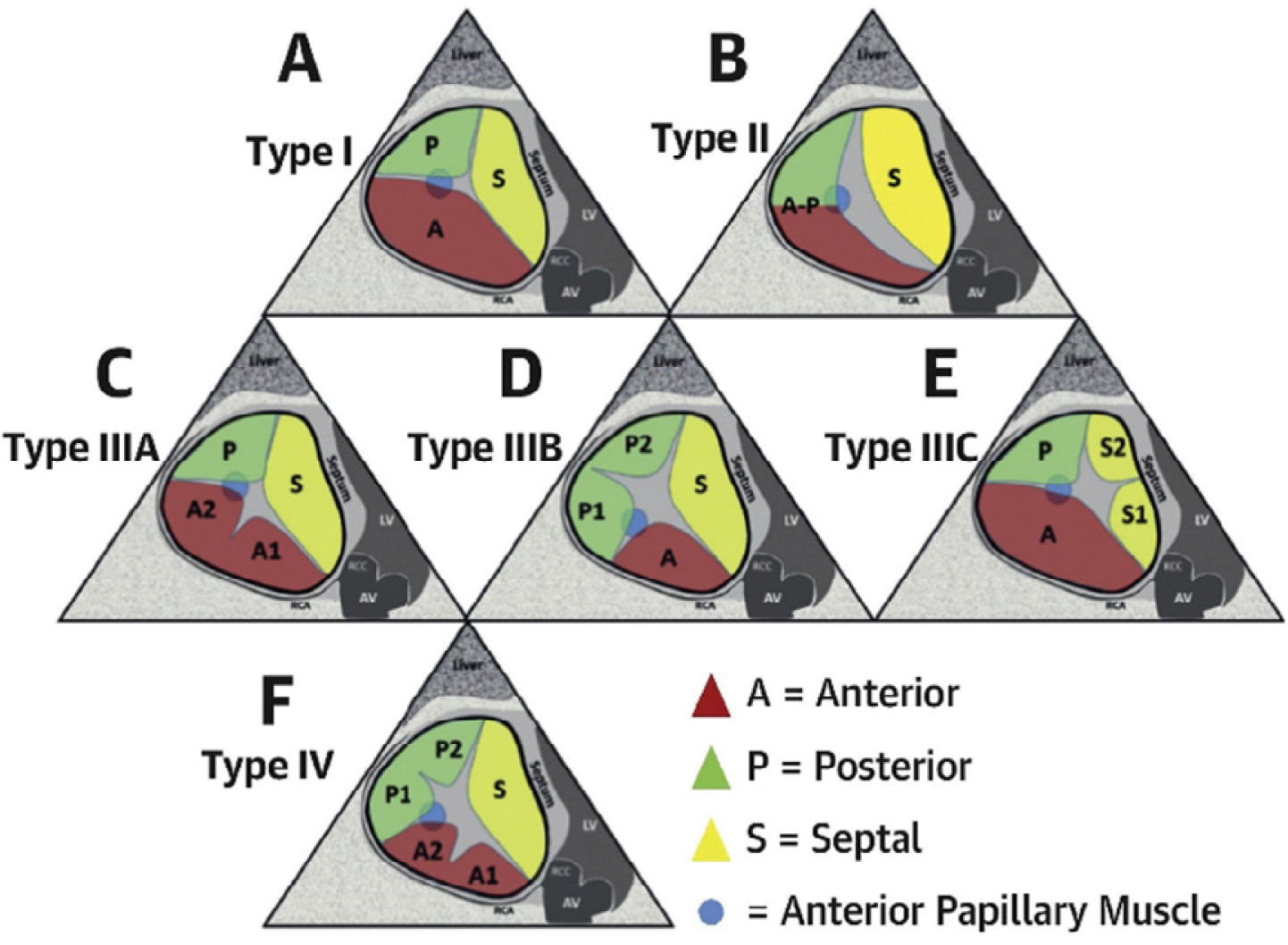
Finalmente, se ha propuesto una nueva nomenclatura morfológica para describir variantes anatómicas del aparato valvular tricuspídeo, que incluye configuraciones con dos, tres, cuatro o más velos (figura 1), considerando su relevancia para la planificación de intervenciones percutáneas o quirúrgicas13.
Nomenclatura de la válvula tricúspide. Esquema
Hahn RT, et al. (2021)13.
La IT significativa genera una sobrecarga de volumen al VD, comprometiendo su eficiencia hemodinámica. En las etapas iniciales, el VD es capaz de compensar esta sobrecarga, pero con el tiempo, la dilatación progresiva y el remodelado adverso del VD resultan en una reducción de la contractilidad, provocando insuficiencia cardíaca derecha (ICD).
Desde el punto de vista fisiopatológico, la regurgitación tricuspídea reduce la fracción de volumen sistólico efectivo, generando un flujo retrógrado hacia la aurícula derecha (AD) y el sistema venoso sistémico. Esta situación incrementa las presiones de llenado en las cavidades derechas, pudiendo afectar la función diastólica del ventrículo izquierdo a través del desplazamiento el septum interventricular, como expresión gráfica de la interdependencia ventricular. Esto puede generar presiones del llenado izquierdas elevadas aún con volúmenes intracavitarios reducidos14.
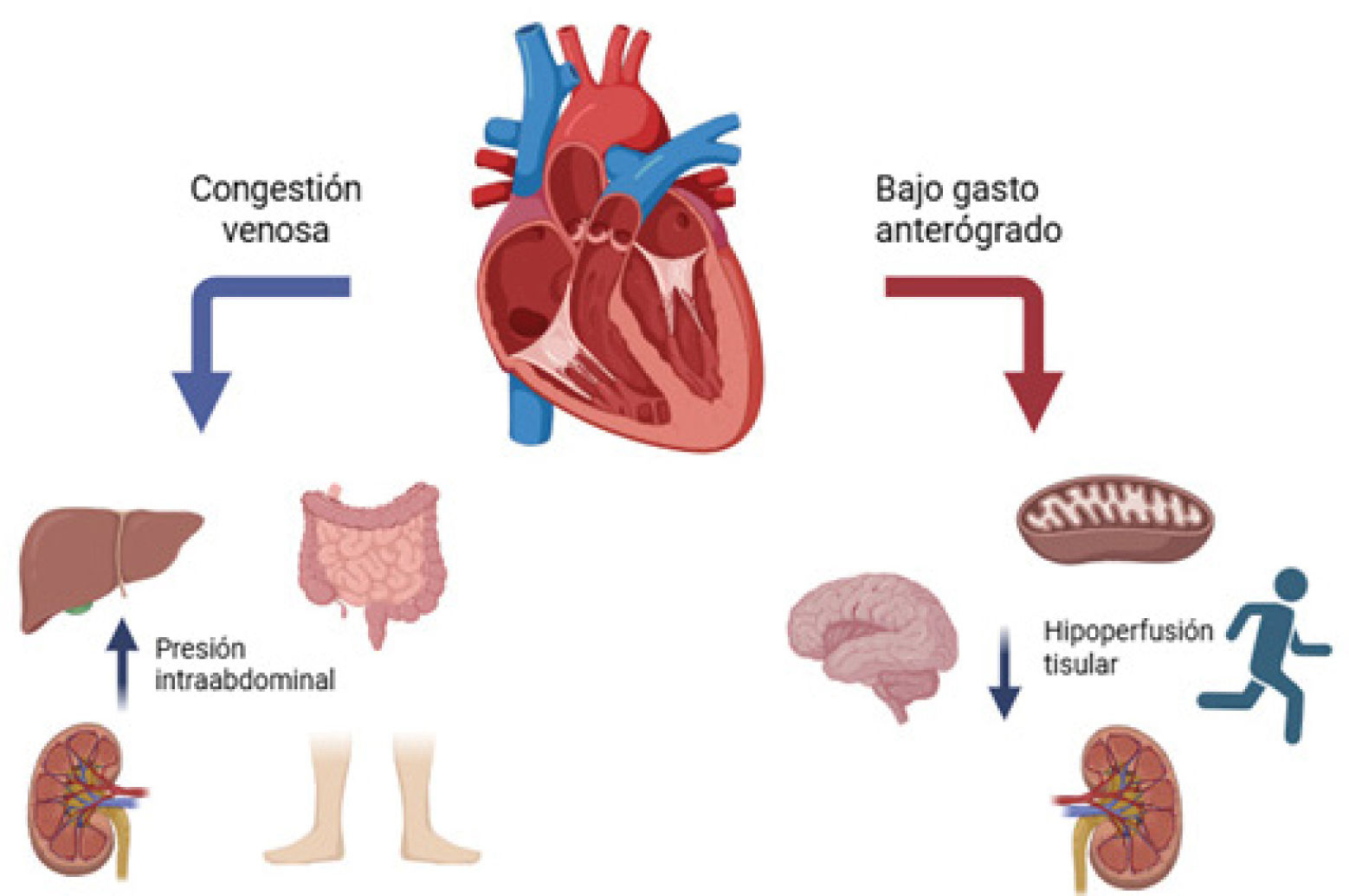
Conceptualmente se puede caracterizar la presentación clínica de la IT en tres condiciones distintas con el correspondiente fundamento fisiopatológico (figura 2):
- 1)
Congestión venosa: manifestada por retención de líquidos, elevación de la presión venosa yugular y periférica, con el consiguiente incremento de la presión intraabdominal.
- 2)
Bajo gasto anterógrado o baja reserva sistólica: generando desde intolerancia al ejercicio y disnea, hasta signos de bajo gasto anterógrado e hipoperfusión tisular.
- 3)
Arritmias auriculares y ventriculares.
La progresión de la IT puede derivar en dos síndromes clave asociados con disfunción orgánica:
- -
El síndrome cardio-renal: La IT severa y más aún su asociación con disfunción ventricular derecha genera un incremento de la presión venosa central. El incremento de la presión venosa renal disminuye el gradiente de presión transrenal disminuyendo la tasa de filtrado glomerular, aún en ausencia de bajo gasto anterógrado15,16.
- -
El síndrome cardio-hepático: La combinación entre la congestión crónica hepática y la hipoperfusión promueven la disfunción hepatocelular (prolongación del tiempo de protrombina) y colestasis (elevación de la bilirrubina indirecta, gamma-glutamil transferasa, fosfatasa alcalina), si bien es menos frecuente en condiciones de bajo flujo puede observarse elevación de las transaminasas hepáticas.
Ambos síndromes son predictores independientes de hospitalización por IC y mortalidad a corto y largo plazo17.
Un concepto clave en la caracterización fisiológica de la ICD secundaria a IT es el acoplamiento ventrículo-pulmonar, que representa la capacidad del VD para adaptarse al incremento de la poscarga inducida por la presión arterial pulmonar (PAP). La pérdida de este acoplamiento (ej. TAPSE/PASP <0,31mm/mmHg) ha demostrado ser un predictor robusto de mortalidad en pacientes tratados farmacológicamente o sometidos a intervenciones percutáneas18.
Es importante considerar que el deterioro es progresivo y pasa por distintos estadios.
En fases iniciales puede haber disfunción ventricular derecha incluso sin síntoma alguno, hasta llegar al extremo final del abanico que es la enfermedad terminal y refractaría al tratamiento19. El reconocimiento precoz es importante ya que permite identificar los pacientes que potencialmente podrían beneficiarse de intervenciones más precoces.
DiagnósticoLa evaluación diagnóstica de la IT se basa fundamentalmente en la ecocardiografía20,21, complementada en algunos casos por otras modalidades de imagen como la resonancia magnética cardíaca o la tomografía computada. La caracterización adecuada de la válvula tricúspide, del aparato subvalvular, del anillo tricuspídeo y de las cámaras derechas es clave para determinar la etiología, el mecanismo y la severidad de la IT.
La ecocardiografía transtorácica (ETT) es el método diagnóstico inicial y esencial para la evaluación de la IT. A través de distintos enfoques (cualitativos, semicuantitativos, cuantitativos y tridimensionales)21–23, permite determinar la presencia, mecanismo, severidad y repercusiones hemodinámicas de la regurgitación.
Ningún parámetro aislado es suficiente, y el análisis integrado permite reducir los sesgos individuales de cada método (tabla 2).
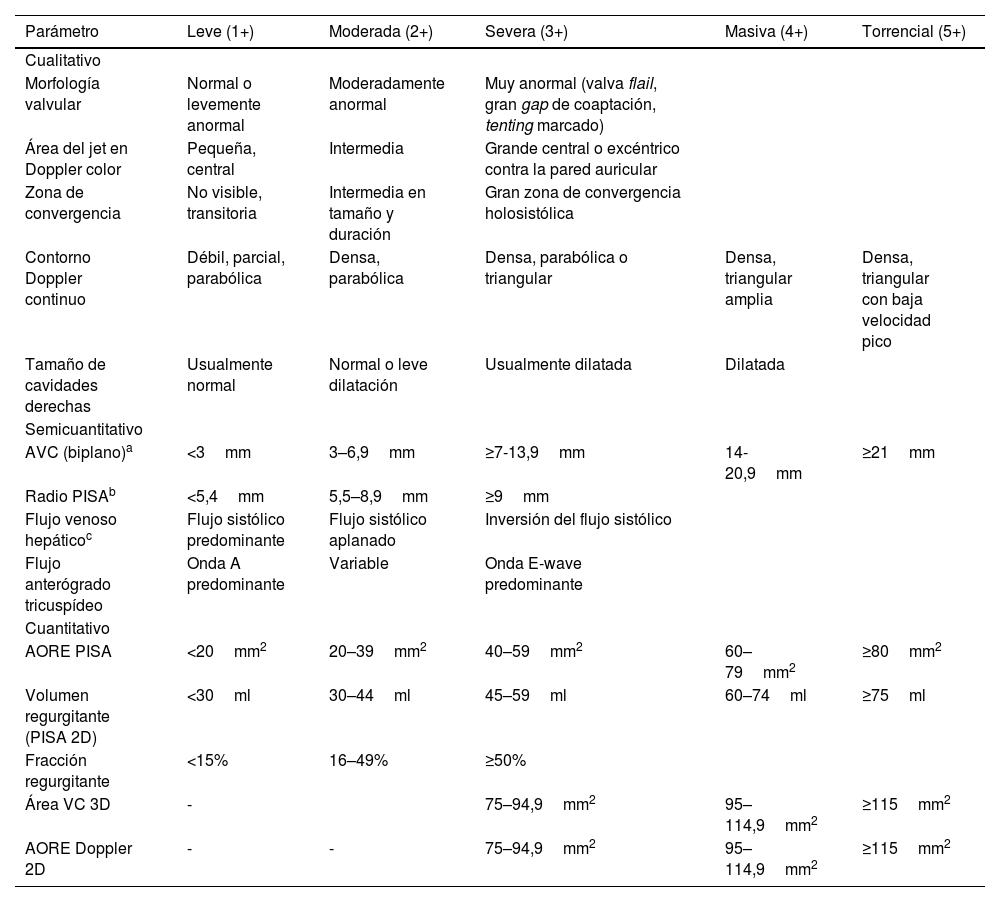
Clasificación de la insuficiencia tricuspídea
| Parámetro | Leve (1+) | Moderada (2+) | Severa (3+) | Masiva (4+) | Torrencial (5+) |
|---|---|---|---|---|---|
| Cualitativo | |||||
| Morfología valvular | Normal o levemente anormal | Moderadamente anormal | Muy anormal (valva flail, gran gap de coaptación, tenting marcado) | ||
| Área del jet en Doppler color | Pequeña, central | Intermedia | Grande central o excéntrico contra la pared auricular | ||
| Zona de convergencia | No visible, transitoria | Intermedia en tamaño y duración | Gran zona de convergencia holosistólica | ||
| Contorno Doppler continuo | Débil, parcial, parabólica | Densa, parabólica | Densa, parabólica o triangular | Densa, triangular amplia | Densa, triangular con baja velocidad pico |
| Tamaño de cavidades derechas | Usualmente normal | Normal o leve dilatación | Usualmente dilatada | Dilatada | |
| Semicuantitativo | |||||
| AVC (biplano)a | <3mm | 3–6,9mm | ≥7-13,9mm | 14-20,9mm | ≥21mm |
| Radio PISAb | <5,4mm | 5,5–8,9mm | ≥9mm | ||
| Flujo venoso hepáticoc | Flujo sistólico predominante | Flujo sistólico aplanado | Inversión del flujo sistólico | ||
| Flujo anterógrado tricuspídeo | Onda A predominante | Variable | Onda E-wave predominante | ||
| Cuantitativo | |||||
| AORE PISA | <20mm2 | 20–39mm2 | 40–59mm2 | 60–79mm2 | ≥80mm2 |
| Volumen regurgitante (PISA 2D) | <30ml | 30–44ml | 45–59ml | 60–74ml | ≥75ml |
| Fracción regurgitante | <15% | 16–49% | ≥50% | ||
| Área VC 3D | - | 75–94,9mm2 | 95–114,9mm2 | ≥115mm2 | |
| AORE Doppler 2D | - | - | 75–94,9mm2 | 95–114,9mm2 | ≥115mm2 |
Estos métodos son rápidos, ampliamente disponibles y frecuentemente utilizados como primera aproximación clínica:
Permiten evaluar:
- •
Anatomía de la válvula tricúspide (número de valvas, movilidad, coaptación).
- •
Dimensiones del anillo tricuspídeo, se define dilatación por encima de los 40mm o 21mm/m2 en la vista de cuatro cámaras apical.
- •
Grado de tethering o tenting (área y altura de tenting).
- •
Función del ventrículo derecho (TAPSE, S’ tisular, acortamiento fraccional del área, strain de la pared libre).
- •
Evaluación del jet regurgitante en Doppler color: se observa su extensión dentro de la aurícula derecha. Un jet pequeño y central sugiere IT leve, mientras que uno amplio, excéntrico y holosistólico podría indicar IT severa.
- •
Vena contracta (VC): medida del diámetro más estrecho del jet regurgitante en Doppler color. Una VC =7mm sugiere IT severa.
- •
Densidad del jet en Doppler continuo (CW): el signo de la daga: un jet denso, triangular y de rápida deceleración se asocia con IT severa. Implica la igualación de la presión de la AD y el VD.
- •
Radio de la isovelocidad proximal (PISA): la medición del radio de PISA consiste en determinar la distancia entre la zona de aliasing (donde el flujo cambia abruptamente de dirección y color, generalmente ajustando la escala de aliasing entre 28-40cm/s) y el orificio de regurgitación de la válvula tricúspide. Un valor mayor a 9mm sugiere severidad.
- •
Evaluación del flujo venoso hepático: la inversión sistólica del flujo en las venas hepáticas es altamente específica para IT severa.
Son más precisos, pero técnicamente demandantes, y requieren experiencia en adquisición y análisis:
- •
Área de orificio regurgitante efectiva (EROA): se calcula mediante el método PISA (proximal isovelocity surface area). Un EROA ≥40mm2 sugiere IT severa.
- •
Volumen regurgitante: representa la cantidad de sangre que refluye por ciclo cardíaco. Valores =45ml son compatibles con IT severa.
- •
Fracción regurgitante: porcentaje del volumen sistólico total que se regurgita hacia la aurícula. Valores =50% apoyan el diagnóstico de IT severa.
La ecocardiografía tridimensional (3D) aporta información adicional sobre la geometría del anillo y la coaptación valvular, especialmente útil en la planificación de intervenciones percutáneas o quirúrgicas.
Los métodos actualmente disponibles son los siguientes:
- •
Área del orificio regurgitante (VCA 3D): medida directa en 3D, especialmente útil cuando las suposiciones geométricas del PISA no se cumplen.
- •
Evaluación de la coaptación de valvas: útil para planear intervenciones percutáneas.
- •
Volúmenes y geometría del VD y del anillo tricuspídeo: más exactos que con métodos bidimensionales.
La valoración de la severidad de la IT es esencial para el manejo clínico, la toma de decisiones terapéuticas y la estratificación pronóstica. Tradicionalmente, la clasificación de la IT se basaba en tres grados (leve, moderada y severa), pero la evidencia reciente ha demostrado que existe un espectro mucho más amplio de severidad, especialmente en pacientes remitidos a intervenciones avanzadas, lo que llevó a la propuesta de categorías adicionales, como “masiva” y “torrencial24. En la tabla 2 se resumen los puntos de corte para cada grado de insuficiencia.
Nomenclatura y clasificación anatómica actual de la válvula tricúspideEl conocimiento anatómico de la válvula tricúspide ha evolucionado gracias a la ecocardiografía 3D, que ha demostrado que la válvula puede presentar variaciones en el número y morfología de las valvas. La clasificación más aceptada hoy distingue seis variantes morfológicas principales (tipo I a IV), según el número y disposición de valvas y comisuras, lo que tiene relevancia para la planificación de intervenciones percutáneas y quirúrgicas27.
La nomenclatura internacional recomienda describir:
- •
Número de valvas: tipo I (3 valvas), tipo II (2 valvas fusionadas), tipos IIIA-C (4 valvas; doble anterior, posterior o septal), tipo IV (>4 valvas). (figura 1).
- •
Localización de las comisuras y presencia de estructuras accesorias.
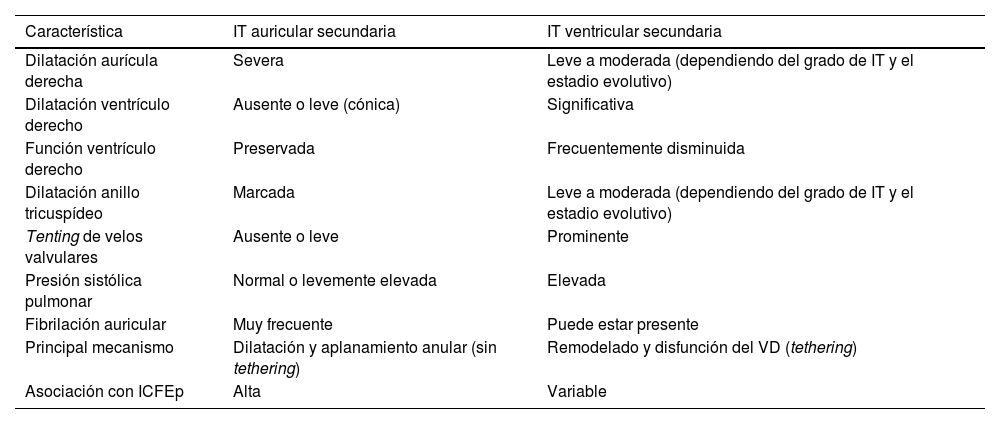
La correcta distinción entre IT secundaria de origen auricular y ventricular es fundamental, ya que ambas entidades presentan diferencias fisiopatológicas, implicancias pronósticas y estrategias terapéuticas. La reciente literatura y las guías internacionales reconocen esta diferenciación como fundamental en la valoración clínica y ecocardiográfica del paciente con IT.
Implicancias diagnósticas de la IT secundariaEcocardiográficamente, el diagnóstico diferencial se apoya en la medición del tamaño y función de la aurícula y ventrículo derechos, la cuantificación del “tenting” valvular, el diámetro del anillo tricuspídeo y la presión sistólica pulmonar. La identificación del mecanismo subyacente es esencial para definir la estrategia terapéutica (tabla 3), ya que la IT auricular puede ser particularmente candidata a tratamiento de estrategias de control del ritmo agresiva en el contexto de FA o incluso anuloplastia. Mientras que la ventricular suele requerir intervenciones más complejas y su pronóstico está marcado en muchas ocasiones por la etiología que lo genera.
Diferencias entre insuficiencia tricuspídea auricular y ventricular
| Característica | IT auricular secundaria | IT ventricular secundaria |
|---|---|---|
| Dilatación aurícula derecha | Severa | Leve a moderada (dependiendo del grado de IT y el estadio evolutivo) |
| Dilatación ventrículo derecho | Ausente o leve (cónica) | Significativa |
| Función ventrículo derecho | Preservada | Frecuentemente disminuida |
| Dilatación anillo tricuspídeo | Marcada | Leve a moderada (dependiendo del grado de IT y el estadio evolutivo) |
| Tenting de velos valvulares | Ausente o leve | Prominente |
| Presión sistólica pulmonar | Normal o levemente elevada | Elevada |
| Fibrilación auricular | Muy frecuente | Puede estar presente |
| Principal mecanismo | Dilatación y aplanamiento anular (sin tethering) | Remodelado y disfunción del VD (tethering) |
| Asociación con ICFEp | Alta | Variable |
Abreviaturas: ICFEp: insuficiencia cardíaca con fracción de eyección preservada.
El manejo farmacológico de la IT y la ICD se basa principalmente en el tratamiento de la congestión y la optimización de las comorbilidades subyacentes, dado que no existen actualmente terapias dirigidas específicamente a la IT funcional. La evidencia indica que la IT significativa suele ser un marcador de mal pronóstico en pacientes con IC, tanto con ICFEp como ICFEr, y se asocia con mayor hospitalización y mortalidad4,5.
Objetivos del tratamientoEl principal objetivo terapéutico es aliviar los síntomas de congestión sistémica (edema periférico, ascitis, distensión abdominal, congestión hepática) y prevenir la progresión del daño multiorgánico secundario a la congestión venosa crónica (síndrome cardiorrenal, cardiohepático, alteraciones gastrointestinales)28.
DiuréticosLos diuréticos de asa constituyen la piedra angular del tratamiento farmacológico en la IT significativa y la ICD, siendo la medida más eficaz para el control de la sobrecarga de volumen. El ajuste debe individualizarse para lograr la descongestión clínica, aun a expensas de un leve deterioro de la función renal, debido a la frecuente resistencia diurética en esta población28.
En casos de resistencia, pueden asociarse otros diuréticos como antagonistas de la aldosterona (ARM) y/o tiazidas para potenciar la natriuresis.
Fármacos modificadores de la enfermedad
- •
En pacientes con ICFEr, se recomienda la optimización del tratamiento según guías (inhibidores de la enzima convertidora de angiotensina [IECA], bloqueadores de los receptores de angiotensina II [BRA], inhibidores de la enzima convertidora de angiotensina-neprilisina [ARNI], betabloqueantes, antagonistas de aldosterona [ARM], inhibidores del cotransportador de sodio-glucosa tipo 2 [SGLT2i]), ya que el control de la sobrecarga de presión y volumen del VD puede frenar la progresión de la IT secundaria5.
- •
En pacientes con ICFEp, la evidencia es menos robusta, pero se recomienda el manejo de comorbilidades (hipertensión, diabetes, fibrilación auricular), así como el uso de SGLT2i y control estricto de la volemia4.
La IT funcional es predominantemente una patología de la aurícula derecha como consecuencia de la dilatación anular y del anclaje de las valvas tricúspideas. En ocasiones o incluso en estadios avanzados coexiste con presión ventricular derecha elevada, disfunción sistólica o sobrecarga de volumen de dicho ventrículo29.
La IT auricular muy a menudo está asociada con fibrilación o aleteo auricular (FA/AA) lo que le confiere mal pronóstico evolutivo30.
Si la FA/AA está presente, el tratamiento basado en la restauración activa del ritmo sinusal (control de ritmo) se presenta como una oportunidad terapéutica para el manejo de la IT funcional, pudiendo revertir los cambios estructurales asociados a la IT funcional31,32.
Las opciones terapéuticas son las drogas antiarrítmicas, que pueden verse limitados por los efectos secundarios, o los procedimientos de ablación de FA/AA, que tienen una mayor eficacia para la prevención de la recurrencia de dichas arritmias.
Algunos estudios recientes han demostrado que los procedimientos que permiten restaurar el ritmo sinusal (cardioversión eléctrica/farmacológica o ablación) pueden reducir la gravedad de la IT e incluso revertir la remodelación cardíaca derecha en pacientes con FA/AA e IT al menos moderada, si se logra mantener el ritmo sinusal32–34.
De tal manera que el control del ritmo, especialmente con ablación por catéter, sería un enfoque inicial razonable para el manejo de la IT auricular antes de considerar intervenciones valvulares.
Se requieren más investigaciones, incluyendo estudios prospectivos y aleatorizados, para determinar la eficacia de este enfoque para reducir e incluso prevenir la IT funcional.
Manejo de hipertensión pulmonar (HP)En pacientes con HP precapilar, se debe considerar el uso de vasodilatadores pulmonares específicos, aunque el beneficio directo sobre la IT es limitado y deben ser seleccionados cuidadosamente según el fenotipo hemodinámico.
Otras medidas- •
La corrección de anemia y el tratamiento de la disfunción renal o hepática son fundamentales para la optimización del estado general.
- •
La reducción del consumo de sal, el control de la ingesta hídrica y la monitorización de peso diario forman parte de la estrategia de autocuidado.
- •
La intervención sobre comorbilidades, como la suspensión o el recambio de dispositivos electrónicos endocavitarios en caso de IT secundaria a cables de marcapasos, puede ser beneficiosa en casos seleccionados.
No existen, hasta el momento, estudios aleatorizados que hayan demostrado un beneficio en la supervivencia con el tratamiento farmacológico específico de la IT. Sin embargo, el manejo óptimo de la IC, la descongestión agresiva y el control de comorbilidades son pilares fundamentales y han demostrado mejorar la calidad de vida y reducir hospitalizaciones4,5,28.
Tratamiento quirúrgico en el contexto de una cirugía cardíacaLas guías internacionales recomiendan la intervención quirúrgica sobre la válvula tricúspide en el contexto de una cirugía cardíaca, especialmente valvular izquierda, bajo ciertas condiciones específicas. En pacientes sometidos a cirugía de válvula mitral o aórtica, la anuloplastia tricuspídea está indicada cuando la IT es severa, independientemente de la sintomatología. Además, se recomienda considerar la reparación tricuspídea en presencia de IT moderada y/o dilatación significativa del anillo tricuspídeo (diámetro =40mm o =21mm/m2 por ecocardiografía), aun en ausencia de IT severa, dado el riesgo elevado de progresión posquirúrgica25,35.
Esta estrategia proactiva busca prevenir el desarrollo de IT significativa y disfunción ventricular derecha en el seguimiento, situaciones asociadas a mayor morbimortalidad y limitada respuesta a tratamientos tardíos. Asimismo, la intervención concomitante sobre la válvula tricúspide debe ser considerada en el contexto de cirugía cardíaca por otras causas (por ejemplo, corrección de cardiopatías congénitas), especialmente si existen factores de riesgo para progresión de IT como fibrilación auricular, HP o remodelado auricular o ventricular derecho25,35.
Estas recomendaciones se fundamentan en la fuerte evidencia que vincula la persistencia o progresión de la IT luego de la cirugía valvular izquierda con un peor pronóstico, mayor desarrollo de ICD y aumento de la mortalidad a mediano y largo plazo.
Tratamiento quirúrgico de la insuficiencia tricuspídea aisladaExiste una gran población no tratada con IT severa sintomática aislada36. Esto en parte se debe a la alta mortalidad intrahospitalaria reportada, de hasta el 10%, en gran marte motivada por la presentación tardía de estos pacientes37,38. El tratamiento quirúrgico de la IT aislada está indicado en pacientes seleccionados con IT severa, especialmente cuando existe sintomatología de ICD refractaria al manejo médico. Las principales opciones quirúrgicas incluyen la reparación valvular, típicamente mediante anuloplastia con anillo protésico rígido o semirrígido, que ha demostrado mejores resultados respecto a técnicas de sutura aislada, y el reemplazo valvular, reservado para casos con alteración estructural muy marcada como retracción severa de velos o fracaso de la reparación previa.
La evidencia señala que la reparación quirúrgica tiene mejores resultados en términos de supervivencia que el reemplazo, siempre que la anatomía lo permita. Sin embargo, la cirugía aislada de la válvula tricúspide, especialmente en fases avanzadas de disfunción ventricular derecha, conlleva una elevada morbimortalidad perioperatoria. La intervención precoz antes del desarrollo de disfunción ventricular derecha irreversible o daño hepatorrenal avanzado se asocia a mejores resultados clínicos y menor mortalidad en el seguimiento39.
Tratamiento percutáneo de la insuficiencia tricuspídeaDispositivos disponibles, evidencia y desafíosEn los últimos años, el desarrollo de dispositivos percutáneos para el tratamiento de la IT ha crecido rápidamente en respuesta a la alta mortalidad asociada al tratamiento médico aislado y a la elevada morbilidad quirúrgica en pacientes de alto riesgo. Los tratamientos percutáneos buscan ofrecer alternativas menos invasivas y mejorar la calidad de vida en pacientes seleccionados.
Los procedimientos percutáneos sobre la válvula tricúspide representan un gran desafío desde el punto de vista técnico y anatómico debido a la variabilidad del aparato valvular, la ubicación y las dificultades técnicas en la visualización y guía por parte de la ecocardiografía transesofágica.
Indicaciones de tratamiento percutáneoLa intervención percutánea en la IT se indica principalmente en pacientes con IT severa sintomática que son considerados de alto riesgo o inoperables para cirugía convencional. También puede considerarse en casos de IT significativa persistente tras cirugía valvular izquierda, IT a disfunción del VD, y en situaciones donde la IT conlleva a la progresión de disfunción de otros órganos35.
Las guías actuales (ESC 2021) otorgan una recomendación Clase IIb, nivel de evidencia C para el tratamiento percutáneo de IT severa en pacientes inoperables35.
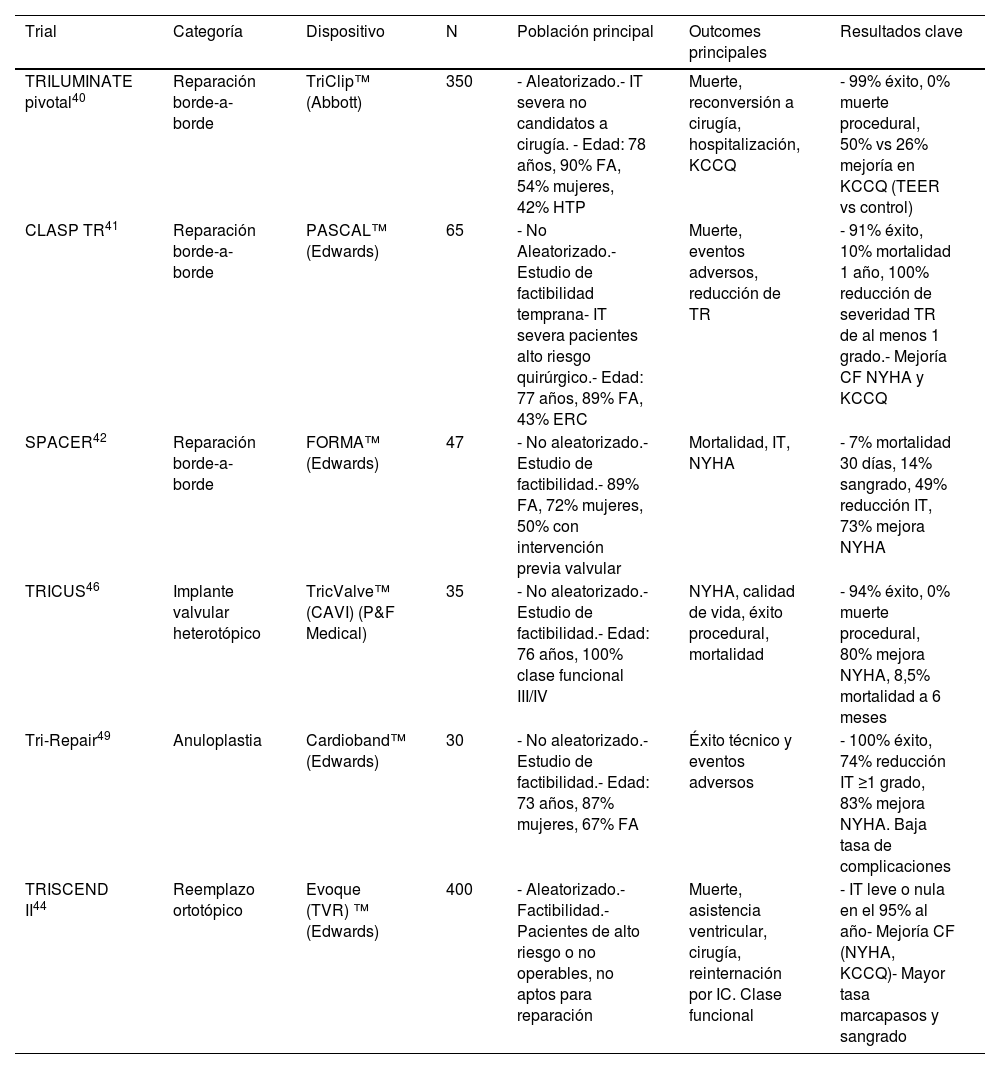
Principales dispositivos disponiblesLos dispositivos pueden clasificarse en las siguientes categorías (tabla 4):
- 1)
Dispositivos que mejoran la coaptación de las valvas tricúspideas:
- a.
TriClip (Abbott): es hoy uno de los más utilizados. Dispositivo derivado del MitraClip. Se basa en afrontar los velos tricuspídeos con la colocación de clips de cromo cobalto recubiertos por poliéster. Se implanta por vía femoral y se posiciona entre las valvas anterior y septal o septal y posterior del aparato tricuspídeo. Produce una bicuspidización funcional que mejora la coaptación valvular. En el ensayo TRILUMINATE40, demostró una reducción significativa de la insuficiencia, mejoría de calidad de vida y clase funcional (New York Heart Association [NYHA] I–II: 84% vs 60% en control)
- b.
PASCAL (Edwards Lifesciences): dispositivo con brazos de captura independientes que combina un espaciador central de 10mm y dos brazos o palas metálicas para aproximar los velos. El estudio CLASP TR41, alcanzó una tasa de éxito del 91%, con mejoría funcional NYHA y un 100% reducción de IT con respecto al basal.
- c.
FORMA (Edwards Lifesciences): se trata de la colocación de un riel espaciador que se ancla en la punta del VD y con balones cilíndricos rellenos de espuma expansible se posicionan en el orificio tricuspídeo, evitando así la IT. El estudio SPACER42 mostró casi un 50% de reducción de la severidad y mejoría de la clase funcional.
- a.
- 2)
Implante valvular percutáneo.
El implante Ortotópico se refiere a la colocación de una prótesis en la ubicación anatómica original de la válvula tricúspide, es decir, directamente en el anillo tricuspídeo.
En general requieren de una anatomía adecuada, la presencia de una gran dilatación anular, un “gap” de coaptación importante. Electrodos de marcapasos o ventrículos pequeños pueden hacer del procedimiento un gran desafío.
Existen al menos 7 dispositivos en estudio43. Entre ellos la Evoque (Edwards Lifesciences) es la única que presenta aprobación en casos seleccionados basado en un ensayo clínico randomizado44. Se trata de una prótesis biológica autoexpandible montada sobre un stent de nitinol recubierto, con velos de pericardio bovino. Se implanta por vía transfemoral o transyugular mediante un sistema de liberación guiado por ecocardiografía transesofágica y fluoroscopía. Otro de los dispositivos disponibles en centros seleccionados para tratamiento compasivo e investigación es la prótesis NAVIGATE (NaviGate Cardiac Structures Inc.)45, que es un stent autoexpandible de nitinol con una prótesis de pericardio porcino.
El implante heterotópico, en cambio, consiste en la colocación de válvulas fuera del anillo tricuspídeo, usualmente en las grandes venas (vena cava inferior y superior), para prevenir el reflujo retrógrado de sangre hacia el sistema venoso sistémico. No corrige la regurgitación tricuspídea en sí mismo, pero mitiga sus consecuencias hemodinámicas, especialmente la congestión venosa severa.
TricValve (P&F Products) es un stent de autoexpandible de Nitinol con una válvula de pericardio bovino que se implanta en vena cava inferior y/o superior. El ensayo TRICUS46 demostró una tasa del 94% de éxito con mejoría de la clase funcional. Además, existen series de casos con la válvula Sapien XT o Sapien 3 (válvula bovina en stent balón expandible) colocada a nivel de la vena cava inferior47.
- 3)
Dispositivos de anuloplastia.
Conceptualmente los dispositivos están orientados a reducir el perímetro y el diámetro anual y de esta forman mejorar la coaptación valvar. De destacan principalmente tres:
- a)
TRIALIGN (Mitralign): Se trata de un sistema de sutura percutáneo alrededor del anillo tricuspideo que permite cerrarlo y reducir la insuficiencia. El sistema imita la técnica quirúrgica de bicuspidización del anillo. Se colocan puntos de sutura entre las valvas anterior y posterior para reducir la circunferencia anular. En el estudio SCOUT, se implantó con éxito un solo par de suturas en 14 de 16 pacientes (87,5%), con una reducción promedio tras el procedimiento del 37% en el anillo tricuspídeo y del 59% en el área del orificio regurgitante48.
- b)
TRICINCH (4Tech Cardio): Sistema que realiza una anuloplastia indirecta. Consiste en un anclaje epicárdico en el anillo anterior y un stent autoexpandible en la VCI conectados por una banda. Esta tracción reduce el diámetro del anillo y permite recuperar recuperar la arquitectura valvar. Requiere un neumopericardio controlado para el implante.
- c)
CARDIOBAND (Edwards Lifesciences): Sistema de banda de dacrón ajustable anclada al anillo tricuspídeo mediante múltiples tornillos percutáneos. Permite reducir de forma controlada el diámetro del anillo, imitando una anuloplastia quirúrgica49.
- a)
Resumen de los dispositivos y ensayos para el tratamiento percutáneo de la insuficiencia tricuspídea
| Trial | Categoría | Dispositivo | N | Población principal | Outcomes principales | Resultados clave |
|---|---|---|---|---|---|---|
| TRILUMINATE pivotal40 | Reparación borde-a-borde | TriClip™ (Abbott) | 350 | - Aleatorizado.- IT severa no candidatos a cirugía. - Edad: 78 años, 90% FA, 54% mujeres, 42% HTP | Muerte, reconversión a cirugía, hospitalización, KCCQ | - 99% éxito, 0% muerte procedural, 50% vs 26% mejoría en KCCQ (TEER vs control) |
| CLASP TR41 | Reparación borde-a-borde | PASCAL™ (Edwards) | 65 | - No Aleatorizado.- Estudio de factibilidad temprana- IT severa pacientes alto riesgo quirúrgico.- Edad: 77 años, 89% FA, 43% ERC | Muerte, eventos adversos, reducción de TR | - 91% éxito, 10% mortalidad 1 año, 100% reducción de severidad TR de al menos 1 grado.- Mejoría CF NYHA y KCCQ |
| SPACER42 | Reparación borde-a-borde | FORMA™ (Edwards) | 47 | - No aleatorizado.- Estudio de factibilidad.- 89% FA, 72% mujeres, 50% con intervención previa valvular | Mortalidad, IT, NYHA | - 7% mortalidad 30 días, 14% sangrado, 49% reducción IT, 73% mejora NYHA |
| TRICUS46 | Implante valvular heterotópico | TricValve™ (CAVI) (P&F Medical) | 35 | - No aleatorizado.- Estudio de factibilidad.- Edad: 76 años, 100% clase funcional III/IV | NYHA, calidad de vida, éxito procedural, mortalidad | - 94% éxito, 0% muerte procedural, 80% mejora NYHA, 8,5% mortalidad a 6 meses |
| Tri-Repair49 | Anuloplastia | Cardioband™ (Edwards) | 30 | - No aleatorizado.- Estudio de factibilidad.- Edad: 73 años, 87% mujeres, 67% FA | Éxito técnico y eventos adversos | - 100% éxito, 74% reducción IT ≥1 grado, 83% mejora NYHA. Baja tasa de complicaciones |
| TRISCEND II44 | Reemplazo ortotópico | Evoque (TVR) ™ (Edwards) | 400 | - Aleatorizado.- Factibilidad.- Pacientes de alto riesgo o no operables, no aptos para reparación | Muerte, asistencia ventricular, cirugía, reinternación por IC. Clase funcional | - IT leve o nula en el 95% al año- Mejoría CF (NYHA, KCCQ)- Mayor tasa marcapasos y sangrado |
Abreviaturas: IT S: insuficiencia tricuspídea severa; CF: clase funcional; NYHA: clasificación funcional de New York Heart Association; KCCQ: KansasCity Cardiomyopathy Questionnaire; FA: fibrilación auricular; ERC: enfermedad renal crónica; IC: insuficiencia cardíaca.
Otros aún en estudio son el MILIPEDE: anillo completo semirrígido con un marco plegable de nitinol en forma de zigzag, con ocho anclajes helicoidales y collares en cada punta que se ajustan de forma individual
Gaps en la evidenciaEl abanico de alternativas para el tratamiento percutáneo de la IT amplió el horizonte, gran cantidad de dispositivos se encuentran en etapas avanzadas de investigación, dispositivos de los más variados. Sin embargo, existen algunos aspectos a considerar. En primer lugar, la heterogeneidad anatómica de la válvula dificulta la estandarización27, tampoco queda claro el beneficio en ciertas situaciones como en los casos de disfunción ventricular derecha asociada a HP significativa.
Por otro lado, es probable que los trabajos sean susceptibles a sesgos, ya se encuentran financiados en general por quienes los desarrollan y los resultados reportados corresponden a centros con experiencia en dichos procedimientos. Por el momento los trabajos disponibles se concentran en pacientes de alto riesgo o inoperables, sin embargo, existe una gran población de un riesgo menos elevado que podría beneficiarse de dichos procedimientos1. También es necesario generar un consenso12 con respecto a puntos finales clínicos y ecocardiográficos (IT residual, mortalidad, reinternaciones, IC, sobrevida, etc.) ya que en ocasiones se reportan puntos finales blandos como clase funcional o KCCQ.
Por último, teniendo en cuenta que se trata de una cavidad de baja presión, la trombosis protésica es la regla. Adaptar los esquemas antitrombóticos a cada uno de los dispositivos disponibles será un nuevo desafío.
ConclusiónLas perspectivas de tratamiento para la insuficiencia tricúspidea han cambiado en los últimos años, fundamentalmente motivado por los nuevos dispositivos percutáneos. Esto le ha dado a la patología una nueva oportunidad de tratamiento. Durante muchos años los pacientes refractarios al tratamiento debieron recurrir a una intervención quirúrgica con modestos resultados, principalmente en el marco de la IT aislada. Definitivamente las mejoras en el tratamiento farmacológico de la IC, el tratamiento quirúrgico y los nuevos dispositivos cambiarán la historia natural de la enfermedad tal cual la conocemos hoy.
Conflictos de InterésJM: Sin conflictos de interés; GE: Sin conflictos de interés; CM: Sin conflictos de interés; JF: Sin conflictos de interés; GB: Proctor de JOTEC.