La insuficiencia cardíaca (IC) es una complicación frecuente y desafiante en los adultos con cardiopatías congénitas (ACHD), una población en aumento gracias a los avances médicos y quirúrgicos. Su origen es multifactorial y difiere según el tipo de cardiopatía, lo que hace que su presentación clínica comprenda una amplia variedad de signos y síntomas, algunos presentes en cardiopatías congénitas (CC) específicas.
El diagnóstico requiere una evaluación clínica integral y estudios complementarios personalizados, desafiando las herramientas actuales de clasificación y estratificación pronóstica que se han basado clásicamente en los pacientes con IC adquirida. Introdujimos la escala anatómico-fisiológica de la AHA/ACC, que permite una mejor identificación de pacientes en riesgo de progresión a IC avanzada.
El tratamiento médico aún se basa en la extrapolación de guías de IC adquirida, ya que los estudios actuales poseen limitaciones en cuanto al número y tipo de pacientes, y varios de ellos arriban a resultados opuestos. Es por eso que, se requieren nuevos ensayos clínicos robustos específicos para esta población.
El objetivo de esta revisión es destacar la importancia del abordaje individualizado de la IC en ACHD, desarrollar los principales mecanismos implicados resaltando la complejidad de cada cardiopatía, resumir la evidencia científica publicada al momento respecto al tratamiento farmacológico disponible, y proponer investigaciones que respalden guías específicas para mejorar el pronóstico de estos pacientes.
Heart failure (HF) is a frequent and challenging complication in adults with congenital heart disease (ACHD), a growing population thanks to advances in medical and surgical care. Its origin is multifactorial and varies depending on the type of congenital heart defect, leading to a wide range of clinical signs and symptoms, some of which are specific to certain congenital heart diseases (CHD).
Diagnosis requires a comprehensive clinical evaluation and personalized complementary studies, posing a challenge to traditional classification and risk stratification tools, which were originally developed for patients with acquired HF. We introduce the anatomical-physiological classification by the AHA/ACC, which enables better identification of patients at risk of progressing to advanced HF.
Medical treatment still relies on the extrapolation of guidelines for acquired HF, since current studies in ACHD are limited in sample size and patient diversity, with some even producing conflicting results. Therefore, there is a clear need for new, robust clinical trials tailored specifically to this population.
The aim of this review is to highlight the importance of an individualized approach to HF in ACHD, to describe the main mechanisms involved while emphasizing the complexity of each congenital heart defect, to summarize the current published scientific evidence regarding available pharmacological treatment, and to propose research that supports specific guidelines to improve the prognosis of these patients.
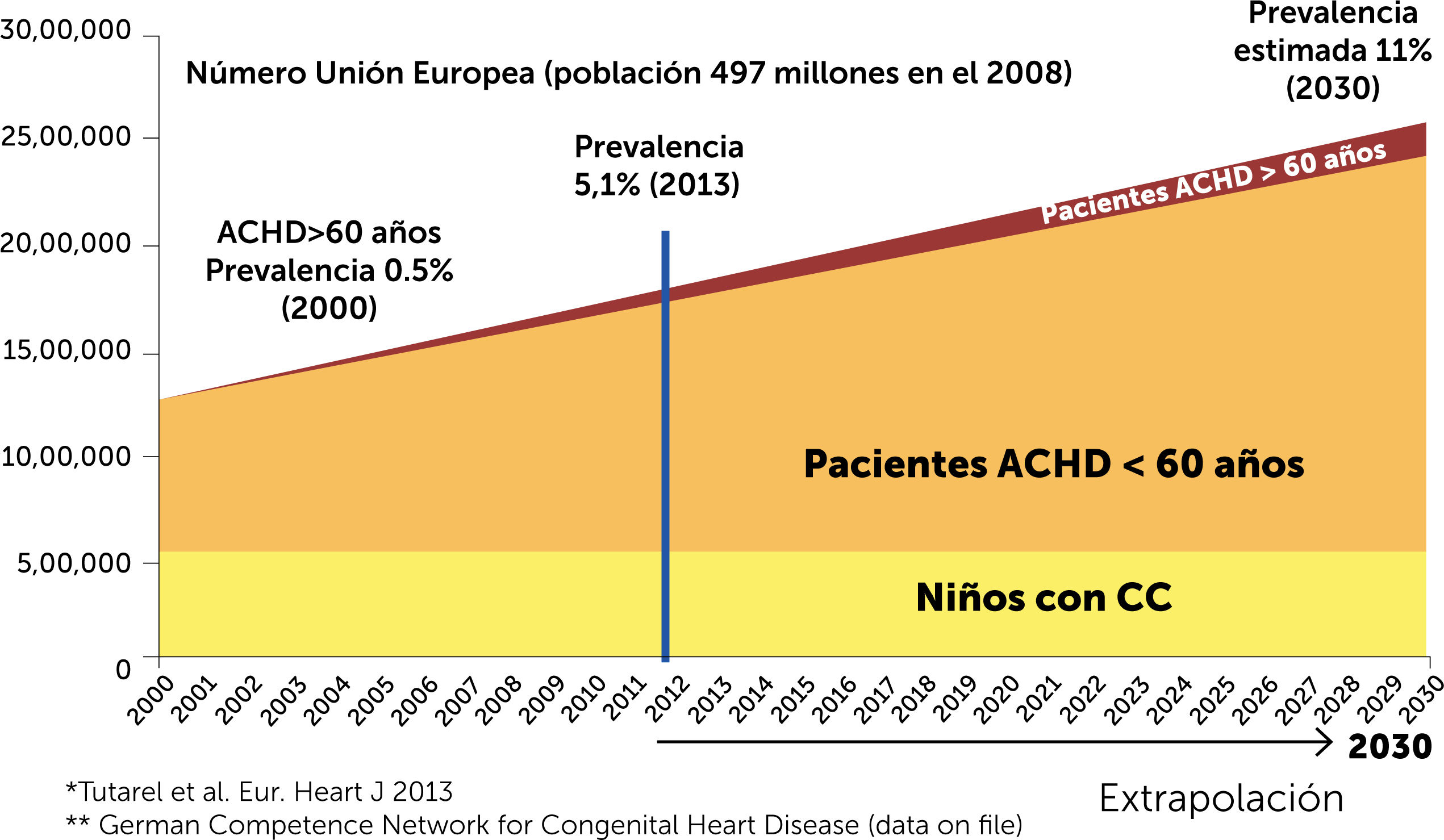
Las cardiopatías congénitas (CC) son las anomalías congénitas más frecuentes (uno de cada 100 niños nace con una lesión congénita) y, gracias a los avances en cirugía y cardiología pediátrica, más del 88% de los niños con CC alcanzarán la adultez1,2. Esto ha generado una nueva población: los adultos con cardiopatías congénitas (ACHD), que hoy en día superan al número de niños con CC. Figura 1. Esto genera una nueva necesidad y un gran desafío ya que son pacientes que serán reintervenidos en múltiples ocasiones (el 70% de pacientes con CC complejas tendrán al menos una cirugía reparadora al llegar a la tercera década de su vida) y que tendrán complicaciones de toda índole: arritmias, hipertensión pulmonar, y por sobre todo insuficiencia cardíaca (IC), que se ha convertido en la principal causa de hospitalización y mortalidad entre los ACHD.
Cambio en la prevalencia de la CC en la Unión Europea según grupo etario.
Las estimaciones aproximadas de la población total de niños, adultos de 18 a 60 años y adultos mayores de 60 años con CC se basan en tasas de natalidad publicadas (en 2008). Adaptado de Leusveld EM, et al. (2020) con licencia Creative Commons Attribution-NonCommercial-NoDerivatives1.
Según el Registro Nacional Holandés CONCOR, la incidencia de la primera internación por IC fue del 1,2 por cada 1 000 pacientes/año, siendo la mortalidad del 2,8% durante el período de seguimiento de 24 865 paciente/año3. Las principales causas de mortalidad según otra cohorte que analizó ACHD fueron: la muerte súbita (19%), no cardiovascular (23%) y la IC (26%)4 (tabla 1). El trabajo de Budts (2016) resume que entre el 6% y 10% de los adultos con CC desarrollarán IC, siendo esta prevalencia mucho mayor en ciertos subgrupos: 22,2% de los pacientes con reparación tipo Mustard por transposición de grandes vasos (TGV), en el 32,3% de los pacientes con transposición corregida congénita de grandes vasos (TCCGV), y en el 40% de los pacientes después de una paliación tipo Fontan3.
Etiología de muerte en diferentes grupos de pacientes con CC. Causa de muerte en 1 573 pacientes adultos con CC. Síntesis de 7 estudios
Debido a lo anteriormente expuesto, se explica que las CC posean una elevada carga de morbilidad y utilización de recursos: estos pacientes tienen hospitalizaciones más prolongadas, (promedio 12 días), requieren más frecuentemente internación en unidad de cuidado intensivo (25%), son reinternados con mayor frecuencia (18%) y tienen mayor mortalidad en comparación con la IC no relacionada a CC1–3. La IC representa hasta el 30% de las hospitalizaciones en esta población y la mortalidad a 5 años puede alcanzar el 60%.
A pesar de su gravedad, la IC en ACHD aún no cuenta con guías de manejo específicas validadas por estudios multicéntricos prospectivos.
Fisiopatología y mecanismos implicadosLa IC en ACHD es un síndrome heterogéneo y existen múltiples factores que pueden contribuir a su desarrollo: anomalías valvulares, cortocircuitos, obstrucción en tracto de entrada o salida, arritmias, defectos anatómicos persistentes, etc. Esto puede resultar en la disfunción sistólica o diastólica, tanto del ventrículo izquierdo o derecho, sistémico o subpulmonar. Subsecuentemente se produce la activación neurohormonal, fibrosis miocárdica y remodelado adverso que perpetúan el deterioro de la función cardíaca y el desarrollo de la IC5. Varios de los mecanismos antes mencionados coexisten, dependiendo de la CC y ello explica la variabilidad en la presentación clínica. Por ejemplo, en pacientes con reparación de D-transposición de grandes vasos (D-TGV) con switch auricular o en la transposición congénitamente corregida de grandes vasos (L-TCGV), la disfunción sistólica del ventrículo derecho sistémico es el mecanismo principal; mientras que en la circulación tipo Fontan (en ventrículos únicos), el fallo progresivo por aumento de la presión del sistema es casi inevitable y provoca una presentación clínica sui generis que hemos decidido ampliar a continuación por sus características distintivas con respecto a la clásica IC.
Insuficiencia cardíaca en pacientes en estadio fontanUn corazón con fisiología univentricular merece especial atención debido a sus características distintivas. En estos pacientes, el objetivo final es alcanzar el estadio Fontan, donde el flujo venoso sistémico es redirigido hacia las arterias pulmonares “salteando” la cámara ventricular subpulmonar. Sin embargo, los pacientes atraviesan diversas intervenciones para arribar a este estadio que incluyen, pero no se limitan a derivaciones subclavio-pulmonares, cirugía de Glenn, etc. Esta circulación (tipo Fontan) paliativa se caracteriza por la ausencia de una bomba ventricular subpulmonar y un flujo sanguíneo pulmonar pasivo impulsado por presiones venosas centrales elevadas6. Es por ello que la presión venosa central debe ser mayor que la presión en las arterias pulmonares para permitir el flujo pasivo.
En estos pacientes la IC es responsable de aproximadamente un tercio o la mitad de las muertes en la población adulta, teniendo por lo tanto un peor pronóstico que en pacientes con fisiología biventricular. Esto puede explicarse desde el punto de vista fisiopatológico de la siguiente manera: las alteraciones hemodinámicas propias de la circulación de Fontan se caracterizan por una presión venosa central elevada, una pre-carga persistentemente reducida que limita el gasto cardíaco y una capacidad disminuida para incrementarlo frente a mayores requerimientos metabólicos; debido a que estos pacientes no logran aumentar el gasto cardíaco durante el ejercicio en condiciones de bajas presiones de llenado, la circulación de Fontan se asocia inevitablemente a un estado crónico de insuficiencia cardíaca. Según el registro CONCOR, la mortalidad en pacientes hospitalizados por IC fue de 24% al año y del 35% a los 3 años desde la presentación clínica7. La hospitalización por disfunción del sistema de Fontan se asocia con una tasa de mortalidad del 8%, cuatro veces mayor que en pacientes con ACHD con fisiología biventricular.
Existen tres problemas específicos asociados en este grupo de pacientes que se suman a la presentación clínica típica de la IC, provocadas principalmente por las elevadas presiones venosas centrales: la enteropatía perdedora de proteínas, la enfermedad hepática asociada a Fontan y la bronquitis plástica8.
- •
Enteropatía perdedora de proteínas: pérdida anormal de proteínas séricas hacia la luz intestinal que ocurre en un 5% a 12% de los individuos después de la cirugía paliativa tipo Fontan. Este edema intestinal provoca un círculo vicioso de malabsorción y aumento de la pérdida de proteínas. El gold standard para el diagnóstico de esta entidad es la determinación de alfa-1 antitripsina en una recolección de materia fecal de 24 horas, o elevación de alfa-1 antitripsina en una única muestra de materia fecal, junto con la presencia de hipoalbuminemia sérica y síntomas de edema sin otra causa identificada.
- •
Bronquitis plástica: la producción excesiva de mucus dentro de la luz de las vías respiratorias se ha reportado en menos del 5% de los pacientes con Fontan. Esto provoca tos crónica con expectoración e hipoxemia. Tanto la bronquitis plástica como la enteropatía perdedora de proteínas forman parte del espectro clínico de insuficiencia linfática asociada a la presión venosa crónicamente elevada del Fontan.
- •
Enfermedad hepática/cirrosis: la elevación en las presiones venosas causa, en algunos casos, congestión hepática centrolobulillar con consecuente necrosis, activando el proceso inflamatorio resultando en fibrosis, cirrosis cardíaca e inclusive pudiendo evolucionar hacia hepatocarcinoma.
Otras manifestaciones de IC en este grupo de pacientes incluyen: arritmias, disfunción de la válvula atrioventricular sistémica, cianosis e insuficiencia renal9. Los pacientes sometidos a cirugía de Fontan pueden desarrollar insuficiencia cardíaca sin deterioro de la función ventricular ni disminución del gasto cardíaco. De hecho, en pacientes con altas presiones en el sistema Fontan y un gasto cardíaco superior a 2,5-3,0 l/min/m2, se han reportado tasas de mortalidad más elevadas10,11. El pronóstico contradictorio puede explicarse por una mayor proporción de enfermedad hepática, enteropatía perdedora de proteínas y colaterales arteriovenosas presentes en este grupo de pacientes.
La medición de la resistencia vascular pulmonar puede ser un gran desafío debido a la ausencia de flujo pulsátil hacia la arteria pulmonar y al desarrollo de circulación colateral veno-venosa, lo que reduce la presión pulmonar. La estenosis en una de las ramas pulmonares puede causar un flujo asimétrico entre los pulmones, y por lo tanto diferencias en la resistencia vascular de cada pulmón. En los pacientes con circulación tipo Fontan, se produce cierto remodelado vascular pulmonar, así como pequeños incrementos en la resistencia vascular pulmonar, los cuales pueden causar reducciones significativas en el gasto cardíaco.
Diagnóstico y evaluación clínicaLa definición clásica de IC comprende un “síndrome clínico caracterizado por síntomas y signos típicos causados por una anomalía cardíaca estructural o funcional que resulta en un índice cardíaco disminuido y/o presiones intra-cardíacas elevadas…” En el caso puntual de las ACHD, queda a simple vista que todos los pacientes tienen alteraciones cardíacas estructurales desde el nacimiento. Esto resulta en general en la adaptación y habituación crónica a algunos de estos síntomas o signos a lo largo de la vida del paciente, lo cual genera como resultado una menor autopercepción de estos, y por lo tanto menor notificación hacia el personal de salud. Además, estos síntomas pueden ser diferentes a los típicos de IC y dependerán de cada cardiopatía puntual. A saber: la congestión a predominio derecha se asocia a shunts izquierda-derecha (comunicación interauricular con repercusión de cavidades derechas o hipertensión pulmonar), anomalía de Ebstein con insuficiencia tricuspídea severa, tetralogía de Fallot (TdF) con patología de la válvula pulmonar o fallo del sistema Fontan como ya mencionamos. Los síntomas de congestión izquierda pueden deberse a un fallo del ventrículo sistémico (morfológicamente derecho en la L-TCGV, o la D-TGV con switch atrial) o del ventrículo único (por ejemplo en la atresia tricuspídea), o patología obstructiva del tracto de salida del ventrículo izquierdo, entre otros. Tener presente e interrogar acerca los síntomas y signos de cada presentación de IC según la cardiopatía estructural de base, resulta fundamental para el cardiólogo tratante, ya que como mencionamos previamente, los pacientes suelen estar adaptados crónicamente a ciertas limitaciones en su clase funcional que normalizan y por lo tanto no reportan como patológicas.
El diagnóstico de IC en ACHD requiere entonces un enfoque integral que incluye un historial clínico completo (especificando tiempo y tipo de intervenciones), examen físico integral y estudios complementarios que determinen la causa de IC ya que en muchos casos puede deberse a un daño estructural reversible mediante intervención quirúrgica o percutánea3. Los estudios complementarios por solicitar dependerán de la CC subyacente, y pueden incluir desde el electrocardiograma, laboratorio con determinación de diferentes biomarcadores, ecocardiograma (bidimensional, strain, 3D de disponerlos), resonancia magnética cardíaca (gold standard para determinar volúmenes de las distintas cavidades), angiotomografía cardíaca, pruebas de esfuerzo, cateterismo cardíaco, etc. Mención especial debería realizarse acerca de la prueba de ejercicio cardiopulmonar ya que ofrece una valoración más amplia de la función y estado físico del paciente y existe una buena correlación entre valores de VO2 <15ml/min/kg y el aumento de la morbimortalidad3,12.
Clasificación de la insuficiencia cardíaca en AchdExisten diversas clasificaciones propuestas, todas con algún tipo de desventaja. Tradicionalmente las CC se han clasificado según su complejidad en simples, moderadas y de gran complejidad o severas; esto obviamente tiene en cuenta la anatomía, pero no la clínica del paciente. Por otro lado, se ha utilizado la clasificación de la New York Heart Association (NYHA), según la clase funcional (CF) del paciente en I, II, III y IV. Esta clasificación tiene la gran desventaja de ser subjetiva y como fue explicado previamente, la adaptación crónica de estos pacientes hace que muchos se identifiquen en CF I de la NYHA a pesar de tener mayores limitaciones en la vida cotidiana13. En 2018, la American Heart Association (AHA)/American College of Cardiology (ACC) propuso una clasificación anatómica-fisiológica combinada, que estratifica a los pacientes según la complejidad anatómica (leve, moderada, compleja) y su estado fisiológico (A a D) (tabla 2). Esta nueva clasificación permite una mejor identificación de pacientes en riesgo de progresión a IC avanzada.
Clasificación propuesta de la IC en ACHD. Utilizando los estadios A a D del sistema de la AHA y las CF de la NYHA, se propone la clasificación combinada de insuficiencia cardíaca en ACHD
| Clasificación propuesta de la IC en ACHD | Clasificación de la NYHA | Clasificación de la IC en ACHD |
|---|---|---|
| Disfunciones orgánicas refractarias, Síndrome de Eisenmenger, arritmias refractarias. | NYHA CF IV | D |
| Disfunciones orgánicas; enfermedad valvular significativa; hipoxemia/cianosis; shunt hemo dinámicamente significativo. | NYHA CF III | C |
| Secuela hemodinámica leve; enfermedad valvular leve; shunt pequeño; deterioro de capacidad de ejercicio. | NYHA CF II | B |
| Sin secuela anatómica/hemodinámica; capacidad de ejercicio normal; función normal multiorgánica. | NYHA CF I | A |
Adaptado de Tedla BA, et al. (2023)14.
Diversos marcadores han sido identificados con valor pronóstico1,15–17.
- •
Parámetros generales de laboratorio: hiponatremia, anemia, disfunción renal y hepática.
- •
Parámetros de imágenes: el deterioro de la función sistólica del ventrículo sistémico es un factor independiente de riesgo de muerte súbita. El aumento de volúmenes de fin de diástole ventriculares se asocia a una mayor mortalidad en pacientes con circulación tipo Fontan y TdF.
- •
Tanto la hipertensión pulmonar como una disminución en el pico de consumo de oxígeno (VO2) durante el test de ejercicio cardiopulmonar se asociaron a mayor tasa de hospitalización, desarrollo de IC, y predijeron de forma independiente la mortalidad1.
- •
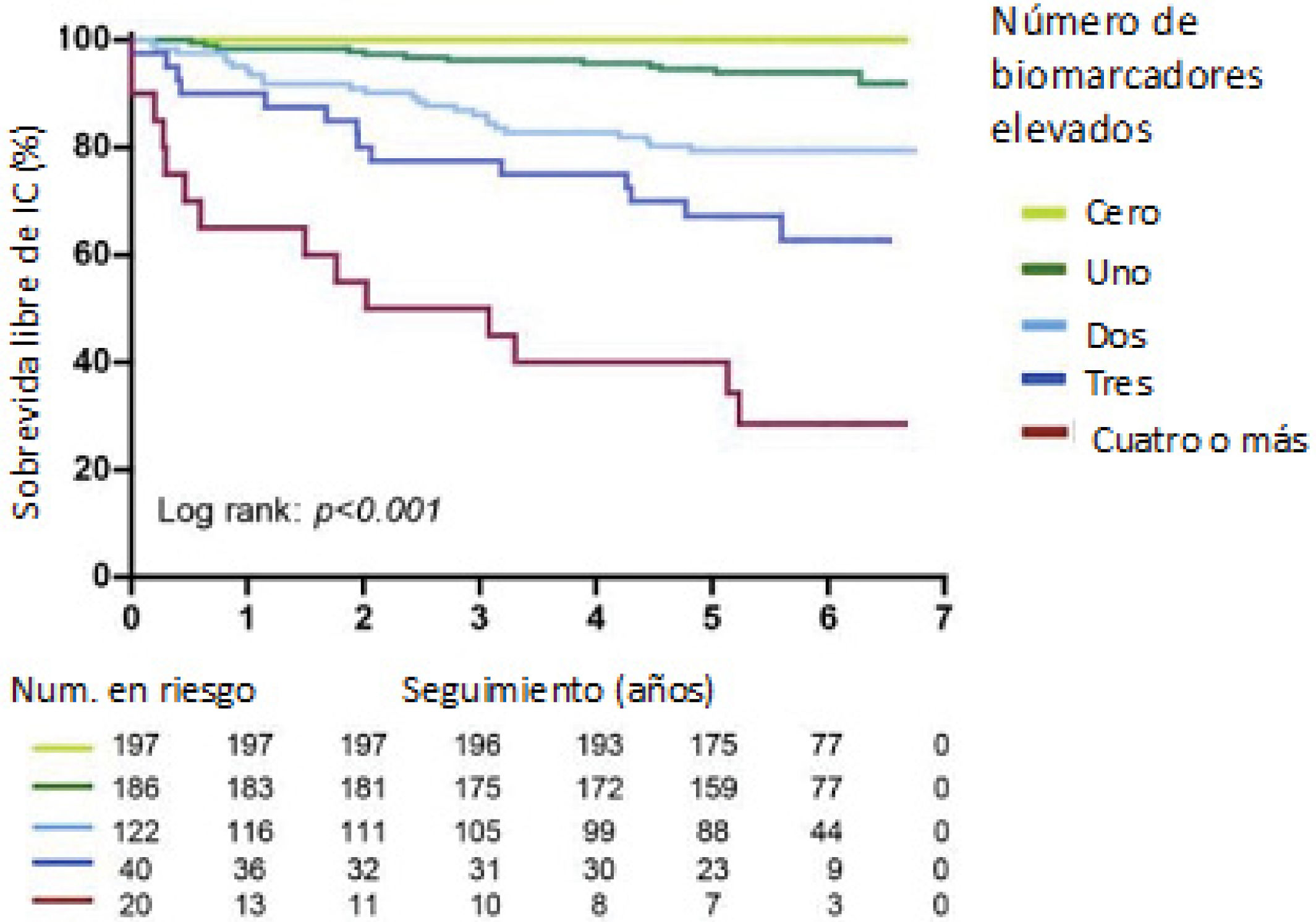
Biomarcadores: Los péptidos natriuréticos (BNP y NT-proBNP) son útiles tanto en diagnóstico como en pronóstico: niveles normales de NT-proBNP (<14pmol/l) pueden descartar con precisión el riesgo de muerte e IC, con un alto valor predictivo negativo. Otros biomarcadores de importancia incluyen la troponina T e I ultrasensibles y el factor de crecimiento y diferenciación 15 (GDF 15). Se ha documentado que, a mayor cantidad de biomarcadores elevados, mayor probabilidad de presentar IC y menor tasa de sobrevida (figura 2).
Figura 2.Supervivencia libre de IC según el número de biomarcadores anormales en ACHD.
Datos combinados publicados previamente por Baggen, et al. (2017)18, Bag-gen et al. (2018)19, Eindhoven et al. (2015)20, Geenen et al. (2019)21. Biomarcadores incluidos y definiciones de niveles anormales: NT-proBNP (>14 pmol/l), troponina T ultrasensible (>14ng/l), proteína C reactiva ultrasensible (>3 mg/ml), sST2 (Hombres >55,85ng/ml, Mujeres >44,50ng/ml), RDW (>16%), GDF-15 (>1 109ng/l). Adaptado de Leusveld EM, et al. (2020)1 con licencia Creative Commons Attribution-NonCommercial-NoDerivatives.
A pesar de la relevancia de las CC que como ya mencionamos afectan a un gran número de pacientes, hasta la fecha no existen ensayos clínicos en IC en ACHD que hayan demostrado beneficios en cuanto a mortalidad y sobrevida1. Por lo tanto, recomendaciones generales se indican en la Guía de Cardiopatías Congénitas del Adulto de la Sociedad Europea de Cardiología del 202012 y de la Asociación Americana de Cardiología de 201822, extrapolando el tratamiento de la IC en pacientes sin CC, basándose en la función ventricular. El manejo, sin embargo, debería individualizarse analizando qué tipo de deterioro de la función ventricular presenta según su CC. A saber: deterioro del ventrículo sistémico morfológicamente derecho o izquierdo, deterioro del ventrículo subpulmonar derecho o izquierdo, deterioro del ventrículo único o fallo del sistema Fontan3.
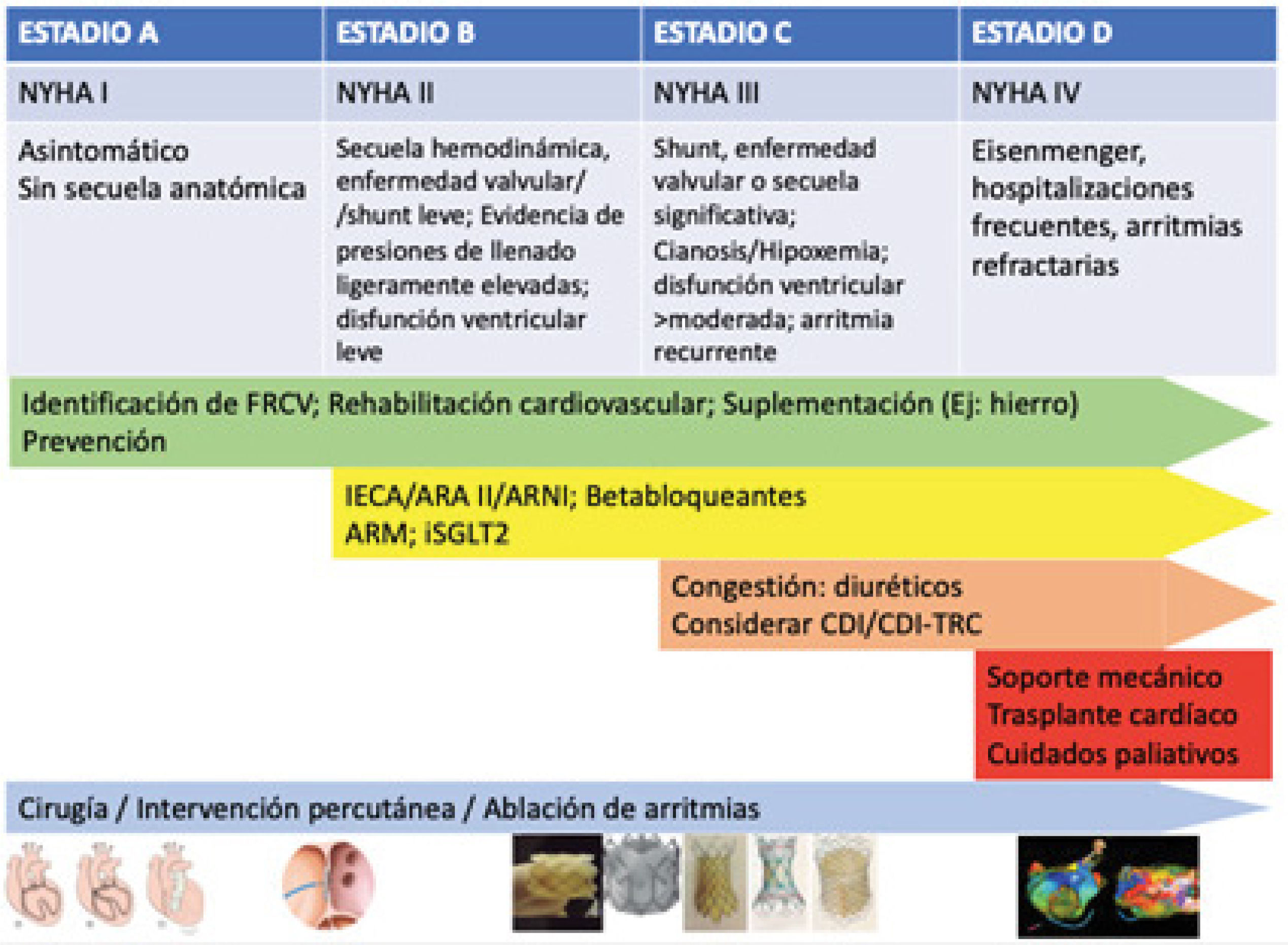
Cuando existe circulación biventricular, y el paciente presenta fallo del ventrículo izquierdo (sistémico) se suele indicar el tratamiento convencional para la IC (esto también es válido para los pacientes sintomáticos con fallo de ventrículo derecho sistémico)13,14. Mientras que el tratamiento de los pacientes con fallo de ventrículo único en circulación de Fontan debe iniciarse con precaución, teniendo en cuenta el equilibrio precario entre la precarga ventricular y la poscarga sistémica13,14. En la figura 3 se propone un algoritmo de seguimiento y tratamiento basándose en la clasificación previamente mencionada anatómico-funcional.
Enfoque escalonado para el manejo de la IC en pacientes con ACHD según la clasificación de IC combinada expuesta previamente.
Abreviaturas: IECA: inhibidor de la enzima convertidora de angiotensina; ARA II: bloqueador del receptor de angiotensina II; ARNI inhibidor del receptor de angiotensina II y de la neprilisina; BB: betabloqueante; TRC: terapia de resincronización cardíaca; ARM: antagonista del receptor de mineralocorticoides; iSGLT2: inhibidor del cotransportador sodio-glucosa tipo 2. Elaboración propia.
Sin embargo, la evidencia demuestra que tratamientos validados en la población con IC adquirida pueden no tener el mismo beneficio terapéutico en pacientes con CC. Las principales limitaciones se deben a que los estudios son retrospectivos, de un solo centro, con diseño de un solo brazo, de corta duración y con variaciones en la fisiología de los pacientes (derivadas de los distintos abordajes quirúrgicos); además existe una falta de métodos estandarizados para medir los desenlaces clínicamente relevantes en esta población. Todo esto puede haber afectado el poder estadístico para detectar cambios sutiles, pero clínicamente significativos en variables como la función ventricular, o pasar por alto posibles beneficios o efectos adversos de la terapia médica dirigida1,5.
A continuación, realizaremos un breve resumen de la evidencia global de diversos grupos farmacológicos hasta la actualidad.
BetabloqueantesSegún el único ensayo prospectivo, aleatorizado, doble ciego y controlado con placebo (en pacientes adultos con TdF con corrección quirúrgica previa, falla del ventrículo derecho y clase funcional NYHA I o II), no se observaron diferencias en los niveles plasmáticos de BNP, VO2, clase NYHA, ni en los volúmenes y fracciones de eyección de ambos ventrículos24. Sin embargo, no existen aún ensayos clínicos aleatorizados de gran escala, sólo estudios observacionales con muestras pequeñas y series de casos que sugieren que los betabloqueantes podrían prevenir el remodelado del ventrículo derecho y mejorar la calidad de vida, la clase funcional NYHA y la tolerancia al ejercicio en pacientes con TGA y disfunción del ventrículo sistémico derecho1,5.
IECA (inhibidor de la enzima convertidora de angiotensina)/ARA II: bloqueador del receptor de angiotensinaEl uso de IECA en pacientes con TdF reparada fue estudiado en el APPROPRIATE trial (“ACE inhibitors in Pulmonary Regurgitation for Right ventrIcular Outflow Tract Protection after TOF rEpAir”): el ramipril no tuvo efecto sobre el volumen ventricular, la clase funcional, la gravedad de la insuficiencia pulmonar ni el consumo pico de oxígeno; no obstante, se observó una mejoría en la fracción de eyección del ventrículo izquierdo (FEVI) y una disminución en la progresión de la disfunción diastólica25. En 2001 Lester et al, realizaron un análisis del losartán en pacientes con ventrículo derecho sistémico en D-TGA con switch atrial, demostrando un beneficio estadísticamente significativo en cuanto a la capacidad de ejercicio26. Ningún estudio a gran escala demostró beneficios en cuanto a mortalidad y progresión de insuficiencia cardíaca.
ARNI (inhibidor del receptor de angiotensina II y de la neprilisina)En 2020 Maurer et al, realizaron un estudio retrospectivo evaluando la eficacia y seguridad del sacubitril/valsartán en pacientes con ventrículo único27. Este estudio no demostró mejoría en la CF según NHYA, NT-proBNP y función sistólica, concluyendo que no existe real beneficio. Sin embargo, Zandstra TE et al, realizaron un estudio prospectivo en pacientes con falla del ventrículo derecho sistémico con FEVI <35%, NHYA II-III, demostrando mejoría en parámetros hemodinámicos, tolerancia del test de marcha de 6 minutos, disminución de congestión hepática, mejoría en la calidad de vida, y en el Strain Longitudinal Global (SLG) y cambio en el área fraccional (FAC) a pesar de no presentar cambios en la FEVI28. Estos beneficios se repitieron en otro estudio posterior, (Fusco et al), agregando también una disminución en los volúmenes de fin de diástole del ventrículo sistémico derecho, y en este caso aumento de la FEVI, además de lo anteriormente mencionado29. Esto hace que exista un poco más de sustento para la utilización de ARNI en este grupo de pacientes seleccionados1,5.
I-SGLT2 (inhibidor del cotransportador sodio-glucosa tipo 2)En 2022, Egorova AD et al, demostraron la utilidad de este grupo farmacológico en pacientes con ventrículo derecho sistémico en la L-TCGV; este estudio arrojó un impacto positivo en las medidas funcionales subjetivas, en los parámetros ecocardiográficos y en la reducción de hospitalizaciones relacionadas con IC30. En el mismo año, Muneuchi J et al. demostraron un aumento en la pérdida de peso, mejor oxigenación sistémica, aumento de la concentración sérica de albúmina y una mejoría en la tasa de filtración glomerular estimada, en pacientes con circulación tipo Fontan1,5,31.
DiuréticosDebido a la mejoría en signos de congestión, se observó un aumento significativo de la capacidad de ejercicio y reducción del empeoramiento de la insuficiencia cardíaca por lo que se recomiendan en pacientes con IC y signos de sobrecarga hídrica.
Trasplante cardíaco en pacientes con cardiopatías congénitasLos datos reportados por la Sociedad Internacional de Trasplante de Corazón y Pulmón (ISHLT) mostraron que, entre 1992 y 2003, el 1,9% del total de los trasplantes cardíacos se realizaron en pacientes con ACHD, cifra que aumentó hasta el 3,1% al considerar los datos entre 2009 y 2017. Aproximadamente el 40% de los pacientes ACHD sometidos a trasplante presentaban fisiología univentricular32.
La transposición de los grandes vasos con disfunción del ventrículo derecho sistémico (adquirida congénitamente o D-transposición con cirugía de switch auricular) fue la siguiente causa en el grupo de trasplante. También se reportaron otras indicaciones menos comunes, como cortocircuitos no reparados o la tetralogía de Fallot28.
Los pacientes con IC por ACHD enlistados para trasplante cardíaco son, en promedio, más jóvenes y presentan un menor porcentaje de obesidad, tabaquismo, enfermedad renal y diabetes en comparación con otras etiologías de IC. Sin embargo, su prioridad en las listas de trasplante cardíaco es baja en comparación con otras causas de IC, permanecen más tiempo en lista de espera, tienen menos probabilidades de recibir un órgano (considerando el mismo nivel de asignación) y enfrentan una mayor tasa de mortalidad mientras están en lista para trasplante33,34.
La supervivencia perioperatoria y la supervivencia al año después del trasplante cardíaco es menor que en los pacientes trasplantados por otras causas; los datos del registro de la ISHLT muestran que el riesgo en los pacientes ACHD sometidos a trasplante fue el doble dentro del primer año en comparación con el grupo de pacientes con cardiopatía adquirida y dependen en gran medida de la cardiopatía subyacente35–37.
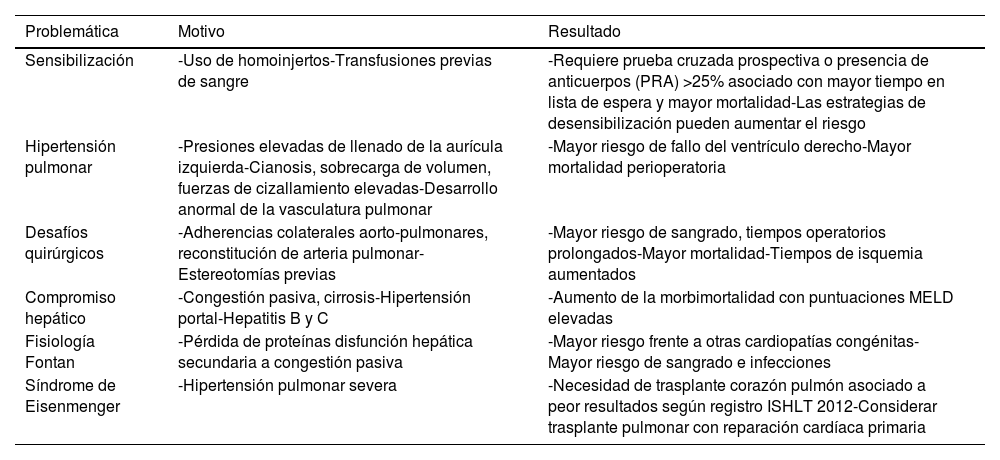
Los tiempos quirúrgicos y los tiempos de isquemia son más prolongados debido a una cirugía más compleja, que generalmente requiere una apertura esternal prolongada, lisis de adherencias, estrategias alternativas de canulación y reconstrucción vascular. Además, el riesgo de sangrado es mayor debido a las características del tejido y al desarrollo de circulación colateral con probabilidad de ruptura. Por esta razón, los factores quirúrgicos representan el 10% de las muertes en pacientes con ACHD, en comparación con el 4% en pacientes sometidos a trasplante por otras causas de IC38. En la tabla 3 se enlistan los diferentes desafíos a los cuales se enfrentan los pacientes con ACHD a la hora de ser considerados candidatos para el trasplante cardíaco39.
Problemáticas específicas de las cardiopatías congénitas que pueden afectar la elegibilidad y el riesgo del trasplante
| Problemática | Motivo | Resultado |
|---|---|---|
| Sensibilización | -Uso de homoinjertos-Transfusiones previas de sangre | -Requiere prueba cruzada prospectiva o presencia de anticuerpos (PRA) >25% asociado con mayor tiempo en lista de espera y mayor mortalidad-Las estrategias de desensibilización pueden aumentar el riesgo |
| Hipertensión pulmonar | -Presiones elevadas de llenado de la aurícula izquierda-Cianosis, sobrecarga de volumen, fuerzas de cizallamiento elevadas-Desarrollo anormal de la vasculatura pulmonar | -Mayor riesgo de fallo del ventrículo derecho-Mayor mortalidad perioperatoria |
| Desafíos quirúrgicos | -Adherencias colaterales aorto-pulmonares, reconstitución de arteria pulmonar-Estereotomías previas | -Mayor riesgo de sangrado, tiempos operatorios prolongados-Mayor mortalidad-Tiempos de isquemia aumentados |
| Compromiso hepático | -Congestión pasiva, cirrosis-Hipertensión portal-Hepatitis B y C | -Aumento de la morbimortalidad con puntuaciones MELD elevadas |
| Fisiología Fontan | -Pérdida de proteínas disfunción hepática secundaria a congestión pasiva | -Mayor riesgo frente a otras cardiopatías congénitas-Mayor riesgo de sangrado e infecciones |
| Síndrome de Eisenmenger | -Hipertensión pulmonar severa | -Necesidad de trasplante corazón pulmón asociado a peor resultados según registro ISHLT 2012-Considerar trasplante pulmonar con reparación cardíaca primaria |
Stout KK, et al. (2016)39.
La prevalencia de los pacientes con CC continúa creciendo. La IC es una complicación frecuente, grave y multifactorial en los ACHD. El abordaje diagnóstico y terapéutico debe ser individualizado, basado en un conocimiento profundo de la anatomía congénita reconociendo que no existen dos pacientes iguales y debe adaptarse el tratamiento a los requerimientos fisiológicos de cada cardiopatía en particular. Aunque los avances médicos y quirúrgicos han mejorado la supervivencia, aún existe un gran vacío en la evidencia científica acerca del tratamiento médico y por lo tanto se necesitan de estudios que generen evidencia robusta y guías específicas para el manejo de la IC en esta población en constante crecimiento.
Conflictos de interés:Los autores declaran no tener conflictos de interés.
Referencias no citadas23.