La crisis miasténica (CM) es una complicación grave y potencialmente fatal de la miastenia gravis autoinmune (MG), caracterizada por un empeoramiento agudo de la musculatura bulbar y respiratoria que puede llevar a insuficiencia respiratoria. Puede presentarse hasta en el 20% de los pacientes con MG, y en algunos casos constituye la manifestación inicial de la enfermedad. El reconocimiento precoz y la intervención temprana son claves para mejorar el pronóstico.
La CM requiere un manejo urgente y multidisciplinario. El soporte respiratorio temprano, la inmunoterapia con inmunoglobulina (IgIV) o plasmaféresis (PLEX) y el uso apropiado de inmunosupresores son fundamentales para obtener buenos resultados. Las investigaciones actuales sobre terapias biológicas ofrecen nuevas alternativas para pacientes con enfermedad refractaria.
El objetivo de este trabajo es comentar la evidencia actual y ofrecer una visión integral de las características clínicas, el enfoque diagnóstico, los factores desencadenantes y las estrategias terapéuticas en el manejo de la CM, sintetizando los mecanismos fisiopatológicos, protocolos de manejo en UCI, intervenciones inmunoterapéuticas y nuevas terapias biológicas.
Myasthenic crisis (MC) is a severe and potentially fatal complication of autoimmune myasthenia gravis (MG), characterized by an acute worsening of bulbar and respiratory muscle weakness that can lead to respiratory failure. It may occur in up to 20% of patients with MG, and in some cases constitutes the initial manifestation of the disease. Early recognition and early intervention are key to improving prognosis.
MC requires urgent, multidisciplinary management. Early respiratory support, immunotherapy with IVIG or PLEX, and appropriate use of immunosuppressants are critical for good outcomes. Current research on biologic therapies offers new alternatives for patients with refractory disease.
This article aims to comment on the current evidence and provide a comprehensive overview of the clinical features, diagnostic approach, triggering factors and therapeutic strategies in the management of MC, synthesizing pathophysiological mechanisms, ICU management protocols, immunotherapeutic interventions and new biologic therapies.
La miastenia gravis autoinmune es una condición que afecta la unión neuromuscular, caracterizada esencialmente por debilidad focal o generalizada, con fatigabilidad muscular como elemento principal. La fatigabilidad corresponde a un fenómeno clínico que puede tener diversos orígenes, en el caso de la fatiga neuromuscular se define como la sensación de agotamiento o disminución de la capacidad energética que el sujeto experimenta, generalmente tras la realización prolongada de una actividad. Habitualmente este síntoma tiende a ser menor al inicio del día y tras el reposo, empeorando a lo largo de las horas y en determinadas circunstancias, como por ejemplo en ambientes calurosos, presencia de fármacos y de infecciones concomitantes.
Las estimaciones actualizadas de la epidemiología de la MG, basadas en análisis poblacional estadounidense, demuestran un aumento en la incidencia y prevalencia reportadas previamente desde hace más de 20 años. Según dichos estudios se estima una incidencia aproximada de entre 31 a 68 casos nuevos por millón de personas-año con una prevalencia aproximada de entre 316,4 a 370 por millón de habitantes1,2.
Los anticuerpos más comunes que se encuentran en pacientes con MG se dirigen contra el receptor de acetilcolina (AChR, por sus siglas en inglés), lo que define el fenotipo clásico de MG seropositiva. Estos anticuerpos están presentes en aproximadamente el 85% de los pacientes con MG generalizada y en aproximadamente el 50% de los pacientes con MG ocular3. Otros anticuerpos relevantes de menor frecuencia son anti-tirosina quinasa músculo específico (MuSK) y anti receptor de lipoproteínas de baja densidad (LRP4). Alrededor del 10 al 20% de los pacientes con miastenia generalizada no tienen anticuerpos anti-AChR en la sangre4.
La MG puede evolucionar como crisis miasténica, condición severa que genera riesgo vital, caracterizada por un deterioro marcado de la fuerza muscular. Esta situación determina una falla respiratoria por compromiso de la musculatura bulbar y/o respiratoria, que requiere intubación y ventilación asistida5. Adicionalmente requiere apoyo alimentario y manejo en unidades de pacientes críticos. La crisis miasténica puede desarrollarse en horas a días, incluso semanas.
IncidenciaLa incidencia anual de crisis miasténica es alrededor de 2,5% de los casos de MG, de acuerdo con un estudio poblacional retrospectivo6,7. Se estima que un 15 a 20% de los miasténicos presentarán una crisis miasténica durante su evolución, la cual se presenta generalmente antes de los 2 a 3 años del inicio de los síntomas. El tiempo medio de presentación de esta complicación esta entre 8 y 12 meses8, existiendo un grupo menor que debuta con una crisis miasténica.
En un estudio alemán, la duración de la intubación endotraqueal se estimó alrededor de 20 días y aproximadamente un 30% de los pacientes se manejaron con ventilación mecánica no invasiva para evitar la intubación9. En un estudio realizado en Mayo Clinic, la crisis miasténica dio cuenta de cerca de un tercio de las fallas respiratorias por causa neuromuscular en las unidades de cuidados intensivos (UCI)10.
La mortalidad descrita en los años sesenta era mayor al 40%, pero con el advenimiento de la ventilación mecánica con presión positiva y el desarrollo de las unidades de pacientes críticos, la mortalidad se ha reducido a alrededor de un 2-5%, que se da principalmente relacionada a las complicaciones médicas y comorbilidades8,11.
Elementos clínicos de alerta previos a una crisis miasténica (banderas rojas)Los signos premonitorios son la debilidad rápida y progresiva de la musculatura respiratoria y bulbar. En la mayoría de los casos el cuadro evoluciona en días o incluso semanas. Muchas veces un paciente miasténico conocido presenta síntomas nuevos o acentuación de la ptosis, disfagia, disartria o paresia extensora cervical12. La debilidad de la musculatura bulbar puede generar obstrucción de la vía aérea superior. Se debe realizar una evaluación de la función respiratoria, tanto inspiratoria como espiratoria. La determinación de la capacidad vital (CV), fuerza inspiratoria negativa (NIF) y fuerza espiratoria positiva son parámetros útiles en el seguimiento de casos en evaluación13.
Es fundamental la detección de los signos clínicos de alerta (banderas rojas), como hallazgos inminentes de una crisis miasténica. La presencia de signos premonitorios y banderas rojas son un factor muy importante en la detección y manejo precoz de las crisis14 (Tabla 1).
Signos clínicos de alerta de crisis miasténica probable
| Infecciones febriles recientes |
| Capacidad vital <1 500ml (hombres) o <1 000ml (mujeres) |
| Tos insuficiente |
| Disartria afónica |
| Debilidad de músculos erectores cervicales (cabeza caída) |
| Barbilla caída: la mandíbula inferior cae hacia abajo después de masticar (durante un tiempo prolongado) |
| Debilidad facial de reciente inicio o progresiva |
| Disfagia progresiva-Salida de alimentos por la nariz, voz nasal progresiva-Tos gatillada por la deglución-Baja de peso debido a disfagia o problemas para tomar alimentos |
Como factor de riesgo destacan: edad mayor de 50 años, crisis previa, una enfermedad severa, compromiso bulbar, presencia de anticuerpos anti-MuSK y timoma15. Por otro lado, la presencia de síntomas leves desde el inicio de la enfermedad por más de 12 meses pronostica un bajo riesgo de exacerbación.
La media del nivel de anticuerpos anti-AChR, es mayor en pacientes que presentan crisis miasténica16.
Factores desencadenantesOtro punto relevante en la crisis miasténica son los factores generadores, que podrían producir una crisis en un paciente ya diagnosticado o de novo. El principal gatillo son las infecciones agudas (30-50%), especialmente las respiratorias, ya sean respiratoria altas, bronquiales o pulmonares. Contrariamente, en torno al 20-30% pueden ocurrir sin factor desencadenante17.
Los medicamentos son un factor desencadenante importante y frecuente. Dentro de los antibióticos destacan los macrólidos, fluoroquinolonas y aminoglucósidos18. Los esteroides, que paradójicamente son un tratamiento clásico de la MG, también pueden ser un factor desencadenante. Esto ocurre más habitualmente en presencia de uso de dosis altas, pacientes mayores, o con compromiso bulbar o severo; por lo cual esta alternativa terapéutica debe usarse con extremo cuidado en pacientes con signos premonitorios y de alerta19.
Otro desencadenante a considerar son las cirugías, con especial mención a las crisis posteriores a una timectomía. El riesgo aumenta en las cirugías que presentan mayor tiempo operatorio, pérdida sanguínea significativa (más de 1 litro), presencia de timoma y cuando se realiza una timectomía transesternal (versus por videoscopia)20.
CLÍNICALa crisis miasténica en pacientes con diagnóstico previo, se caracteriza por una acentuación progresiva de los síntomas y signos miasténicos. Generalmente con evolución rápida de los signos bulbares, disartria nasal, habla arrastrada, disfagia, regurgitación nasal, tos ineficiente, además de la disminución de fuerza de la musculatura cervical posterior. La presencia de debilidad diafragmática produce el signo clásico de respiración paradojal, con expansión torácica baja y aparición de uso de musculatura accesoria (escalenos, esternocleidomastoideos y abdominales). Por último, aparece debilidad en las extremidades21,22. Existen casos que presentan solo falla respiratoria aguda. De igual modo, la debilidad de la musculatura orofaríngea y bulbar puede ocasionar una obstrucción severa de la vía aérea, produciendo aspiración y falla respiratoria17,23.
Un desafío diagnóstico mayor es que un quinto de los pacientes no tienen el antecedente de miastenia, siendo la CM su primera manifestación23.
Además de la evaluación clínica y seguimiento estricto de los pacientes, es relevante el estudio y análisis de la función respiratoria. En relación a la función inspiratoria se considera indicadores de debilidad respiratoria significativa, una CV menor de 1 litro (o >20-25ml/kg) o la NEF menor de 20 cmH2O. Se estima que, dentro de estos parámetros, el criterio menos predictivo es la CV24,25.
Crisis colinérgicaHistóricamente la crisis colinérgica, producida por exceso uso de anticolinesterásicos, se planteaba como diagnóstico diferencial en pacientes con miastenia conocida. En estos pacientes, además de la debilidad muscular asociado a la toxicidad nicotínica, destacan los signos clásicos muscarínicos como sudoración, salivación excesiva, bradicardia y fasciculaciones, entre otros.
Es importante incluir la crisis colinérgica en el diagnóstico diferencial al evaluar un paciente con sospecha de CM, pero en la actualidad es poco frecuente. En pacientes con CM es recomendable la reducción o suspensión de anticolinesterásicos, para evitar el exceso de secreciones traqueobronquiales26,27.
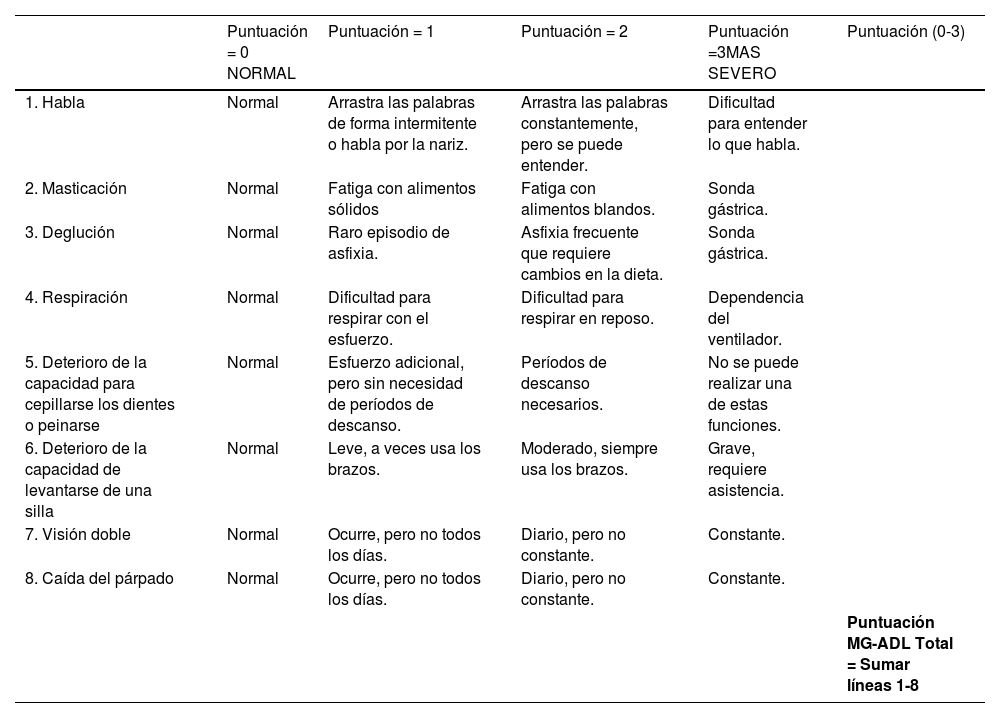
Manejo de crisis miasténicaTodas las crisis miasténicas deberían ser admitidas en UCI. Para definir la necesidad de apoyo en una UCI se pueden utilizar diversas escalas de actividades de la vida diaria como la MG Activity of Daily Living (ADL) Scale (Tabla 2), que a través de su puntuación refleja su severidad. Un score superior a 18 puntos predice la necesidad de UCI con una sensibilidad de 75% y especificidad de 78%28.
Escala miastenia gravis actividades de la vida diaria (MG-ADL)29
| Puntuación = 0 NORMAL | Puntuación = 1 | Puntuación = 2 | Puntuación =3MAS SEVERO | Puntuación (0-3) | |
|---|---|---|---|---|---|
| 1. Habla | Normal | Arrastra las palabras de forma intermitente o habla por la nariz. | Arrastra las palabras constantemente, pero se puede entender. | Dificultad para entender lo que habla. | |
| 2. Masticación | Normal | Fatiga con alimentos sólidos | Fatiga con alimentos blandos. | Sonda gástrica. | |
| 3. Deglución | Normal | Raro episodio de asfixia. | Asfixia frecuente que requiere cambios en la dieta. | Sonda gástrica. | |
| 4. Respiración | Normal | Dificultad para respirar con el esfuerzo. | Dificultad para respirar en reposo. | Dependencia del ventilador. | |
| 5. Deterioro de la capacidad para cepillarse los dientes o peinarse | Normal | Esfuerzo adicional, pero sin necesidad de períodos de descanso. | Períodos de descanso necesarios. | No se puede realizar una de estas funciones. | |
| 6. Deterioro de la capacidad de levantarse de una silla | Normal | Leve, a veces usa los brazos. | Moderado, siempre usa los brazos. | Grave, requiere asistencia. | |
| 7. Visión doble | Normal | Ocurre, pero no todos los días. | Diario, pero no constante. | Constante. | |
| 8. Caída del párpado | Normal | Ocurre, pero no todos los días. | Diario, pero no constante. | Constante. | |
| Puntuación MG-ADL Total = Sumar líneas 1-8 |
Dentro del manejo en UCI, resulta fundamental el cuidado de la vía área. Una temprana intubación y ventilación mecánica son quizás los pasos más importantes y así evitar las complicaciones de una intubación de urgencia.
Indicaciones para intubaciónDebido a la naturaleza fluctuante de la miastenia, no es recomendable utilizar un único parámetro para predecir la necesidad de soporte ventilatorio. La saturación de oxígeno y los gases arteriales no son suficientemente sensibles para ser usados de forma aislada16.
Algunos parámetros utilizados en la decisión de intubación son:
- 1.
Signos de distrés respiratorio con taquipnea y disminución de volumen pulmonar.
- 2.
Severa disfunción bulbar, tos débil y dificultad para manejo de secreciones.
- 3.
Hipercarbia progresiva.
- 4.
Presencia de atelectasias y aspiración significativa en radiografías de tórax.
La regla 20/30/40 (Capacidad vital (VC) <20ml/kg; una Fuerza Inspiratoria Negativa (NIF) peor que -30 cmH2O; y una Presión Espiratoria Máxima (PEM) <40 cmH2O) es una herramienta útil para guiar las decisiones con respecto a la intubación20.
Algunos expertos sostienen que una VC de menos de 15ml/kg, un volumen corriente de menos de 4 a 5ml/kg, NIF peor de 20 cmH2O o PEM de menos de 40 cmH2O indican la necesidad de intubación15. Sin embargo, es importante señalar que la decisión de intubar es siempre una decisión clínica integral y no debe depender únicamente de mediciones de parámetros aislados.
Extubación y traqueostomíaEl destete debería ser considerado cuando hay una mejoría clínica significativa con adecuado VC (>15ml/kg). Para el destete se debe enfatizar la determinación diaria de los siguientes parámetros: oxigenación satisfactoria, PaO2/FiO2 ≥200, Presión Positiva de Espiración (PEEP) ≤8 cmH2O, que el paciente presente un nivel de conciencia suficiente y la capacidad para toser eficazmente. Después de la extubación, se recomienda un período de observación de 48 horas en UCI antes del traslado a una unidad de menor complejidad.
Los predictores de fracaso de extubación incluyen edad >50 años, antecedentes de crisis miasténica, complicaciones pulmonares (atelectasia, neumonía), intubación de larga duración y VC baja en el momento de la extubación30,31.
Uso de ventilación no invasivaLa ventilación no invasiva provee poco soporte a la musculatura respiratoria. No es ideal para un paciente con fatiga muscular. Puede ser útil previo y posterior a la intubación. En general, el uso inicial de la ventilación no invasiva se asocia con una duración del soporte ventilatorio y estancia en UCI más corta. Una prueba con BiPAP antes de que se produzca la hipercapnia puede prevenir la intubación y la ventilación prolongada, reduciendo así las complicaciones pulmonares y la duración de la estancia en UCI y en el hospital32.
TRATAMIENTOInmunoglobulinas y plasmaféresisAproximadamente entre el 15% y el 20% de los pacientes experimentan crisis respiratorias al menos una vez en la vida. La mortalidad de la primera crisis es aproximadamente del 2 al 5%12. Históricamente las intervenciones de rescate utilizadas para prevenir la progresión a la CM son la inmunoglobulina intravenosa (IgIV) y plasmaféresis (PLEX)33,34.
Diversos estudios controlados aleatorios sugieren que las dos intervenciones son iguales en eficacia, pero no hay evidencia clara con respecto a su intercambiabilidad o superioridad35.
Inmunoglobulinas intravenosasLas preparaciones de IgIV contienen inmunoglobulina humana extraídas de diferentes donantes. El modo de acción exacto no está claro. Parecen estar involucrados en procesos reguladores de las células T y B. Algunos mecanismos conocidos serían: la modulación de autoanticuerpos, inhibición del complemento, la disrupción del complejo de ataque a membranas (CAM) y modulación de citoquinas e inmunidad celular36.
La IgIV se ha utilizado durante décadas como terapia de rescate en la miastenia gravis a pesar de su precio y disponibilidad. La dosis estándar de inmunoglobulina es de 2 gramos por kilogramo, dosis total repartida en 3 a 5 días.
Por varios factores, entre los cuales se incluyen la conveniencia y simplicidad de su aplicación, en los últimos años se ha observado una tendencia a preferir la inmunoglobulina por sobre la plasmaféresis. Además, en pacientes sin una comorbilidad medica relevante (como insuficiencia renal, diabetes mellitus, hipertensión arterial o estados de hipercoagulabilidad), la inmunoglobulina es segura y ofrece un efecto favorable a largo plazo.
Los efectos colaterales habituales de la IgIV son cefalea, escalofríos, mialgias e hipertensión transitoria. Estos efectos se relacionan principalmente con el inicio del tratamiento y con la velocidad de infusión de la terapia. Aun cuando se describen complicaciones graves, en general resultan poco frecuentes; entre ellas están la meningitis aséptica transitoria, trombosis venosa profunda, anemia hemolítica, reacciones anafilácticas y el deterioro de la función renal en pacientes susceptibles37,38.
Plasmaféresis (PLEX)Este procedimiento involucra la remoción, regreso o intercambio del plasma sanguíneo usando técnicas específicas. Estas técnicas pueden ser mediante la centrifugación (basado en gravedades diferenciales de las moléculas) o en filtración de membrana (basado en tamaños diferenciales de las moléculas). Una de las diferencias clave entre estas dos técnicas es que, en la centrifugación, el plasma filtrado se elimina y se utiliza plasma de un donante y coloides como reemplazo. En la filtración por membrana, el plasma se devuelve al paciente. Por lo general, el procedimiento estándar implica 5-6 sesiones en días alternos, con un volumen diario de 2-4 litros. Una técnica más reciente implica la inmunoadsorción específica de antígeno.
La plasmaféresis requiere acceso venoso central, que pudiera ser un factor limitante para utilizar el procedimiento.
Plasmaféresis vs. inmunoglobulinas intravenosasTradicionalmente, los expertos han catalogado a la inmunoglobulina y la plasmaféresis como procedimientos igualmente efectivos en el tratamiento de la miastenia severa o de las crisis miasténicas. La selección de cada procedimiento se basa en factores como las características del paciente, la experiencia institucional, accesibilidad y experiencia y guías prácticas de la institución.
También existen ciertas concepciones sobre las características de cada procedimiento en el uso clínico que se resumen en la siguiente tabla 339.
Comparación de beneficios y desventajas de inmunoglobulinas y plasmaféresis
| Aspectos | Plasmaféresis | Inmunoglobulinas EV |
|---|---|---|
| Ventajas | - Adecuado para intervención inmediata- Eliminación rápida de anticuerpos que pudieran generar enfermedad | - Adecuado para intervención inmediata- Requiere intervención mínimamente invasiva- Adecuado para el ambulatorio- No elimina la terapia aplicada |
| Desventajas | - Procedimiento invasivo que requiere acceso vascular- Requiere instrumentos especiales y personal capacitado- Elimina la terapia utilizada previamente | - Opción de tratamiento más costosa- Puede haber escasez de suministros |
Se han realizado estudios clínicos para comparar diversos aspectos de estos procedimientos. En un estudio aleatorizado de 199740, se evaluó la tolerabilidad y eficacia de PLEX vs IgIV en miastenia gravis exacerbada. Se utilizó la escala Myasthenic Muscular Score (MMS) a los 15 días como resultado primario. De 87 pacientes, 41 fueron a PLEX en tres sesiones y 46 recibieron IgIV en dosis diarias de 0,4g/kg/día durante 3 o 5 días consecutivos. El estudio no reveló diferencias significativas en términos de eficacia, pero se observó una mejor tolerabilidad en el grupo de pacientes tratados con inmunoglobulina. El esquema de 5 días de IgIV no fue superior al esquema de 3 días.
En otro estudio multicéntrico retrospectivo se comparó la eficacia y la tolerabilidad de ambos tratamientos34. El estudio analizó el tratamiento de 54 episodios de crisis miasténica y observó el estado ventilatorio de los pacientes a las 2 semanas (incluida la capacidad de extubación) y el resultado funcional al cabo de 1 mes. Los pacientes del grupo PLEX tuvieron 5-6 sesiones realizadas en días alternos. Los pacientes del grupo IgIV recibieron 0,4g/kg/día de IgIV durante un total de 5 días. El estudio demostró que la plasmaféresis produjo resultados superiores en comparación con la IgIV en términos de extubación a las 2 semanas y resultados funcionales al mes. Sin embargo, la tasa de complicaciones fue mayor con PLEX en comparación con la IgIV, observándose complicaciones de naturaleza cardiovascular e infecciosa.
Más recientemente, en 2022, Wang et al41, realizaron un estudio de cohorte prospectivo que involucró a 40 pacientes con crisis miasténica, todos los cuales tenían anticuerpos anti-AChR positivos. Sus hallazgos indicaron que la plasmaféresis se asoció con una estadía más corta en la UCI y una mejoría clínica más rápida. Sin embargo, la eficacia clínica al mes fue similar con ambos tratamientos. El tratamiento con IgIV se asoció con una disminución significativa del título de anticuerpos anti-AChR.
En 2010, Barth et al.42, realizaron un estudio aleatorizado en pacientes con miastenia gravis moderada a grave, comparando la eficacia de la IgIV frente a la PLEX. El estudio contó con 84 pacientes e incluyó no solo a pacientes con crisis miasténica, sino también a pacientes con miastenia gravis con una puntuación cuantitativa de miastenia grave (Quantitative Myasthenia Gravis Scale, QMG) >10,5 y empeoramiento de la debilidad. No se excluyeron a los pacientes seronegativos, y la presencia de anticuerpos anti-AChR y anticuerpos anti-MuSK se consideraron como un hallazgo que apoyaba el diagnóstico. Los pacientes fueron aleatorizados a grupos de tratamiento que incluían IgIV o PLEX. El grupo de IgIV recibió 1g/kg/día de IgIV durante 2 días consecutivos. El grupo PLEX recibió 5 sesiones de intercambio de plasma en total realizadas cada 2 días. Este estudio proporcionó evidencia clase 1 de eficacia comparable con 1g/kg/día de IgIV o 5 sesiones de PLEX en pacientes con miastenia gravis de moderada a grave. La presencia de un peor estado clínico inicial y títulos positivos anti-AChR sugirieron una mejor respuesta a ambas terapias.
Murthy et al43, realizaron un estudio retrospectivo de 23 episodios de crisis miasténica tratados con PLEX o IgIV. El resultado primario fue el número de días necesarios para la estabilización de la enfermedad, medido por el tiempo necesario para la extubación del paciente. El tiempo de estabilización de la enfermedad fue de 8 días en el grupo PLEX y de 10 días en el grupo IgIV. En conclusión, este estudio retrospectivo demostró que tanto la IgIV como la PLEX tienen la misma eficacia en la estabilización de la enfermedad, medida según el número de días necesarios para la extubación.
Pavlekovics et al. en 202344 realizaron una revisión sistemática y un metaanálisis de la eficacia y seguridad de PLEX frente a IgIV en la miastenia gravis de moderada a grave, con especial atención en un control más rápido de las recaídas. Dos ensayos clínicos aleatorizados cumplieron los estrictos criterios de inclusión para el metaanálisis sumando un total de 114 pacientes. El estudio incluyó a pacientes con miastenia gravis moderada (QMG de 10 a 16) y miastenia gravis severa (QMG >16). No se demostraron diferencias significativas entre los dos tratamientos en términos de perfiles de efectos secundarios. El PLEX podría tener un efecto mayor como lo demuestra la diferencia en la puntuación QMG de más de 2,5 puntos de mejoría con PLEX en comparación con IgIV a las 2 semanas. Desde un punto de vista práctico, los autores consideramos ambas alternativas como válidas y la elección se debe basar en las características de cada paciente, la situación clínica y la presencia de comorbilidades que puedan contraindicar alguna de ellas.
PiridostigminaLa piridostigmina debe suspenderse en pacientes intubados con CM. Su potencial beneficio, aunque escaso, se ve contrarrestado por el riesgo de promover la secreción y la formación de tapones mucosos. El uso de piridostigmina también dificulta la evaluación de la respuesta a otras terapias. Por otro lado, una pausa en el tratamiento puede aumentar la respuesta a la piridostigmina20,45. La piridostigmina puede reiniciarse antes de la retirada gradual de la ventilación mecánica en pacientes que se recuperan de CM. La infusión intravenosa de piridostigmina va de la mano de una valoración del riesgo de su uso, pues puede gatillar arritmias complejas.
CorticoidesEn pacientes que no reciben corticoides al momento de una descompensación y debido al riesgo de profundización de esta, muchos expertos aconsejan diferir el inicio de los corticoides para después de la plasmaféresis o inmunoglobulina, hasta que se observe el efecto buscado22,45. Muchas veces se pueden iniciar si es que el paciente ya se encuentra intubado. Una vez intubado o luego de la mejoría clínica después de la plasmaféresis o la inmunoglobulina intravenosa es posible utilizar dosis moderadas a altas de prednisona. En el caso de un paciente inestable, se puede preferir un inicio escalonado. Es importante tener en cuenta que los corticosteroides pueden aumentar el riesgo de miopatía del paciente crítico. Si existe una infección significativa, el tratamiento con corticosteroides debe retrasarse hasta que la infección esté controlada.
InmunosupresoresLos medicamentos inmunosupresores, como la azatioprina, el micofenolato mofetil, el tacrolimus, el metotrexato y la ciclosporina, no son particularmente útiles durante la CM, principalmente debido a su inicio de acción retardado (tabla 5). El inicio de terapia con inmunosupresores debe considerar las comorbilidades del paciente, los efectos secundarios y el costo de los medicamentos, así como la preferencia del especialista neuromuscular. Su uso se contempla idealmente al finalizar el tratamiento agudo en la UCI o en el ámbito ambulatorio.
Latencias de las principales terapias de miastenia gravis
| Terapia | Latencia del efecto |
|---|---|
| PE/IA (plasmaféresis/inmunoadsorción) | Menor a 1 semana |
| IVIG (inmunoglobulina intravenosa) | Menor a 1 semana |
| Cortisona | 3-4 semanas |
| Azatioprina | 3-9 (-12) meses |
| Micofenolato | 6-12 meses |
| Rituximab | 2-3 meses |
| Timectomía | Meses - años |
Pese al efecto retardado se puede plantear el inicio de inmunosupresión durante el tratamiento de la CM, en especial en paciente con escasa tolerancia a los corticoides. De los fármacos disponibles se prefiere frecuentemente la azatioprina como primera opción. La dosificación óptima de azatioprina se basa en el recuento total de leucocitos y linfocitos: se debe aspirar a un recuento absoluto de linfocitos de 0,6-1,0 linfocitos/nanolitros, evitando una leucopenia por debajo de 3,0 linfocitos/nanolitros45.
La aparición de una crisis bajo inmunosupresión efectiva (miastenia gravis refractaria al tratamiento) suele ser motivo para escalar a rituximab, que se administra tras completar la terapia de recambio plasmático o la terapia con inmunoglobulina intravenosa. El rituximab ha demostrado eficacia en la miastenia seropositiva para anticuerpos anti-AChR y más aún en la miastenia anti-MuSK (+), la que a menudo responde de manera insatisfactoria a los inmunosupresores convencionales. Se administra en dos dosis de 1g con un intervalo de 14 días, siguiendo un esquema similar al tratamiento de la artritis reumatoide45.
El efecto terapéutico comienza aproximadamente entre 8 y 12 semanas después de la administración. Sin embargo, la evidencia de su eficacia en la miastenia gravis refractaria al tratamiento se basa únicamente en análisis retrospectivos y series de casos, por lo que su uso sigue siendo fuera de indicación (off-label).
Fármacos nuevos potencialmente útiles en crisis miasténicaDesde su aprobación, el eculizumab se ha convertido en una nueva opción de terapia de escalación para la MG previamente refractaria al tratamiento. Al unirse a la proteína C5, interrumpe la cascada del complemento y puede usarse como coadyuvante en terapias inmunosupresoras existentes.
El eculizumab se ha utilizado en un escaso número de pacientes que no obtuvieron respuesta a la IgIV, la plasmaféresis o ambas. La mayoría presentaba anticuerpos anti-AChR. En los estudios se han observado mejoras rápidas y sostenidas, que generalmente se produjeron dentro de los 10 días posteriores a la primera dosis de eculizumab46,47. En la mayoría de los pacientes, se suspendió la ventilación invasiva y no invasiva, sin observarse efectos secundarios significativos. Las guías del Consenso Internacional para el Manejo de la Miastenia Gravis de 2020, recomiendan considerar el eculizumab en el tratamiento de la MG generalizada, grave y refractaria, con anticuerpos anti-AChR positivo48.
Otro fármaco utilizado es el efgartigimod, el cual se une al FcRn (receptor Fc neonatal) que se une a la inmunoglobulina IgG e interrumpe el proceso de reciclaje y reduce los niveles de IgG, incluidos los anticuerpos anti-AChR, en la sangre, debido a lo que es considerado como una “plasmaféresis médica”. Pese a lo anterior su respuesta es más lenta, en torno a las 1 a 2 semanas 22,49.
Timectomía y riesgo de crisis miasténicaLa timectomía no se considera parte del tratamiento de la CM. Eventualmente pueden existir situaciones puntales en las que es necesario su realización, por ejemplo, si existe una necesidad urgente de extirpar un timoma debido a posibles complicaciones cardiopulmonares y riesgo de metástasis. En estos casos, se puede realizar una timomectomía cuando el paciente se encuentra hemodinámicamente estable mientras permanece intubado. Idealmente, debería realizarse después de la administración de IgIV o PLEX para minimizar la debilidad48.
Alguno factores de riesgos pre y posoperatorios para desarrollar una CM tras la timectomía se resumen en un metaanálisis de 202050, donde se describieron los siguientes factores de riesgo independientes para desarrollar una CM post timectomía: antecedentes preoperatorios de CM, síntomas bulbares preoperatorios, estadío de Osserman de MG preoperatoria IIb a IV, dosis preoperatorias altas de piridostigmina, niveles séricos preoperatorios elevados de anticuerpos anti-AChR (> a 100nm/l), función pulmonar anormal previa a la cirugía, complicaciones posoperatorias mayores, duración de la enfermedad antes de la timectomía, pérdida sanguínea, toracotomía, infección pulmonar posoperatoria y timoma.
CONCLUSIÓNLa CM es una condición de riesgo vital caracterizada por una debilidad severa y progresiva de la musculatura respiratoria y/o bulbar, que ocurren en hasta un quinto de las MG autoinmunes. Su detección precoz es fundamental en pacientes miasténicos conocidos, teniendo una especial atención en las condiciones de exacerbación y los signos de alerta. Por otro lado, se debe mantener un alto índice de sospecha en los pacientes que debutan su MG con una crisis y falla respiratoria. Los avances del manejo respiratorio y las unidades de cuidado intensivo han reducido significativamente la mortalidad en la actualidad, manteniéndose como pilares fundamentales, las terapias con inmunoglobulinas intravenosas y la plasmaféresis. Resulta de gran importancia el concientizar tanto a médicos residentes de las unidades de paciente crítico y no especialistas, como educar a los paciente y familiares que padezcan de MG sobre los síntomas premonitores, pues de esta forma se pueden prevenir las complicación asociadas a esta severa condición.
Conflictos de interésLos autores declaran no tener conflictos de interés.
FinanciamientoLos autores declaran no haber recibido financiamiento para la redacción de este manuscrito.