La neuromodulación por estimulación eléctrica del sistema nervioso constituye una novedosa estrategia terapéutica para mitigar el dolor crónico. Se ha mostrado que la electroacupuntura (EA) activa las fibras nerviosas de manera similar a la estimulación eléctrica directa de los nervios periféricos. La diferencia estriba en que la EA constituye una estimulación percutánea, por medio de agujas, menos invasiva que la cirugía requerida para el implante de electrodos en los nervios periféricos. En modelos de dolor neuropático se ha demostrado que la EA modula múltiples sistemas interconectados del organismo. A nivel de la médula espinal, la EA activa vías serotoninérgicas, adrenérgicas, colinérgicas y de opiáceos; así como mecanismos presinápticos asociados a la despolarización de aferentes primarias. También se ha demostrado que sus efectos se extienden a la neuroglia. Caracterizar los parámetros de la EA como intensidad, frecuencia y duración del pulso es de relevancia para provocar la neuromodulación de la eficacia sináptica en la médula espinal, así como para el desarrollo de protocolos para el tratamiento del dolor neuropático.
Neuromodulation by electrical stimulation of the nervous system constitutes a novel therapeutic strategy in the treatment of pain. It has been shown that electroacupuncture (EA) may activate afferent fibres in a similar manner to direct electrical stimulation of peripheral nerves. The difference is that EA is a percutaneous stimulation using needles, and is less invasive than the surgery required for the implantation of electrodes in the peripheral nerves. In neuropathic pain models, it has been shown that EA modulates multiple interconnected systems in the body. At the level of the spinal cord, EA activates serotonergic, adrenergic, cholinergic, and opioid pathways, as well as presynaptic mechanisms associated with primary afferent depolarisation. It has also been shown that EA effects extend to neuroglia. The characterisation of EA parameters as intensity, frequency, and duration of pulses is essential for the induction of neuromodulation of synaptic transmission at the spinal cord level, and consequently, it could be used for the development of optimal therapeutic actions in pain treatment.
La Asociación Internacional para el Estudio del Dolor define el dolor como una experiencia sensorial y emocional desagradable asociada con daño tisular real o potencial, o descrita en términos de dicho daño1. Woolf propuso en 2010 clasificar el dolor en 3 tipos: nociceptivo, inflamatorio y neuropático2. El dolor nociceptivo resulta de estímulos de gran intensidad que se perciben como nocivos. En función de la fuente del dolor nociceptivo este puede ser visceral o somático. El dolor inflamatorio está asociado a daño tisular y a la infiltración de células inmunitarias. El dolor neuropático es producto del daño directo al sistema nervioso, ya sea por algún traumatismo o como resultado de alguna enfermedad neurodegenerativa, como sería el caso de la diabetes. En el paciente, el dolor neuropático se caracteriza clínicamente por la presencia de alodinia, es decir, un estímulo inocuo que normalmente no produce dolor comienza a ocasionarlo. También refieren hiperalgesia, en que los estímulos nocivos generan una sensación exacerbada y prolongada de dolor en el sitio de daño y en áreas adyacentes2,3.
En la actualidad, el tratamiento farmacológico del dolor neuropático incluye a los agonistas opiáceos, antiinflamatorios no esteroideos, antidepresivos tricíclicos y anticonvulsivos4,5. Desafortunadamente, se ha reportado que los fármacos disminuyen el dolor en aproximadamente un 50%, y sus efectos son variables en magnitud6. Además, se ha reportado que su uso prolongado desencadena efectos secundarios no deseados, tales como alteraciones motoras, vegetativas y centrales6. En atención a lo cual, se continua en la búsqueda de estrategias terapéuticas que complementen y mejoren tales tratamientos.
La neuromodulación es una técnica que se emplea para aumentar o disminuir la excitabilidad de un grupo de neuronas mediante la aplicación de pulsos eléctricos, a través de electrodos de estimulación o de un catéter con fármacos administrados en distintas regiones del sistema nervioso7. La investigación básica ha dilucidado diversos mecanismos plausibles asociados a la neuromodulación, los cuales incluyen cambios en la expresión de receptores neuronales en el axón, las dendritas y el cuerpo celular, así como en la cinética y en contenido y la liberación de los neurotransmisores. También se han reportado modificaciones en la actividad de los astrocitos y la microglía que acompañan y regulan el medio ambiente cercano de las neuronas7.
Se conocen diversas técnicas de neuromodulación: a) estimulación nerviosa transcutánea; b) estimulación nerviosa percutánea; c) estimulación de nervios periféricos; d) estimulación medular; e) estimulación cortical profunda, y f) administración de fármacos intraespinales e intracerebroventriculares8. Estas técnicas pueden producir cambios neuroplásticos a corto o largo plazo en el sistema nervioso central.
La acupuntura forma parte de la medicina tradicional china y se ha empleado durante muchos años para el tratamiento de diferentes condiciones de salud. La electroacupuntura (EA) es una variante relativamente reciente de la acupuntura, que consiste en aplicar pulsos de corriente eléctrica a través de agujas insertadas en sitios específicos del cuerpo denominados puntos de acupuntura9,10. Los pulsos eléctricos de la EA tienen como parámetros la frecuencia, la intensidad y la anchura; los cuales pueden ser ajustados y estandarizados para conseguir un determinado efecto, como es el caso de la analgesia. En años recientes, se ha considerado la EA un tratamiento complementario para atender diversas afecciones médicas, incluyendo el dolor neuropático. Actualmente se están realizando estudios clínicos controlados y metaanálisis para determinar el alcance clínico de esta9. Diversos estudios han demostrado que la EA modula la eficacia sináptica de distintos circuitos neuronales a través de la activación de las fibras nerviosas, de manera similar a la estimulación eléctrica aplicada directamente a los nervios periféricos11. La diferencia estriba en que la EA es una estimulación percutánea, por medio de agujas, en un área muy pequeña de la piel; por lo cual, existe menor riesgo de traumatizar los tejidos, en comparación con el implante de electrodos requerido para la estimulación directa de los nervios periféricos que amerita cirugía.
En la presente revisión se analizan algunos estudios efectuados en modelos animales de dolor neuropático, los cuales han demostrado los efectos neuromoduladores de la EA sobre las neuronas nociceptivas de la médula espinal. Se enfatizan los mecanismos asociados a la despolarización de aferentes primarios, los sistemas de inhibición descendente y la interacción con la neuroglia.
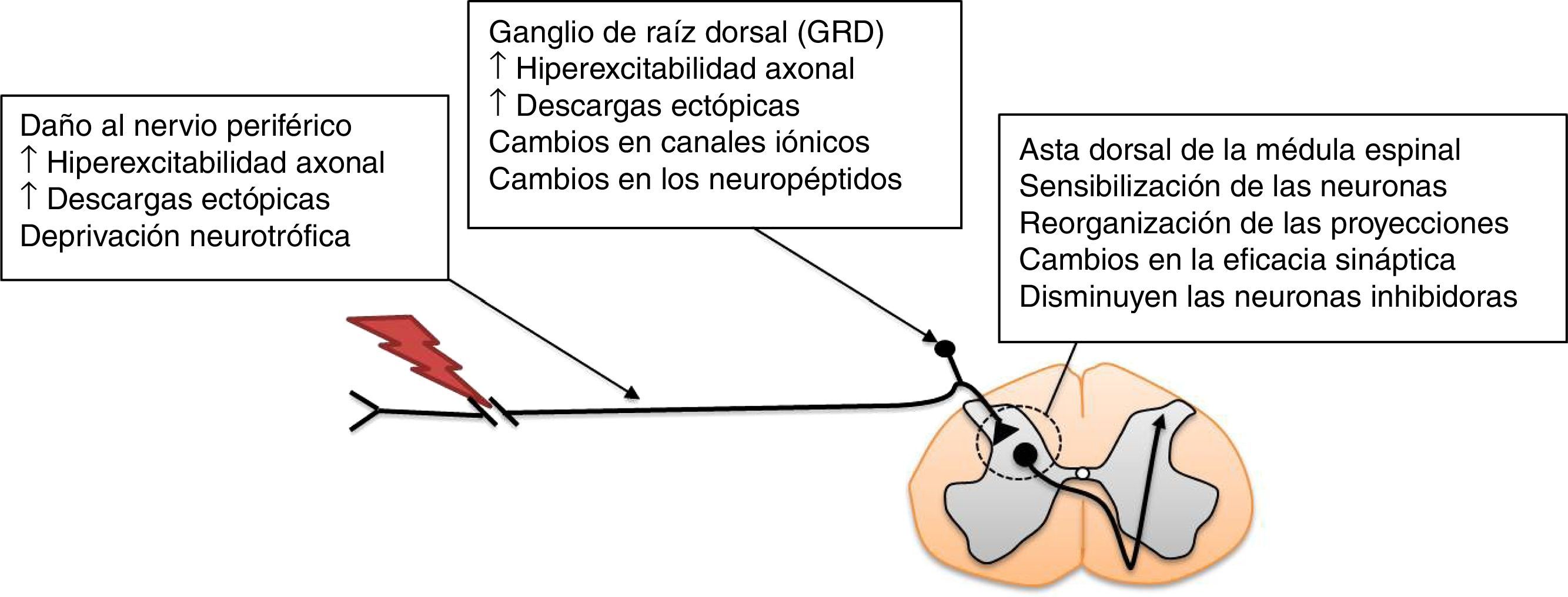
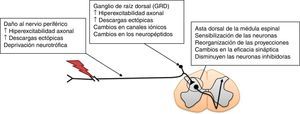
Modelos animales para el estudio del dolor neuropáticoEl dolor neuropático puede ser provocado de manera experimental mediante diversos procedimientos. Entre estos se encuentran: a) la resección del extremo caudal de los nervios espinales sacros S1 y S2; b) la lesión por constricción crónica del nervio ciático, y c) la ligadura del nervio espinal L512,13. Tales modelos animales presentan conductas álgicas como hiperalgesia mecánica, térmica y alodinia14. Estas respuestas conductuales son similares a las observadas en humanos, y se utilizan para determinar la eficacia de la EA para el tratamiento del dolor neuropático12,13,15. Se ha mostrado que existen distintos procesos neuroplásticos que ocurren después de la lesión de un nervio periférico y que contribuyen al desarrollo de la respuesta dolorosa exagerada en intensidad y duración en el asta dorsal de la médula espinal, también denominada sensibilización central (fig. 1). Estos procesos patogénicos conducen, en última instancia, al dolor neuropático16. La sensibilización central implica no solo la participación de neuronas, sino también de la interacción con la neuroglia17.
Mecanismos que participan en la patogénesis del dolor neuropático en la médula espinal. Adaptada de Navarro et al., 200716.
Los nervios periféricos interactúan sinápticamente en las neuronas de la médula espinal, de tal manera que la actividad de algunos de ellos modifica la eficacia sináptica de otros18. La estimulación eléctrica y prolongada de las fibras aferentes Aδ, del nervio ciático, provocan una depresión a largo plazo (long-term depression [LTD]) de los potenciales de campo en las neuronas de la sustancia gelatinosa de la médula espinal, y generados por la activación de las fibras C19,20. La estimulación autogénica de alta frecuencia del nervio articular posterior también produce depresión de los potenciales espinales provocados por otras fibras aferentes articulares21. Tales observaciones indican que la activación de las fibras aferentes primarias modula la eficacia sináptica en la médula espinal22.
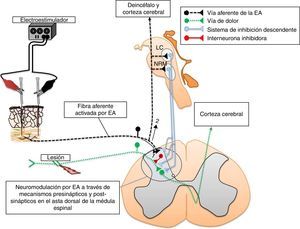
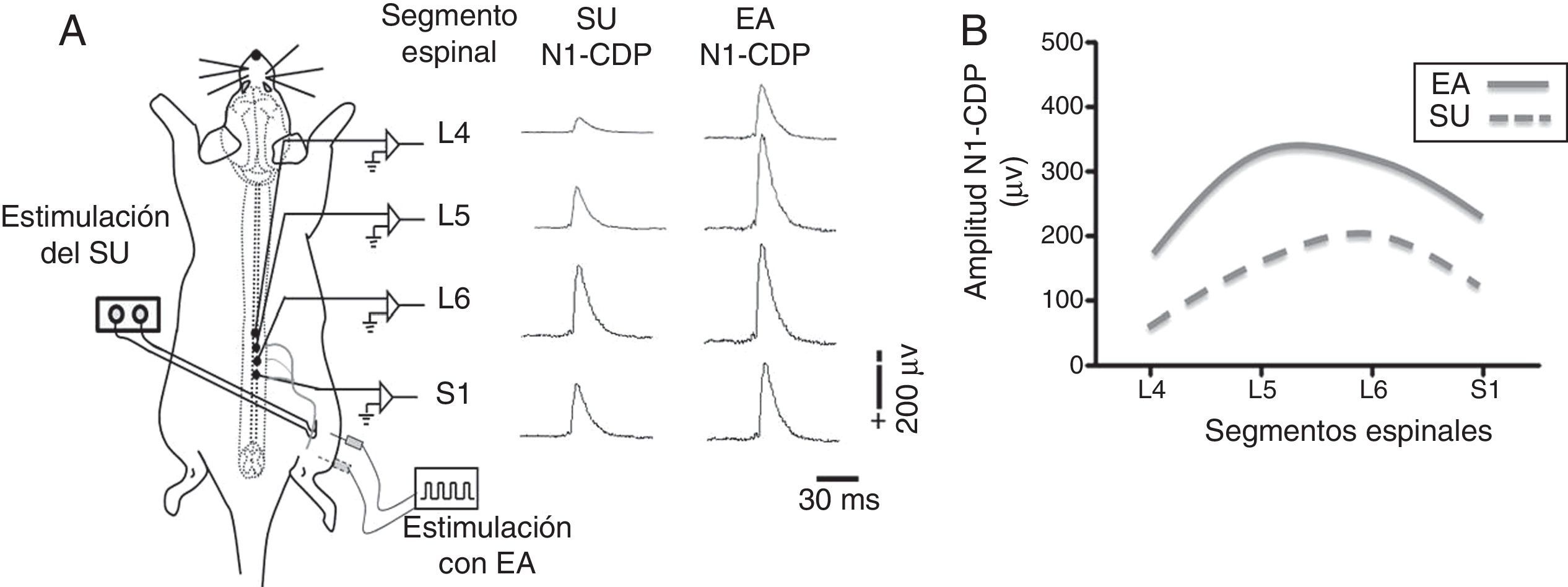
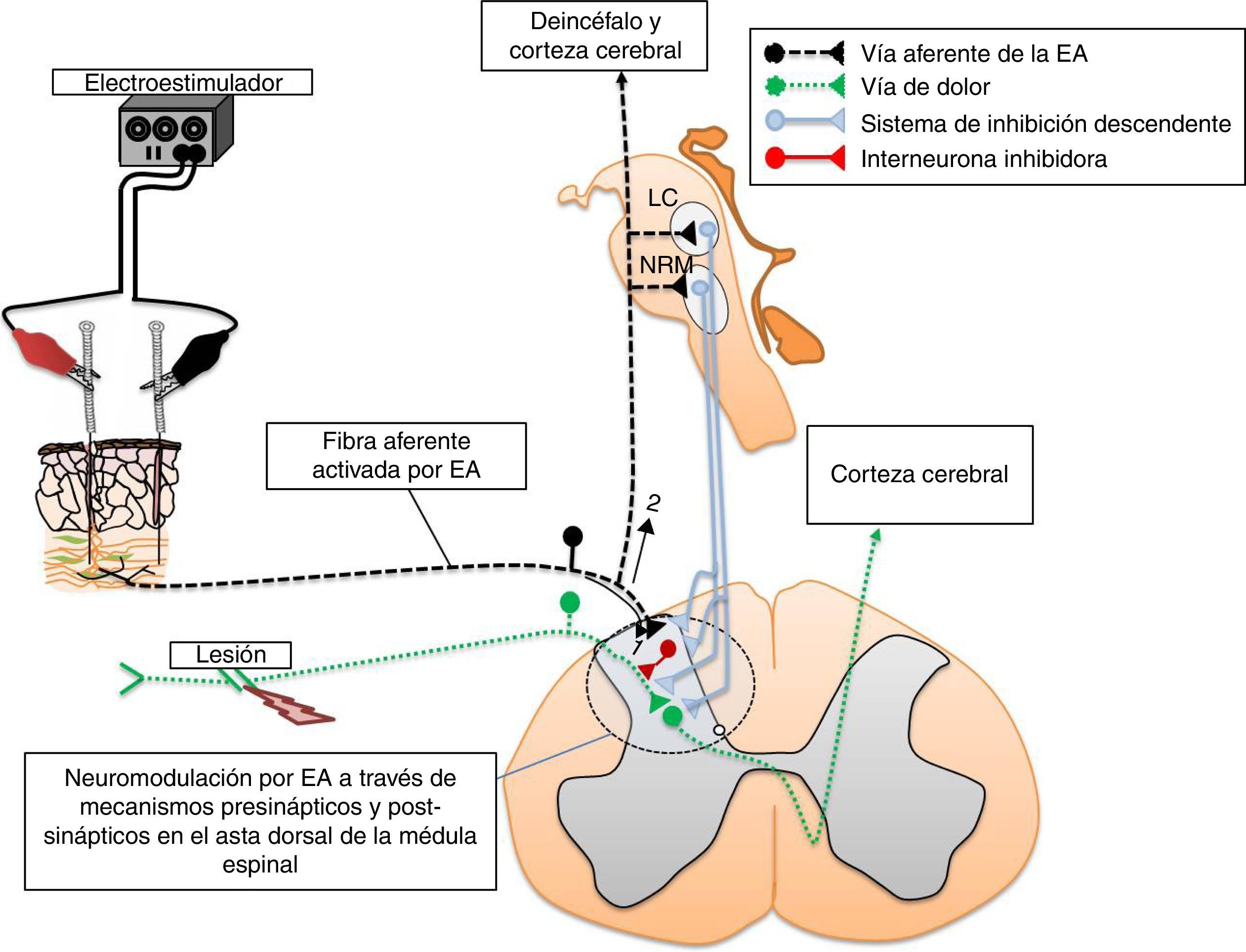
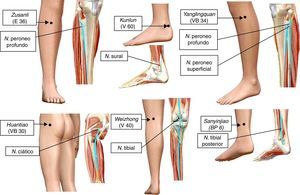
La electroacupuntura y la eficacia sináptica en la médula espinalAlgunos puntos de acupuntura guardan una relación anatómica con los trayectos de los nervios periféricos (fig. 2). Por tal situación, la estimulación de estos puntos puede producir cambios significativos en la transmisión sináptica, de manera similar a la estimulación directa de los nervios periféricos11,23. Se ha demostrado experimentalmente que la EA deprime la actividad nociceptiva de las neuronas localizadas en las láminas IV-VII de la médula espinal24. Aunado a estos cambios, produce LTD de los potenciales de campo provocados por la estimulación de fibras C y registrados en el asta dorsal de la médula espinal de ratas con dolor neuropático25. En la médula espinal existe una convergencia de los estímulos provenientes de los nociceptores, así como de aquellos generados por la EA. En esta estructura, la actividad nociceptiva de las neuronas puede ser deprimida por mecanismos inhibitorios pre-y postsinápticos15,26,27. Nuestro grupo de trabajo ha demostrado la existencia de una importante superposición, en varios segmentos de la médula espinal, de la actividad neuronal producida por la entrada sensorial de bajo umbral con aquella generada por la EA (fig. 3). Tal evidencia podría indicar que las fibras aferentes sensoriales de bajo y alto umbral, así como aquellas activadas por la EA, excitan grupos de neuronas en la cuales convergen ambos estímulos para producir la neuromodulación de la eficacia sináptica11,15,28.
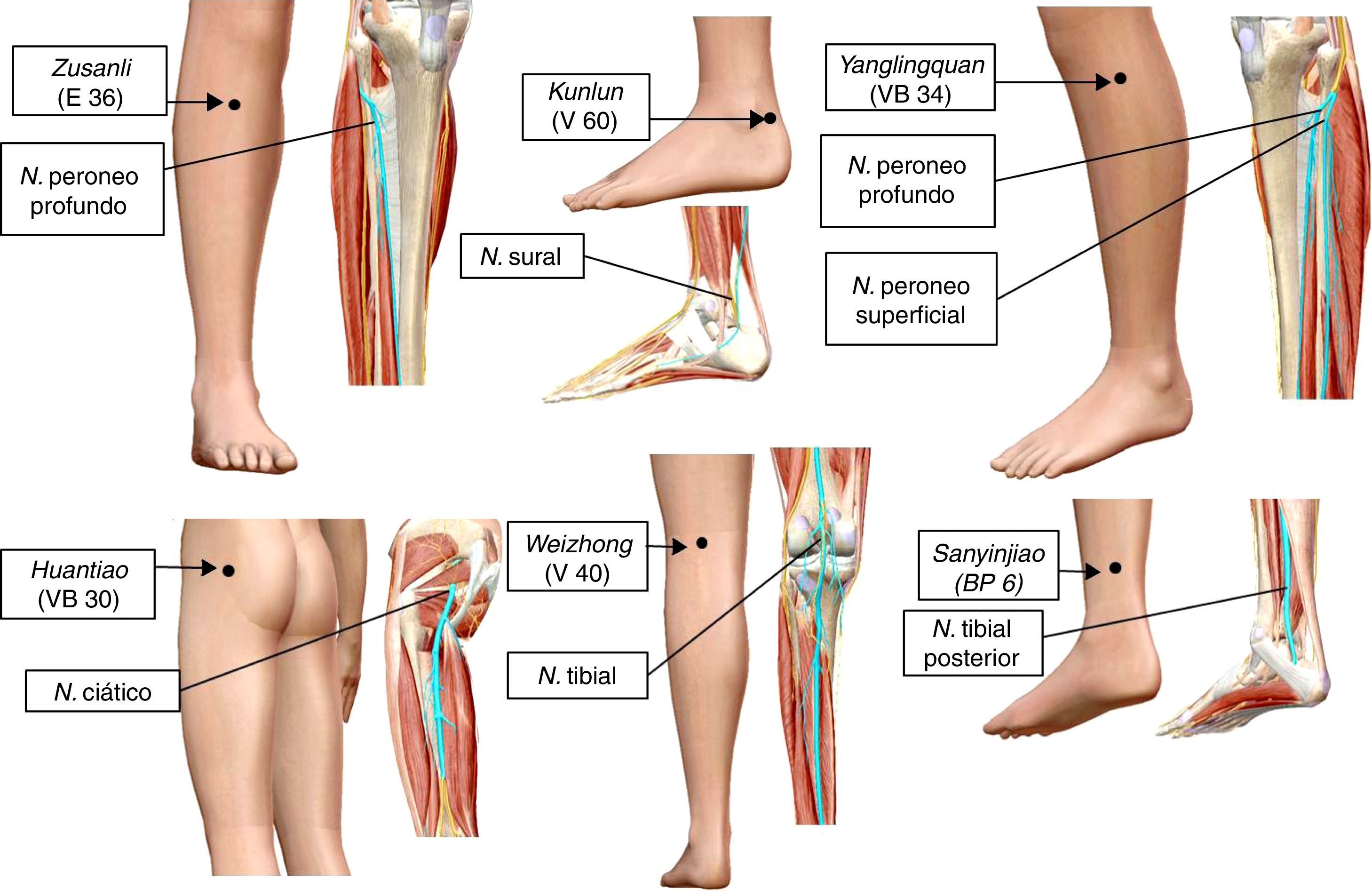
Trayectos nerviosos y puntos de acupuntura en el humano utilizados para evaluar los efectos neuromoduladores de la electroacupuntura (EA) sobre las neuronas del asta dorsal de la médula espinal, en modelos animales de dolor neuropático, E: Estómago; N.: nervio; V: Vejiga; VB: Vesícula Biliar; BP: Bazo Páncreas.
Potenciales del dorso de la médula espinal (cord dorsum potential [CDP]) producidos por el estímulo del nervio sural (SU) y estimulación con electroacupuntura (EA) en Zusanli (E 36) y Sanyinjiao (BP 6). A. Representación esquemática del protocolo experimental y del primer componente negativo del CDP (N1-CDP) producido por estímulos eléctricos únicos aplicados al nervio SU y por la EA, y registrados en los segmentos espinales L4-S1. B. Representación gráfica de la distribución longitudinal de la amplitud del componente N1-CDP producido por la estimulación del nervio SU y por la EA. Adaptada de Quiroz-González et al., 201411.
En la médula espinal, las neuronas nociceptivas del asta dorsal se encuentra bajo la influencia de vías descendentes serotoninérgicas, noradrenérgicas y encefalinérgicas. Sus cuerpos neuronales se localizan en el núcleo del rafe, el núcleo paragigantocelular, el locus coeruleus, y la sustancia gris periacueductal, respectivamente29. Las neuronas espinales colinérgicas, GABAérgicas y del sistema opiáceo se encuentran bajo la influencia sináptica de las fibras aferentes de alto y bajo umbral de activación, así como de los sistemas de inhibición descendente29. Estas neuronas asumen un papel primordial en la neuromodulación de los estímulos nociceptivos a nivel de la médula espinal, y no es sorprendente que también participen en los mecanismos neuromoduladores de la EA. Se ha demostrado que los sistemas de inhibición descendente, así como la despolarización de las fibras aferentes primarias, son mecanismos por medio de los cuales la EA modula la neurotransmisión en la médula espinal15. Asimismo, los estudios de neuroquímica y neurobiología molecular han revelado que tales cambios se acompañan de modificaciones en la expresión de receptores, en la liberación de neurotransmisores, neuromoduladores, así como de la liberación de las citocinas antiinflamatorias por la microglía30,31.
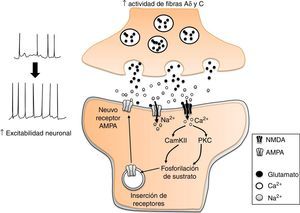
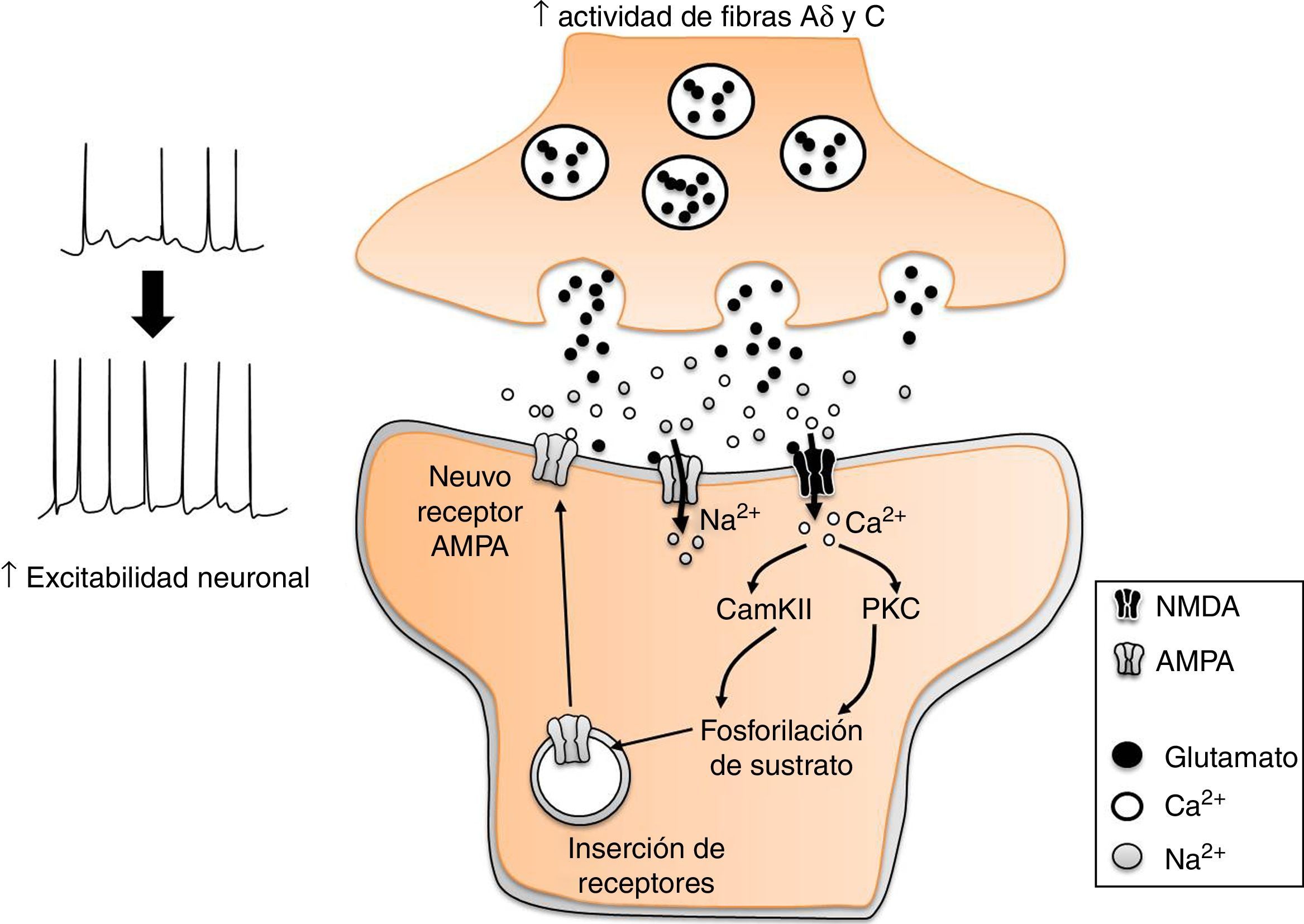
Glutamato y aspartatoSe conoce que el aumento en la actividad de las fibras aferentes nociceptivas Aδ y C, incrementa la liberación de glutamato en las terminales nerviosas que establecen contacto sináptico con neuronas del asta dorsal, lo que a su vez produce el aumento en la expresión de receptores postsinápticos en las neuronas de tal región espinal (fig. 4). Estos cambios producen un incremento en la excitabilidad neuronal para la transmisión de la nocicepcion16. Los efectos antinociceptivos de la EA (2Hz) en los acupuntos Zusanli (E 36), Weizhong (V 40) y Huantiao (VB 30) se acompañan de una disminución significativa en la concentración de glutamato y aspartato en la médula espinal lumbar32, así como en la expresión de la subunidad receptora NMDA-NR2B33. Tales efectos son reducidos por la administración intratecal de naloxona (antagonista de los receptores opiáceos), idazoxano (antagonista α2-adrenérgico) y propranolol (antagonista β-adrenérgico), pero no por la aplicación de prazosina (antagonista α1-adrenérgico)33,34. Lo anterior sugiere que la EA disminuye la actividad glutamatérgica por la activación de receptores opiáceos y adrenoceptores α2 y β.
Participación del glutamato en la sensibilidad central en el dolor neuropático. El incremento en la actividad de las fibras Aδ y C, incrementa la liberación de glutamato en las neuronas nociceptivas de la médula espinal. Esto desencadena diversos procesos mediados por el influjo de Ca2+ a la neurona, como la fosforilación y expresión de receptores AMPA a la membrana plasmática. El resultado es un incremento en la excitabilidad neuronal.
Los receptores purinérgicos P2X son una familia de canales iónicos que se activan por la unión del trifosfato de adenosina (ATP). Se han identificado 7 subtipos de receptores P2X, los P2X1-P2X735. El receptor P2X3 se localiza en las neuronas nociceptivas del ganglio de raíz dorsal (GRD) así como en el asta dorsal espinal36. Este receptor favorece la nocicepción37. Recientemente, Wang et al38 demostraron que la EA de 2 y 100Hz aplicada en los acupuntos Zusanli (E 36) y Yanglingquan (VB 34) deprime las corrientes iónicas en las neuronas del GRD inducidas por ATP38. Además, observaron que tales efectos se incrementan por la administración del fármaco A-317491, un antagonista del receptor P2X3; lo que posiblemente indica que la EA inhibe la transmisión en las fibras aferentes nociceptivas por un bloqueo de los receptores P2X3.
OpiáceosLos opiáceos antinociceptivos como la endomorfina, la encefalina y la dinorfina son ligandos endógenos de los receptores μ, δ y κ, expresados en la médula espinal39. La EA de baja frecuencia (2Hz) induce la liberación de endomorfina y encefalina. En contraste, la EA de alta frecuencia (100Hz) produce la liberación de dinorfina, mientras que la de 15Hz favorece la liberación de los 3 opiáceos40. En modelos de dolor neuropático, la EA de 2 y 15Hz produce efectos más prolongados y robustos que la EA de 100Hz24,41. Los programas de EA que incluyen la combinación de 2, 15, y 100Hz activan a los 3 receptores opiáceos, y también pueden desencadenar efectos analgésicos de mayor intensidad que aquellos obtenidos por la aplicación de una sola frecuencia de estimulación41.
Serotonina y adrenorreceptoresLa serotonina (5-HT) y sus receptores, 5HT1 y 5HT3, disminuyen la actividad nociceptiva de la médula espinal42. Se ha mostrado una disminución en los efectos antialodínicos de la EA (2Hz) por la aplicación de fármacos antagonistas de los receptores α2-adrenérgicos (yohimbina), del subtipo serotoninérgico 5-HT1A (NAN-190) y el subtipo 5-HT3 (MDL 72222), pero no por la administración de prazosina (antagonista del adrenoceptor α1) o de cetanserina (antagonista del receptor 5-HT2A)34. Esto sugiere que los receptores α2-adrenérgicos espinales, 5-HT1A y 5-HT3 serotoninérgicos, pero no los receptores α1-adrenérgicos o 5-HT2A, están involucrados en el efecto analgésico de la EA.
Receptores colinérgicosEn neuronas del asta dorsal superficial y profunda de la médula espinal se expresan receptores nicotínicos y muscarínicos cuya activación produce analgesia42. Los efectos antialodínicos de la EA de 2Hz en Zusanli (E 36) disminuyen por la administración intratecal de atropina (antagonista muscarínico no selectivo) y pirenzepina (antagonista muscarínico, M1). Estos resultados sugieren que los receptores muscarínicos espinales, especialmente del subtipo M1, median la antialodinia inducida por EA43.
Neurotransmisores inhibidoresDurante la patogénesis del dolor neuropático, se ha observado una disminución en las corrientes postsinápticas inhibidoras mediadas por receptores GABAA, que son registradas en neuronas espinales44. Ello indicaría una notable reducción en la liberación de GABA en el asta dorsal espinal. La EA de 2Hz, aplicada en los acupuntos Weizhong (V 40) y Huantiao (VB 30), aumenta la expresión de los receptores GABAérgicos en la médula espinal lumbar y reduce sustancialmente el umbral de las respuestas mecánicas y térmicas en un modelo de dolor neuropático45. También se ha mostrado que los efectos antialodínicos de la EA de 2Hz, aplicada en el acupunto Zusanli (E 36), disminuyen significativamente después de la administración intratecal de gabazina (antagonista del receptor GABAA) o baclofeno (antagonista del receptor GABAB)46. Estos resultados sugieren que los receptores GABAA y GABAB participan en el efecto antinociceptivo de la EA de baja frecuencia y que esta se encuentra mediada, al menos parcialmente, por la activación de mecanismos inhibidores GABAérgicos espinales46.
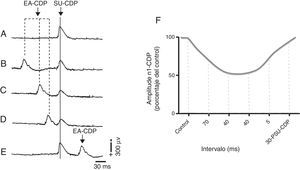
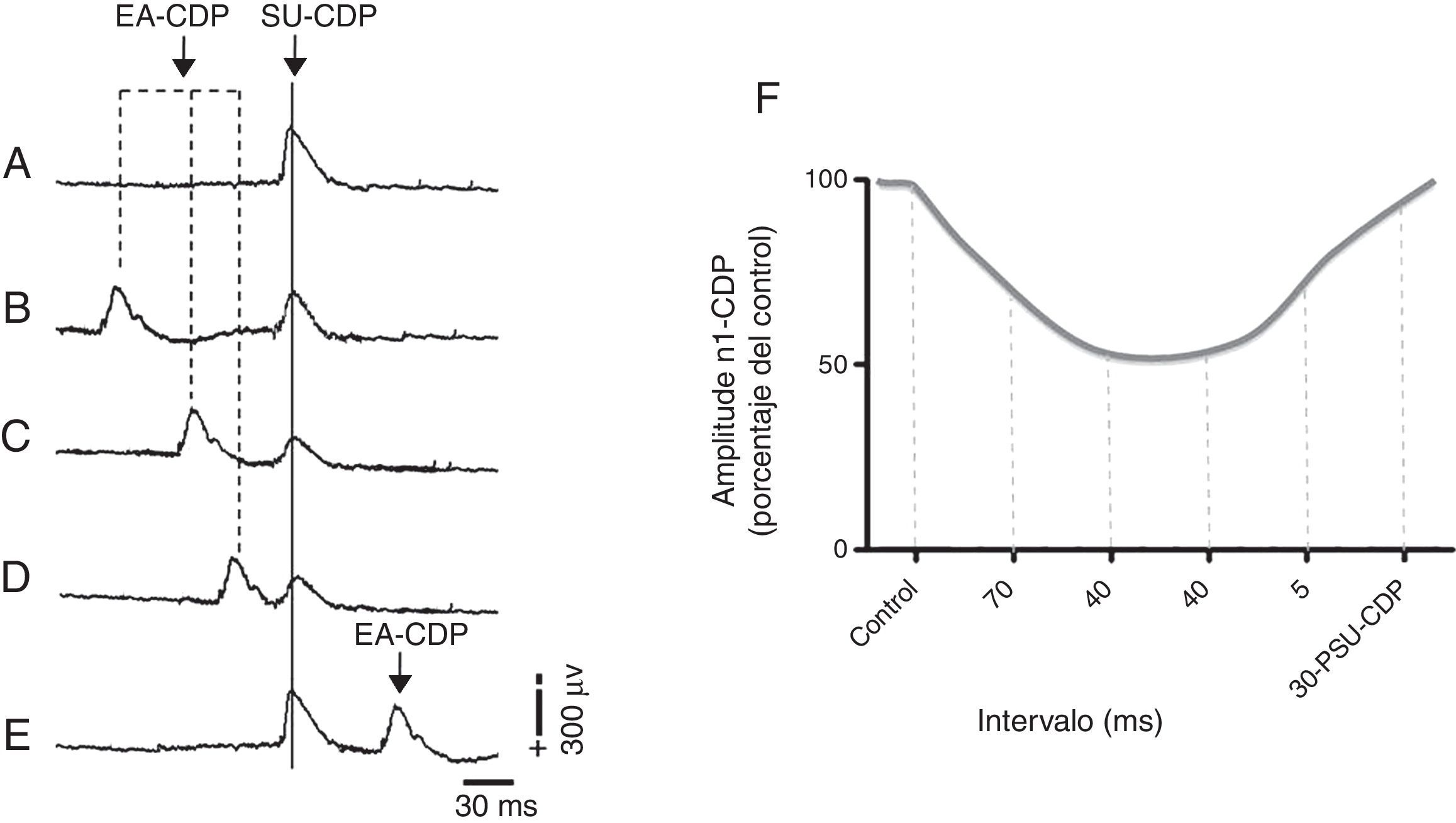
Recientemente nuestro grupo mostró que la EA de 2 y 100Hz, en los acupuntos Zusanli (E 36) y Sanyinjiao (BP 6), deprime la actividad de las neuronas espinales que reciben influencias sinápticas excitadoras de aferentes sensoriales de bajo umbral de activación en el nervio sural11. Tal depresión se produce en el intervalo de tiempo entre 5 y 90ms, y es parcialmente revertido por picrotoxina (un antagonista del receptor GABAA). El curso temporal de la depresión provocada por la estimulación con EA (fig. 5) es semejante a la depresión producida durante la despolarización de fibras aferentes y la inhibición presináptica47. Debido a que la estimulación con EA ejerce efectos analgésicos y antinociceptivos modulando la actividad de las neuronas del asta dorsal espinal y deprimen las respuestas neuronales generadas por la excitación de vías sensoriales de alto y bajo umbral de activación, podría proponerse la participación de mecanismos presinápticos GABAérgicos en la médula espinal como mediadores de los efectos analgésicos de la acupuntura para el tratamiento del dolor neuropático.
Inhibición del primer componente negativo del potencial del dorso de la médula espinal (N1-CDP) producido por el estímulo eléctrico del nervio sural (SU-CDP) y registrado en el segmento espinal L6 antes de la EA (A) durante la EA de 2Hz en Zusanli (E 36) y Sanyinjiao (BP 6), 70ms, previo al estímulo de prueba aplicado al nervio sural (B), 40ms (C), 20ms (D), y 30ms después de la respuesta N1-CDP producida por el nervio sural (E). Representación gráfica del porcentaje de reducción de la amplitud del componente N1-CDP durante la estimulación con EA. 30-PSU-CDP: 30ms posterior al componente N1 del CDP producido por el estímulo eléctrico del nervio sural; CDP: cord dorsum potential; EA: electroacupuntura. Adaptada de Quiroz-González et al., 201411.
En la médula espinal, el factor neurotrófico derivado de la glía (glial cell-line derived neurotrophic factor [GDNF]), y sus receptores GFRA-1, ejercen efectos analgésicos sobre el dolor neuropático experimental48. Este factor limita el crecimiento de las fibras aferentes de bajo umbral en la lámina II49; deprime las descargas ectópicas espontáneas en las fibras aferentes nociceptivas, y promueve la liberación de somatostatina: un neuropéptido analgésico endógeno no opiáceo50. Además, suprime la producción del neuropéptido Y, que se genera por la lesión nerviosa51. Se ha mostrado que la EA de 60 y 2Hz, en los acupuntos Huantiao (VB 30) y Yanglingquan (VB 34), incrementa la expresión del GDNF y la de su receptor GFRα-1 en las células del GRD, así como en el cuerno dorsal de la médula espinal52. En conjunto, las evidencias sugieren que el GDNF y el receptor GFRα-1 participan en las acciones antinociceptivas de la EA en la modulación del dolor neuropático.
Modulación de la neurogliaEstudios en diferentes laboratorios han evidenciado que la microglía y los astrocitos en la médula espinal participan en el mantenimiento y la patogénesis del dolor neuropático53. Las metaloproteinasas de la matriz extracelular (matrix metalloproteinases [MMP]) favorecen la activación glial y, en consecuencia, la neuroinflamación54. La MMP-9 induce dolor neuropático y la activación de la microglía durante las primeras etapas de neuroinflamación, mientras que la MMP-2 mantiene el dolor neuropático y la activación de astrocitos durante el proceso de inflamación54. Como resultado de la lesión, la microglía y los astrocitos liberan sustancias pronociceptivas que aumentan la transmisión del dolor. Entre estas figuran prostaglandinas, citocinas proinflamatorias, ATP, aminoácidos excitatorios y óxido nítrico55. En tales condiciones, la EA de 2Hz —aplicada en el acupunto Zusanli (E 36)— disminuye la actividad de MMP-9 y MMP-256 y reduce las actividades de las citocinas proinflamatorias, el factor de necrosis tumoral alfa (TNF-α), las interleucinas 1 beta (IL-1β) y la IL-6. En macrófagos cultivados, la inmunoglobulina G (IgG) inhibe la producción de MMP-957. Según esto último, se propone que la EA suprime los valores de MMP-9 mediante la regulación positiva de la IgG sérica56. La EA también disminuye la expresión de IL-1β, IL-6 y TNF-α que se encuentran en los nervios periféricos y en el GRD. Estas observaciones indican que la EA disminuye significativamente el incremento en los valores de citocinas proinflamatorias generadas por la lesión nerviosa58.
En la patogénesis del dolor neuropático se ha encontrado una regulación positiva en la expresión de la ciclooxigenasa-2 (COX-2) en el asta dorsal de la médula espinal, así como de la MAPK p-38, una proteincinasa activada por estrés e inflamación59,60. Ambas moléculas participan en la iniciación y mantenimiento de la hipersensibilidad al dolor después de la lesión nerviosa61,62. La EA de 2 y 100Hz, en los acupuntos Zusanli (E 36) y Kunlun (V 60), disminuye la expresión de la MAPK p-p38; la activación del OX-42 (un marcador de microglía), y la inmunorreactividad de la COX-263.
Se ha demostrado que los complejos de señalización Ephrin-B/EphB participan en el desarrollo y mantenimiento del dolor crónico después de la lesión del nervio periférico64. Estos complejos activan a los astrocitos y a la microglía, regulando positivamente la fosforilación de los receptores NR1, NR2B y N-metil-D-aspartato65. Tales procesos incrementan la expresión de los receptores de glutamato en el asta dorsal de la médula espinal y, por ende, favorecen la entrada excitadora nociceptiva66. Se ha reportado que la EA modula la actividad de los astrocitos y la microglía al disminuir el incremento en la expresión del ARN mensajero de Ephrin-B1 en el asta dorsal de modelos animales con dolor neuropático67.
Las células gliales de la médula espinal expresan receptores P2X4, TLR2/4 y NMDA, los cuales participan en la modulación de la actividad neuronal68. Por lo tanto, la EA podría inhibir la activación glial vía receptores TLR4 y NMDA58.
Óxido nítricoEl óxido nítrico es un gas que actúa como molécula mensajera en el sistema nervioso y participa en la sensibilización periférica y central después de la estimulación nociva69. El óxido nítrico modula las vías nociceptivas del asta dorsal potenciando la liberación de neurotransmisores pronociceptivos, tales como el glutamato y la taquicinina: una molécula que participa en la síntesis de la sustancia P70. La EA (1Hz), en los acupuntos Zusanli (E 36) y Sanyinjiao (BP 6), disminuye la inmunorreactividad de la sintasa de óxido nítrico en las láminas superficiales de la médula espinal71; lo que sugiere que la disminución en el contenido de los neurotransmisores pronociceptivos como el glutamato32 también ocurre mediante la modulación de la expresión de la sintasa del óxido nítrico en las neuronas espinales (fig. 6)72.
Receptores de potencial transitorio vanilloideLos receptores de potencial transitorio (transient receptor potential [TRP]) constituyen una extensa familia de receptores cuyo papel fundamental consiste en la transducción de distintas modalidades somatosensoriales en los mamíferos. La familia del receptor de potencial transitorio vanilloide (TRPV) comprende 6 subtipos, TRPV1-673,74. Se ha reportado que la sobreexpresión de los canales TRPV1 y TRPV4 en el GRD y en el asta dorsal de la médula espinal asumen un papel fundamental en la hiperalgesia térmica y mecánica en el dolor neuropático e inflamatorio75–77. En el modelo de dolor neuropático por ligación del nervio espinal L5, la EA de 2Hz en Zusanli (E 36), disminuye la alodinia mecánica; así como la sobreexpresión del canal TRPV1 en el GRD de los segmentos espinales L4 y L678. Se ha demostrado la coexpresión del canal TRPV1 con varios neuropéptidos, incluyendo el péptido relacionado con el gen de la calcitonina (CGRP), en los ganglios sensoriales y las fibras sensoriales C y Aδ79. La activación de canal TRPV1 promueve la liberación de CGRP desde la terminal nerviosa80, agravando la sintomatología del dolor neuropático81,82. Los efectos de la EA sobre la regulación a la baja del canal TRPV1 también se acompañan de una disminución en la expresión de CGRP en el GRD78. En otros modelos de dolor crónico, la EA (2Hz) en Zusanli (E 36) y Shangjuxu (E 37) disminuye la hiperalgesia térmica acompañado de una reducción en la expresión del TRPV1 y TRPV4 tanto en el GRD como en el asta dorsal de la médula espinal83–85. Los resultados permiten sugerir que los efectos de la EA sobre la disminución en la hipersensibilidad térmica y mecánica, asociados a la sensibilización periférica y central, también están mediados por una disminución en la sobreexpresión de los canales TRPV1 y TRPV4; así como por la reducción en la liberación de CGRP por las fibras aferentes primarias.
ConclusiónDeterminados puntos de acupuntura están relacionados con vías nerviosas y campos receptivos de las neuronas espinales. Estos nervios periféricos pueden estimularse con la EA. Se ha demostrado experimentalmente que la EA neuromodula la transmisión de las neuronas nociceptivas en la médula espinal, a través de mecanismos complejos que involucran la participación de vías inhibidoras descendentes adrenérgicas y serotoninérgicas. Asimismo, requiere de la activación de las neuronas intrínsecas espinales GABAérgicas, colinérgicas y del sistema opiáceo. También se ha mostrado que sus efectos se extiendan a los astrocitos y la microglía. La acción que ejerce la EA sobre las vías sensoriales no dolorosas tiene un papel relevante en la modulación de la entrada sensorial de las fibras aferentes de alto y bajo umbral de activación; por lo cual la EA de baja frecuencia podría considerarse un buen procedimiento para el tratamiento de la hiperalgesia y la alodinia. Esta terapéutica puede incluso combinarse con el uso de algunos fármacos agonistas adrenérgicos, serotoninérgicos y GABAérgicos para potenciar así su efecto y complementar el tratamiento del dolor neuropático.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.




![Potenciales del dorso de la médula espinal (cord dorsum potential [CDP]) producidos por el estímulo del nervio sural (SU) y estimulación con electroacupuntura (EA) en Zusanli (E 36) y Sanyinjiao (BP 6). A. Representación esquemática del protocolo experimental y del primer componente negativo del CDP (N1-CDP) producido por estímulos eléctricos únicos aplicados al nervio SU y por la EA, y registrados en los segmentos espinales L4-S1. B. Representación gráfica de la distribución longitudinal de la amplitud del componente N1-CDP producido por la estimulación del nervio SU y por la EA. Adaptada de Quiroz-González et al., 201411. Potenciales del dorso de la médula espinal (cord dorsum potential [CDP]) producidos por el estímulo del nervio sural (SU) y estimulación con electroacupuntura (EA) en Zusanli (E 36) y Sanyinjiao (BP 6). A. Representación esquemática del protocolo experimental y del primer componente negativo del CDP (N1-CDP) producido por estímulos eléctricos únicos aplicados al nervio SU y por la EA, y registrados en los segmentos espinales L4-S1. B. Representación gráfica de la distribución longitudinal de la amplitud del componente N1-CDP producido por la estimulación del nervio SU y por la EA. Adaptada de Quiroz-González et al., 201411.](https://static.elsevier.es/multimedia/18878369/0000001100000003/v1_201711081127/S1887836917300509/v1_201711081127/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)