Se considera infección fúngica invasora (IFI) la que afecta al torrente sanguíneo o a tejidos profundos normalmente estériles, excepto al tracto urinario bajo. En adultos no neutropénicos, las IFI con una prevalencia mayor (> 90%) son producidas por Candida y tienen una distribución bimodal: por una parte, se producen de forma temprana en pacientes críticos que presentan intensas alteraciones agudas de las barreras defensivas, y, por otra parte, se producen de forma más tardía en pacientes con deterioro grave de sus mecanismos generales de defensa, que sobreviven durante más tiempo a tratamientos más agresivos y que están previamente colonizados, aunque no hay acuerdo unánime sobre este punto.
Incidencia de infecciones fúngicas invasoras en pacientes críticos no neutropénicos
En las últimas 3 décadas, se ha observado un incremento significativo de las IFI en pacientes críticos no neutropénicos (PCNN)44,50,62. La mayoría son producidas por Candida, aunque se incrementa de forma progresiva la incidencia de infecciones por hongos filamentosos, como Aspergillus o zigomicetos. Son excepcionales los casos de hialohifomicosis (principalmente Fusarium) o feohifomicosis (generalmente Scedosporium prolificans) que precisan tratamiento en una unidad de cuidados intensivos (UCI), pero es preciso conocer que tienen una incidencia aproximada de un caso por millón de habitantes y año, y una mortalidad muy elevada.
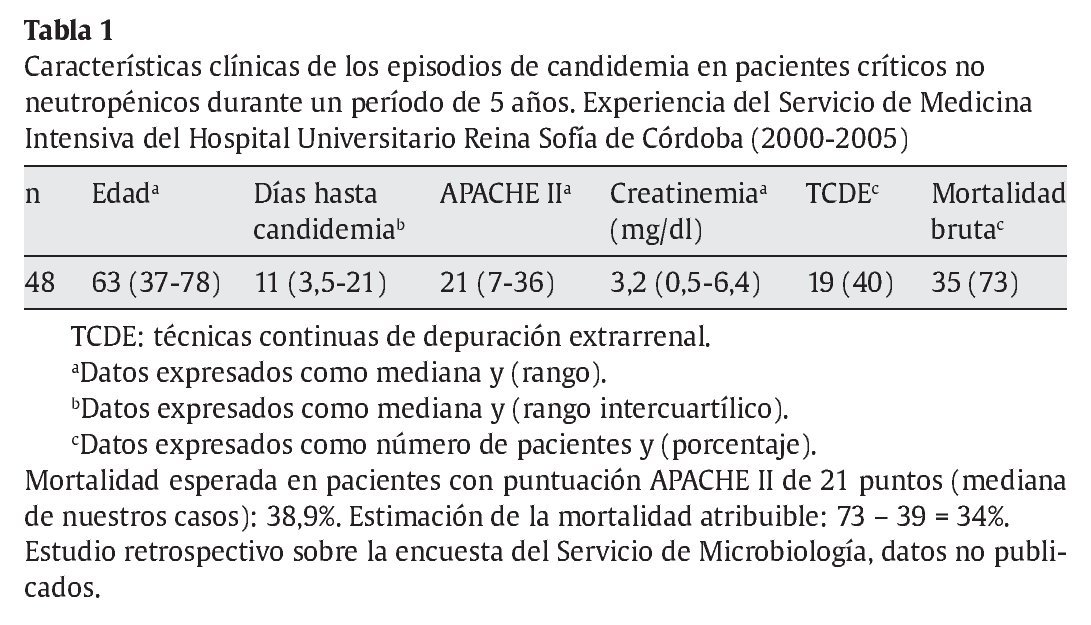
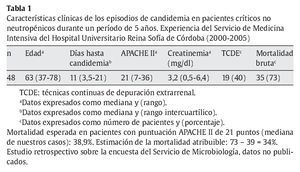
El principal obstáculo para conocer la dimensión exacta de la incidencia de las IFI en pacientes críticos es su diagnóstico. Se estima que en las UCI quirúrgicas la incidencia es aproximadamente de 9,9 casos por cada 1.000 ingresos50. Nuestros datos en UCI polivalente con programas de trasplante de órganos sólidos coinciden con esta tasa (tabla 1). Recientemente, los grupos de trabajo de la European Organization for Research and Treatment of Cancer y el Mycoses Study Group han revisado las definiciones de enfermedad fúngica invasora (EFI)8 y reconocen la limitación que supone el diagnóstico en estos pacientes, admitiendo solamente el diagnóstico de certeza para la estratificación en estudios clínicos, aunque lógicamente consideran la posibilidad de EFI en casos que no puedan probarse. Otros pacientes críticos sí pueden encuadrarse dentro de las categorías de infección fúngica probable o posible, como son los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que hayan recibido tratamiento esteroideo muy prolongado, que han de considerarse inmunodeprimidos, y presenten criterios de sospecha de aspergilosis pulmonar invasora, o los pacientes trasplantados de órganos sólidos que ingresen por cuadros infecciosos.
Sabiendo que la detección de candidemia por los procedimientos habituales de laboratorio es inferior al 60%27 y de la dificultad extrema de realizar biopsias en los pacientes críticos, podemos inferir que sólo se diagnostican la mitad de las EFI que se producen en pacientes con un cuadro clínico compatible. Se ha intentado establecer marcadores clínicos, mediante factores de riesgo3,6,10,28,35,44,53, o biológicos38,45 de candidiasis, pero o bien no han demostrado suficiente potencia en otros estudios, o bien no se han estandarizado para considerarlos como marcadores subrogados de enfermedad. Hay que tener en cuenta que los factores clínicos de riesgo de EFI pueden introducir un importante factor de confusión, ya que, al ser una enfermedad infecciosa sin síntomas específicos evidentes, coinciden con los síntomas propios de cualquier tipo de infección grave en los pacientes críticos. Quizás una mejor aproximación desde el punto de vista clínico sea identificar grupos de riesgo por su enfermedad de base o tipo de cirugía (p. ej., EPOC, pancreatitis aguda, quemados o cirugía abdominal), a los que hay que controlar mediante marcadores biológicos (como el β-1,3-D glucano [BG], técnicas moleculares de PCR, galactomanano u otros).
El proyecto Cava intenta diferenciar entre colonización e infección mediante la aplicación del Candidascore (CS) y la determinación de BG, pero sólo el 35% de los pacientes con CS > 3 y BG ≥ 100 pg/ml tuvieron candidiasis invasora documentada59.
Las técnicas moleculares de PCR parecen comportarse mejor, pero todavía no se han comercializado y no ha sido posible su validación multicéntrica, y al no estar estandarizadas actualmente no se aceptan para el diagnóstico de EFI8.
En España, la mayoría de las candidemias y candidiasis invasoras que presentan los PCNN son producidas por Candida albicans (> 50%), aunque la proporción de especies de Candida diferentes de C.albicanssigue aumentando28,44, así como la tasa de cepas con resistencia a fluconazol7.
Mortalidad atribuible a la candidemia en pacientes críticos no neutropénicos
Si es difícil conocer la incidencia de IFI en PCNN, mucho más complejo es saber la mortalidad atribuible a la infección, dado que en ocasiones es un hallazgo post mórtem y el número de autopsias realizadas es cada vez más bajo31,39.
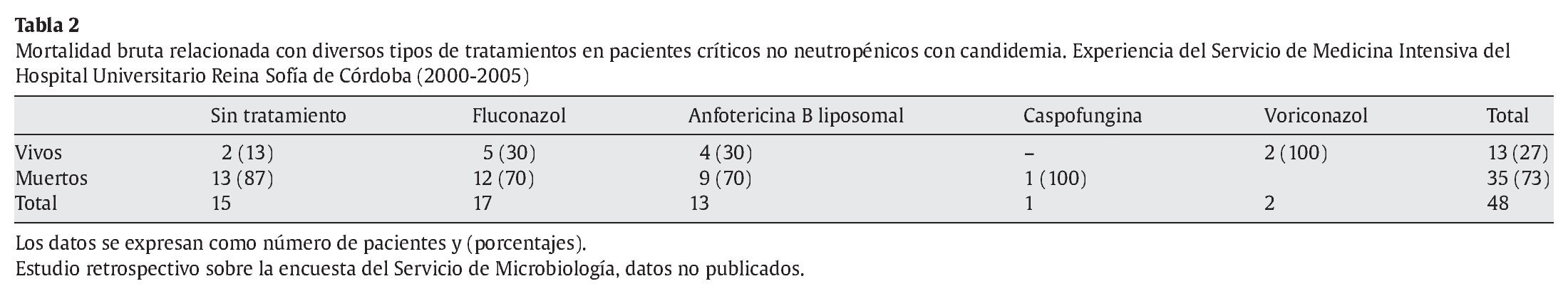
Se ha comunicado un rango de mortalidad atribuible en pacientes adultos con candidemia nosocomial entre el 15 y el 49%, aunque en pacientes de UCI podría ser menor13,19, por la elevada mortalidad de los pacientes control, el uso de profilaxis en pacientes de riesgo alto y la iniciación precoz de tratamiento antifúngico empírico en los casos probables. Pero también se ha comunicado que hay una variabilidad importante dependiente del grupo de pacientes incluidos, y del tipo de hospital. En nuestra experiencia, como en otros hospitales universitarios y de tercer nivel, la mortalidad bruta de la candidemia es muy elevada, a pesar de los tratamientos habituales, a causa de la gravedad de los pacientes y de la elevada incidencia de fallo renal agudo con necesidad de instaurar técnicas de depuración extrarrenal (tablas 1 y 2). Al estimar la mortalidad esperada asociada a la puntuación APACHE II de un grupo control (21 puntos, mediana de nuestra serie) en el 39%, podríamos considerar que la mortalidad atribuible a la candidemia sería del 34% en nuestros pacientes. Es preciso saber que en el 25% de los pacientes la candidemia apareció antes del cuarto día de ingreso en la UCI, y el 31% de ellos no recibió tratamiento, en casi todos los casos por retraso en el diagnóstico y muerte del paciente.
Está claramente establecido que la profilaxis con azoles disminuye a la mitad la incidencia de candidiasis invasora, y la mortalidad en un 25%, aproximadamente,3,54 por lo que deberá considerarse en todos los grupos de pacientes que presenten incidencias superiores al 10%26. También se conoce el impacto positivo en la supervivencia del tratamiento antifúngico precoz desde los estudios experimentales de MacCallum y Odds37, que se ha confirmado en estudios clínicos de PCNN15,40.
Si consideramos la dificultad del diagnóstico precoz y la elevada mortalidad atribuida a los episodios de IFI en pacientes graves, que con frecuencia presentan criterios de disfunción multiorgánica, entendemos que se busquen estrategias que puedan disminuir la mortalidad de estos pacientes.
Estrategias terapéuticas en la candidiasis invasora de pacientes críticos
Sin duda, la estrategia más eficaz y con una evidencia científica mayor es la profilaxis con fluconazol a todos los grupos de pacientes de riesgo alto (> 10%) de presentar candidiasis, lo cual es una pauta en ocasiones incomprensiblemente difícil de cumplir. No está establecida la dosis ni la duración, por lo que posiblemente sean suficientes pautas cortas de profilaxis para conseguir el objetivo.
Aunque se ha propuesto iniciar el tratamiento antifúngico en relación con factores de riesgo de diseminación fúngica10,41, en la mayoría de las ocasiones se inicia como tratamiento empírico en pacientes con progresión de una sepsis grave que no responden al tratamiento antibacteriano o en casos de colonizaciones múltiples en pacientes graves1. La obtención de un marcador subrogado haría posible el tratamiento anticipado al desarrollo de los síntomas producidos por la candidiasis diseminada, disminuiría la mortalidad, como ha ocurrido en otras situaciones2,61, y evitaría el tratamiento no adecuado de pacientes con sospecha de infección fúngica. Hoy día únicamente el BG puede utilizarse para el diagnóstico de las infecciones producidas por Candida8. El BG es un marcador panfúngico que también permite el diagnóstico de EFI producidas por hongos filamentosos8,45, y que junto a los anticuerpos antimicelio han demostrado su utilidad en pacientes neutropénicos con candidiasis invasoras55.
Las guías de la Infectious Diseases Society of America (IDSA) de 2004 recomendaban el tratamiento empírico en pacientes adultos no neutropénicos con fiebre y sospecha de candidiasis diseminada con anfotericina B desoxicolato o fluconazol, con el objetivo de resolver la fiebre y prevenir la candidemia y las complicaciones asociadas a la candidiasis diseminada por el torrente sanguíneo. No había una preferencia específica por uno de los 2 fármacos, aunque se tenía en cuenta el riesgo adicional de fallo renal en pacientes críticos tratados con anfotericina B47.
En los casos de candidiasis probada, la recomendación era anfotericina B, o fluconazol en los que no habían recibido previamente azoles, por lo que aunque también se aceptaba el tratamiento con caspofungina47. Posteriormente, se demostró que el tratamiento con voriconazol tenía una eficacia igual que anfotericina B desoxicolato seguida de fluconazol, pero con menos efectos secundarios, principalmente nefrotoxicidad32. La introducción de anidulafungina mejoró los resultados al final del tratamiento un 15% comparada con fluconazol56, estándar del tratamiento de candidemia en pacientes críticos, aunque no alcanzó significación de superioridad16. Asimismo, en el único estudio comparativo directo entre equinocandinas, micafungina ha demostrado no inferioridad con caspofungina48, por lo cual hemos de considerar que tiene la misma evidencia científica que ésta. Las nuevas guías IDSA de tratamiento de la candidiasis incluyen las candinas también como tratamiento de elección en pacientes graves no neutropénicos, tanto en caso de tratamiento dirigido, como para el tratamiento empírico49. La anfotericina liposomal no debe considerarse como tratamiento de primera elección en PCNN por sus efectos adversos33,34.
Actualmente hay un debate apasionante sobre cuál debe ser el tratamiento de primera línea de la candidiasis invasora16,20,49,52,58,60. Aunque el fluconazol ha sido el tratamiento de elección en pacientes críticos durante los últimos 15 años5,57, ahora disponemos de fármacos de espectro más amplio, que precisan concentraciones mínimas inhibitorias (CMI) menores para conseguir el efecto antifúngico, con una tasa menor de fallos terapéuticos y de efectos adversos, y con una mejoría leve de la supervivencia14,55. La dificultad de disminuir la mortalidad bruta en estos pacientes -los cuales frecuentemente presentan criterios de fallo multiorgánico o enfermedades últimamente fatales por imposibilidad de tratamiento de la enfermedad inicial- hace complicado poder realizar estudios de grupos homogéneos que podrían mejorar de forma significativa estos resultados. Sólo la relación coste-eficacia impediría actualmente establecer el tratamiento de primera línea de la candidemia y candidiasis invasora con candinas.
Por otra parte, si bien el fluconazol debe seguir siendo de elección en la profilaxis de los pacientes de riesgo alto (excepto que se publique alguna evidencia contraria, dado que en la mayoría de los estudios está comparado a placebo), no parece tan adecuado realizar tratamiento empírico o anticipado con fluconazol en detrimento de las candinas. La estrategia de desescalada ha demostrado ser efectiva en distintos estudios y es adecuada para disminuir los costes, sin perder eficacia36. En los estudios de coste-eficacia en tratamiento empírico de candidiasis en pacientes críticos, el fluconazol permanece coste-efectivo incluso con tasas de resistencia del 43%17, situación difícil de admitir en la actualidad cuando sabemos que el retraso en iniciar tratamiento adecuado incrementa la mortalidad15,37,40. Por todo ello, creemos indicado el uso de candinas como tratamiento empírico de primera línea de la candidemia y candidiasis invasoras en PCNN, y la posterior conversión a azoles, como estrategia de desescalada, bien cuando se tenga confirmación de la sensibilidad de la especie o bien después del tratamiento.
¿Cuál es la utilidad clínica de micafungina en candidiasis invasoras de pacientes críticos no neutropénicos?
La micafungina pertenece al grupo de las candinas y es un potente inhibidor selectivo y no competitivo de la βG sintetasa, enzima necesaria para la formación de un componente esencial de la pared celular de gran cantidad de hongos. Presenta un espectro de actividad in vitro similar a caspofungina y anidulafungina; es excelente contra Candida, pero menor en Aspergillus y otros hongos patógenos. La actividad antimicrobiana es baja o nula en los hongos que tienen escasa cantidad o carecen del sustrato diana en su pared, como criptococos o zigomicetos12. Tiene actividad dependiente de la concentración y ha demostrado efecto postantifúngico prolongado. La micafungina es un fungicida, lento, pero potente, para Candida, incluso a bajas concentraciones (CMI90), y aunque carece de efecto fungicida también es un potente inhibidor in vitro para Aspergillus, produciendo daño en las hifas con efecto dependiente del tiempo. Los resultados de sensibilidad in vitro no necesariamente se correlacionan in vivo con los resultados clínicos4,11, debido a causas diversas, como la unión a proteínas plasmáticas46.
La micafungina es un fármaco hidrosoluble, de 1.292 Da de peso molecular, no tiene una biodisponibilidad adecuada después de su administración oral y requiere la infusión por vía intravenosa. Tiene farmacocinética lineal, por lo que en principio a mayor dosis corresponde una exposición mayor al fármaco, y alcanza un pico de concentración en estado estable de 10 μg/ml después de una dosis de 100 mg/día, sin precisar la dosis de carga. Tiene un volumen de distribución aceptable (0,20-0,26 l/kg), lo que supone prácticamente distribución sobre agua plasmática. Se une casi totalmente a las proteínas del plasma (99%), y su vida media beta es de 14-15 h. En estudios animales, la distribución tisular del fármaco medida por su concentración en hígado, riñón y pulmón fue 1,15, 1,64 y 2,58 veces mayor, respectivamente, que en plasma a los 5 min después de una dosis de 1 mg/kg, y el área bajo la curva (ABC0-24) fue 1,61, 3,42 y 2,89 veces mayor que en plasma, respectivamente18,42. Se metaboliza en el hígado de forma secuencial a través de la vía arilsulfatasa, seguida de la catecol-O-metiltransferasa, y en menor proporción por hidroxilación a nivel del citocromo P-450 (CYP450). Es sustrato de las isoenzimas CYP1A2, 2B6, 2C y 3A4, e inhibidor débil de CYP3A4, del complejo CYP450. Se han identificado metabolitos, pero sin actividad fúngica relevante en clínica. No es sustrato para la glucoproteína P intestinal ni tisular. No parece presentar degradación plasmática, como anidulafungina. Se elimina en forma inactiva por heces (71%) y orina24,29,43.
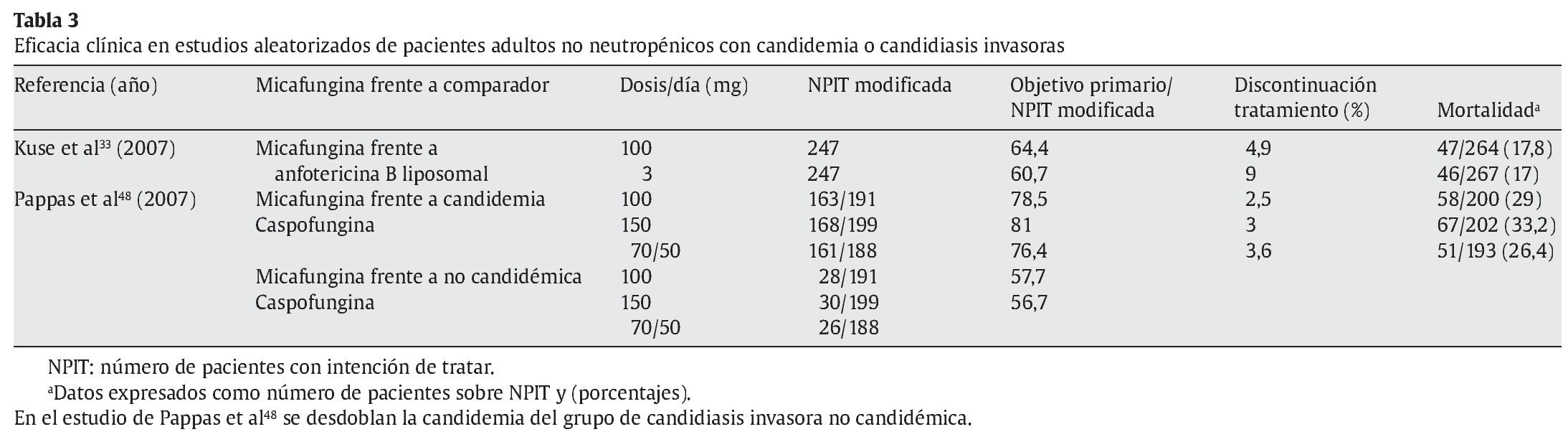
La micafungina tiene un perfil de seguridad comparable a fluconazol y a otras candinas. En los estudios clínicos realizados, ha demostrado menor toxicidad que la anfotericina B liposomal, principalmente menor nefrotoxicidad y un menor porcentaje de pacientes retirados del estudio de Kuse et al33, y similar al grupo de caspofungina en el trabajo de Pappas et al48 (tabla 3). Las reacciones adversas más frecuentes son erupción cutánea, leucopenia, flebitis, náuseas, vómitos, dolor abdominal o incremento de las aminotransferasas, que tienen una incidencia inferior al 5-10%9,33,48,63. El hígado se identificó como el principal órgano diana de toxicidad para micafungina en los estudios preclínicos. En voluntarios sanos, se incrementaron de forma transitoria las cifras de aminotransferasas al doble o triple del valor límite normal, y en estudios clínicos se relacionó con algún caso de daño hepático grave; pero, en general, el perfil de toxicidad hepática es similar a fluconazol. También se han comunicado casos aislados de reacciones de hipersensibilidad grave, reacciones anafilácticas o anafilactoides, incluidos casos de shock, así como casos de hemólisis o anemia hemolítica y disfunción renal. No se recomienda su uso durante el embarazo. Hay que tomar precauciones especiales si el paciente presenta insuficiencia hepática grave, tiene alguna enfermedad hepática crónica con procesos preneoplásicos (p. ej., fibrosis hepática avanzada, cirrosis, hepatitis viral, trastorno hepático neonatal o defectos enzimáticos congénitos), está recibiendo un tratamiento concomitante con propiedades hepatotóxicas y/o genotóxicas, o presenta antecedentes de hemólisis, anemia hemolítica o insuficiencia renal. Deberá tenerse en cuenta un riesgo potencial de desarrollar tumores hepáticos, como ocurrió en estudios animales durante tratamientos prolongados, aunque no se conocen casos en humanos.
La eficacia in vitro de micafungina, al igual que otras candinas, está correlacionada a la exposición al fármaco medida a través de la relación ABC/CMI o Cmáx/CMI22. Más del 98% de las cepas testadas de Candida son susceptibles a todas las candinas con CMI ≤ 2 μg/ml, y el 100% son susceptibles para micafungina y a CMI discretamente más bajas, en comparación con las otras. Sin embargo, los resultados del tratamiento en pacientes con candidiasis invasora, al comparar micafungina con anidulafungina, fueron similares, cualquiera que fuese la CMI, aunque hubo pocos aislamientos con CMI > 0,5 μg/ml51.
La eficacia clínica se ha demostrado en 2 estudios comparativos, aleatorizados y controlados, en pacientes no neutropénicos con candidemia o candidiasis invasoras. Muestra una eficacia clínica similar a anfotericina B liposomal33 y caspofungina48, aunque en este trabajo parece que la dosis de 150 mg/día puede ser superior (tabla 3).
En humanos, hay que tener en cuenta que los pacientes de peso mayor de 66 kg precisan incrementar la dosis de micafungina para alcanzar la misma exposición al fármaco que otros de peso menor, dado que los primeros tienen un aclaramiento mayor21. Esto puede tener importancia clínica, sobre todo en candidemias producidas por especies de Candida con menor susceptibilidad a las candinas (Candida parapsilosis yCandida guillermondi), o en candidiasis invasoras no candidémicas, en las que la distribución del fármaco al foco etiológico puede estar dificultada.
El estudio preclínico de micafungina en poblaciones especiales demostró una menor ABC0-∞en individuos con disfunción hepática moderada (Child B) respecto al grupo control (98 frente a 126 μg/kg/ml, dosis única de 100 mg), con incremento leve del volumen de distribución en estado estable. No precisa ajustar la dosis en pacientes con disfunción hepática moderada, pero no se realizaron estudios en casos con insuficiencia hepática avanzada. En pacientes con disfunción renal grave (aclaramiento de creatinina < 30 ml/min), los parámetros farmacocinéticos fueron similares a los del grupo control al ajustar el aclaramiento de creatinina al peso del individuo24, por lo tanto tampoco es preciso modificar la dosis en caso de fallo renal. La micafungina no se dializa y no se han observado modificaciones significativas de su farmacocinética en pacientes sometidos a técnicas continuas de depuración extrarrenal30.
No tiene interacciones medicamentosas significativas, excepto posiblemente con los inmunodepresores inhibidores de calcineurina en pacientes trasplantados de órganos sólidos. En los estudios de interacciones medicamentosas realizados en voluntarios sanos, se apreciaron pequeñas modificaciones de los parámetros farmacocinéticos de micafungina con la administración concomitante de ciclosporina o tacrolimus24,25, pero no se han realizado estudios en pacientes críticos trasplantados.
Las Food and Drug Administration estadounidense y la European Medicines Agency aprobaron inicialmente el uso de micafungina para la profilaxis de las infecciones por Candida en pacientes sometidos a trasplantes de precursores hematopoyéticos y para el tratamiento de candidiasis esofágica, y posteriormente para el tratamiento de candidemia, candidiasis aguda diseminada, peritonitis y abscesos por Candida. Estas agencias recomiendan interrumpir el tratamiento si hay elevación significativa y persistente de las aminotransferasas hepáticas. Dado que micafungina es un fármaco de reciente aparición, y a pesar de que hay numerosos estudios en pacientes hematológicos, la experiencia en PCNN y en las diversas formas de candidiasis invasoras todavía es escasa, y debe ampliarse.
Conclusiones
Micafungina es una opción terapéutica de primera línea en pacientes con candidemia y candidiasis invasoras, dado que el fármaco mantiene buenas concentraciones en el compartimiento de agua plasmática, tiene excelente susceptibilidad para todas las Candidaspp., y su perfil de seguridad es comparable a fluconazol. Hay que considerar incrementar la dosis en pacientes obesos, tener precaución en pacientes con disfunción renal, sin necesidad de ajustar la dosis, incluso durante las técnicas continuas de depuración extrarrenal, y evitar micafungina en pacientes con disfunción hepática, cirrosis o disfunción multiorgánica. La dosis de 100 mg/día en PCNN con candidemia o candidiasis invasora es probable que sea insuficiente, y difícilmente explicable en un fármaco con farmacocinética lineal y escasa toxicidad general, que muestra mejores resultados en conseguir el objetivo primario con dosis mayores, como también se ha observado en el tratamiento de la esofagitis candidiásica, por lo que se aconseja la dosis de 150 mg/día.
Conflicto de intereses
El autor ha participado en actividades de formación subvencionadas por Pfizer, Merck y Gilead.
Historia del artículo:
Recibido el 2 de febrero de 2009 Aceptado el 16 de febrero de 2009
Correo electrónico:juancarlos.pozo@ono.com