La toxicidad, fundamentalmente renal, asociada al uso de anfotericinas y el incremento de aislamientos de Candida con resistencia asociada a fluconazol posibilita a las equinocandinas ocupar un puesto privilegiado en el tratamiento de la candidiasis invasiva.
La micafungina es un antifúngico del grupo de las equinocandinas, como caspofungina y anidulafungina. En marzo de 2005, la Food and Drug Administration aprobó la micafungina en Estados Unidos para las indicaciones de candidiasis esofágica y profilaxis frente a las infecciones por Candida en pacientes sometidos a trasplante de progenitores hematopoyéticos, y, en enero de 2008, amplió su indicación al tratamiento de candidiasis y/o candidemia, peritonitis y abscesos por Candida. En abril de 2008, la European Medicines Agency (EMEA) aprobó su utilización en Europa para las mismas indicaciones. Sin embargo, su introducción en Japón desde diciembre de 2002 la convierte en la equinocandina con más años de experiencia de uso clínico.
La micafungina presenta una actividad fungicida natural frente a Candida, consigue unas concentraciones adecuadas en suero y es la única equinocandina aceptada para el tratamiento de candidiasis en neonatos. Su buen perfil de seguridad y el nivel bajo de interacciones garantizan un comportamiento excelente en la candidiasis invasiva y la hace especialmente interesante para el tratamiento de algunos grupos especiales de pacientes28.
Características microbiológicas
Las equinocandinas interfieren en la síntesis de la pared celular mediante la inhibición no competitiva de β-1,3-D-glucano sintetasa, enzima encargada de la formación de polímeros de glucano en la pared celular. Este mecanismo de acción es diferente al resto de antifúngicos y es raro el desarrollo de resistencias. No obstante, éstas se pueden producir por mutación de la subunidad FKS122.
Al igual que las otras equinocandinas, la micafungina es activa frente a Candida y Aspergillus. La actividad frente a Candida es fungicida y su concentración mínima inhibitoria (CMI) no varía entre los aislamientos de Candida resistente a azoles17,27.
En un estudio reciente se ha comparado la actividad in vitro de micafungina, caspofungina y anidulafungina en 5.346 candidiasis invasivas24. La micafungina mostró una actividad global excelente (CMI50 0,015 μg/ml, CMI90 1 μg/ml), similar a la de caspofungina (CMI50 0,03 μg/ml, CMI90 0,25μg/ml) y anidulafungina (CMI50 0,06 μg/ml, CMI90 2 μg/ml). Más del 99% de los aislamientos se inhibieron a concentraciones ≤ 2 μg/ml de las 3 equinocandinas; si bien, por especies, la micafungina fue la única que inhibió el 100% de los aislamientos a concentraciones ≤ 2 μg/ml. Estas diferencias fueron inferiores al 1% en Candida albicans, Candida glabrata, Candida tropicalis y Candida krusei. Sin embargo, hubo diferencias mayores en Candida parapsilosis, donde anidulafungina inhibió a esa concentración sólo el 92,5% de los aislamientos, frente al 99,9% de caspofungina y el 100% de micafungina; y en Candida guilliermondii, donde el porcentaje de inhibición fue del 90,2, el 95,1 y el 100%, respectivamente. La importancia de estas diferencias in vitro no está bien establecida, ya que en algunos estudios se han normalizado tras la adición de suero a las pruebas de sensibilidad20 y no parecen tener una repercusión clínica importante23.
Un estudio que analizó la eficacia de micafungina en 315 aislamientos de Candida, resistente a fluconazol (CMI > 32 μg/ml), confirmó que todas las cepas eran inhibidas a concentraciones de ≤ 1 μg/ ml de micafungina, con una CMI90 de 0,06 μg/ml17.
Metabolización, interacciones y características farmacocinéticas
La farmacocinética de micafungina es lineal en adultos y niños y no necesita dosis de carga. En neonatos prematuros (> 1.000 g) también la farmacocinética es lineal, pero la vida media es más corta y los porcentajes de aclaramiento son más rápidos que en niños mayores2,11.
Su metabolismo es hepático, especialmente por acción de arilsulfatasa y catecol-O-metiltrasferasa. También se metaboliza por isoenzimas del citocromo P-450, pero ésta no es la vía fundamental2.
No requiere ajuste en presencia de insuficiencia renal, ni tampoco lo requiere por edad o peso. Debido a su elevada unión a proteínas, la micafungina no es dializable, por lo que no se requiere suplementar las dosis2. La hemodiafiltración continua y la venovenosa continua modifican poco sus valores12. Requiere reducción de dosis en insuficiencia hepática moderada y su experiencia en insuficiencia hepática grave es limitada.
La micafungina es un sustrato, aunque pobre, de CYP y tiene efecto ligeramente inhibitorio en CYP3A25. Las interacciones se han evaluado en voluntarios sanos2,5,8,10,13,30-32, en trasplantados hepáticos19 y en pacientes hematológicos26. La farmacocinética de micafungina no se ve significativamente alterada por la coadministración de micofenolato mofetil2,5, ciclosporina2,5,10, tacrolimus2,5,8, prednisona2,5, sirolimus2,5, nifedipino2,5, fluconazol2,5, voriconazol5,13, itraconazol5,31, anfotericina B5,.32, ritonavir2,5,30 o rifampicina2,30. Por el contrario, micafungina no altera significativamente los valores de tacrolimus2,8,26, voriconazol13, anfotericina B32, micofenolato mofetil2, prednisona2 o fluconazol2.
Cuando micafungina se coadministra con sirolimus o nifedipina, los valores de éstos deben controlarse, dado que puede observarse un incremento de un 21% en el área bajo la curva de sirolimus y de un 18% en la de nifedipina2,5. Además, la EMEA también recomienda que se realice el seguimiento de los valores de itraconazol, porque puede observarse hasta un 22% de incremento5.
Eficacia de micafugina en candidiasis invasiva
La eficacia y la tolerabilidad de micafungina se ha demostrado en un ensayo clínico en fase II abierto y en 2 grandes ensayos clínicos en fase III, cuyos comparadores han sido anfotericina B liposomal15 y caspofungina21.
El estudio de micafungina frente a anfotericina B liposomal fue aleatorizado, doble ciego, multinacional (115 centros) y de no inferioridad15. Se seleccionó a 531 pacientes con candidiasis o candidemia y se comparó micafungina, 100 mg/día (pudiendo alcanzar 200 mg/día) con anfotericina B liposomal, 3 mg/kg/día. La variable de eficacia primaria fue el porcentaje de respuesta clínica y microbiológica al final del tratamiento, y el 13 y el 10% de los pacientes en cada grupo, respectivamente, presentaban neutropenia al inicio del tratamiento. No hubo diferencias entre ambos grupos en el análisis global por intención de tratar (el 74,1 y el 69,6%, respectivamente), ni el análisis por protocolo (el 89,6 y el 89,5%, respectivamente). Tampoco las hubo en los subanálisis de candidemias, candidiasis o cuando se analizaron los resultados en pacientes neutropénicos o en niños menores de 15 años.
El estudio de micafungina frente a caspofungina también fue aleatorizado, doble ciego, multinacional (128 centros) y de no inferioridad, frente a pacientes con candidemia o candidiasis21. Se seleccionó a 595 pacientes en 3 brazos, estratificados por el grado de gravedad según la escala APACHE: micafungina 100 mg, micafungina 150 mg y caspofungina 50 mg (con dosis de carga de 70 mg el primer día). El análisis de eficacia no mostró diferencias significativas entre los 3 brazos (el 76,4, el 71,4 y el 72,3%, respectivamente).
Perfil de seguridad
Un análisis global realizado en más de 3.000 pacientes que recibieron micafungina en ensayos clínicos demostró un perfil muy satisfactorio de seguridad3. Los efectos adversos ocurrieron en el 2-3% de los casos y fueron: náuseas, vómitos, diarrea, flebitis, fiebre, hipopotasemia, aumento de transaminasa glutamicoxalacética, transaminasa glutámico pirúvica y fosfatasa alcalina, sin que hubiera relación con la dosis administrada, ni la edad de los pacientes. En relación con la anfotericina B liposomal, produjo de forma significativa una incidencia menor de alteración renales y electrolíticas15. Respecto a caspofungina, el perfil de seguridad de ambas equinocandinas fue similar21.
La incidencia comunicada de efectos adversos hepáticos en los ensayos clínicos es alrededor del 8%, siendo la mayoría de carácter leve-moderado y similar a los comparadores (anfotericina B liposomal, caspofungina y fluconazol)3. No obstante, dado que en ensayos preclínicos en ratas se observó el desarrollo de focos de alteraciones hepatocitarias y tumores hepatocelulares tras tratamientos superiores a 3 meses, es recomendable suspender el tratamiento si se produce elevación significativa y persistente de transaminasas. La incidencia de algunos efectos adversos (trombopenia, taquicardia, hipotensión e hipertensión, hiperbilirrubinemia, hepatomegalia y fracaso renal agudo) se observó con más frecuencia en niños que en adultos2. No está clara si esta mayor toxicidad se debe a inmadurez por menor edad o que las enfermedades basales de los niños seleccionados eran significativamente más graves que las de los adultos (p. ej., neutropenia, trasplante de progenitores hematopoyéticos o neoplasias hematológicas).
Experiencia de micafungina en trasplantados
La micafungina se ha utilizado con éxito en trasplantados de progenitores hematopoyéticos, y demuestra ser superior a fluconazol en la prevención de micosis invasivas en este tipo de pacientes7,33. Sin embargo, el 70% de los pacientes incluidos en el estudio de Van Burik et al33 eran trasplantes autólogos o con enfermedades con riesgo bajo de infección fúngica. En sus últimas guías publicadas en 2007 sobre profilaxis de pacientes hematológicos de riesgo alto de infección fúngica, la European Conference on Infections in Leukaemia recomienda la utilización de posaconazol o fluconazol, pero considera a la micafungina una alternativa segura en esta indicación16.
La experiencia con micafungina en trasplantados de órgano sólido es muy reducida. En los ensayos clínicos de micafungina frente a anfotericina B liposomal y caspofungina, el número de trasplantados de órgano sólido que recibió micafungina fue de 36 y 16, respectivamente, y en ninguno de los 2 estudios se realiza un análisis específico de estos pacientes15,21.
En un estudio reciente se evaluó la eficacia y la seguridad de micafungina en 18 trasplantes, de los que 7 de ellos recibieron un trasplante de órgano sólido6. En estos pacientes, micafungina (100 mg/ día) se utilizó para el tratamiento de candidiasis invasivas (5 candidemias y 2 peritonitis) por diferentes especies: 4 C. parapsilosis, 2 C. glabrata y 1 C. albicans. En todos los casos se consiguió éxito terapéutico tras una mediana de 11 días (rango: 3-35 días), y la mayoría se completó con fluconazol. Siete pacientes recibieron tacrolimus; 3, sirolimus, y uno, ciclosporina. Los valores séricos de ciclosporina, tacrolimus y sirolimus permanecieron en rango terapéutico en el 100% (4/4), el 97% (44/45) y el 75% (3/4) de los pacientes, respectivamente. En un paciente hubo elevación (×4) de los valores de sirolimus que los autores relacionaron con una sepsis bacteriana6.
El papel de la micafungina en los pacientes trasplantados ha de analizarse especialmente en los trasplantados hepáticos. La frecuencia de micosis invasivas en los trasplantados renales es muy reducida y condiciona el uso de la micafungina u otras equinocandinas, a pesar de la seguridad de éstas en presencia de daño o insuficiencia renal. Por otro lado, en los trasplantados pulmonares o cardiopulmonares, la micosis más prevalente es la aspergilosis, y aunque la micafungina presenta actividad in vitro frente a Aspergillus similar a la de caspofungina o anidulafungina, la ausencia de indicación hasta el momento de la micafungina en aspergilosis no hace recomendable su uso en estos trasplantados.
La escasa, pero presente, metabolización en el ámbito de CYP3AP se ha implicado como la causa de los valores altos de micafungina observados en un trasplantado hepático con un injerto pequeño, en relación con el volumen hepático estándar18. A este paciente se le trasplantó un injerto con un volumen pequeño para su tamaño teórico (ratio: 0,26); tras una dosis de 50 mg de micafungina, la vida media de eliminación fue de 16 h, y pasó a 75 h con una dosis de 100 mg. Comparado con 6 pacientes que tenían injertos con volúmenes de injertos con ratios > 0,3, el paciente que recibió un injerto pequeño tenía significativamente más baja en orina (p < 0,05) la proporción entre 6β-hidroxicortisol y cortisol (una cifra que expresa la actividad estimada de CYP3AP), lo que indica que la saturación en su eliminación pudiera estar en relación con el menor contenido de CYP3AP en el hígado.
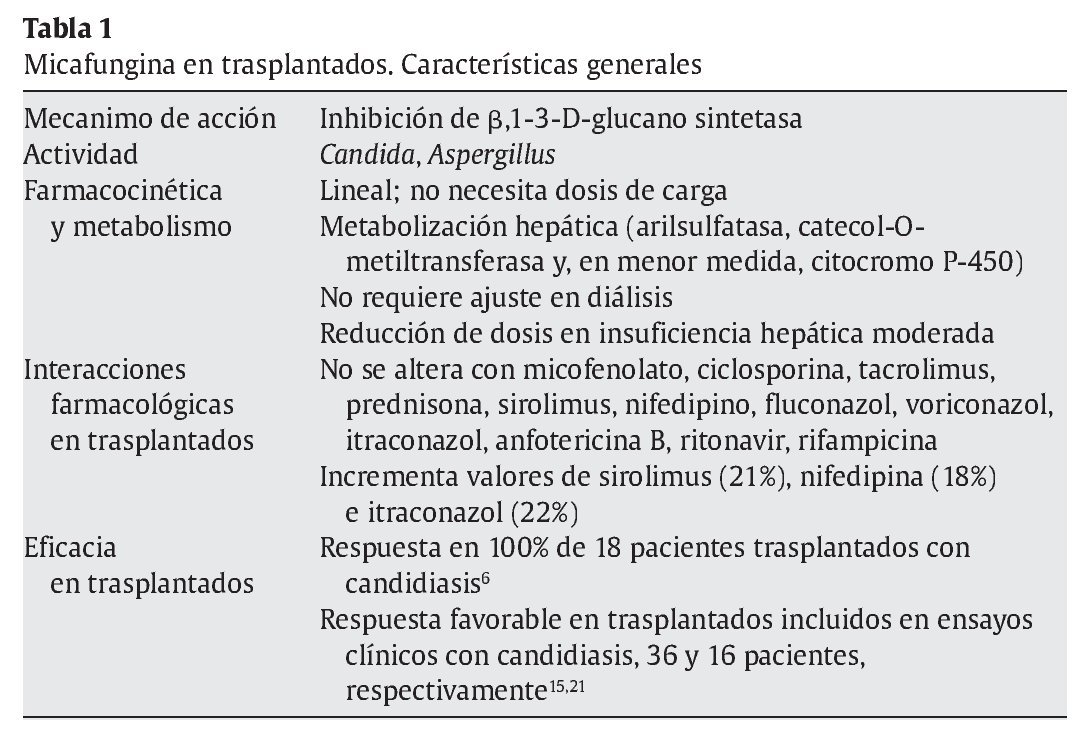
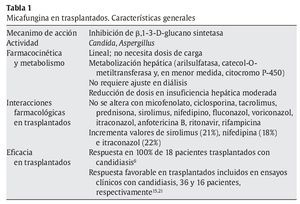
A pesar de todo, no está claro el comportamiento de la micafungina en presencia de insuficiencia hepática, y el estudio anterior es contradictorio con otros. En un estudio realizado en pacientes con hepatopatía moderada (Child 7-9) en comparación con voluntarios sanos9, se demostró que los pacientes con insuficiencia hepática alcanzaban concentraciones séricas (área bajo la curva) significativamente inferiores (22%) que las alcanzadas en voluntarios sanos (97,5 ± 19 μg/h/ml frente a 125 ± 26,4 μg/h/ml; p = 0,03). Aunque había diferencia de peso entre los casos y los controles que pudieran justificar estas diferencias, otras explicaciones lo relacionan con una sobreexpresión enzimática mayor en estos casos. La información sobre arilsulfatasa en humanos con insuficiencia hepática es limitada, pero en modelos animales de ligadura del conducto biliar se ha confirmado un incremento de la actividad de esta enzima en presencia de colestasis, incluso antes de desarrollar daño hepático4,29. Por otro lado, la actividad arilsulfatasa leucocitaria es un 38% menos activa en pacientes con cirrosis alcohólica y un 58% menor si hay antecedente de encefalopatía1. Las sulfatasas se distribuyen por todos los tejidos y es difícil predecir cómo se afecta su actividad en presencia de cirrosis. En la tabla 1 se recogen las características más destacables de micafungina en relación con los pacientes trasplantados.
En conclusión, la utilización de micafungina en trasplantados, a pesar de la poca interacción de micafungina (limitada a sirolimus), presenta algunas dificultades, sobre todo en trasplantados hepáticos. La poca experiencia con micafungina en pacientes con hepatopatías avanzadas y la paradójica farmacocinética de micafungina en pacientes con insuficiencia hepática observada en diferentes estudios no hacen predecible su comportamiento. Finalmente, la confirmación en ensayos preclínicos en ratas acerca del desarrollo de focos de degeneración hepatocitaria después de tratamientos superiores a 3 meses (que hacen recomendable suspender el tratamiento si hay elevación significativa y persistente de transaminasas), dificulta su utilización en el postrasplante hepático inmediato, en el que las enzimas hepáticas están sistemáticamente elevadas y que es el período de más riesgo de candidiasis en estos pacientes. En otros trasplantados no hepáticos, las características de micafungina la hacen especialmente atractiva para el tratamiento de candidiasis invasiva.
Declaración del autor
El autor ha dictado conferencias subvencionadas y ha sido asesor científico de las compañías Merck Sharp & Dohme, Pfizer, Astellas, Gilead y Schering Plough.
Correo electrónico:fortun@ono.com
Historia del artículo:
Recibido el 25 de enero de 2009
Aceptado el 11 de febrero de 2009