Las infecciones fúngicas invasoras (IFI) son cada vez, con más frecuencia, causa de morbilidad y mortalidad en los niños inmunodeprimidos con enfermedades malignas y especialmente en los sometidos a trasplante hematopoyético9,16,17. Aunque Candida era inicialmente la infección más frecuente, en los últimos años hemos observado un aumento en el número de aspergilosis invasiva, así como de otros hongos, que en muchos casos son resistentes a los antifúngicos habituales. Además de estos niños con cáncer, los neonatos, y en particular los pretérminos, tienen también un riesgo alto de desarrollar IFI10,14. En los pretérminos, la aspergilosis invasiva es extremadamente rara.
El tratamiento de la IFI era limitado inicialmente a la anfotericina B desoxicolato, introducida en 1958, y durante muchos años fue el único agente antifúngico del que se dispuso, el cual estaba asociado a una toxicidad alta y una eficacia limitada. En la década de 1980, se introdujeron nuevas opciones, como fluconazol, itraconazol, así como formulaciones lipídicas de la anfotericina B, que mejoraron el perfil de seguridad y eficacia de la anfotericina B convencional. Más recientemente, se introdujo la segunda generación de agentes triazólicos (voriconazol y posaconazol) con un espectro de acción mayor. En el año 2001 se presentaron las equinocandinas, una nueva clase de agentes antifúngicos con actividad ante Candida y Aspergillus. La caspofungina fue la primera en recibir la aprobación de la Food and Drug Administration, seguida un poco después por la micafungina3. En esta publicación, revisaremos algunos de los aspectos de la micafungina en los pacientes pediátricos.
Microbiología
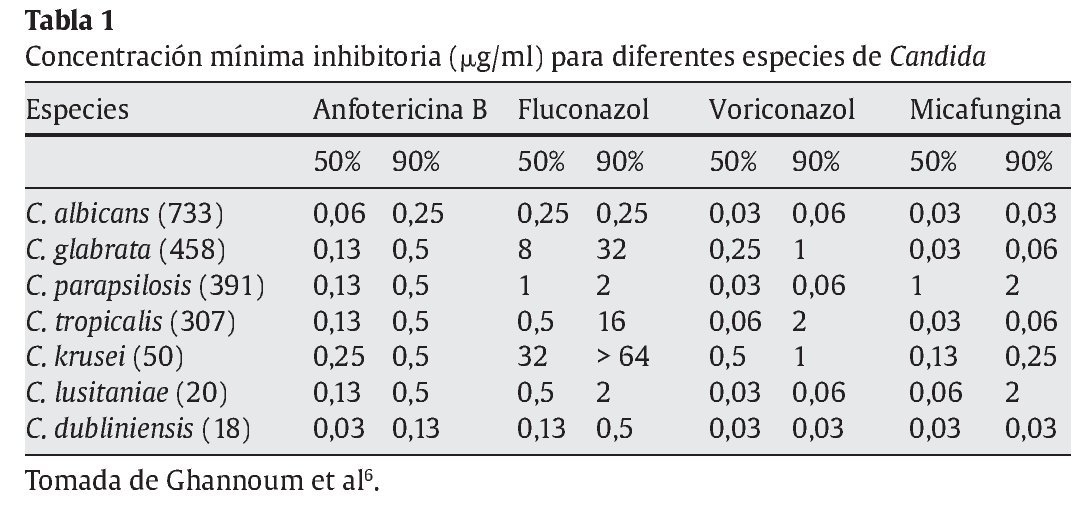
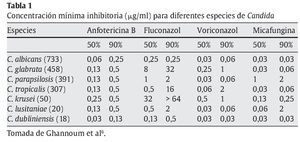
La micafungina es un inhibidor no competitivo de la β-1,3-D-glucano sintetasa4. Esta enzima interviene en la síntesis de β-1,3-D-glucano, un polímero que es un componente de la pared celular de hongos tan comunes como Candida y Aspergillus. La micafungina se considera fungicida para Candida6. De todas las especies de Candida, la micafungina tiene una concentración mínima inhibitoria superior para Candida glabrata, pero mejor que fluconazol, voriconazol y anfotericina B liposomal6,11 (tabla 1).
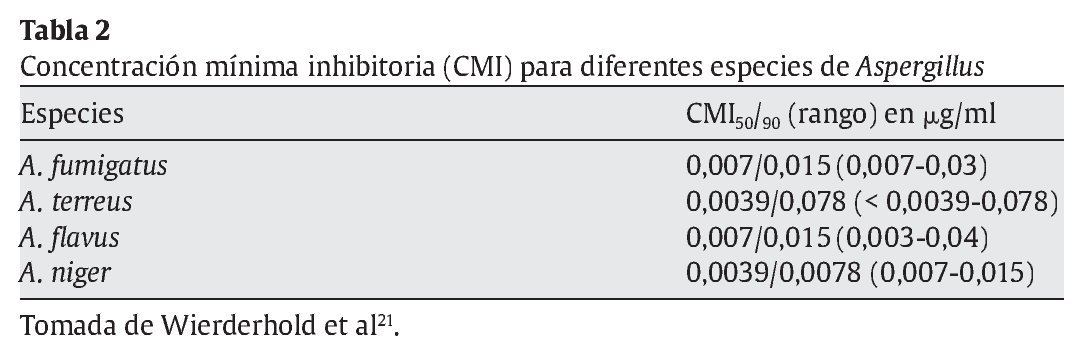
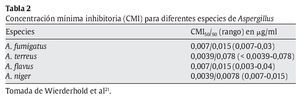
La concentración mínima inhibitoria de micafungina para Aspergillus es muy baja y debe considerarse que tiene un efecto fungistático frente a este hongo21 (tabla 2). La micafungina no es activa frente a Trichosporon, Fusarium o Pseudallescheria boydii21 y tiene actividad in vitro contra formas unicelulares de hongos endémicos (Blastomyces dermatitidis, Coccidioides e Histoplasma capsulatum)8.
Farmacocinética
La micafungina tiene una farmacocinética lineal, es decir, se puede predecir un aumento del fármaco al aumentar la dosis. El perfil de farmacocinética plasmática en niños es similar al de los adultos15. En cambio, hay una relación inversa entre el aclaramiento y la edad, de forma que el aclaramiento en niños de 2-8 años de edad es aproximadamente 1,35 veces más rápido que el observado en niños ≥ 9 años de edad15. La vida media de eliminación también es significativamente más corta en los pacientes más jóvenes que en los pacientes de ≥ 9 años de edad. En niños con neutropenia febril, se mostró la absorción lineal de la dosis y no hubo evidencia de toxicidad limitante de dosis15. En recién nacidos prematuros de peso > 1.000 g, se observó que la vida media de micafungina era más corta y el aclaramiento, más rápido7.
La dosificación en pediatría no está totalmente esclarecida, aunque, en general, la evidencia indica que en los niños de edades comprendidas entre los 2 y los 8 años debería utilizarse una dosificación en mg/kg con dosis 1,5 veces más altas que las utilizadas en adultos. Los recién nacidos de peso extremadamente bajo necesitarán dosis 3-5 veces superiores que los niños de 8-17 años2. Las dosis recomendadas para niños con un peso inferior a 40 kg es de 2 mg/kg/día para el tratamiento de la candidiasis invasiva y de 1 mg/kg/día para la profilaxis de la infección por Candida en niños sometidos a trasplante hematopoyético.
Interacciones con otros fármacos
Las interacciones con otros fármacos son relativamente raras, al no metabolizarse por el sistema del citocromo P-450. Así, no se han descrito interacciones con ciclosporina, tacrolimus, micofenolato o esteroides. Solamente los pacientes que reciben sirolimus o nifedipina pueden tener alguna interacción, casos en los que es preciso realizar el seguimiento de la dosis de sirolimus o nifedipina.
El uso de micafungina con otros azoles se ha estudiado en modelos animales y no hay evidencia de antagonismo. Al tener un mecanismo de acción muy diferente al de los azoles, no hay la posibilidad de resistencia cruzada y, en algunos ensayos, se ha demostrado que micafungina es activa frente a aislamientos de Candida que son resistentes a fluconazol o voriconazol18.
Podría producirse resistencia cruzada con las otras equinocandinas (caspofungina y anidulafungina) al tener mecanismos de acción similares; no obstante, en un ensayo se observó que en una serie de aislamientos de Candida parapsilosis que mostraban resistencia frente a caspofungina y a anidulafungina resultó ser sensible a micafungina20.
Profilaxis
La profilaxis de IFI con micafungina se ha evaluado en un ensayo clínico de pacientes que recibían un trasplante de progenitores hematopoyéticos. Se trataba de un ensayo comparativo, aleatorizado, doble ciego, multicéntrico y en fase III, en el que participaron 882 pacientes, de los cuales 84 eran niños con edades comprendidas entre los 6 meses y los 16 años de edad19. En el ensayo, el brazo comparador era fluconazol. En el subgrupo pediátrico, el tratamiento con micafungina fue de 50 mg cuando el peso era superior a 40 kg y de 1 mg/kg/día si el peso era inferior a 40 kg. El estudio demostró una eficacia mayor en la prevención de la infección de brecha en el grupo de micafungina que en el de fluconazol (el 80 frente al 73,5%; p = 0,35). Las infecciones fúngicas desarrolladas durante el período de estudio fueron: un caso de infección por zigomiceto en el grupo de la micafungina y 3 casos (2 Aspergillus y una Candida parapsilopsis) en el grupo de fluconazol19.
Candidemia y candidiasis
La eficacia de la micafungina en el tratamiento de la candidiasis invasiva se evaluó en un estudio en el que se comparó el tratamiento con micafungina (2 mg/kg) frente a anfotericina B liposomal (3 mg/ kg), en el que mostró una efectividad favorable en ambos grupos13. En el subestudio pediátrico, se incluyó a un total de 106 niños con enfermedades oncológicas que incluían neutropenia y prematuros. El éxito terapéutico era definido como la respuesta clínica y micológica al final del estudio. Los resultados mostraron que había una respuesta favorable en 35 de los 48 pacientes (72,9%) que recibieron micafungina y en 38 de los 50 pacientes (76%) que recibieron anfotericina B liposomal.
La incidencia de efectos adversos era más baja en el grupo de la micafungina que en el de la anfotericina B liposomal (el 36,5 frente al 42,6%, respectivamente), y la incidencia de efectos adversos serios fue igualmente menor (el 3,8 frente al 9,3%). Además, el número de pacientes que tuvo que interrumpir el tratamiento por el efecto adverso fue menor que el grupo de la micafungina (el 3,8 frente al 16,7%, respectivamente).
Ostrosky-Zeichner et al12 realizaron un estudio en el que usaron micafungina sola o en combinación para 126 pacientes diagnosticados de candidiasis refractaria. En el estudio se utilizó una dosificación de 1 mg/kg para Candida albicans y de 2 mg/kg para especies de Candida diferentes de C. albicans. El porcentaje de respuesta fue del 83,3% y los efectos adversos fueron poco frecuentes12.
Aspergillus
La experiencia pediátrica se limita al trabajo de Flynn et al5, en el cual se incluyó a un total de 331 pacientes, de los cuales 58 eran niños. La dosis inicial era de 1,5 mg/kg/peso, que podría incrementarse, y la dosis máxima utilizada fue de 7,5 mg/kg/día. Los datos del estudio son difíciles de interpretar al incluir diferentes situaciones clínicas (de novo y refractarias) y diferentes estrategias (monoterapia o tratamiento combinado). No obstante, había un índice de respuesta alto, 24 de 54 casos (44,4%), en niños con aspergilosis refractaria tratados con tratamiento combinado que incluía micafungina.
Seguridad
La micafungina es un antifúngico generalmente muy bien tolerado. La incidencia de reacciones adversas en niños menores de 16 años es similar a la vista en adultos y muy raramente determina la interrupción de la medicación. En general, la elevación de las enzimas hepáticas, la hiperbilirrubinemia y las náuseas son los efectos adversos más comunes.
Del estudio de 296 pacientes pediátricos incluidos en diferentes publicaciones, solamente 7 niños (2,4%) presentaron efectos adversos que determinaron la interrupción del tratamiento, y el investigador solamente clasificó a 2 de estos casos como efectos adversos serios1.
Conclusiones
La micafungina es una de las 3 equinocandinas disponibles en este momento. Se ha demostrado efectiva frente a Candida y Aspergillus y no tiene efectividad frente a Fusarium y Trichosporon. El mecanismo de acción es la inhibición de la síntesis de la enzima β-1,3-D-glucano, que determina un daño en las células de la pared del hongo. La micafungina no es metabolizada por la vía de citocromo P-450, y por tanto las interacciones con otros fármacos son escasas. La farmacocinética en pacientes pediátricos es lineal, pero tiene una vida media y una tasa de aclaramiento más bajas, sobre todo en neonatos, lo que indica la necesidad de una dosis mayor en este grupo de edad.
Declaración del autor
El autor no tiene conflictos de interés con esta publicación.
Correo electrónico:lmadero.hnjs@salud.madrid.org
Historia del artículo:Recibido el 4 de febrero de 2009
Aceptado el 11 de febrero de 2009