La primoinfección por Pneumocystis jirovecii ocurre de forma asintomática antes de los 6 meses de edad, lo que sugiere que la infección se adquiere muy precozmente en la vida. Se ha descrito también la presencia de neumonía por Pneumocystis en recién nacidos, lo que indica la necesidad de estudiar la colonización en el binomio madre-hijo.
ObjetivosEvaluar la prevalencia de colonización de Pneumocystis en gestantes y explorar la potencial transmisión transplacentaria.
MétodosEstudio transversal que incluyó a mujeres gestantes mayores de 18 años con 37 o más semanas de gestación y negativas para el VIH que acudieron al Hospital Cayetano Heredia en los años 2016-2017. Se obtuvo información clínica y demográfica de la gestante y del recién nacido. Se tomaron muestras de lavado orofaríngeo/hisopado nasal de la gestante, de placenta y de aspirado nasofaríngeo/hisopado nasal del recién nacido. Todas las muestras respiratorias fueron analizadas mediante PCR anidada. En el caso de las muestras de placenta solo fueron analizadas aquellas procedentes de mujeres con resultados positivos de PCR para Pneumocystis en las muestras respiratorias.
ResultadosDe las 92 gestantes incluidas en el estudio cinco presentaban colonización por Pneumocystis (5,43%). Se evaluaron las muestras de 87 recién nacidos y las placentas de las cinco madres con PCR positiva, no encontrándose ADN de Pneumocystis en ninguna de ellas.
ConclusionesAunque el 5,43% de las mujeres gestantes estuvieran colonizadas por Pneumocystis no pudo determinarse el rol de esta colonización en la transmisión a sus recién nacidos, ya que en ninguno de ellos se demostró la presencia de Pneumocystis.
Pneumocystisjirovecii primary infection occurs asymptomatically before 6 months of age, suggesting that the infection is acquired very early in life. Furthermore, Pneumocystis pneumonia has been described in newborns, which emphasizes the importance of studying Pneumocystis colonization in mother-infant pairs.
AimsTo evaluate the prevalence of Pneumocystis colonization among pregnant women and to determine the potential transplacental transmission.
MethodsA cross-sectional study was carried out on HIV-negative women over 18 years-old, and 37 or more weeks of pregnancy attending Hospital Cayetano Heredia Maternity unit during 2016-2017. Clinical and demographical information was collected on them and their newborns. Oropharyngeal washes, nasal swabs, and placenta samples were collected from women, as well as a nasopharyngeal aspirate and nasal swab from newborns. All respiratory samples were analysed by nested-PCR for the detection of Pneumocystis. Placenta samples from women with a positive PCR result in their respiratory samples were also analysed by nested-PCR.
ResultsOf the 92 pregnant women included, five of them (5.43%) were colonized by Pneumocystis. Pneumocystis DNA was not found in any of the 87 available newborn samples or in the placentas of the five women who had a positive result by PCR in their upper respiratory samples.
ConclusionsIt was found that 5.43% of the pregnant women were colonized by Pneumocystis, there was no evidence of any role of this colonization in the transmission to their newborns, since none of them tested positive for Pneumocystis.
Pneumocystis jirovecii es un hongo oportunista que cobró notoriedad después de la aparición de la pandemia de sida, por ser la causa más común de neumonía en los pacientes con recuento de linfocitos CD4+ menores a 200células/μl4. Antes del advenimiento del sida esta condición era descrita raramente: menos de 200 casos fueron reportados en los EE.UU. entre 1967 y 197022.
La infección por Pneumocystis ocurre tempranamente en la niñez y puede manifestarse como una enfermedad respiratoria de vías altas autolimitada6. Más aún, casos de neumonía por P. jirovecii fueron descritos en recién nacidos en la era presida1,12. Montes Cano et al. evaluaron muestras fijadas en formalina y conservadas en parafina de placenta y óbitos fetales, y encontraron por medio de técnicas moleculares ADN de Pneumocystis en ambos tipos de muestras, hecho que sugiere la transmisión placentaria8. Ante esto surge la posibilidad de que, además de la vía respiratoria, Pneumocystis pueda transmitirse de forma vertical o transplacentaria. Nuestro objetivo fue evaluar la prevalencia de colonización por Pneumocystis en mujeres gestantes y explorar la potencial transmisión transplacentaria.
Materiales y métodosEste estudio fue aprobado por los Comités Institucionales de Ética de la Universidad Peruana Cayetano Heredia y del Hospital Cayetano Heredia. Se realizó un estudio transversal en el Servicio de Obstetricia del Hospital Cayetano Heredia (Lima, Perú) entre diciembre de 2016 y octubre de 2017 en el que participaron, previa firma del consentimiento informado, 92 mujeres gestantes mayores de 18 años con 37 o más semanas de gestación y negativas para el VIH programadas para cesárea. Se obtuvo la información clínica y demográfica de las gestantes y de sus recién nacidos a través de la revisión de la historia clínica. Durante las 24horas anteriores al parto se tomaron muestras de lavado orofaríngeo e hisopado nasal a las gestantes de acuerdo con los protocolos establecidos15,17. En el recién nacido se tomaron muestras de aspirado nasofaríngeo e hisopado nasal en las primeras 24horas. La placenta se recogió en una bolsa plástica de forma aséptica y fue transportada al laboratorio. Se tomaron muestras de seis cotiledones en total, en línea recta, siguiendo un trayecto periferia-centro-periferia; de cada cotiledón se tomaron 0,4g. Las muestras de tres cotiledones se juntaron y fragmentaron para formar una mezcla de 1,2g, de los que se tomaron 0,5g para extraer el ADN. Se repitió el mismo procedimiento para los otros tres cotiledones, de manera que se trabajó con dos mezclas independientes por paciente. Cada mezcla se colocó en un frasco Erlenmeyer que contenía 20ml de PBS (pH=7,2) estéril, y se puso en agitación a una temperatura de 4°C durante 30minutos. El macerado fue filtrado con una gasa estéril y centrifugado a 2.900g y 4°C durante 10minutos. Se retiró el sobrenadante y el sedimento se resuspendió en 600μl de PBS (pH=7,2) estéril. Para la extracción y purificación de ADN se utilizó QIAamp® DNA Mini Kit (Qiagen, Alemania) según las especificaciones del fabricante. Para ello se tomaron 200μl del homogeneizado inicial. Para las placentas se utilizó un volumen de 40μl de proteinasa K (18mg/ml). El ADN obtenido fue cuantificado mediante el biofotómetro D5 (Eppendorf, Alemania) y diluido a 50ng/μl para prevenir la inhibición por exceso de ADN. Asimismo, las muestras de aspirado nasofaríngeo e hisopado nasal de cada recién nacido fueron procesadas de acuerdo con lo descrito17.
Se realizó la reacción en cadena de la polimerasa (PCR) anidada en todas las muestras respiratorias, y en las muestras de placenta de las mujeres cuyas muestras respiratorias resultaron positivas en la detección de Pneumocystis por PCR. Con el propósito de aumentar la sensibilidad en la detección de Pneumocystis las dos muestras respiratorias de la madre se procesaron juntas como una sola muestra. El mismo procedimiento se realizó para las muestras respiratorias obtenidas del recién nacido. Las muestras obtenidas de la gestante y del recién nacido fueron analizadas por separado. Por cada placenta se evaluaron dos muestras de manera independiente. Para la identificación del ADN de Pneumocystis se utilizaron cebadores para la amplificación del gen que codifica la subunidad mayor del rARN mitocondrial; en la primera ronda, pAZ102-E: 5‘GATGGCTGTTTCCAAGCCCA 3‘y pAZ102-H: 5‘GTGTACGTTGCAAAGTACTC 3‘, cuyo producto de amplificación se corresponde con un fragmento de 346 pb, y en la segunda ronda, pAZ102-X: 5‘GTGAAATACAAATCGGACTAGG3‘y PAZ102-Y: 5‘TCACTTATTATTAATTGGGGAGC3‘, que dan lugar a un producto de amplificación de 263pb. Se usó el siguiente protocolo de PCR: 40 ciclos de 1minuto 30segundos a 95°C, 1minuto 30segundos a 55°C, 2minutos a 72°C20,21. Se utilizaron controles negativos para el control de la contaminación cruzada en las etapas de extracción y purificación del ADN y para cada muestra en la etapa de PCR. Como control de inhibición y de presencia de ADN humano se llevó a cabo la amplificación del gen de la beta-globina mediante los cebadores PCO3: 5’ CTTCTGACACAACTGTGTTCACTAGC3’ y PCO4: 5’ TCACCGCAACTTCATCCACGTTCACC3’16. Después de la amplificación 5μl de cada producto de PCR fueron sometidos a electroforesis en gel de agarosa al 1,5%, tinción con GelRed (Biotium, EE. UU.) y visualización bajo luz ultravioleta. Se incluyó como control positivo una muestra de lavado broncoalveolar de un paciente con diagnóstico de neumocistosis (proporcionada por el Instituto de Ciencias Biomédicas de la Universidad de Chile).
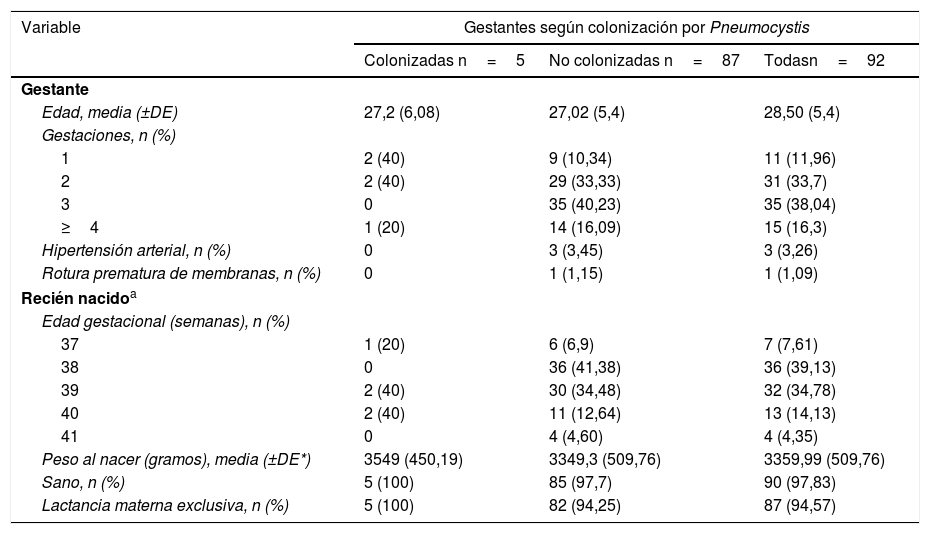
ResultadosEl promedio de edad de las 92 mujeres gestantes fue de 28,5 años (desviación estándar±5,4). El 32,7% de ellas eran gestantes por segunda vez y el 38,04% por tercera vez (tabla 1). Tres de ellas (3,26%) tenían hipertensión arterial asociada a la gestación y una presentaba rotura prematura de membranas (1,09%). Ninguna presentaba diabetes gestacional u otra condición inmunosupresora conocida. La PCR de cinco de ellas (5,43%) fue positiva para Pneumocystis en las muestras respiratorias; dos de ellas eran gestantes por primera vez, dos por segunda vez y una por cuarta vez. Las placentas de estas cinco gestantes fueron negativas para Pneumocystis. Entre los 92 recién nacidos la mayoría tenían 38 y 39 semanas de gestación (39,13% y 34,78%, respectivamente). Los cinco recién nacidos cuyas madres habían tenido secreciones respiratorias positivas para Pneumocystis tenían 37 (n=1), 39 (n=2) y 40 (n=2) semanas de edad gestacional, se encontraban sanos y recibieron lactancia materna exclusiva. En cinco de los 92 recién nacidos no se pudieron obtener muestras respiratorias, por lo que fueron finalmente analizadas las muestras de 87 de ellos, con resultado de PCR negativo para Pneumocystis.
Características clínicas y epidemiológicas de las mujeres gestantes y los recién nacidos según la colonización de las gestantes por Pneumocystis jirovecii
| Variable | Gestantes según colonización por Pneumocystis | ||
|---|---|---|---|
| Colonizadas n=5 | No colonizadas n=87 | Todasn=92 | |
| Gestante | |||
| Edad, media (±DE) | 27,2 (6,08) | 27,02 (5,4) | 28,50 (5,4) |
| Gestaciones, n (%) | |||
| 1 | 2 (40) | 9 (10,34) | 11 (11,96) |
| 2 | 2 (40) | 29 (33,33) | 31 (33,7) |
| 3 | 0 | 35 (40,23) | 35 (38,04) |
| ≥4 | 1 (20) | 14 (16,09) | 15 (16,3) |
| Hipertensión arterial, n (%) | 0 | 3 (3,45) | 3 (3,26) |
| Rotura prematura de membranas, n (%) | 0 | 1 (1,15) | 1 (1,09) |
| Recién nacidoa | |||
| Edad gestacional (semanas), n (%) | |||
| 37 | 1 (20) | 6 (6,9) | 7 (7,61) |
| 38 | 0 | 36 (41,38) | 36 (39,13) |
| 39 | 2 (40) | 30 (34,48) | 32 (34,78) |
| 40 | 2 (40) | 11 (12,64) | 13 (14,13) |
| 41 | 0 | 4 (4,60) | 4 (4,35) |
| Peso al nacer (gramos), media (±DE*) | 3549 (450,19) | 3349,3 (509,76) | 3359,99 (509,76) |
| Sano, n (%) | 5 (100) | 85 (97,7) | 90 (97,83) |
| Lactancia materna exclusiva, n (%) | 5 (100) | 82 (94,25) | 87 (94,57) |
DE: desviación estándar.
Encontramos que el 5,43% de las mujeres gestantes estaban colonizadas por Pneumocystis. Aunque hay limitados estudios en gestantes la gestación se considera un factor de riesgo en la colonización por Pneumocystis9. Estudios realizados en Chile y Colombia estimaron una tasa de colonización de 15,5% y 16% entre mujeres gestantes, respectivamente18,19. Esta similitud en la tasa de colonización de mujeres gestantes es interesante, ya que en estudios realizados en distintas localizaciones geográficas se han observado diferencias en la prevalencia de colonización por Pneumocystis en concomitancia con algunas enfermedades pulmonares crónicas, diferencias que han sido atribuidas a factores climáticos3,11. La menor proporción de gestantes colonizadas en este estudio no tiene una explicación evidente.
Se sabe que la inmunidad materna debe continuar con su función protectora, pero a la vez permitir la tolerancia al feto, por lo que tienen lugar una serie de regulaciones complejas que permiten lograr este equilibrio. En relación con la inmunidad adaptativa, por ejemplo, se ha observado que durante el embarazo tiene lugar una respuesta predominante de Th2 sobre Th1; asimismo, las hormonas producidas en el embarazo, como el estradiol, el estriol y la progesterona también promueven cambios en la respuesta inmune2,7,13. Debido a estos cambios las gestantes podrían sufrir cierto riesgo de ser colonizadas por Pneumocystis14. Por otro lado, la transmisión transplacentaria de Pneumocystis se ha descrito en algunas especies de animales como el conejo, cuya placenta es monocorial, similar a la humana, pero no en otras como la rata o el ratón que tienen placenta bicorial5. Un estudio que evaluó 40 placentas y 20 pulmones de fetos abortados determinó la presencia de ADN de Pneumocystis en 8 y 11 de estos especímenes, respectivamente, lo que sugeriría la transmisión transplacentaria8. Asimismo, Mortier et al. describieron el caso de una gestante con sida y neumonía en la que se detectó Pneumocystis en la placenta y en el pulmón del feto (natimuerto)10. En nuestro estudio no pudimos determinar si las mujeres colonizadas pudieron transmitir la infección a sus recién nacidos, ya que no se logró detectar Pneumocystis en la placenta o en los recién nacidos. Una de las limitaciones de este estudio fue que solo se incluyeron gestantes con parto por cesárea, por lo que estos resultados no podrían ser extrapolados a toda la población de gestantes. Tampoco se realizó un seguimiento en los recién nacidos para evaluar en ellos la presencia de Pneumocystis posteriormente. Otra limitación fue la evaluación de la presencia de Pneumocystis en el lavado orofaríngeo y en el hisopado nasal, cuyos resultados no necesariamente se corresponden con aquellos obtenidos de la secreción pulmonar.
Concluimos que en este estudio el 5,43% de las mujeres gestantes sin inmunosupresión conocida estaban colonizadas por Pneumocystis, a diferencia de sus recién nacidos, en los que no se encontró la misma colonización, por lo que no se pudo establecer una asociación entre la colonización por Pneumocystis de las madres y la transmisión a sus recién nacidos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
FinanciaciónEste trabajo se realizó en el marco de la Red Iberoamericana sobre Pneumocystosis (212RT0450) del Programa para el Desarrollo de la Ciencia y la Tecnología en Iberoamérica (CYTED) y fue financiado por CONCYTEC, Perú, en el contexto del proyecto ERANet-LAC (HID0254 ELAC2014), 7.° Programa Marco de la Unión Europea.