El pescado de mar es fuente de AG omega-3 (AGO3). La ingesta de AGO3 ha mostrado disminuir la producción de derivados del ácido araquidónico con actividad inflamatoria, aumentar los valores de derivados del ácido eicosapentaenoico de menor actividad e inhibir linfocitos T helper-2 mediadores de reacciones inflamatorias alérgicas. Por otro lado, el pescado de mar es un importante alérgeno alimentario y también puede actuar como alimento liberador de histamina. El objetivo de este trabajo es evaluar la relación entre el consumo de pescado de mar y los síntomas de enfermedades alérgicas.
MétodosEste estudio transversal se realizó en 765 alumnos (el 83,4%, mujeres) elegidos al azar de la Universidad del Centro Educativo Latinoamericano, con edades entre 17 y 65 años, mediante cuestionarios validados para enfermedades alérgicas e ingesta de pescado de mar.
ResultadosQuienes consumían pescado de mar una o más veces al mes, semanal o diario (46,7%), presentaron prevalencia de síntomas de asma del 8% en el último año, mientras que en los que nunca lo consumían o lo hacían menos frecuentemente fue del 12,9% (p < 0,05). Esto mismo ocurrió con síntomas de asma por ejercicio (el 7,9 frente al 12,2%; p < 0,05), tos seca nocturna no asociada a infecciones (el 13,3 frente al 19,6%; p < 0,05) y rinoconjuntivitis alérgica en el último año (el 20,8 frente al 27,5%; p < 0,05) y con síntomas de ambas enfermedades alérgicas respiratorias (el 4,2 frente al 8,7%; p < 0,005). Se mantuvo la significación estadística al estratificar por sexo, edad, obesidad, reflujo y hábito de fumar. También hubo mayor frecuencia de síntomas de urticaria en individuos que consumían pescado de mar más de dos veces a la semana (el 29,5 frente al 12,5%; p < 0,05).
ConclusionesLos resultados señalan que el consumo mensual de pescado de mar podría proteger, por su contenido de AGO3, contra enfermedades como asma y rinoconjuntivitis alérgica. Sin embargo, consumos elevados incrementarían la frecuencia de urticaria, probablemente en relación con fenómenos alérgicos o seudoalérgicos.
Sea fish (SF) is a natural source of omega-3 fatty acids (O3FA). Intake of O3FA reduces the production of arachidonic acid derivatives, which have antiinflammatory activity, and elevates levels of eicosapentaenoic acid derivatives, with lower activity. O3FA also inhibit T helper-2 lymphocytes, which mediate allergic inflammatory reactions. SF is a major food allergen and could also act as a histamine-releasing food. The objective of this study was to analyze the association between SF consumption and the presence of allergic symptoms.
MethodsWe conducted a cross-sectional study in 765 randomly selected students (83.4% women), aged 17–65 years old, attending the Universidad del Centro Educativo Latinoamericano. The students completed validated questionnaires on allergic diseases and the frequency of SF intake.
ResultsThe prevalence of asthma symptoms in the previous 12 months was 8.0% among participants reporting SF consumption daily, weekly or once a month or more (46.7%) and was 12.9% in those reporting SF consumption less than once a month or never (p<0.05). Similar results were obtained when we evaluated exercise-induced asthma (7.9% vs 12.2%; p<0.05), nocturnal dry cough not associated with infections (13.3% vs 19.6%; p<0.05), allergic rhinoconjunctivitis in the last year (20.8% vs 27.5%; p<0.05) and symptoms of both allergic respiratory diseases (4.2% vs 8.7%; p<0.005). Statistical significance was maintained when stratification by sex, age, obesity, reflux and smoking habits was performed. In contrast, a higher frequency of urticaria symptoms was found in participants who reported SF consumption more than twice a week (29.5% vs 12.5%; p<0.05).
ConclusionsThese data suggest that SF consumption at least once a month could protect against diseases such as asthma and allergic rhinoconjunctivitis, due to the O3FA content of SF. However, high SF intake could increase the prevalence of urticaria, probably because of allergic or pseudoallergic phenomena.
Los notables avances en el estudio de la relación entre alimentación y enfermedades han permitido un gran crecimiento en la prevención y el tratamiento de diversas afecciones.
Uno de los logros más importantes es el realizado en enfermedades cardiovasculares al encontrar efectos beneficiosos en las placas de ateroma y de reducción de colesterol, en individuos sometidos a dietas con altas proporciones de ácidos grasos poliinsaturados1. En particular, los ácidos grasos omega-3 (AGO3) han mostrado disminuir la agregación plaquetaria y los fenómenos inflamatorios que agravan los cuadros de ateromatosis2.
Una gran cantidad de estudios han acumulado evidencia respecto a la posible relación entre la ingesta de AGO3 y la disminución del riesgo de enfermedades alérgicas3. Estas son un claro ejemplo de una respuesta inflamatoria inapropiada (hipersensibilidad) del sistema inmunitario, mediada por mecanismos específicos frente a la exposición a diversos elementos del entorno. La reacción de hipersensibilidad alérgica constituye una respuesta patógena a una molécula no propia denominada alérgeno4.
Las enfermedades alérgicas pueden denominarse atópicas cuando resultan de la combinación de las siguientes características: a) capacidad de reconocer alérgenos medioambientales, esencialmente inocuos para el resto de la población, desarrollando una respuesta de anticuerpos IgE específicos; b) actividad incrementada de células inflamatorias, como mastocitos, basófilos y eosinófilos, y c) hiper-reactividad de los tejidos afectados u órganos de expresión de las manifestaciones clínicas5.
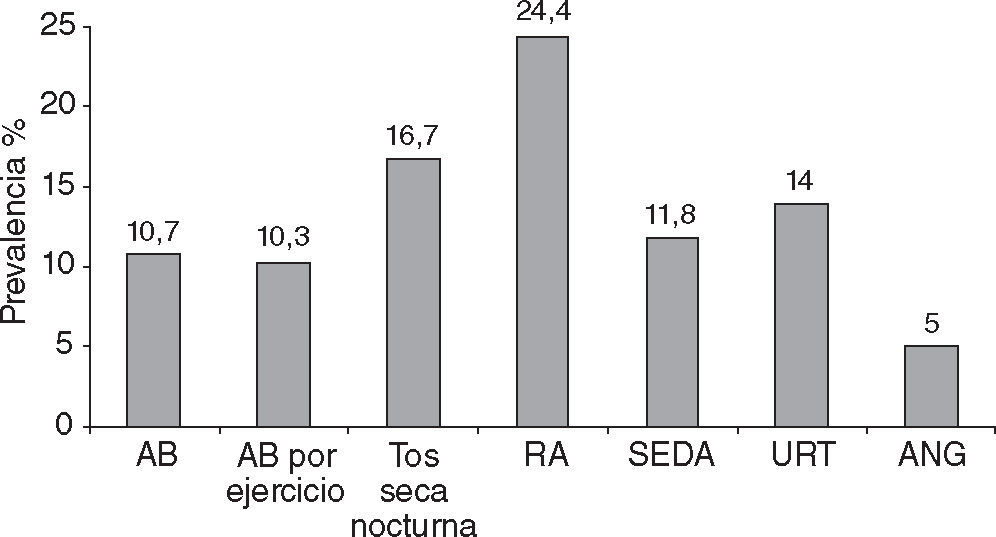
Las enfermedades atópicas tienen diversos fenotipos, los más frecuentes son el asma bronquial (AB), enfermedad inflamatoria crónica de las vías aéreas que causa episodios recurrentes de sibilancias, disnea, opresión torácica y tos asociados a una obstrucción del flujo aéreo reversible de forma espontánea o con tratamiento6, la rinoconjuntivitis alérgica (RA), inflamación de la mucosa nasal y/o conjuntival caracterizada por estornudos, rinorrea, lagrimeo, prurito nasal o conjuntival y obstrucción nasal7, el síndrome de eccema y dermatitis atópica (SEDA), inflamación pruriginosa superficial de la piel con erupción polimorfa constituida por vesículas, eritema, costras y descamación8, la urticaria (URT), reacción inflamatoria eritematosa, macular o papular circunscripta y pruriginosa, que afecta capas superficiales de la piel y que revierte generalmente en menos de 24 h9, y el angioedema (ANG), reacción inflamatoria que afecta al tejido subcutáneo y mucosas, y produce hinchazón en el sitio afectado que no deja fóvea y es no pruriginoso10.
En los pacientes atópicos hay una desviación hacia las respuestas inmunitarias de linfocitos Th2. La activación de esta estirpe celular se traduce en la secreción característica de IL-4, IL-5 e IL-13. Debido a la mayor expresión de IL-4 y/o IL-13 las células beta se diferencian a plasmocitos y son inducidas a sintetizar altas concentraciones de IgE específica para el alérgeno, las cuales se ubican en la membrana de los mastocitos de todo el organismo. El reingreso de alérgenos y su contacto con dos moléculas de IgE específica adheridas al mastocito iniciará el proceso de desgranulación, liberando mediadores químicos productores de inflamación aguda y atracción de eosinófilos que favorecerán la inflamación crónica11.
Las enfermedades atópicas requieren de mastocitos y basófilos, células efectoras localizadas en el tejido conectivo de todo el organismo (piel, aparatos respiratorio, digestivo y urinario y plasma, entre otros), las cuales, una vez activadas, liberan mediadores químicos inflamatorios (desgranulación), como histamina, triptasa, prostaglandinas, leucotrienos, bradiquinina, TNFα, IL-4, IL-5, IL-6, TGFβ, IL-13 y PAF, entre otros, los cuales colaboran con la respuesta inflamatoria inmediata. Libera, además, otros mediadores como C-C quimiocinas (RANTES, eotaxina, MIP-1α, MIP-1β, MCP-1,2 y 4), C3a, C5a, ECF-A e IL-5 que colaboran con la respuesta tardía o crónica, y genera una activación inmunitaria sistémica más compleja, que renueva la aparición de síntomas clínicos característicos; sobre todo atrae al lugar y activa eosinófilos, basófilos, monocitos y linfocitos12,13.
Particular importancia adquieren las prostaglandinas y los leucotrienos en la inflamación alérgica, ya que son parte de los gránulos del mastocito y se liberan rápidamente luego del contacto del antígeno con la molécula de IgE, pero posteriormente comienza una nueva síntesis de estos a partir de los fosfolípidos de membrana que sostiene la respuesa inflamatoria. Los subtipos de prostaglandinas E2 y F2 y los subtipos de leucotrienos B4 son los que tienen mayor efecto inflamatorio14.
Los pescados de mar, así como las algas y plancton marino, constituyen una importante fuente de ácidos grasos poliinsaturados de tipo omega-3; los principales son: ácido eicosapentaenoico (20:5 n-3) y docosahexaenoico (22:6 n-3)15.
Hay estudios que señalan que el alto consumo de pescado de mar en los primeros años de vida se asociaría con un menor desarrollo de enfermedades alérgicas en los años subsiguientes16,17. Se conoce que la ingesta de AGO3 disminuye la producción de derivados del ácido araquidónico de conocida actividad quimiotáctica en enfermedades inflamatorias (por ejemplo, leucotrieno B4 y postaglandinas E2 y F2) y aumenta los valores de derivados del ácido eicosapentaenoico que poseen menor efecto inflamatorio (por ejemlo, de leucotrieno B5 y prostaglandinas E3 y E3a). La ingesta de ácidos grasos omega 6 genera efectos contrarios; aumenta los valores de mediadores derivados del ácido araquidónico18.
Los AGO3 producen una potente inhibición in-vitro de la secreción de IL-1, IL-2 y TNFα e incrementan la producción de TGFβ, lo cual induce la disminución de la respuesta TH219.
Es interesante aumentar la evidencia científica respecto a la relación entre consumo de pescado de mar y enfermedades alérgicas a AGO3, para acentuar su impacto regional y permitir en un futuro la posibilidad de generar recomendaciones que induzcan hábitos alimentarios que mejoren la calidad de vida.
ObjetivoEvaluar si la frecuencia de consumo de pescado tiene relación con la prevalencia de síntomas de enfermedades alérgicas inflamatorias, como AB, RA, SEDA, URT y ANG.
Material y métodosDiseñoSe utilizó un modelo de estudio observacional de corte transversal para valorar la relación entre frecuencia de consumo de pescados de mar (variable predictiva) y síntomas de enfermedades alérgicas (estimadores de las variables de impacto). Los potenciales factores de confusión estadística considerados fueron la edad, el sexo, el índice de masa corporal (no se realizó medición directa, sólo se encuestó peso y talla) y la presencia de reflujo gastroesofágico.
PoblaciónEl trabajo se realizó sobre estudiantes universitarios adultos (población) y la muestra fue tomada en la Universidad del Centro Educativo Latinoamericano, durante el año 2007, con alumnos de todas las carreras elegidos al azar, y contuvo 765 alumnos, 638 mujeres (83,4%) y 127 varones (16,6%), con edades comprendidas entre 17 y 65 (media, 21,42 ± 4,18) años. El tamaño de la muestra se calculó utilizando un poder del 80% con un valor de significación del 95%.
Herramientas de valoraciónSe encuestó a los estudiantes con el cuestionario validado al español del estudio ISAAC para valorar síntomas de AB, RA y SEDA. Si bien los cuestionarios se aplicaron en su totalidad, de cada uno de los anteriores se seleccionó la pregunta guía que tiene mayores especificidad y sensibilidad para la aproximación al diagnóstico de la enfermedad20. Ante la falta de cuestionarios validados para URT y ANG, se procedió a la confección de preguntas que valoren los síntomas de estas enfermedades. También se anexó un cuestionario de frecuencia de consumo21 de pescado de mar y se interrogó edad, sexo, peso, talla, hábito de fumar y síntomas de reflujo gastroesofágico. Los principales aspectos del cuestionario que definieron las variables que utilizar en los estudios de asociación pueden observarse en la tabla 1.
Análisis estadísticoEl análisis estadístico de la información se efectuó con el programa Epi-Info. Para el análisis de la significación de las asociaciones entre variables cualitativas se calculó la oddsratio (OR, desigualdad relativa) con intervalo de confianza (IC) de Cornfield del 95%, mediante la prueba de la χ2 con corrección de Yates. Para ponderar la influencia de los factores de confusión se realizaron análisis estratificados calculando la OR bruta para todos los estratos y la OR ponderada de Mantel-Haenszel con límites de confianza de Cornfield del 95%.
Consideraciones éticasLos cuestionarios y el protocolo fueron aprobados por el comité de ética de la universidad y se respetó estrictamente el anonimato de los encuestados en virtud de la legislación vigente (habeas data).
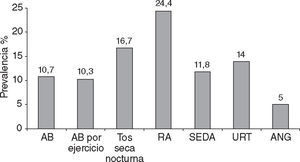
ResultadosPrevalencia de enfermedades alérgicasSe halló una alta prevalencia de síntomas de enfermedades alérgicas. En la figura 1 pueden observarse las frecuencias correspondientes a los principales síntomas de enfermedades respiratorias y dérmicas.
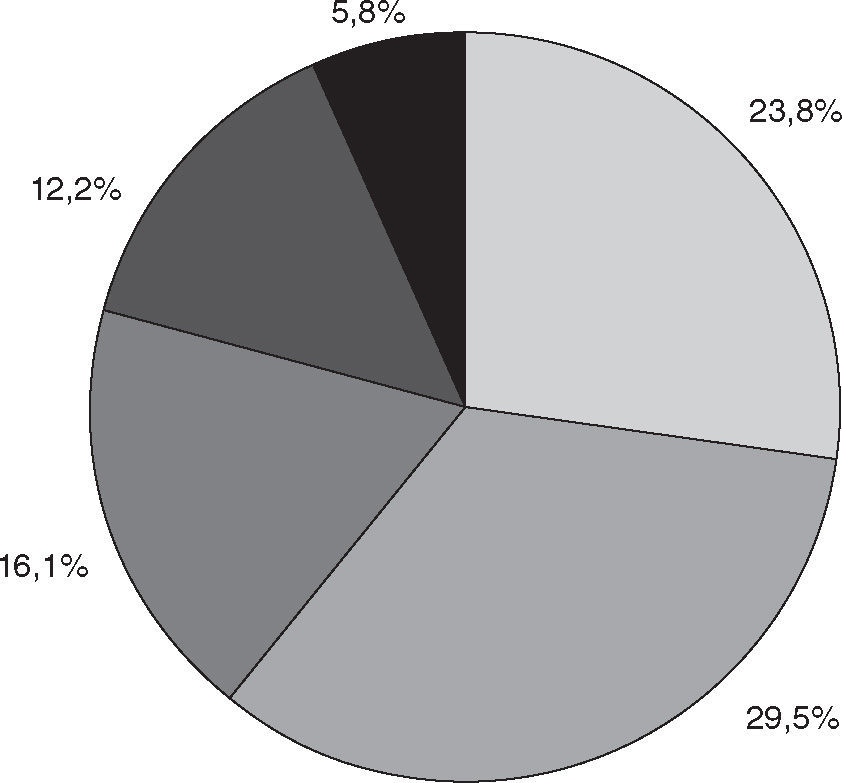
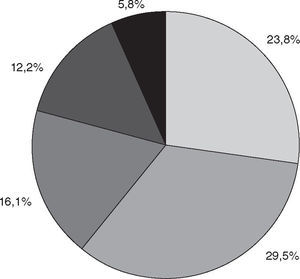
Consumo de pescado de marLa frecuencia de consumo de pescado de mar se observa en la figura 2. Comparado con los no consumidores, los varones manifestaron ingerir pescado de mar con mayor frecuencia (82,5%) que las mujeres (73,5%) (OR = 1,7; IC del 95%, 1,01–2,91; p < 0,05), y los mayores de 20 años manifestaron alimentarse con pescado de mar con mayor frecuencia (80,3%) que los de dicha edad o menores (70,1%) (OR = 1,74; IC del 95%, 1,22–2,47; p < 0,005).
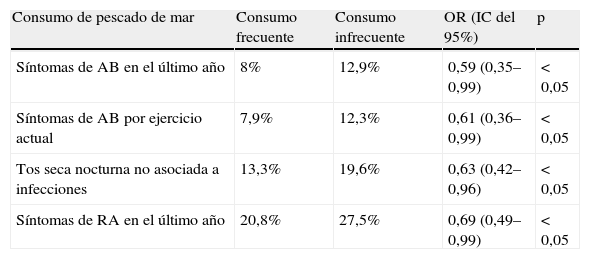
Prevalencia comparativa de consumo de pescado en relación con síntomas de enfermedades alérgicasSe hallaron diferencias significativas en la prevalencia de enfermedades alérgicas respiratorias al diferenciar la frecuencia de consumo del pescado de mar en dos grupos: A: frecuente (una o más veces al mes, semanal o diario) y B: infrecuente (nunca o menos de una vez al mes), que representan el 46,7 y el 53,3%, respectivamente.
En el grupo de consumo frecuente, la prevalencia de síntomas de AB en los últimos 12 meses fue significativamente menor que en los que nunca consumían o lo hacían menos de una vez al mes. Esto mismo ocurrió con síntomas de AB por ejercicio, tos seca nocturna no asociada a infecciones y RA en el último año (tabla 2).
Comparación de síntomas alérgicos respiratorios con diferentes consumos de pescado de mar
| Consumo de pescado de mar | Consumo frecuente | Consumo infrecuente | OR (IC del 95%) | p |
| Síntomas de AB en el último año | 8% | 12,9% | 0,59 (0,35–0,99) | < 0,05 |
| Síntomas de AB por ejercicio actual | 7,9% | 12,3% | 0,61 (0,36–0,99) | < 0,05 |
| Tos seca nocturna no asociada a infecciones | 13,3% | 19,6% | 0,63 (0,42–0,96) | < 0,05 |
| Síntomas de RA en el último año | 20,8% | 27,5% | 0,69 (0,49–0,99) | < 0,05 |
AB: asma bronquial; IC: intervalo de confianza; OR: odds ratio; RA: rinoconjuntivitis alérgica.
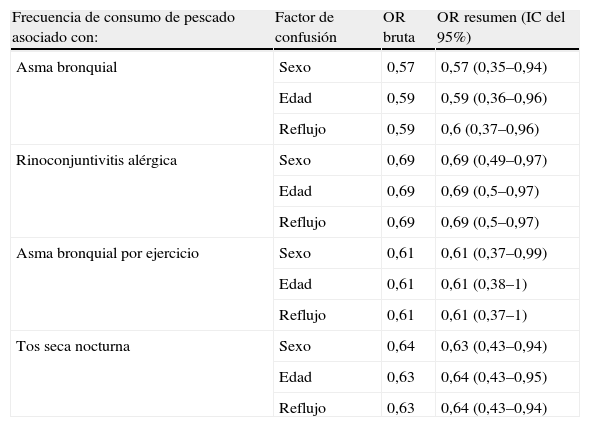
En todos los resultados mostrados anteriormente se mantuvo la significación estadística luego del ajuste por sexo, categorías de edad (mayores o menores de 20 años), presencia de reflujo gastroesofágico, categorías de índice de masa corporal (con o sin obesidad) y hábito de fumar. En todos estos casos las OR brutas y ponderadas de Mantel-Haenszel fueron similares y la significación estadística resumen de los distintos estratos fue < 0,05. A modo de ejemplo, la tabla 3 muestra el ajuste por sexo, edad y reflujo de la asociación frecuencia de consumo de pescado y síntomas alérgicos respiratorios en el último año.
Análisis estratificado por diferentes factores de confusión en la asociación de síntomas alérgicos respiratorios y frecuencia de consumo de pescado
| Frecuencia de consumo de pescado asociado con: | Factor de confusión | OR bruta | OR resumen (IC del 95%) |
| Asma bronquial | Sexo | 0,57 | 0,57 (0,35–0,94) |
| Edad | 0,59 | 0,59 (0,36–0,96) | |
| Reflujo | 0,59 | 0,6 (0,37–0,96) | |
| Rinoconjuntivitis alérgica | Sexo | 0,69 | 0,69 (0,49–0,97) |
| Edad | 0,69 | 0,69 (0,5–0,97) | |
| Reflujo | 0,69 | 0,69 (0,5–0,97) | |
| Asma bronquial por ejercicio | Sexo | 0,61 | 0,61 (0,37–0,99) |
| Edad | 0,61 | 0,61 (0,38–1) | |
| Reflujo | 0,61 | 0,61 (0,37–1) | |
| Tos seca nocturna | Sexo | 0,64 | 0,63 (0,43–0,94) |
| Edad | 0,63 | 0,64 (0,43–0,95) | |
| Reflujo | 0,63 | 0,64 (0,43–0,94) |
IC: intervalo de confianza; OR: odds ratio.
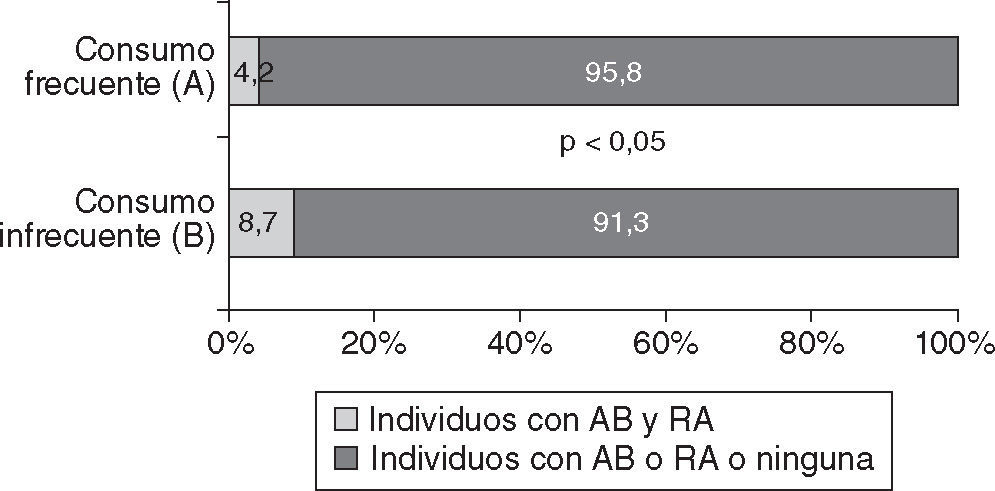
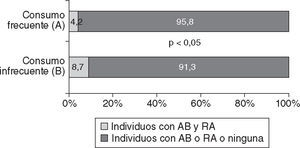
En la figura 3 puede observarse una menor prevalencia de individuos que manifestaron padecer las dos enfermedades respiratorias (AB y RA) entre los que referían consumir pescado de mar en la forma frecuente (A) que en los que mencionaban un consumo infrecuente (OR = 0,46; IC del 95%, 0,23–0,88; p < 0,005).
No se hallaron diferencias significativas entre la frecuencia de consumo de pescado de mar y síntomas de ANG y SEDA.
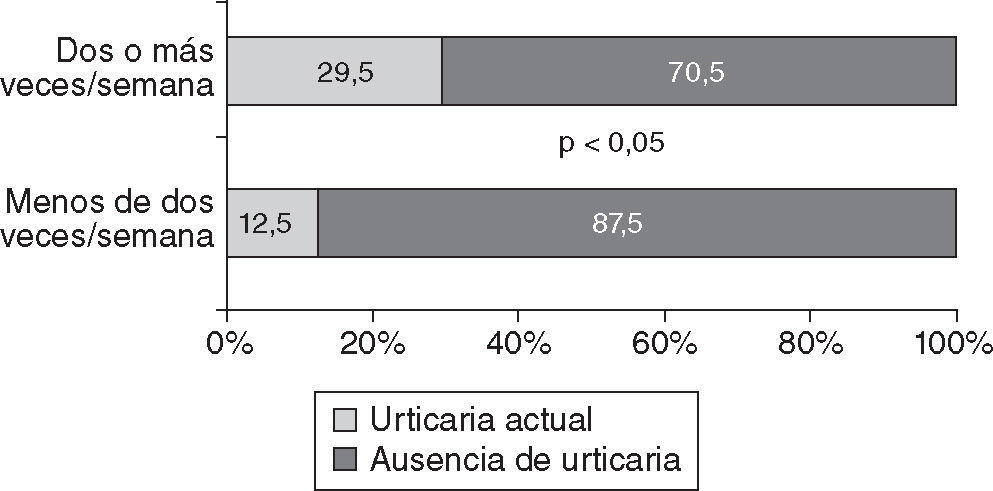
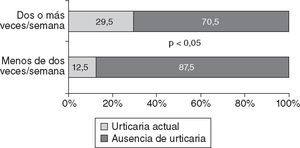
Por otro lado, hubo una mayor frecuencia de síntomas de URT en los individuos que manifestaron un consumo de pescado de mar mayor de dos veces a la semana (el 29,5 frente al 12,9%; OR = 2,81; p < 0,05) (fig. 4).
DiscusiónLa prevalencia mundial de enfermedades alérgicas se ha incrementado un 200% en los últimos 20 años22. En la actualidad las cifras oscilan entre el 10 y el 25% tanto en los países desarrollados como en los subdesarrollados23.
En nuestra región, también se han encontrado cambios en la frecuencia de estas enfermedades en corto tiempo y con metodologías de estudio similares. A modo de ejemplo, en Rosario durante el año 2001 la prevalencia, en 400 adultos jóvenes, de síntomas actuales de AB, RA y SEDA fue del 10, el 41,5 y el 7,6% respectivamente24, que se incrementó al 13,6, el 45,5 y el 12,6%, respectivamente, durante 2008 en un estudio donde se encuestó a 1.876 individuos de similar edad25.
A pesar de la multiplicidad de rasgos genéticos involucrados en la concepción de los fenotipos alérgicos, estas enfermedades resultan de una colección de genes en profunda interacción con el medio ambiente26. El creciente y significativo aumento de estas enfermedades en el mundo se ha intentado explicar con la hipótesis higiénica, la cual propone que esta rápida variación temporal está relacionada con factores ambientales que favorecen la desviación de la respuesta inmunitaria hacia un perfil T helper-2 (Th2) con producción de IgE específica contra alérgenos. Alguno de los factores propuestos son la limpieza excesiva, la ausencia de infecciones desde temprana edad, la polución, el destete prematuro y la introducción de alimentos sólidos en forma anticipada27. Se ha señalado que el perfil de ácidos grasos consumidos puede tener relación con esta desviación, por ejemplo, los AGO3 se han mostrado capaces de inhibir el desarrollo Th2 y poseen menor capacidad inflamatoria. En este sentido, prostaglandina E3 y leucotrieno B5 formados a partir de AGO3 tienen menor efecto inflamatorio que prostaglandina H2 y leucotrieno B4 derivados de ácidos grasos omega-628.
Los resultados de este trabajo mostraron un elevado porcentaje de enfermedades alérgicas en la población analizada. La prevalencia de síntomas de AB, RA y SEDA, evaluada con cuestionarios validados internacionalmente, y de URT y ANG, valorada con cuestionarios propios, fue similar al promedio de los resultados encontrados en estudiantes de entre 18 y 30 años que concurrían a una universidad pública y una privada29,30.
Con respecto a la frecuencia de consumo de pescado de mar se ha encontrado un bajo consumo en formas semanal o diaria. La lejanía al mar de la ciudad de Rosario y la consiguiente restricción comercial hacen a estos productos menos accesibles, frente al intenso comercio de carnes rojas imperante en la zona.
En la muestra analizada, se observó una distribución diferencial del consumo al menos mensual de pescado de mar preferentemente en individuos no asmáticos y no riníticos en ese momento; probablemente esto indique que la susceptibilidad reducida a presentar estas enfermedades inflamatorias podría estar influida por nutrientes beneficiosos de aquellos. Sin embargo, el consumo mayor de dos veces en la semana incrementó la frecuencia de síntomas de URT probablemente en relación con fenómenos alérgicos o seudoalérgicos. Variados antígenos del pescado se encuentran entre los más frecuentes alérgenos alimentarios y, además, el alto contenido de aminas biógenas lo perfila como alimento capaz de producir fenómenos inflamatorios sin necesidad de que medien moléculas de IgE31.
Estos resultados concuerdan con otros estudios que encuentran una menor prevalencia de asma en individuos que consumen pescado de mar con mayor frecuencia32,33. En un estudio realizado sobre 5.024 niños con edades comprendidas entre 6 y 7 años de la ciudad de Rosario y de localidades rurales de la Pampa húmeda y de la región mesopotámica de la Argentina, el consumo de pescado una o más veces por semana se asoció significativamente con una menor frecuencia de síntomas de asma, al igual que el antecedente de haber tenido lactancia materna34. Además, en todo el mundo se han realizado intervenciones con administración de AGO3 en pequeñas muestras, con evidencias de menor grado de inflamación bronquial. Un ejemplo reciente es la medición de óxido nítrico espirado (indicador de inflamación bronquial) en 23 individuos asmáticos, que mostró menores valores de este gas, tras el desafío con alérgenos, en quienes habían consumido durante 5 semanas AGO3, en comparación con los que habían recibido placebo35.
En gran cantidad de ensayos epidemiológicos, se registró una mayor prevalencia de síntomas de AB en el sexo femenino36, en sujetos fumadores37, con mayor índice de masa corporal38 y con síntomas de reflujo gastroesofágico39. La edad es un factor conocido que influye en las enfermedades alérgicas en general40. Además, nuestros resultados actuales muestran una mayor frecuencia de consumo de pescado de mar en los varones y en individuos con mayores de 20 años.
Para comprobar si la asociación entre consumo de pescado de mar y síntomas de asma no se encontró afectada por estas variables se procedió al ajuste de los resultados por sexo, edad, presencia de reflujo, obesidad y hábito de fumar, y se evidenció que la significación estadística se mantuvo luego de la estratificación de todos los casos. En otras palabras, la menor prevalencia de síntomas de RA, AB, sibilancias por ejercicio y tos seca nocturna, en individuos que consumieron pescado de mar una o más veces al mes, se mantiene significativamente entre los dos sexos, en presencia o ausencia de reflujo, obesidad y hábito de fumar, por lo que estas variables no constituyeron factores de confusión estadística en nuestro estudio.
Cabe reflexionar, por lo expuesto anteriormente, que consumir pescados de mar con mayor frecuencia podría disminuir la frecuencia de enfermedades alérgicas respiratorias de creciente prevalencia, lo cual podría implicar mejoras en el manejo médico de esta enfermedad. De todas maneras, el consumo exagerado (dos o más veces por semana) podría elevar la frecuencia de fenómenos inflamatorios cutáneos.
El consumo de alimentos es una variable poco valorada habitualmente en los consultorios donde se trabaja en la prevención y el tratamiento de enfermedades alérgicas respiratorias. Esta puede ser una herramienta simple y de gran importancia para reducir la morbilidad y la mortalidad del AB y la gran afectación de la calidad de vida de la RA con el consiguiente avance en las políticas de salud pública.
Las evidencias encontradas en nuestro trabajo, así como las aportadas por diversos autores en el ámbito internacional, muestran que este alimento podría ser útil para prevenir el desarrollo de enfermedades alérgicas. Se requerirá de estudios prospectivos más grandes que aporten mayor nivel de evidencia en el verdadero sentido de esta asociación.
Profundizar el conocimiento en este tema admitiría un abordaje terapéutico interdisciplinario que apunte a la prevención primaria, secundaria y terciaria de estas enfermedades, y que realce el papel de la alimentación saludable en nuestra sociedad.
ConclusionesEl consumo, al menos, mensual de pescado de mar se asoció con menor frecuencia de síntomas de AB y RA, independientemente del sexo, la edad, la presencia de obesidad, reflujo y hábito de fumar. Esto podría deberse al alto contenido de AGO3 en dicho alimento. Sin embargo, su consumo dos o más veces por semana se relacionó significativamente con una mayor frecuencia de síntomas de URT, probablemente en relación con fenómenos alérgicos o seudoalérgicos.