Estudiar la relación entre los valores de plomo en la sangre (VPS) y la adecuación (%) en el consumo de nutrientes en mujeres del sur de México.
MétodosParticiparon 424 embarazadas. Se aplicó un cuestionario de frecuencia de consumo de alimentos referido al año anterior. Se estimó la prevalencia de VPS elevados (> 10 μg/dl, según la Norma Oficial Mexicana [NOM] 199 SSA 1–2000 y el Center for Disease Control and Prevention de Estados Unidos, 2007).
ResultadosLa media de adecuación de la ingesta de cinc, calcio, hierro total, hierro hem, vitamina C y vitamina A fue del 37,4, el 88,2, el 38,5, el 12,8, el 78,9 y el 84,6%, respectivamente. La prevalencia de VPS elevados fue del 41,5% y el riesgo concomitante estuvo explicado por la edad > 35 años (odds ratio [OR] = 3,8 [1,4–10,3] con respecto a las de edad < 25 años; p = 0,01), concentraciones bajas de hemoglobina en sangre (< 12 g/dl) (OR = 3,1 [1,9–5]; p < 0,0001), índice de masa corporal ≥30 (OR = 1,9 [1,1–3,5]; p = 0,026), uso de piezas de cerámica vidriada en la preparación y/o el consumo de alimentos (OR = 2,3 [1,5–3,6]; p < 0,0001), adecuación en el consumo de hierro hem < 20% (OR = 2,7 [1,1–6,6]; p = 0,025), adecuación en el consumo de calcio < 80% (OR = 1,4 [1–2]; p = 0,056], adecuación en el consumo de cinc del 50–99% (OR = 1,9 [1–3,5]; p = 0,038) y adecuación < 50% (OR = 4,3 [2,2–8,7]; p = 0,044) con respecto a quienes consumían el 100% o más de los valores recomendados.
ConclusionesEl déficit en el consumo de hierro hem, calcio y cinc está asociado a mayor riesgo de VPS elevados, que también tuvieron relación con anemia, consumo de alimentos en piezas de cerámica vidriada, obesidad y mayor edad.
To analyze the association between blood lead levels and nutrient consumption, as well as associated factors, in women from southern Mexico.
MethodsA total of 424 pregnant women participated in this study by completing a questionnaire on the frequency of food consumption in the previous year. The prevalence of high blood lead levels (>10 μg/dL) was defined according to the Mexican Official Norm (NOM- 199 SSA 1–2000) and the Center for Disease Control and Prevention, USA, 2007.
ResultsThe mean percentage of adequacy of intake of zinc, calcium, total-iron, heme-iron, vitamin C and vitamin A was 37.4%, 88.2%, 38.5%, 12.8%, 78.9% and 84.6%, respectively. The prevalence of high blood lead levels was 41.5%. The risk associated with the prevalence of high blood lead levels was explained by age >35 years old [OR: 3.8 (1.4,10.3)] compared with age <25 years old (P=0.010), low blood hemoglobin levels (< 12g/dL) [OR: 3.1 (1.9, 5.0)] (P<0.0001), body mass index 30 Kg/m2 [OR: 1.9 (1.1, 3.5)], (P=0.026); compliance with heme-iron recommendations <20% [OR: 2.7(1.1, 6.6)], (P=0.025), calcium recommendations <80% [OR: 1.4 (1.0, 2.0)] (P=0.056), and zinc recommendations 50–99% [OR: 1.9 (1.0, 3.5)] (P=0.038), and <50% adequacy [OR: 4.3 (2.2, 8.7)] (P = 0.044) with respect to persons consuming 100% or more of recommended intake.
ConclusionsLow heme-iron, zinc and calcium consumption was associated with a higher risk of high blood lead levels, which in turn were also associated with anemia, food consumption from ceramic plates and containers, obesity and older age.
El plomo no tiene una función conocida en el cuerpo humano, pero puede dar lugar a la intoxicación crónica e incluso a la muerte. Sus compuestos son transformados por la luz solar, el aire y el agua. Tienen importancia industrial el óxido y el tetraetilo de plomo, así como las aleaciones formadas con estaño, cobre, arsénico, antimonio, bismuto, cadmio y sodio. Lo pueden contener las pilas y baterías de automóviles y de ordenadores, grifos y accesorios de bronce, soldaduras de tuberías de cobre, antidetonantes, aceites automotrices de desecho, municiones, dispositivos para evitar irradiación con rayos X, piezas vidriadas, pintura metálica, esmaltes, cerámica vidriada, tintes para el cabello, labiales, lápices, crayones1. A diferencia del suelo rural, en el que es de especial cuidado la contaminación microbiológica, el polvo urbano puede convertirse además en una fuente importante de contaminación por metales derivados de actividades humanas2,3.
En la zona de estudio, se fabrican piezas de cerámica vidriada con esmalte a base de óxido de plomo que genera cierto gradiente del metal en la atmósfera, el suelo y la población4,5. Con el horneado de piezas a baja temperatura el plomo queda disponible para reaccionar con el alimento contenido en estas. La concentración media de plomo (1.265 ppm) en alimentos cocinados en recipientes de barro vidriado fue muy superior a la de aquellos cocinados en recipientes de acero inoxidable (4 ppm)6. Recientemente, distintos programas de salud en México promueven el uso de otro esmalte sin plomo; no obstante, las piezas vidriadas con esmalte a base de plomo aún se fabrican y la población las utiliza en la preparación y el consumo de alimentos. Se han descrito valores elevados de plomo sanguíneo en escolares y sujetos mayores de 16 años7, así como en más del 80% de las personas de entre 21 y 49 años de edad8; los cuales se han atribuido a la fabricación y el uso alimentario de cerámica vidriada decorada con esmalte que contiene plomo7–11. En la frontera México-Estados Unidos se halló que la concentración media de plomo sanguíneo en niños mexicanos fue de 4,3 μg/dl, mientras que en niños estadounidenses fue de 2,2 μg/dl, lo que señala una diferente distribución de riesgos12.
Los efectos de intoxicación crónica por plomo se reflejan en casi todos los sistemas y órganos del ser humano. Entre la población con alto riesgo están los niños menores de edad y las mujeres embarazadas debido a que la exposición in utero, aun en dosis bajas (10–20 μg/dl de plomo en sangre del cordón umbilical), afecta al desarrollo temprano del niño y produce retraso en el crecimiento físico y las funciones neurológicas13,14. La exposición crónica se ha asociado a disminución de la fertilidad en ambos sexos15, bajo peso al nacer y déficit de talla, disminución del rendimiento intelectual16, disminución de la agudeza auditiva y dificultades para la concentración y memoria17,18, daño renal, hipertensión, trastornos digestivos, dolores musculares y en articulaciones, osteoporosis19, alteración de los mecanismos de defensa del organismo y del metabolismo de fármacos en el hígado por su acción sobre el citocromo P45020, anemia, dolores de cabeza y convulsiones21. No obstante los signos y síntomas de la intoxicación por plomo, el método más recurrido para su detección en tejidos es la concentración sanguínea22.
La cantidad de plomo que pasa del intestino a la sangre puede ser del 10% en adultos y del 40–50% en niños; basta 1 mg diario durante 15 días para que aparezcan glóbulos rojos punteados23. Se puede acumular en sangre, hígado, pulmones, riñones y médula ósea, con una vida media de 36 días; después migra hacia el sistema óseo o bien es excretado por la orina24. Un 95% del plomo de los huesos puede permanecer durante 17–27 años, pero puede liberarse al aumentar los requerimientos de calcio, como durante el embarazo, con alto riesgo para el feto ya que traspasa fácilmente la placenta25–27. Durante la lactancia, se excreta en la leche materna28. Las mujeres en edad reproductiva pueden convertirse en una fuente de exposición directa al plomo para el feto y el niño lactante22,29,30.
Aunque se ha descrito exposición a plomo en población de distintos países, su impacto en la salud no es el mismo31,32. Existe evidencia de que un consumo adecuado de nutrientes, particularmente de vitamina C33, hierro34, calcio35, fósforo36 y cinc37, limita la fijación y los efectos tóxicos del plomo en el organismo38. La suplementación materna con calcio se ha asociado a reducción en las concentraciones sanguíneas de plomo durante el embarazo y la lactancia en humanos y en animales39. El escaso valor de hierro sanguíneo en niños de 6 meses de edad se asoció a mayor concentración de plomo en sangre40.
El propósito de este trabajo fue estudiar la relación entre el valor de plomo sanguíneo (VPS) y la adecuación (%) en el consumo de nutrientes en mujeres embarazadas del sur de México. Adicionalmente, estudiar el papel de otros factores concomitantes.
Material y métodosSe realizó un estudio observacional, transversal. Participaron 424 mujeres gestantes que acudieron a la consulta de control del embarazo, durante el periodo 2006–2007, en los 9 centros de salud ubicados en la ciudad de Oaxaca y zona conurbana, pertenecientes a los Servicios de Salud de Oaxaca, organismo del Sistema Nacional de Salud de México. Las participantes cubrieron los siguientes criterios: asistir a la consulta de control de embarazo, tener 6 o más meses de gestación, haber habitado permanentemente en la zona de estudio durante uno o más años, especificar por escrito su consentimiento informado y participación voluntaria, haber respondido a los cuestionarios de información sociodemográfica y de dieta, haberse sometido a la valoración clínica y a la determinación de VPS. No hubo casos de falta de respuesta.
El tamaño de muestra (n) se calculó con la fórmula n = p q / (e / 1,96)2, considerando un porcentaje poblacional (p) esperado de VPS > 10 μg/dl del 50%, q = 1 – p, error del 0,05% y nivel de confianza del 95%. Se obtuvo n = 385 a los que se sumaron 39 casos (10%) previendo una tasa de participación del 90%. El tamaño muestral fue de 424 mujeres, aunque no hubo casos de falta de respuesta.
Mediante la aplicación de un cuestionario de frecuencia de consumo de alimentos durante el último año, se obtuvo la media de consumo diario de nutrientes41 y el porcentaje de adecuación a las recomendaciones establecidas para mujeres embarazadas mexicanas42. Los nutrientes incluidos fueron: energía, proteínas, grasas, calcio, hierro total, hierro hem, cinc y vitamina C.
La valoración clínica incluyó determinaciones habituales en el control del embarazo: a) antropométricas: peso (kg), estatura (m) e índice de masa corporal ajustado sin producto (IMCa = Pa – PGT / E2, donde: Pa es el peso actual; E, la estatura en metros, y PGT, la ganancia de peso esperado por trimestre de embarazo: primer trimestre, 1,500 kg; segundo trimestre, 3 kg, y tercer trimestre, 7 kg)43; b) presión arterial sistólica y diastólica (mmHg), y c) hemoglobina (g/dl) y hematocrito (%) en sangre.
Se obtuvo una muestra de sangre entera (50 μl) por punción digital que se recolectó en tubo capilar. La cuantificación de los VPS se realizó por electroquímica con el equipo LeadCare, que detecta concentraciones de plomo en sangre desde una cantidad de 1,4 μg/dl hasta 65 μg/dl, mediante un sensor con electrodo de oro, sin mercurio ni otros materiales tóxicos. Las muestras obtenidas por la mañana se mantuvieron en refrigeración (4°C) hasta su lectura, el mismo día de la extracción. El valor criterio de VPS fue 10 μg/dl, de acuerdo con el US Center for Disease Control and Prevention (CDC)44 y la Secretaria de Salud de México45. Se clasificó con VPS elevado a las mujeres con concentración sanguínea > 10 μg/dl de plomo.
En el análisis estadístico se aplicaron pruebas paramétricas al comprobar el supuesto de normalidad en la distribución de las variables mediante el test de Kolmogorov-Smirnov. El análisis bivariable se basó en las pruebas de la t de Student y ANOVA; se describen las medias en cada grupo de comparación, así como su intervalo de confianza (IC) del 95% y la significación estadística. Mediante regresión logística multivariable se estimó el riesgo en relación con la prevalencia de VPS elevados en función de las exposiciones que mostraron asociación estadísticamente significativa en el análisis bivariable; se describe el valor de la odds ratio (OR), su IC del 95% y la significación estadística46.
ResultadosDe las 424 mujeres embarazadas participantes, el 58,3% tenía entre 13 y 25 años de edad; el 37%, entre 26 y 35 años, y el 4,7% eran mayores de 35 años. El 56% de las mujeres habitaban en el medio urbano y el 44%, en el medio suburbano. La mediana de escolaridad fue de 9 (0–20) años de estudio. El 58% contaba con un trabajo asalariado.
Entre las posibles exposiciones a plomo se observó que un 12% de ellas estaban expuestas a humos de vehículos, esmaltes, gasolina o solventes. Un 30% carecía de instalación hidráulica en su vivienda, un 54% la tenían de cobre con soldadura de plomo y un 16%, de otros materiales. El 28% bebía agua del grifo con o sin filtrar. Un 45% utilizaba cerámica de barro vidriado con fines alimentarios, distribuidos de la siguiente manera: un 30% para guisar, un 11% para servir y/o consumir alimentos calientes y un 4% para consumir alimentos fríos. Con relación a la pintura de esmalte en la vivienda, un 68% la tenía en ventanas y puertas; un 20%, en tanques de almacenamiento de agua, y un 26%, en techo, muros y/o pisos.
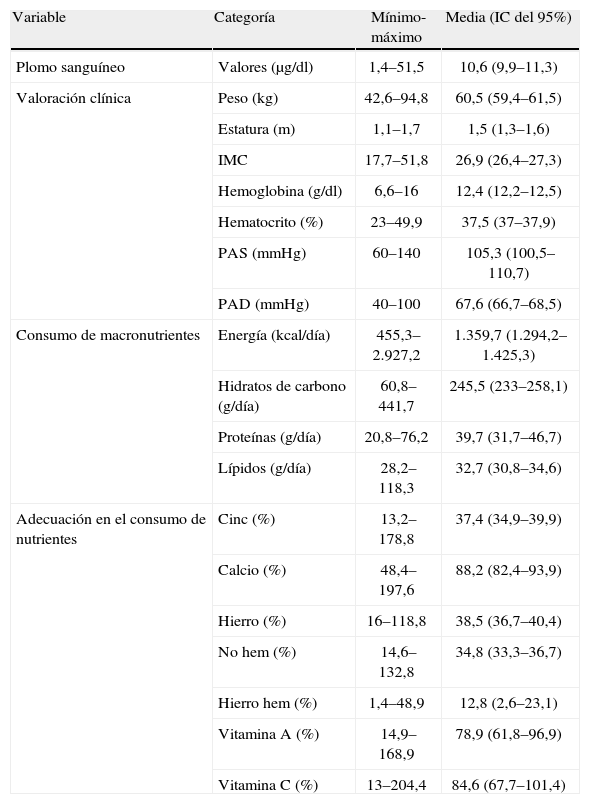
El estudio clínico nutricional indicó que la muestra estaba constituida por mujeres con sobrepeso, baja estatura, una tendencia de cifras altas de presión arterial sistólica y una dieta limitada en nutrientes; resalta la baja ingesta de hierro y cinc. Particularmente, el bajo consumo de productos de origen animal se tradujo en un limitado consumo de hierro hem (tabla 1).
Caracterización de las mujeres embarazadas en función de la valoración clínica y de la dieta (n = 424)
| Variable | Categoría | Mínimo-máximo | Media (IC del 95%) |
| Plomo sanguíneo | Valores (μg/dl) | 1,4–51,5 | 10,6 (9,9–11,3) |
| Valoración clínica | Peso (kg) | 42,6–94,8 | 60,5 (59,4–61,5) |
| Estatura (m) | 1,1–1,7 | 1,5 (1,3–1,6) | |
| IMC | 17,7–51,8 | 26,9 (26,4–27,3) | |
| Hemoglobina (g/dl) | 6,6–16 | 12,4 (12,2–12,5) | |
| Hematocrito (%) | 23–49,9 | 37,5 (37–37,9) | |
| PAS (mmHg) | 60–140 | 105,3 (100,5–110,7) | |
| PAD (mmHg) | 40–100 | 67,6 (66,7–68,5) | |
| Consumo de macronutrientes | Energía (kcal/día) | 455,3–2.927,2 | 1.359,7 (1.294,2–1.425,3) |
| Hidratos de carbono (g/día) | 60,8–441,7 | 245,5 (233–258,1) | |
| Proteínas (g/día) | 20,8–76,2 | 39,7 (31,7–46,7) | |
| Lípidos (g/día) | 28,2–118,3 | 32,7 (30,8–34,6) | |
| Adecuación en el consumo de nutrientes | Cinc (%) | 13,2–178,8 | 37,4 (34,9–39,9) |
| Calcio (%) | 48,4–197,6 | 88,2 (82,4–93,9) | |
| Hierro (%) | 16–118,8 | 38,5 (36,7–40,4) | |
| No hem (%) | 14,6–132,8 | 34,8 (33,3–36,7) | |
| Hierro hem (%) | 1,4–48,9 | 12,8 (2,6–23,1) | |
| Vitamina A (%) | 14,9–168,9 | 78,9 (61,8–96,9) | |
| Vitamina C (%) | 13–204,4 | 84,6 (67,7–101,4) |
IC: intervalo de confianza; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
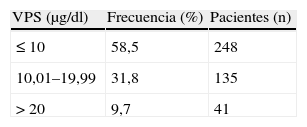
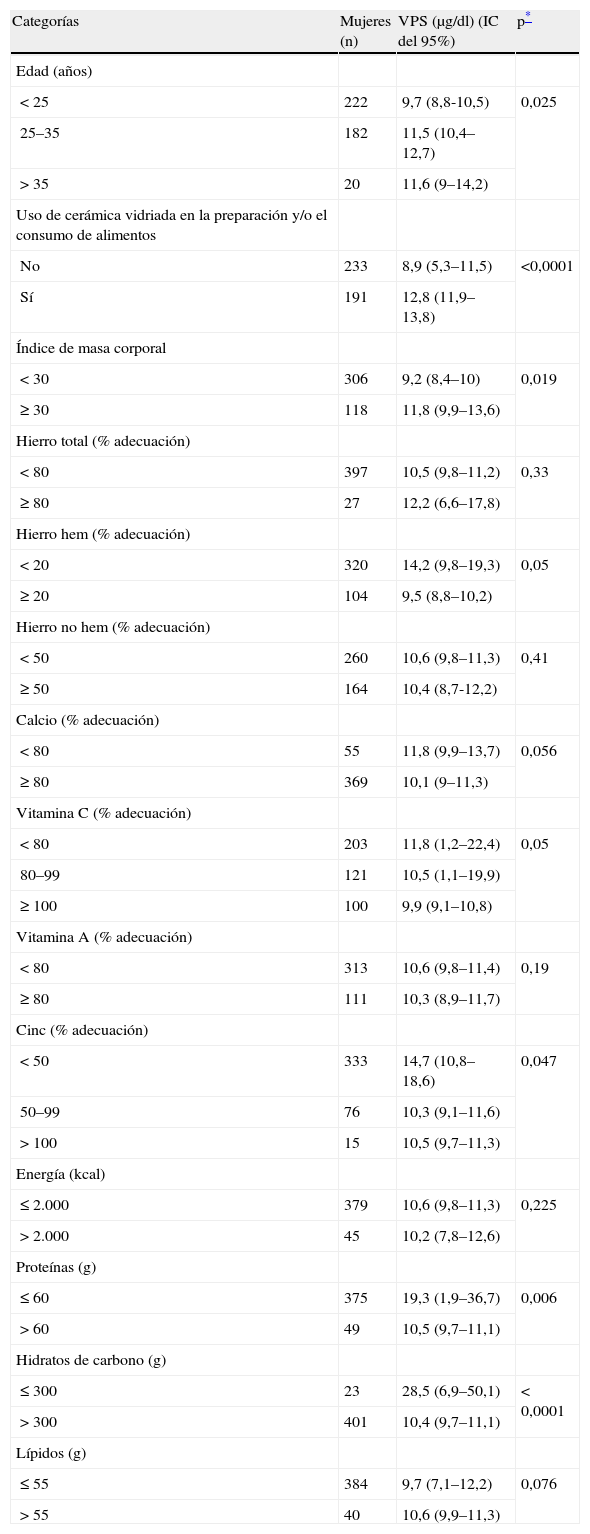
La prevalencia de VPS elevados (> 10 μg/dl) fue del 41,5% (tabla 2). Entre las exposiciones en relación con VPS elevados se halló que las mujeres que utilizaban cerámica vidriada para guisar (45%) tenían una media de VPS superior (13,3 μg/dl; IC del 95%, 11,9–14,8), en comparación con aquellas que la utilizaban sólo para servir o consumir alimentos (10,3 μg/dl; IC del 95%, 7,5–13) o quienes no la utilizaban (8,9 μg/dl; IC del 95%, 5,3–11,5) (ANOVA, p < 0,0001). Igualmente, quienes trabajaban con esmaltes y en el pintado de las piezas de cerámica (3%), presentaron una media de VPS mayor (26 μg/dl; IC del 95%, 3,2–48,7) que aquellas que tenían otro tipo de actividad (10,5 μg/dl; IC del 95%, 7,7–14,4) (t de Student, p < 0,0001). Otros factores estudiados, como el humo de vehículos, la instalación hidráulica con soldadura de plomo en la vivienda, pintura de esmalte en la vivienda y el tipo de agua de bebida, no tuvieron relación significativa con VPS más elevados en las mujeres expuestas en comparación con las no expuestas.
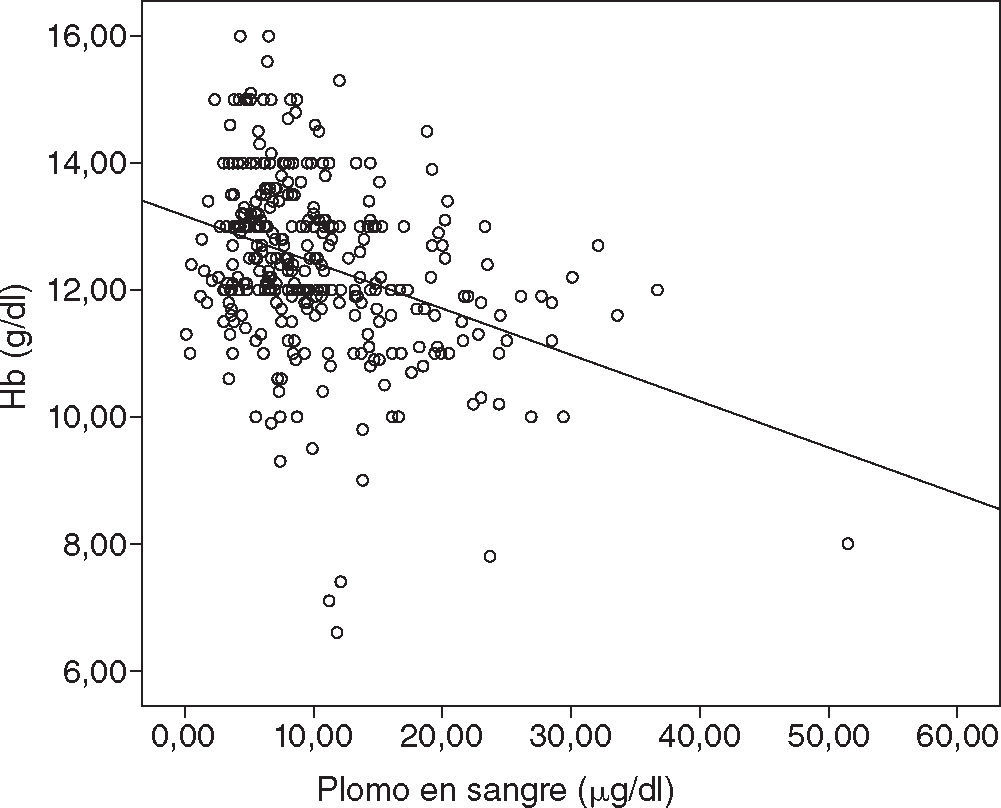
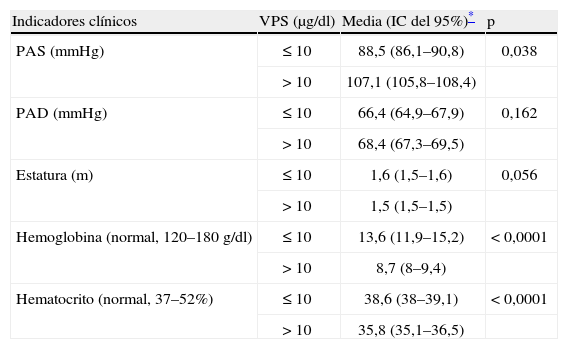
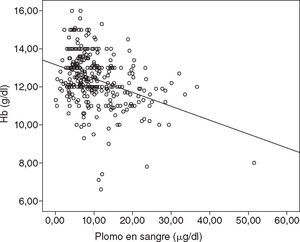
Se observó que los VPS tienen efecto en parámetros clínicos. Entre las mujeres con VPS > 10 μg/dl, la media de la presión arterial sistólica fue más elevada, la estatura era más baja y la media de valores de hemoglobina en sangre fue más baja; las diferencias fueron estadísticamente significativas en los tres casos (fig. 1, tabla 3).
Efecto de los valores de plomo sanguíneo (VPS) en la estimación de la media e intervalo de confianza (IC) del 95% de parámetros clínicos (n = 424)
| Indicadores clínicos | VPS (μg/dl) | Media (IC del 95%)* | p |
| PAS (mmHg) | ≤ 10 | 88,5 (86,1–90,8) | 0,038 |
| > 10 | 107,1 (105,8–108,4) | ||
| PAD (mmHg) | ≤ 10 | 66,4 (64,9–67,9) | 0,162 |
| > 10 | 68,4 (67,3–69,5) | ||
| Estatura (m) | ≤ 10 | 1,6 (1,5–1,6) | 0,056 |
| > 10 | 1,5 (1,5–1,5) | ||
| Hemoglobina (normal, 120–180 g/dl) | ≤ 10 | 13,6 (11,9–15,2) | < 0,0001 |
| > 10 | 8,7 (8–9,4) | ||
| Hematocrito (normal, 37–52%) | ≤ 10 | 38,6 (38–39,1) | < 0,0001 |
| > 10 | 35,8 (35,1–36,5) |
PAD: presión arterial diastólica; PAS: presión arterial sistólica.
La valoración de la ingesta de nutrientes mostró que la media de VPS fue superior, con significación estadística, en los casos de bajo consumo de hierro hem, cinc, calcio, vitamina C, proteínas e hidratos de carbono. Sin embargo, en el caso del consumo de grasa la asociación se observó en sentido inverso, aunque sin significación estadística (tabla 4). Otros factores, como tener 25 años o más, obesidad y usar cerámica vidriada en la elaboración y/o consumo de alimentos, estuvieron asociados a VPS más elevados, con significación estadística (tabla 4).
Medias de valores de plomo sanguíneo (VPS), en las mujeres participantes en función de categorías de factores de riesgo (n = 424)
| Categorías | Mujeres (n) | VPS (μg/dl) (IC del 95%) | p* |
| Edad (años) | |||
| < 25 | 222 | 9,7 (8,8-10,5) | 0,025 |
| 25–35 | 182 | 11,5 (10,4–12,7) | |
| > 35 | 20 | 11,6 (9–14,2) | |
| Uso de cerámica vidriada en la preparación y/o el consumo de alimentos | |||
| No | 233 | 8,9 (5,3–11,5) | <0,0001 |
| Sí | 191 | 12,8 (11,9–13,8) | |
| Índice de masa corporal | |||
| < 30 | 306 | 9,2 (8,4–10) | 0,019 |
| ≥ 30 | 118 | 11,8 (9,9–13,6) | |
| Hierro total (% adecuación) | |||
| < 80 | 397 | 10,5 (9,8–11,2) | 0,33 |
| ≥ 80 | 27 | 12,2 (6,6–17,8) | |
| Hierro hem (% adecuación) | |||
| < 20 | 320 | 14,2 (9,8–19,3) | 0,05 |
| ≥ 20 | 104 | 9,5 (8,8–10,2) | |
| Hierro no hem (% adecuación) | |||
| < 50 | 260 | 10,6 (9,8–11,3) | 0,41 |
| ≥ 50 | 164 | 10,4 (8,7-12,2) | |
| Calcio (% adecuación) | |||
| < 80 | 55 | 11,8 (9,9–13,7) | 0,056 |
| ≥ 80 | 369 | 10,1 (9–11,3) | |
| Vitamina C (% adecuación) | |||
| < 80 | 203 | 11,8 (1,2–22,4) | 0,05 |
| 80–99 | 121 | 10,5 (1,1–19,9) | |
| ≥ 100 | 100 | 9,9 (9,1–10,8) | |
| Vitamina A (% adecuación) | |||
| < 80 | 313 | 10,6 (9,8–11,4) | 0,19 |
| ≥ 80 | 111 | 10,3 (8,9–11,7) | |
| Cinc (% adecuación) | |||
| < 50 | 333 | 14,7 (10,8–18,6) | 0,047 |
| 50–99 | 76 | 10,3 (9,1–11,6) | |
| > 100 | 15 | 10,5 (9,7–11,3) | |
| Energía (kcal) | |||
| ≤ 2.000 | 379 | 10,6 (9,8–11,3) | 0,225 |
| > 2.000 | 45 | 10,2 (7,8–12,6) | |
| Proteínas (g) | |||
| ≤ 60 | 375 | 19,3 (1,9–36,7) | 0,006 |
| > 60 | 49 | 10,5 (9,7–11,1) | |
| Hidratos de carbono (g) | |||
| ≤ 300 | 23 | 28,5 (6,9–50,1) | < 0,0001 |
| > 300 | 401 | 10,4 (9,7–11,1) | |
| Lípidos (g) | |||
| ≤ 55 | 384 | 9,7 (7,1–12,2) | 0,076 |
| > 55 | 40 | 10,6 (9,9–11,3) | |
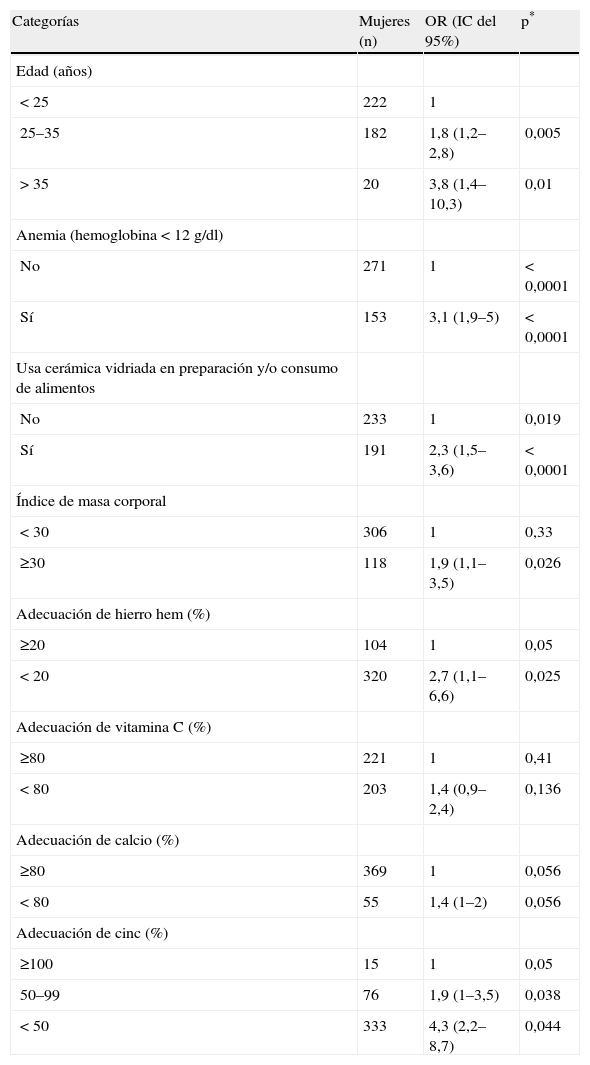
En el análisis multivariable, los factores que mostraron asociación estadísticamente significativa, directa e independiente con los VPS elevados fueron: tener edad ≥ 25 años, presentar anemia, consumir o preparar alimentos en piezas de cerámica vidriada, tener obesidad y presentar una adecuación < 20% de hierro hem, < 80% de calcio, < 100% de cinc y < 80% de vitamina C, con respecto a mayores porcentajes de adecuación a las recomendaciones establecidas para embarazadas mexicanas (tabla 5).
Modelo que explica el riesgo asociado a la prevalencia de valores de plomo sanguíneo elevados, en mujeres embarazadas, en función de factores concomitantes (n = 424)
| Categorías | Mujeres (n) | OR (IC del 95%) | p* |
| Edad (años) | |||
| < 25 | 222 | 1 | |
| 25–35 | 182 | 1,8 (1,2–2,8) | 0,005 |
| > 35 | 20 | 3,8 (1,4–10,3) | 0,01 |
| Anemia (hemoglobina < 12 g/dl) | |||
| No | 271 | 1 | < 0,0001 |
| Sí | 153 | 3,1 (1,9–5) | < 0,0001 |
| Usa cerámica vidriada en preparación y/o consumo de alimentos | |||
| No | 233 | 1 | 0,019 |
| Sí | 191 | 2,3 (1,5–3,6) | < 0,0001 |
| Índice de masa corporal | |||
| < 30 | 306 | 1 | 0,33 |
| ≥30 | 118 | 1,9 (1,1–3,5) | 0,026 |
| Adecuación de hierro hem (%) | |||
| ≥20 | 104 | 1 | 0,05 |
| < 20 | 320 | 2,7 (1,1–6,6) | 0,025 |
| Adecuación de vitamina C (%) | |||
| ≥80 | 221 | 1 | 0,41 |
| < 80 | 203 | 1,4 (0,9–2,4) | 0,136 |
| Adecuación de calcio (%) | |||
| ≥80 | 369 | 1 | 0,056 |
| < 80 | 55 | 1,4 (1–2) | 0,056 |
| Adecuación de cinc (%) | |||
| ≥100 | 15 | 1 | 0,05 |
| 50–99 | 76 | 1,9 (1–3,5) | 0,038 |
| < 50 | 333 | 4,3 (2,2–8,7) | 0,044 |
IC: intervalo de confianza; OR: odds ratio.
Los VPS encontrados en las mujeres participantes fueron mayores (media, 10,6 μg/dl) que los de las mujeres embarazadas (4,5 μg/dl) de Monterrey47 y aproximados a los comunicados en el Distrito Federal, México (10 μg/dl)29.
Sin argumentar causalidad, por ser un estudio transversal, la evidencia muestra que la vía más importante de exposición al plomo no está en las características de la vivienda, el agua de consumo ni en los humos de vehículos, sino en el contacto con el óxido de plomo, ya sea por el trabajo artesanal de pintado de piezas o por medio del consumo de alimentos en estas, lo que coincide con otros trabajos realizados en la zona de estudio6,9,11,48. Entre niños escolares de California, Estados Unidos, el consumo de alimentos elaborados e importados de Oaxaca se ha identificado como factor de riesgo de VPS elevados49,50.
Un 41,5% de las embarazadas tiene VPS elevados (> 10 μg/dl), lo que se traduce en daño a la salud materna en el presente, afectación a su esperanza y calidad de vida futura y riesgo para sus futuros hijos. Adicionalmente, hay un daño al ser humano en formación por la exposición fetal al plomo. Los hijos de las mujeres con VPS > 20 μg/dl (8%, esto es unos 34 seres humanos en formación entre las mujeres participantes en el estudio) tenían alta probabilidad de nacer con un determinado VPS, lo que limitará su crecimiento físico, el desarrollo de su sistema nervioso central y su capacidad de aprendizaje, así como la fisiología de otros órganos, por mencionar algunos efectos derivados de la exposición al plomo sufrida durante su etapa de gestación.
Los resultados de la valoración clínica son coherentes con otros estudios en población de México47 e India21, esto indica que la anemia y la hipertensión son efectos de la acción del plomo en el organismo. Es sabido que el plomo inhibe la síntesis de hemoglobina.
De acuerdo con la presente evidencia, una ingesta adecuada de hierro hem, cinc, calcio y vitamina C puede tener un efecto protector en el caso de la intoxicación crónica por plomo, en coincidencia con los hallazgos de otros autores33,35,37–39,47. En el modelo multivariable disminuyó la significación estadística del riesgo de VPS asociado a bajo consumo de vitamina C, que a su vez favorece la absorción de hierro, aunque se mantiene la tendencia de mayor riesgo de VPS elevados en relación con su menor consumo.
Es importante la magnitud de la exposición, pero a esta se añade la vulnerabilidad del grupo de población, que en este caso está determinada por la etapa de gestación y por la falta de una dieta adecuada que limite la fijación de plomo en el organismo, esto es, suficiente en hierro hem, proteínas, calcio, cinc y vitamina C42; así como la deficiente atención sanitaria y la falta de disponibilidad de un control sistemático de VPS para grupos con alto riesgo, como las embarazadas, los niños menores de 5 años y la población ocupacionalmente expuesta15, como existe en Francia51 o en Estados Unidos44,52.
Instituciones internacionales (Agencia de Protección Ambiental y los CDC de Estados Unidos)44,53 y la misma Secretaría de Salud en México45 han establecido el protocolo de actuación para dar atención médica al problema. Según los valores de intoxicación, se recomienda una intervención nutricional y de control en casos leves; pero en casos severos, se requiere la intervención médico-toxicológica y el tratamiento con quelantes como edetato cálcico disódico (CaNa2EDTA), dimercaprol (BAL), ácido 2,3-dimercapto succínico (DMSA), con resultados y efectos secundarios específicos. Recientemente en algunos bioensayos, mezclas de N-acetilcisteína y metionina han mostrado efecto quelante y efectos favorables en la reducción de radicales libres54. Adicionalmente, es posible recurrir a alternativas de remediación para la contaminación ambiental por plomo55,56.
ConclusionesUn 41,5% de las mujeres embarazadas participantes en el estudio presentaron VPS elevados (> 10 μg/dl). La preparación y/o el consumo de alimentos en piezas de cerámica vidriada con esmalte de plomo y horneadas a bajas temperatura son medios de exposición al plomo en la población estudiada. La anemia y la obesidad mostraron asociación directa e independiente con VPS elevados. En las condiciones de la población estudiada, asegurar un consumo adecuado de hierro de origen animal, calcio, cinc y vitamina C puede representar una estrategia de prevención en la reducción de los VPS maternos, en la exposición al plomo del feto en desarrollo y del niño lactante y, consecuentemente, en las concentraciones de hemoglobina.
AgradecimientosAl Departamento de Riesgos Ambientales, la Subdirección de Salud Ambiental y la Dirección de Regulación y Fomento Sanitario de los Servicios de Salud de Oaxaca, como parte del Sistema Federal de Protección Sanitaria en México.