Dentro de los síndromes mieloproliferativos crónicos (SMPC) Philadelphia negativos (Ph−) se engloban la policitemia vera (PV), la trombocitemia esencial (TE) y la mielofibrosis primaria (MFP). La PV fue descrita por primera vez en 1892 por Louis Henri Vaquez como enfermedad adquirida de etiología desconocida y de origen clonal caracterizada por una proliferación predominantemente de los progenitores eritroides, con aumento de la masa eritrocitaria (eritrocitosis eritropoyetina [EPO]-independiente/baja), de comienzo gradual y desarrollo progresivo1. No fue hasta 2005 cuando se relacionó con la mutación janusquinasa2 (JAK2-V617F), con valor predictivo positivo del 95%1. Su incidencia máxima se encuentra entre la quinta y la séptima décadas de vida (0,5-2,6 casos/100.000 habitantes), con una mayor incidencia en personas de ascendencia judía y una ligera preponderancia masculina (1,2:1)1. La presentación clínica de la PV se puede dividir en tres fases: latente (asintomática), proliferativa (sintomática), como el caso que presentamos, y gastada (mielofibrosis). La sintomatología se relaciona directamente con un síndrome de hiperviscosidad e hipermetabolismo: fatiga (80%), visceromegalia (70%), rubicundez facial (67%), cefalea (48%), prurito (43%), acufenos (33%), claudicación intermitente (25%), angor hemodinámico (15%) y eritromelalgia (EM) (3%), entre otros síntomas2.
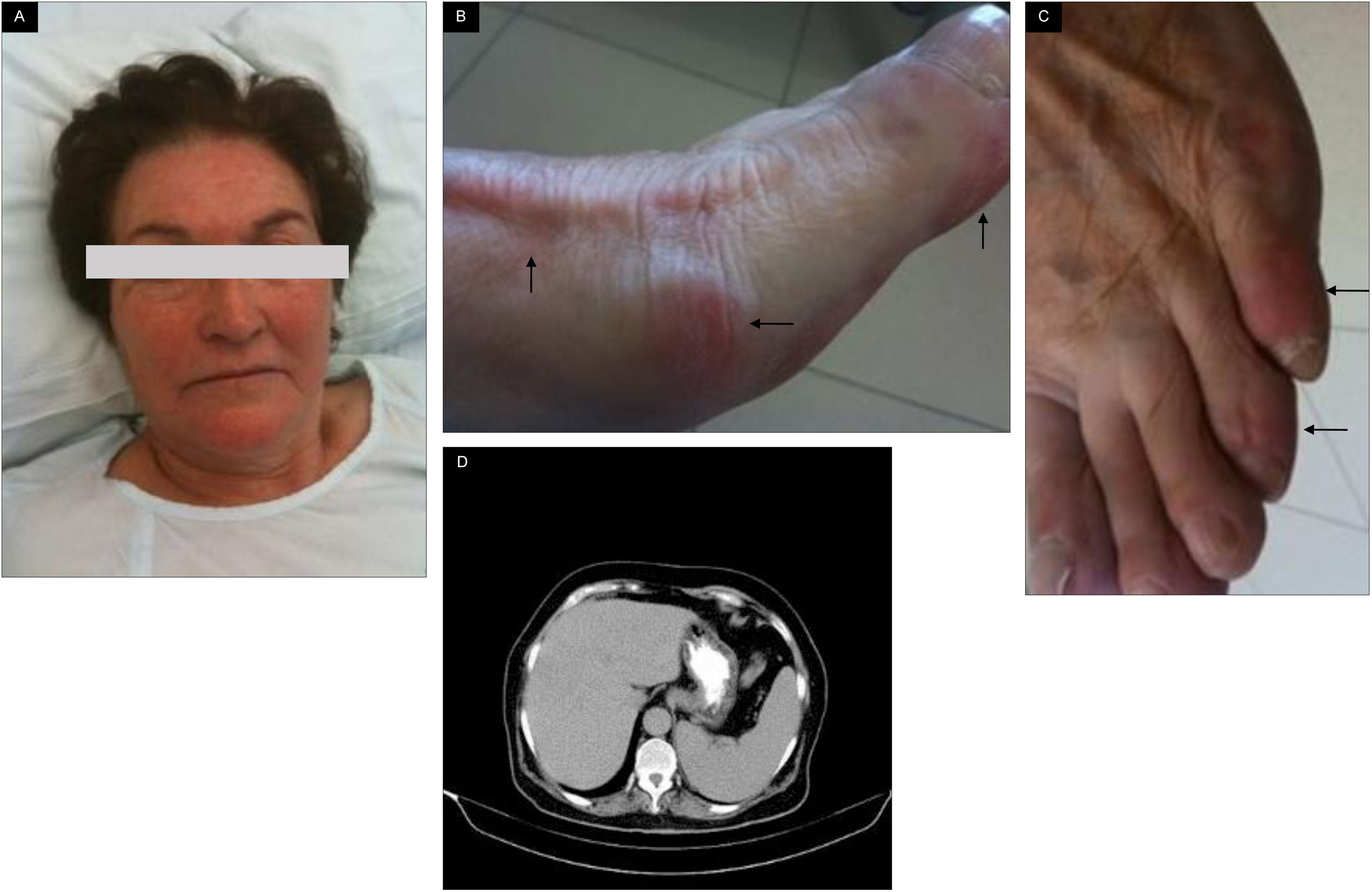
Presentamos el caso de una mujer octogenaria, caucásica, independiente para las actividades de vida cotidiana, sin sintomatología de deterioro cognitivo y bien nutrida, diagnosticada de HTA de larga evolución en tratamiento farmacológico con IECA y beta-bloqueante, sin otros antecedentes destacables, que ingresó en nuestro centro por cuadro clínico de 4meses de duración de discromía eritematoviolácea y disestesia plantar lateral de ambos pies, de predominio izquierdo. En las últimas 2semanas se asoció disnea progresiva y dolor epigástrico lancinante. A la exploración se destacaba facies pletórica (fig. 1A), se encontraba eupneica en reposo (saturación basal de oxígeno del 93%), con cifras tensionales de 179/92mmHg y frecuencia cardíaca de 105/minuto; la auscultación cardíaca y la pulmonar fueron normales, se palpaba ligera esplenomegalia, no adenopatías periféricas y se evidenciaban las lesiones descritas de los pies con pulsos pedios presentes y simétricos (fig. 1B,C). Al ingreso, en los análisis de sangre se destacaron leucocitos 15,8×109/l (neutrófilos 86%), hematíes 9,16×1012/l, hemoglobina 20,4g/dl, hematocrito 66,7%, VCM 72,8fL, HCM 22,2pg, plaquetas 551×109/l, LDH 552U/l, ácido úrico 7,7mg/dl, troponinaI negativa, D-dímeros 462ng/ml e índice quick 1,98. Una gaso-oximetría basal mostró hipoxemia (paO2 de 60mmHg) hipocápnica (paCO2 de 33mmHg). El electrocardiograma fue normal. Se realizó angio-tomografía computarizada de tórax que no evidenció tromboembolismo pulmonar, así como de abdomen, que mostró esplenomegalia moderada (fig. 1D).
Con el diagnóstico diferencial de exclusión de causas de pseudoeritrocitosis (con EPO normal: poliglobulia espurea —varones fumadores— y hemoconcentración —diuréticos—) y secundarias (con EPO elevada: hipoxia crónica —EPOC— y tumores secretores de eritropoyetina —hipernefroma y feocromocitoma—), y ante la sospecha clínico-analítica de SMPC tipo PV, se determinó la EPO sérica, que resultó baja (1,5mU/ml; valores normales: 2,6-18,5). Se analizó el cromosoma Ph, el cual resultó negativo, y la mutación JAK2-V617F, la cual resultó positiva, estableciéndose el diagnóstico de PV según los criterios 2001 y 2008 de la OMS1.
En concordancia con hematología, se inició tratamiento antiagregante con ácido acetilsalicílico 100mg, alopurinol 100mg y ciclos de flebotomía (350ml/96horas, 6 en total durante 4semanas), presentándose modesta mejoría de los parámetros analíticos: leucocitos 9,7×109/L, hematies 6,5×1012/l, hemoglobina 16,5g/dl, hematocrito 52,2%, plaquetas 419×109/l, LDH 424U/l, ácido úrico 6,6mg/dl e índice quick 1,25. Posteriormente, a las 2 semanas se inició tratamiento con fósforo radiactivo (P-32) intravenoso (2,3cy/m2, 1-2 dosis/3 meses), indicado en pacientes de edad avanzada con difícil seguimiento analítico semanal que precisa la hidroxiurea (el citorreductor que más se recomienda y menos desarrolla leucemia secundaria)2-4. A las 12 semanas del tratamiento con P-32 se normalizaron los parámetros hematimétricos. Cabe destacar que la flebotomía (450-500ml/72horas) es la piedra angular y más inocua del tratamiento; la cantidad extraída en pacientes de edad avanzada y factores de riesgo cardiovascular debería ser menor (como es en el caso que presentamos), pero tiene el inconveniente de incrementar el riesgo de sufrir eventos cardiovasculares trombóticos (ECVT) durante los primeros 36 meses2-4. A los 12 meses del diagnóstico presentó un buen control duradero sin necesidad de recurrir a la hidroxiurea y sin presentar ECVT ni tampoco transformación a leucemia mieloide aguda post-PV (las dos complicaciones que más reducen la calidad de vida y la supervivencia <24 meses en pacientes no controlados).
Consideramos que es de gran interés detenernos en la EM, también conocida como enfermedad de Mitchel o neuralgia del rojo, un síntoma clave en nuestro caso. Es una entidad poco frecuente, de etiopatogenia desconocida (anormalidad microvascular y disfunción plaquetaria) e histopatología inespecífica (proliferación capilar y edema perivascular). Se caracteriza por episodios de eritema, aumento de la temperatura e hiperalgesia, que involucra principalmente a las extremidades inferiores, con pulsos intactos5. Se estima que el 66% de los casos son formas primarias (familiares o esporádicas) y el 33% son formas secundarias a otras condiciones patológicas: la diabetes mellitus, la insuficiencia venosa, el lupus eritematoso sistémico, el liquen escleroso, la gota y los SMPC. Pueden preceder a la EM, coincidir con su inicio o aparecer durante la evolución de la misma5,6. Davis et al., en un estudio retrospectivo de una serie de 168 pacientes con EM, encontraron 15 pacientes con SMPC como causa subyacente (9PV, 4TE y 2LMC)6.
Es probable que la EM esté infradiagnosticada, por lo cual su reconocimiento precoz es crucial para poder excluir o diagnosticar potenciales causas secundarias como es la PV en pacientes con dolor neuropático paroxístico. Por lo general, los casos de EM asociados a SMPC responden al tratamiento con ácido acetilsalicílico y antidepresivos tricíclicos7.
Como conclusión, es esencial el diagnóstico precoz de la PV, individualizar el tratamiento y estratificar el riesgo de ECVT según la edad del paciente, los síntomas y la progresión de la enfermedad.