Introducción
Uno de los retos que se ha planteado la cirugía ortopédica es el alivio del dolor articular sin menoscabar su función. En base a este principio, la artroplastia de cadera ha constituido uno de los avances más importantes durante las cuatro últimas décadas. La sustitución articular de la cadera se inicia en 1938 por Wiles, proponiendo una fijación puramente mecánica de los componentes metálicos. En 1959, Charnley impulsa el concepto de la fijación del vástago femoral mediante un compuesto químico, el cemento acrílico. Los prometedores resultados obtenidos con esta técnica,12 estimularon a la comunidad ortopédica durante los años 70 a su aprendizaje, y posterior perfeccionamiento. Se reconoce que la prótesis cementada ha constituido un procedimiento eficaz para la mayoría de los pacientes con artrosis de cadera. No obstante, una serie de problemas relacionados con la cementación se han puesto de manifiesto tras analizar sus resultados a largo plazo. Así, cabe enumerar: alta tasa de fracasos protésicos en pacientes menores de 50 años, cercana al 50% en los primeros 10 años;13,16,76,91 existencia de zonas de osteolisis, consecuencia de la reacción inflamatoria ante la presencia de partículas de polimetilmetacrilato (la denominada: «enfermedad del cemento»);27,36,52 y la dificultad que plantea la cirugía de revisión de este tipo de prótesis para eliminar los restos de cemento.60
La constatación de estos hechos impulsaron el desarrollo de vástagos no cementados diseñados para obtener la fijación biológica. El concepto básico consistía en lograr la fijación del implante mediante el crecimiento óseo, para lo cual era indispensable mantener la estabilidad inicial del componente femoral, y un contacto íntimo con el hueso receptor.35 De esta forma, los primeros diseños que se introdujeron conseguían dicho objetivo mediante el ajuste a presión del vástago en el canal medular (press-fit), y una superficie irregular y excrecente que facilitara la aposición ósea (ingrowth). En 1971, Judet y cols37 con su prótesis de «porometal», fueron los pioneros en la utilización de este tipo de implantes. Basados en este concepto, se desarrollaron en Europa diversos modelos entre los que destacaban: el madrepórico de Lord, Mittelmeier y Zweymuller.
Como alternativa a la superficie metálica rugosa, se propuso la denominada superficie de «recubrimiento poroso». Esta consistía en la superposición de varias capas de microesferas para crear pequeñas intercomunicaciones que facilitaran el crecimiento óseo (ingrowth). Su idea ha sido avalada por estudios histológicos de componentes fémorales revisados y obtenidos de autopsia, que han demostrado de manera evidente la existencia de crecimiento óseo perdurable en el interior de la superficie porosa;20 los análisis biomecánicos también ha podido comprobar, que este tipo de prótesis cuando estaba bien osteointegradas, presentaban un micromovimiento entre el implante y el hueso inferior a 40 µm al ser sometida a carga fisiológica simulada.9,23 Se ha llegado a determinar la biocompatibilidad de los materiales empleados en su fabricación, así como el tamaño óptimo del poro para permitir el crecimiento óseo, el cual debía oscilar entre 100 y 400 µ.8
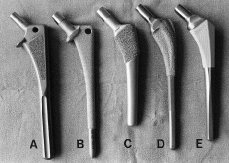
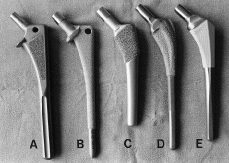
En base a estas investigaciones, las prótesis no cementadas de recubrimiento poroso han obtenido la aceptación de la mayoría de los cirujanos ortopédicos, pues podría llegar a constituir el sistema de fijación idóneo que garantice la duración del implante. De esta forma, se han introducido en el mercado durante los años 80 un gran número de vástagos fémorales que mostraban importantes variaciones, tanto en la forma (rectos vs anatómicos) como en la extensión de la superficie porosa (proximal vs extendida), con objeto de mejorar la estabilidad y el contacto óseo, e incrementar así, la probabilidad de crecimiento de hueso en el implante (tabla 1) (Fig. 1).
Figura 1. Diferentes diseños de vástagos femorales no cementados de uso frecuente. A: Harris-Galante (Zimmer); B: AML (De Puy); C: PCA (Howmedica); D: Mallory-Head (Biomet); E: Omnifit (Striker).
Sin embargo, la evaluación de los primeros resultados con este tipo de implantes ha suscitado una serie de cuestiones, diferentes a las observadas con las prótesis cementadas, pero que pueden poner en peligro su éxito a largo plazo.26 Se ha podido determinar: 1) migración distal del componente femoral; 2) despegamiento de la superficie de recubrimiento poroso; 3) presencia de áreas de osteolisis periprotésica; y 4) aparición de signos radiológicos tempranos que sugieren la existencia de una atrofia ósea proximal. Todos estos hechos han sido objeto de intensa investigación durante la presente década, y serán discutidos en los siguientes apartados.
Migración y osteolisis
La incidencia de migración temprana del vástago femoral no cementado se ha cifrado entre el 4 y el 9%.8 Se ha propuesto que un desplazamiento distal radiológico, no progresivo e inferior a 3 mm, no representa un fracaso de la prótesis, sino más bien un asentamiento de la misma en el canal femoral.61,75 Un estudio realizado mediante radiología estereofotométrica (RSA) ha puesto de manifiesto que el umbral de migración vertical, para predecir un futuro aflojamiento, sería tan solo de 1,2 mm.25 Los desplazamientos superiores a los señalados serían consecuencia de una falta de estabilidad inicial del implante, y la consiguiente ausencia de osteointegración. De hecho, la mayoría de los cambios de posición del vástago femoral están relacionadas con implantes con un tallaje inferior al que correspondería, fracturas femorales intraoperatorias, y separaciones de la superficie de recubrimiento.26,48 Parece por tanto, que la migración distal temprana del vástago obedece más a un error de técnica quirúrgica o de manufactura del material, que al concepto en sí de prótesis de recubrimiento poroso. Sin embargo, no ha sido establecida aún la causa del hundimiento tardío del implante. Recientemente, Taylor y cols86 ha sugerido, que la migración distal del vástago a medio plazo estaría provocada por un excesivo estrés, el cual sería capaz de desarrollar un fracaso por fatiga del hueso esponjoso periprotésico.
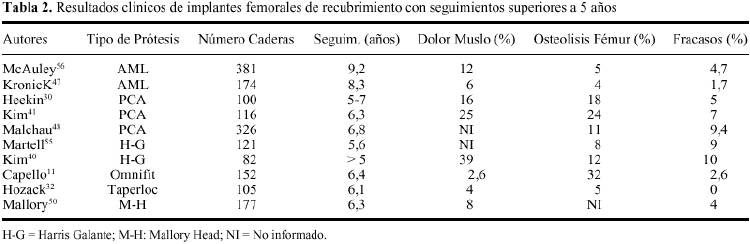
La osteolisis se reconoce radiológicamente por un adelgazamiento difuso de la cortical femoral o como un lesión quística focal.35 Aunque con características diferentes a las prótesis cementadas, el problema de la osteolisis no ha quedado resuelto con los implantes de recubrimiento poroso. Una incidencia relevante de osteolisis alrededor del componente femoral se ha puesto de manifiesto con todos los diseños no cementados de uso corriente (tabla 2). Además, se ha podido demostrar, que tanto la prevalencia como el tamaño de la lesión, se incrementan con el paso del tiempo, si bien estos hechos no parecen tener un efecto evidente sobre la estabilidad del implante. Maloney y cols51 informaron de 16 pacientes con osteolisis femoral con el diseño Harris-Galante. La lesión osteolítica, en forma de erosión endostal, se localizaba en la región diafisaria del fémur, y se apreciaba radiológicamente a partir del tercer año de su implantación. Este mismo autor encontró posteriormente, con un seguimiento de 6 años, que la incidencia de osteolisis femoral se había incrementado al 52% de los casos analizados con el citado diseño54. También, Tanzer y cols84 observaron como el 86% de los casos con lesión osteolítica, ésta aumentaba de tamaño con el paso del tiempo.
La distribución «parcheada» de la superficie porosa, que no reviste la totalidad del perímetro de la prótesis, ha sido implicada como responsable de este patrón de osteolisis.55 Se ha informado de una prevalencia de osteolisis cercana al 40% con este tipo de diseños.15,80 Schmalzried y cols77 observaron histológicamente que la lesión osteolítica está producida por la reacción inflamatoria secundaria a la presencia de partículas de desgaste del polietileno. En base a estos hallazgos, propusieron el concepto de «espacio articular efectivo», por el cual, toda región periprotésica que no está en íntimo contacto con el hueso es accesible al fluido sinovial, y por tanto, susceptible de recibir partículas de desgaste presentes en él. Emerson Jr y cols17 han confirmado esta hipótesis, al determinar una incidencia de osteolisis cuatro veces superior cuando compararon el revestimiento parcheado con el circunferencial en un mismo diseño.
Sin embargo, la osteolisis femoral no ocurre exclusivamente con los implantes de recubrimiento parcheado. Xenos y cols94 analizaron los resultados de la prótesis PCA con un seguimiento superior a 7 años. Estos encontraron una frecuencia de osteolisis del 14%, y una progresión de la lesión en el 33% de los casos. De forma similar, se han comportado otros diseños con recubrimiento poroso circunferencial, si bien todos ellos han mostrado osteolisis con un patrón diferente. Así, la lesión osteolítica se localizó preferentemente en el área trocantérica (Zonas 1 y 7 de Gruen), presentaba un aspecto quístico, y tuvo una progresión algo más lenta24,31,95. La mayoría de estudios coinciden en la escasa sintomatología que manifiesta este tipo de lesión, y en su presentación en pacientes jóvenes que desarrollan mayor actividad.11,24,31,42,94,95 Además, aunque la osteolisis fue más severa en implantes inestables, su presencia no incrementó la tasa de aflojamientos cuando la prótesis se demostró osteointegrada.42,56 Para explicar este tipo de osteolisis, Aspenberg y cols2 han implicado al aumento de presión del líquido sinovial, el cual sería capaz de provocar una necrosis del hueso esponjoso, cuya resorción provocaría la formación de canales periprotésicos. De esta forma, los problemas asociados con el polietileno continúa siendo la indicación más frecuente de cirugía de revisión en prótesis no cementadas.85 La mayoría de autores recomiendan evitar el empleo de cabezas fémorales de 32 mm, y la utilización de polietilenos de calidad y espesor adecuados.35,56,95 En un futuro habrá que analizar, sí los nuevos pares de fricción, metal o cerámica,5 serán capaces de evitar la osteolisis.
Remodelación ósea adaptativa
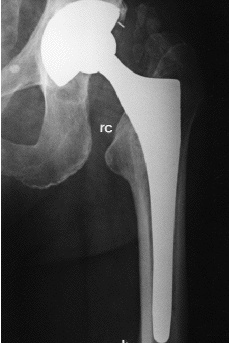
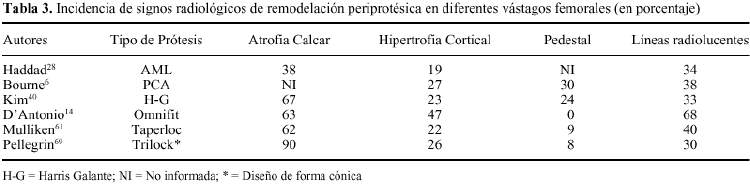
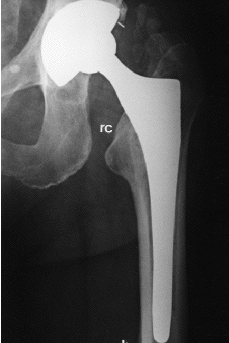
Aparte de cambios tan evidentes como la osteolisis o el hundimiento del vástago femoral, el análisis radiológico de las prótesis no cementadas ha permitido detectar una serie de signos, cuyo significado continúa siendo controvertido. Entre ellos cabe citar: líneas radiolucentes periprotésicas, redondeamiento y esponjialización del calcar, hipertrofia cortical distal, esclerosis por debajo de la punta del vástago (pedestal), ensanchamiento del canal medular, y densificación endostal adyacente a la zona de recubrimiento (puntos de soldadura). Engh y cols21 definieron el significado de estos signos radiológicos y establecieron, a partir de ellos, unos criterios que permitían definir sí la fijación de una prótesis era estable, con crecimiento óseo o fibroso, o inestable. Para estos autores, las líneas radiolucentes periprotésicas y la formación del pedestal indicarían una falta de osteointegración del implante. Por el contrario, el redondeamiento y atrofia del calcar, y la hipertrofia cortical distal, serían la expresión de fenómenos de adaptación del hueso al implante femoral (tabla 3) (Fig 2).
Figura 2. Presencia de signos radiológicos de remodelación ósea adaptativa en implante femoral de recubrimiento. rc: redondeamiento del calcar; h: hipertrofia cortical distal.
Se ha cuestionado la validez de estos criterios cuando son aplicados a prótesis no cilíndrica.49,61 Algunos autores piensan que la estabilidad solo debe ser juzgada por el cambio de posición del vástago, y por la presencia de líneas radiolucentes en el contorno poroso del implante. Khalily y cols38 han demostrado, que la aparición en los dos primeros años de líneas radiolucentes rodeando la superficie porosa, tiene un alto valor predictivo de fracaso de la prótesis. Así, la formación de un pedestal incompleto o la existencia de líneas radiolucentes en el área distal pulida del implante, representarían también un fenómeno adaptativo consecuencia del micromovimiento y de la estimulación endóstica de la punta del implante.14,58,61,69
De cualquier forma, los signos sugestivos de remodelación ósea adaptativa mencionados, y en particular la atrofia de hueso metafisario, puede ser aparente radiológicamente, pero resulta difícil de observar durante su fase temprana, y más aún, de cuantificar de forma objetiva. Se considera necesaria una disminución superior al 30% de la masa ósea para poder ser detectada por radiología convencional. Tampoco, la gammagrafía con tecnecio 99 ha demostrado su capacidad para evaluar este tipo de cambios, a pesar de su gran sensibilidad, ya que por el contrario, presenta una limitada especificidad.
Estudios densitométricos
El reciente desarrollo de la densitometría de absorción de rayos X (DEXA) ha permitido cuantificar de forma objetiva la densidad mineral ósea (DMO) y los cambios adyacentes a un implante metálico (Fig 3). Pequeños cambios en la masa ósea, cercanos al 5%, pueden ser analizados usando esta técnica.44 El error de precisión se ha establecido en el 2% para las prótesis de cadera.46 Por tanto, la DEXA se considera un sistema preciso y reproducible para valorar la DMO periprotésica, que permite además, la comparación entre distintos diseños.71,72.
Figura 3. Estudio densitométrico realizado en artroplastia de cadera.
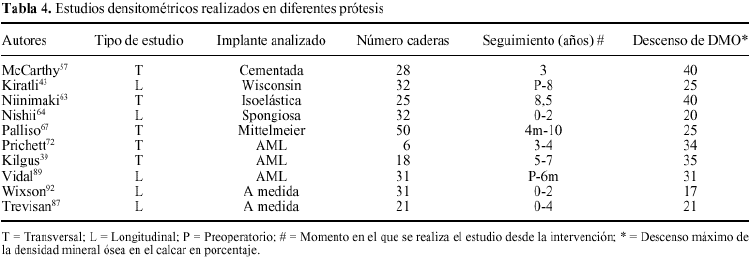
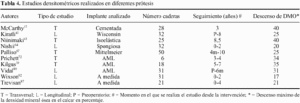
Durante los años 90, se han llevado a cabo diversos estudios de DEXA con objeto de cuantificar la atrofia ósea secundaria a una artroplastia de cadera. Inicialmente, estos estudios tenían un carácter retrospectivo (transversal), valorando la perdida de masa ósea en un momento determinado de la evolución del implante, y comparándola con el fémur contralateral intacto.39,57,63,67 Sus resultados demostraron una disminución de la DMO, de entre el 20 y el 40%, con variaciones según el diseño analizado, y localizada de forma más patente en la región del trocánter menor del fémur (tabla 4). No obstante, mayor valor tienen los estudios longitudinales, capaces de mostrar la evolución de la perdida ósea periprotésica a lo largo del tiempo.89 De estas investigaciones se ha podido deducir, que el descenso de la DMO producido por el implante, no necesariamente es progresivo. La mayoría de trabajos coinciden que la mayor perdida de DMO se produce durante los primeros 6 meses desde la cirugía, y que al año, este valor se estabiliza y se mantiene constante a lo largo de su evolución.64,87,92 Solo Kiratli y cols43 han observado un discreto, pero continuo, descenso de la DMO en la zona trocantérica a lo largo de 8 años. La mayoría de autores no han encontrado una relación evidente entre el descenso de la DMO y otras variables analizadas, tales como: la edad, el peso, el diagnóstico primario, o la patología concomitante del paciente.
Los estudios densitométricos también ha sido realizados en fémures protetizados obtenidos de cadáveres. Utilizando este modelo, Engh y cols22 observaron una disminución del contenido mineral, tan variable como de un 7% a un 52%, en 5 pacientes con el diseño AML. Sychterz y cols83 encontraron un descenso medio del contenido mineral en el calcar del 42%, en 11 piezas fémorales portadoras de una prótesis con una duración media de 6 años. Maloney y cols,53 utilizando el mismo modelo experimental, fueron capaces de describir los cambios histomorfométricos asociados al proceso de remodelación. Estos autores observaron: adelgazamiento cortical por resorción subperióstica, descenso del contenido mineral, y reducción del área ocupada por hueso cortical, todo ello limitado de forma específica al cuadrante medial de la zona proximal del fémur.
En base a los datos expuestos, se acepta que la artroplastia de recubrimiento poroso produce una remodelación ósea adaptativa, que conlleva entre otros aspectos, a la perdida de hueso de la parte proximal del fémur. Este argumento ha hecho plantearse a la comunidad ortopédica una serie de cuestiones: ¿Qué factores intervienen en su desarrollo?, ¿Como se manifiesta clínicamente?, ¿Qué consecuencias tendrá para el futuro del implante?
Factores implicados en la remodelación ósea
Para explicar la atrofia ósea proximal secundaria a una artroplastia de cadera se ha trabajado sobre la hipótesis de un proceso de remodelación-adaptación del hueso ante la anómala transferencia de la carga mecánica, de acuerdo a los principios de la ley de Wolff. Así, la carga sería conducida distálmente por el implante hacia la diáfisis, en vez de distribuirse por el hueso esponjoso metafisario, dando lugar a una «desfuncionalización proximal» o (Stress-Shielding).35,81 Con objeto de determinar que elementos condicionan la anormal transferencia de carga, se han evaluado tanto factores mecánicos, que implican al propio implante, como biológicos relacionados con el hueso receptor.
Factores Mecánicos
Tres características básicas definen a un vástago femoral: su diseño, el material empleado en su fabricación, y la morfología de su revestimiento poroso, tanto el tipo de recubrimiento como la extensión que ocupa sobre la superficie del implante. Cualquiera de estas características puede intervenir de forma activa en el proceso de remodelación ósea. Por este motivo, dichos aspectos ha sido ampliamente investigados desde un punto de vista: densitométrico, teórico (análisis de elementos finitos), y experimental.
Los estudios clínicos de Engh y cols18,19 y experimentales de Bobyn y cols. (4), pusieron de manifiesto que la remodelación ósea adaptativa ocurría de forma más pronunciada en aquellos vástagos que tenían una superficie porosa extensa, y cuando el componente femoral implantado era de mayor tamaño (diámetro transversal > 13 mm), y por tanto más rígido. Con análisis tridimensional de elementos finitos, Skinner y cols79 encontraron una mejor transferencia de carga generada por una prótesis parcialmente recubierta, respecto al mismo diseño pero recubierto en su totalidad. Kilgus y cols39 comprobaron, mediante DEXA en pacientes, un descenso en la DMO a nivel del calcar del 35% con vástagos extensamente recubiertos, frente al 22%, cuando el revestimiento se limitaba a la región proximal. Los estudios experimentales realizados con perros han confirmado que la atrofia ósea fue ligeramente superior en los implantes con mayor superficie recubrimienta. No obstante, la intensidad de este fenómeno fue «tiempo dependiente», mayor durante los primeros 6 meses, pero similar a los implantes de revestimiento proximal a los 2 años de la cirugía, por lo cual, la extensión del recubrimiento poroso pareció tener una escasa trascendencia en el proceso de resorción ósea.81 Igualmente, el tipo de recubrimiento: microesferas, fibra metálica, o pulverización con plasma (plasma-spray), no ha influido de forma evidente en el proceso de remodelación proximal. Sumner y cols82 observaron histológicamente en un modelo experimental similar, que no existían diferencias significativas, en cuanto al crecimiento óseo en el implante, y a la remodelación adaptativa del hueso, cualquiera que fuese el tipo de recubrimiento empleado.
Mayor importancia parece tener la rigidez del implante en la atrofia ósea. En un trabajo comparativo de vástagos femorales de distinta rigidez, mediante análisis de elementos finitos, Huiskes y cols34 han determinado que las prótesis más flexibles (isoelásticas con módulo de elasticidad similar al hueso cortical) reducen la carga transmitida, y la perdida proximal de hueso de un 23% a un 9%. Ang y cols1 soportaron este concepto al evaluar con DEXA dos tipos de implantes en un grupo de pacientes. Estos autores encontraron un menor descenso de la DMO en la zona trocantérica con una prótesis isoelástica, al compararla con otra de diseño convencional. Un estudio histomorfométrico realizado en perros a los que se implantó dos tipos de prótesis de distinta rigidez, permitieron a Turner y cols88 observar como las prótesis más flexibles mostraban un 50% más de hueso cortical en el área metafisaria del fémur. Sin embargo, recientemente y en un idéntico modelo experimental, Harvey y cols29 han podido comprobar que existe un «límite efectivo», por debajo del cual, el incremento en la flexibilidad del implante no puede prevenir la resorción ósea, bien por el contrario, esta flexibilidad resulta en un significativo descenso del crecimiento óseo, posiblemente al no poder lograr una adecuada estabilidad. Conjugar estabilidad y flexibilidad del implante se antoja un objetivo difícil de obtener, motivo por el cual, la remodelación ósea adaptativa a una artroplastia parece un hecho inevitable.
El modo efectivo de promover la transferencia proximal de la carga desde el implante al hueso receptor, sería reducir la rigidez del vástago femoral, disminuyendo su tamaño o su módulo de elasticidad. Para conseguir este objetivo se puede actuar, tanto sobre la composición (material), como sobre la geometría (diseño) del implante. De esta forma, se ha propuesto el empleo de aleaciones de titanio (Ti), en vez de cromo-cobalto (Cr-Co), al tener este material un módulo de elasticidad inferior y más cercano al del hueso femoral. Los estudios comparativos de ambos materiales: realizados en animales de experimentación,4 con modelos tridimensionales de elementos finitos,62 y mediante DEXA en pacientes con implantes fabricados con ambos materiales,33,78 han puesto de manifiesto: la mejor trasferencia de carga a la metáfisis femoral, y una reducción significativa de la resorción ósea en el calcar, tanto desde un punto de vista histológico como densitométrico, con los implantes de aleación de Ti. Por tanto, el Ti puede constituir una alternativa válida para reducir la atrofia proximal del fémur, aunque sería necesario valorar, sí el beneficio que proporciona, justifica su mayor coste.
Otra alternativa implicaría modificar la geometría del vástago, disminuyendo el área de sección transversal con objeto de aumentar su flexibilidad. Basados en este principio, se han introducido vástagos de forma cónica.5 Los estudios clínicos con estos diseños han mostrado una menor incidencia de cambios radiológicos remodelativos,50 pero no han resuelto completamente el problema de la atrofia metafisaria .66 En mi conocimiento, no existen estudios experimentales con este tipo de vástagos, que demuestren de forma evidente su capacidad para limitar la remodelación ósea adaptativa. Kiratli y cols43 encontraron una disminución del 25% en la DMO de la región proximal del fémur con una prótesis de diseño cónico (Wisconsin) al año de su implantación, escasamente inferior por tanto, a la informada con vástagos de forma cilíndrica.
No obstante, estos estudios han permitido mejorar los diseños, dando lugar a la denominada «tercera generación» de prótesis.59 En la actualidad, la mayoría de los vástagos fémorales se presentan: hendidos, afilados, o acanalados en su parte distal con el fin de obtener una mayor flexibilidad, han limitado la extensión de la superficie porosa al área proximal, y han aumentado el número de tamaños disponibles con objeto de lograr una mejor estabilidad inicial. En un futuro será necesario evaluar, sí estas modificaciones consiguen el objetivo de limitar la remodelación adaptativa.
Factores Biológicos
Por el contrario, todos aquellos factores implicados en la remodelación ósea relacionados con el hueso receptor, apenas han sido tenidos en cuenta. En fémures protetizados obtenidos de cadáver, Engh y cols20 encontraron histológicamente como la calidad del hueso receptor influía en la cantidad de crecimiento óseo que existía en el implante. Los análisis densitométricos realizados sobre especímenes obtenidos de autopsia también han podido demostrar la influencia de la calidad ósea sobre la atrofia de hueso metafisario. Así, la perdida de DMO en el fémur receptor se correlacionaba con un menor contenido mineral inicial en el fémur contralateral.22,53,83 Igualmente, los estudios densitométricos realizados en pacientes han confirmado que la calidad del hueso receptor, en el momento de la cirugía, expresada como contenido mineral, tiene una importante influencia en la prevención del proceso de resorción ósea proximal.64,68
Queda por conocer, sin embargo, la influencia que puedan tener otros factores ligados al hueso receptor, tales como la morfología del fémur. Los estudios anatómicos han demostrado la variabilidad del fémur, y como ésta puede influir en la adecuada estabilidad que requiere el componente femoral.65,74 Bourne y cols.5 han observado clínicamente como los diseños cónicos eran menos adecuados para los fémures en forma de chimenea. Igualmente, Kobayashi y cols45 determinaron, que este tipo de fémur, era mecánicamente desfavorable para las prótesis cementadas. En base a estos datos, cabe pensar que la morfología del fémur pueda tener también una importante implicación en la remodelación ósea. Sin embargo, no existen en mi conocimiento estudios que hayan evaluado esta posibilidad. Tampoco han sido analizados otros factores dinámicos del paciente, tales como el patrón de marcha que realiza tras una artroplastia de cadera, el cual podría intervenir activamente en el proceso de resorción ósea, más sí tenemos en cuenta, las alteraciones en los parámetros de marcha que desarrollan los pacientes con coxartrosis previa a la cirugía.70
Repercusión clínica
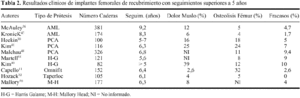
El dolor en muslo es un síntoma relativamente frecuente que padecen muchos de los pacientes sometidos a una artroplastia de recubrimiento poroso, motivo por el cual, se ha relacionado con el proceso de remodelación ósea adaptativa. La prevalencia de dolor en muslo oscila considerablemente según los autores y el diseño utilizado. Se ha informado de una incidencia tan variable como del 4% al 41%73 (tabla 2). La severidad del dolor en muslo tampoco ha sido correctamente definida en la literatura médica; así, el dolor moderado que aparece al inicio de la marcha no suele representar un problema clínico mayor. Algunos autores han encontrado un descenso en la prevalencia con el paso del tiempo.73,93 De esta forma, la mayoría de los datos informados no se corresponden con la verdadera incidencia de dolor incapacitante y perdurable que puede repercutir en el resultado clínico de la prótesis.59
Otro aspecto controvertido acerca del dolor en muslo, viene marcado por la confusión que existe respecto a su origen.73 Entre los factores causales propuestos cabe destacar: la fijación inestable del vástago, el diferente módulo de elasticidad entre el implante y el fémur, y la irritación endostal por la punta de la prótesis. Algunos trabajos han señalado que la falta de osteointegración del implante determinaba la existencia de dolor en el muslo.10,19 Sin embargo, la mayoría de las revisiones clínicas no han encontrado una correlación evidente entre dolor en muslo y aflojamiento del componente femoral.6,56,61 Barrack y cols3 estudiaron histológicamente 6 prótesis revisadas por dolor en muslo, y en todas ellas encontraron presencia de crecimiento óseo en el implante.
Igualmente, el dolor en el muslo se ha relacionado con la remodelación ósea, y la anómala transferencia de carga que soporta la diáfisis femoral ante el diferente módulo de elasticidad entre el implante y el hueso.32,30,41 De esta forma, las características protésicas, como su rigidez, condicionarían la aparición del dolor en muslo. No se han demostrado diferencias, en cuanto a la incidencia de dolor en muslo, entre diseños con distinta extensión en la superficie de recubrimiento.66 Vresilovic y cols.90 encontraron una relación significativa entre el mayor tamaño de la prótesis implantada (más rígida) y la existencia de dolor en el muslo. De aceptar este planteamiento, sería de esperar que los pacientes con buena calidad ósea portadores de prótesis pequeñas (diámetro transversal < 13 mm) no sufrirán de dolor en el muslo, pero los estudios clínicos no ha podido confirmar este hecho. Tampoco, factores ligados al paciente, como la morfología fémoral6 o la calidad ósea,56 han podido relacionarse con la presencia de dolor en muslo.
El micromovimiento de la punta del implante, capaz de provocar una reacción endóstica dolorosa, también se ha propuesto como factor causante de este síntoma.28,30 Las revisiones clínicas no han podido demostrar signos radiológicos específicos, tales como formación de hueso endóstico o perióstico en el área de la punta de la prótesis, asociados de forma significativa con la presencia del dolor en el muslo.6,42,56,61,69 En un estudio realizado con DEXA, el autor71 fue incapaz de relacionar la existencia de dolor en muslo, con una evidente alteración de la DMO en la punta del vástago femoral. Así, la remodelación ósea adaptativa no parece ser un factor determinante del dolor en el muslo, ni que este proceso en sí mismo vaya a desencadenar una repercusión clínica evidente. Mientras tanto, la causa del dolor en el muslo, como síntoma asociado a las prótesis de recubrimiento poroso, continúa siendo un enigma.
Consecuencias para el futuro de la prótesis
La perdida de hueso metafisario tras una artroplastia de revestimiento poroso ha creado cierta alarma, ya que este hecho podía poner en peligro la duración del implante. De esta forma, entre las posibles consecuencias atribuidas en la literatura médica a la atrofia ósea proximal cabe enumerar: 1) el incremento del dolor en el muslo, 2) la fractura del fémur o del componente femoral, 3) la perdida de fijación del implante, 4) el incremento de la prevalencia o severidad de la osteolisis, y 5) la dificultad para realizar una futura revisión.46 Sin embargo, se desconoce el efecto real que pueda tener este proceso sobre la integridad mecánica del implante a largo plazo.49
La prevalencia de atrofia ósea proximal en prótesis de recubrimiento poroso apenas ha sido informada en la literatura. McAuley y cols.56 y Kronick y cols.47 con el diseño cilíndrico AML, han determinado una prevalencia de cambios radiológicos asociados a intenso stress shielding del 25 y del 9%, respectivamente. McLaughlin y cols.58 informaron de una incidencia de atrofia ósea proximal en el 15% con una prótesis de diseño cónico (Taperloc). La importante presencia de signos radiológicos de remodelación adaptativa, cualquiera que sea diseño protésico analizado, se muestra en la tabla 3. Sí comparamos los datos expuestos, con la baja incidencia informada de prótesis inestables o revisadas, resulta cuestionable la trascendencia de los cambios observados sobre la estabilidad del implante. Las revisiones clínicas han determinado una frecuencia de fracasos en vástagos de recubrimiento inferior al 10%, cuando los pacientes fueron seguidos más de 5 años (tabla 2). En esta línea, la mayoría de trabajos no han encontrado una relación estadísticamente significativa entre el aflojamiento del componente femoral y la atrofia ósea proximal.7,38,47,56,69
Bugbee y cols.7 han estudiado durante 10 años a 45 pacientes que presentaban importante stress-shielding a los 2 años de la intervención. Sus resultados pusieron de manifiesto: una incidencia de dolor en muslo similar a la serie general, una tasa de osteolisis y de revisión menor que en la serie general, y ausencia de signos radiológicos que sugerían aflojamiento de la prótesis. McAuley y cols.,56 en los 112 pacientes de su serie que presentaban marcada resorción proximal, no encontraron una mayor predisposición a la osteolisis ni al aflojamiento femoral. Este fenómeno tampoco tuvo un efecto adverso sobre el resultado funcional o la satisfacción de sus pacientes. Recientemente, se han publicado resultados clínicos referentes a vástagos de recubrimiento poroso con un seguimiento superior a 10 años (tabla 5). La limitada incidencia de fracasos del componente femoral informada con prótesis de recubrimiento poroso, permite señalar varios hechos: 1) la fijación biológica es posible con la mayoría de los diseños, 2) la remodelación ósea adaptativa ocurre con cualquier tipo de prótesis, a pesar de las diferencias existentes entre ellas, y 3) la perdida de hueso proximal no va a resultar perjudicial para el futuro a largo plazo de la artroplastia.
Conclusiones
Las prótesis de cadera con recubrimiento poroso, propuestas para la fijación biológica, han demostrado a lo largo de la presente década que constituyen un procedimiento eficaz y duradero para el tratamiento de la coxartrosis. Sin embargo, importantes cuestiones quedan aún por resolver, entre las que cabe citar: el mecanismo íntimo causante del aflojamiento tardío del implante cuando éste se demuestra inicialmente osteointegrado, el efecto de polietilenos de mayor calidad o de los nuevos pares de fricción (metal o cerámica) para limitar la prevalencia de osteolisis, el efecto de los nuevos diseños que constituyen la denominada tercera generación sobre la prevención de la remodelación ósea adaptativa, la influencia de otros factores relacionados con hueso receptor en el desarrollo de la desfuncionalización proximal del fémur, y finalmente, la identificación de la causa del dolor en el muslo asociada al reemplazo protésico no cementado.
Se ha podido demostrar, que la remodelación ósea periprotésica secundaria a la anómala transmisión de la carga mecánica, resulta inevitable, pero no por ello perjudicial para la estabilidad del implante. No obstante, parece lógico incidir en su prevención hasta no tener un mayor conocimiento de las cuestiones pendientes. A la espera de nuevos materiales y diseños que mejoren la biomecánica del implante, pensamos que la única forma de limitar la prevalencia y la severidad de los cambios remodelativos pasa por una correcta selección de los pacientes, y una adecuada planificación preoperatoria, que tenga en cuenta, además de la edad, la morfología femoral, la calidad ósea, y la demanda de actividad física, a la hora de elegir el tipo de implante más apropiado para «cada paciente» entre las distintas posibilidades que ofrece el mercado.