Las infecciones periprotésicas de rodilla son complicaciones graves post-artroplastia de rodilla que afectan entre el 1 y el 2% de pacientes con cirugía primaria y hasta el 20% de las revisiones. La estrategia DAIR (desbridamiento, antibióticos y retención de implantes, por sus siglas en inglés) surge como tratamiento para infecciones agudas, permitiendo en ciertos casos retener los componentes, con una alta tasa de éxito.
ObjetivosEsta revisión discute su aplicación, los factores de éxito, las técnicas como el «doble DAIR» y el manejo postoperatorio, subrayando la importancia en la correcta selección de pacientes y la combinación con una técnica quirúrgica prolija y meticulosa con terapia antibiótica adecuada para la optimización de resultados.
MétodosSe realizó una búsqueda exhaustiva actualizada de la literatura en relación con el uso del DAIR en infecciones agudas periprotésicas, destacando el paso a paso del procedimiento como algunos tips quirúrgicos que son de ayuda al momento de realizarlo; en base a eso, se realizaron recomendaciones para médicos interesados en el tema.
ResultadosSe realiza una serie de recomendaciones basada en la literatura actual, las cuales son una guía útil al momento de enfrentarnos a pacientes con infecciones agudas en contexto de prótesis de rodilla, con una tasa de éxito mayor al 70% en la mayoría de los casos donde el paciente es bien seleccionado.
ConclusionesEl DAIR es una herramienta útil y eficaz en la erradicación y el tratamiento de infecciones periprotésicas agudas, con una buena tasa de éxito. Es un procedimiento barato, técnicamente sencillo y reproducible, por lo que, como grupo, sugerimos sea adoptado de manera global por cirujanos ortopédicos.
Periprosthetic knee infections are serious complications after knee arthroplasty, affecting 1 to 2% of patients with primary surgery and up to 20% of revisions. The DAIR strategy (debridement, antibiotics, and implant retention) has emerged as a treatment for acute infections, allowing component retention in certain cases, with a high success rate.
ObjectivesThis review discusses its application, success factors, techniques such as the «double DAIR» and postoperative management, highlighting the importance of correct patient selection and the combination of a thorough and meticulous surgical technique with appropriate antibiotic therapy to optimize results.
MethodsAn exhaustive updated literature search was conducted regarding the use of DAIR in acute periprosthetic infections, highlighting the step-by-step procedure and some surgical tips that are helpful when performing it. Based on this, recommendations were made for physicians interested in the subject.
ResultsA series of recommendations are made based on current literature, which are a useful guide when dealing with patients with acute infections in the context of knee prostheses, with a success rate greater than 70% in most cases where the patient is well selected.
ConclusionsDAIR is a useful and effective tool in the eradication and treatment of acute periprosthetic infections, with a good success rate. It is a cheap, technically simple and reproducible procedure, so as a group, we suggest it be adopted globally by orthopedic surgeons.
Las infecciones periprotésicas (IPP) de rodilla representan una de las complicaciones más complejas y desafiantes luego de la realización de una artroplastia de rodilla, y afectan entre el 1% y el 2% de las artroplastias primarias y hasta el 20% de las artroplastias de revisión.
Actualmente, la definición de IPP aguda carece de un consenso universal y varía significativamente en la literatura, abarcando desde las infecciones que se presentan dentro de las primeras cuatro semanas después de la cirugía1, hasta aquellas que ocurren dentro de las doce semanas posteriores a ella2. Las IPP hematógenas agudas se caracterizan por la aparición de síntomas en un período inferior a 4-6 semanas, pero que ocurren más de 3meses después de la cirugía índice2.
A pesar de los avances en la técnica quirúrgica y en los cuidados postoperatorios, la incidencia de IPP agudas en prótesis de rodilla sigue siendo una preocupación relevante, representando la primera causa de revisión precoz. La elevada cantidad de artroplastias totales de rodilla que se realizan año tras año en el mundo, y el envejecimiento progresivo de la población mundial, hacen que las infecciones de las articulaciones protésicas sean muy costosas para los sistemas de salud, debido a que se asocian a mayor fracaso del implante, múltiples cirugías de revisión, aflojamientos y hasta tres veces mayor mortalidad3. El enfrentamiento precoz y efectivo de estas infecciones es esencial para lograr resultados favorables y asegurar la sobrevida de los implantes, mejorando así la calidad de vida de los pacientes y disminuyendo los costos asociados, que se han reportado de hasta USD $60.000 por cada caso3.
Si bien el recambio en dos tiempos se reconoce como el gold standard en el tratamiento de las IPP4, en el caso de infecciones agudas la literatura ha mostrado resultados favorables con aseos quirúrgicos radicales, logrando conservar los componentes protésicos, como lo son el desbridamiento, el cambio del inserto, los antibióticos y la retención del implante (debridement, antibiotics, and implant retention [DAIR]) y también, la revisión en un tiempo.
El DAIR enfatiza la importancia de realizar en una misma cirugía un desbridamiento quirúrgico agresivo combinado con una terapia antibiótica adecuada, recambio de componentes móviles protésicos, manteniendo los implantes femorales, tibiales y rotulianos en su lugar. En los últimos años también se ha descrito el «doble DAIR», técnica que implica un segundo aseo quirúrgico tras un periodo de 5-7días, que puede ser con o sin nuevo recambio del inserto y que podría mejorar las tasas de éxito de este procedimiento5.
Por otro lado, la revisión en un tiempo adopta un enfoque más radical, reemplazando la totalidad de la prótesis infectada en una única intervención quirúrgica. Cada procedimiento cuenta con sus propios méritos y limitaciones, reflejando la evolución constante de nuestro entendimiento sobre las IPP agudas.
Este artículo busca recopilar la evidencia más reciente sobre el DAIR con el fin de apoyar la toma de decisiones clínicas. Las recomendaciones que se presentan a continuación derivan de una exhaustiva revisión de la bibliografía reciente en relación con el tema en sitios como PubMed, Embase y Cochrane. Estas recomendaciones han sido sintetizadas de manera clara y accesible para facilitar su comprensión y su aplicación por parte de cirujanos ortopédicos.
Aspectos generalesEn el tratamiento de las IPP agudas, el DAIR se reconoce como un procedimiento menos invasivo, de menor exigencia técnica, menor morbilidad, hospitalización más breve, mayor preservación del stock óseo y una mayor costo-efectividad6, en relación con el recambio protésico en dos tiempos; sin embargo, está indicado en casos específicos, donde puede llegar a conseguir tasas de control de infecciones de entre el 12% y el 80%6. Es importante destacar que la correcta selección de los pacientes es un punto de suma importancia, donde se debe considerar el tiempo transcurrido desde la cirugía protésica, el tiempo de sintomatología que presenta el paciente, el tipo de patógeno involucrado y su sensibilidad antibiótica, la ausencia de aflojamiento de los componentes o de osteomielitis, así como la ausencia del compromiso de partes blandas o de fístulas.
Uno de los puntos más centrales es la duración de los síntomas, lo que ha determinado una gran controversia. Según el Consenso Internacional de Infecciones Musculoesqueléticas de Philadelphia en 2018 (ICM), la mayor ventaja en la realización de DAIR se ha observado en las infecciones postoperatorias agudas (antes de las 4semanas) y hematógenas agudas7.
Sin embargo, un reciente estudio publicado por Van der Ende et al.8, enfocado en evaluar la eficacia del tratamiento DAIR aplicado a pacientes en dos periodos distintos tras la cirugía de implante (los tratados dentro de las primeras cuatro semanas y aquellos atendidos entre la cuarta y la duodécima semana), mostró tasas de éxito del 91% y del 83%, respectivamente. Pese a que el grupo de prótesis de rodilla tratado más tardíamente mostró una menor tasa de éxito, el 83% aún se considera un resultado positivo, por lo que podría representar una estrategia eficaz y adecuada en casos más tardíos.
Después de haber realizado una adecuada selección del paciente, otro factor relevante para un procedimiento exitoso es conocer cuáles son los aspectos técnicos del DAIR.
En términos generales, se recomienda utilizar la incisión previa más lateral, a modo de prevenir problemas vasculares y de cierre. Se requiere un desbridamiento exhaustivo con una técnica meticulosa para maximizar la disminución de la carga patógena; además, se deben tomar múltiples muestras de tejidos para detectar bacterias y hongos, siendo necesario muchas veces realizar cultivos prolongados, en medios especiales o enriquecidos, para optimizar la identificación del microorganismo causal, pues la identificación de este es fundamental para el éxito del procedimiento.
Se recomienda realizar una irrigación prolija y directa con distintas soluciones antisépticas y antibióticas, como por ejemplo la clorhexidina o la povidona. Durante el procedimiento, se debe realizar una sinovectomía y el desbridamiento meticuloso de los tejidos blandos, junto con el reemplazo de los componentes modulares de la prótesis cuando este sea factible. Se debe retirar el polietileno de forma cuidadosa para no comprometer la estabilidad del componente tibial, lo que se puede llevar a cabo insertando un tornillo cortical en la superficie de este mismo, haciendo contrapresión contra el implante tibial (fig. 1). Es importante destacar que un desbridamiento mecánico exhaustivo requiere tiempo y no se debe realizar de manera apresurada, ya que es un aspecto central en el manejo, siendo una herramienta muy útil el escobillado generalizado de todas las superficies (fig. 2).
Se debe realizar una evaluación de la integridad y la estabilidad de los componentes implantados. Esta incluye tanto la interfaz implante-cemento, como la interfaz cemento-hueso. La decisión de conservar los componentes debe basarse en varios factores, dentro de los que recalcamos: pacientes no inmunocomprometidos, microorganismos de baja virulencia y contención de biofilm en un corto período de tiempo4. Dentro de los factores estudiados la obesidad es reconocida como un factor de riesgo significativo para las IPP tanto de cadera como de rodilla; sin embargo, no se ha establecido una correlación clara entre la obesidad y el aumento en la tasa de fracasos posteriores al DAIR, como lo establecen Longo et al.9 en su reciente revisión sistemática. En esta misma línea, Katakam et al.10 realizaron un estudio retrospectivo donde sugieren que los pacientes con obesidad mórbida se enfrentan a un mayor riesgo de fracaso de DAIR en comparación con los no obesos (57,9% vs 36,8%, respectivamente); sin embargo, concluyen que este riesgo se puede mitigar si se realiza el DAIR dentro de las 48horas posteriores al inicio de los síntomas, lo que nos confirma que la temporalidad parece ser uno de los factores más determinantes de buenos resultados.
Según la misma revisión de Longo et al.9, los microorganismos más frecuentemente implicados en las IPP incluyen Staphylococcus aureus, Propionibacterium acnes, Staphylococcus epidermidis y otros estafilococos coagulasa negativos9. La identificación precisa del microorganismo causante antes del procedimiento es altamente recomendable. Sin embargo, este proceso no debe retrasar la intervención quirúrgica una vez que se considera necesaria, como también sugieren en el último ICM. Un retraso de la cirugía teóricamente podría facilitar una mayor consolidación del biofilm bacteriano. Por lo tanto, es crucial equilibrar la necesidad de identificar el patógeno con la urgencia de realizar el DAIR para optimizar los resultados clínicos.
La tasa de éxito del tratamiento DAIR en IPP varía según el germen implicado. Las infecciones por estreptococos tienen la mayor tasa de éxito (70-90%), mientras que las de Staphylococcus aureus, especialmente S.aureus resistentes a la meticilina (MRSA), tienen tasas más bajas (30-60%). Las infecciones por estafilococos coagulasa negativos y bacterias gramnegativas presentan tasas de éxito intermedias (50-70%). Las infecciones polimicrobianas y aquellas con gérmenes que forman biofilms suelen tener tasas de éxito más bajas. Factores como la rapidez en el diagnóstico, las comorbilidades del paciente y la formación de biofilms también influyen significativamente en el resultado del tratamiento.
Estrategias habituales en el intraoperatorioDesbridamiento mecánicoLa efectividad del desbridamiento mecánico es posiblemente el factor más crucial para el éxito del procedimiento DAIR, aunque también es uno de los aspectos más difíciles de investigar. Se aconseja la eliminación completa de los tejidos desvitalizados e infectados, así como la membrana sinovial hipertrófica circundante.
Para asegurar la erradicación del tejido infectado alrededor de la articulación, se sugiere realizar una sinovectomía radical. No obstante, en ocasiones puede ser complicado diferenciar entre tejido infectado y tejido sano.
Posteriormente, es fundamental realizar un meticuloso cepillado de todos los componentes no modulares retenidos con un cepillo estéril, seguido de una adecuada irrigación.
IrrigaciónNo encontramos estudios clínicos específicos que evalúen el volumen óptimo de irrigación durante el DAIR para el tratamiento de las IPP. A pesar de esta carencia, sugerimos guiarse por la recomendación del ICM, donde, basándose en estudios que proporcionan datos secundarios, se recomendó una irrigación con volúmenes de aproximadamente 9litros.
En cuanto a la presión de la irrigación, tampoco hay evidencia clínica que respalde de manera concluyente el uso específico de irrigación de baja o alta presión. Las sugerencias existentes se basan en estudios extrapolados del manejo de fracturas expuestas, en donde no habría una diferencia significativa a diferentes presiones; sin embargo, no sabemos si son extrapolables por la posible existencia de un biofilm inicial. Por ahora debemos basarnos en la experiencia clínica, a la espera de futura evidencia que pueda arrojar luz sobre este aspecto.
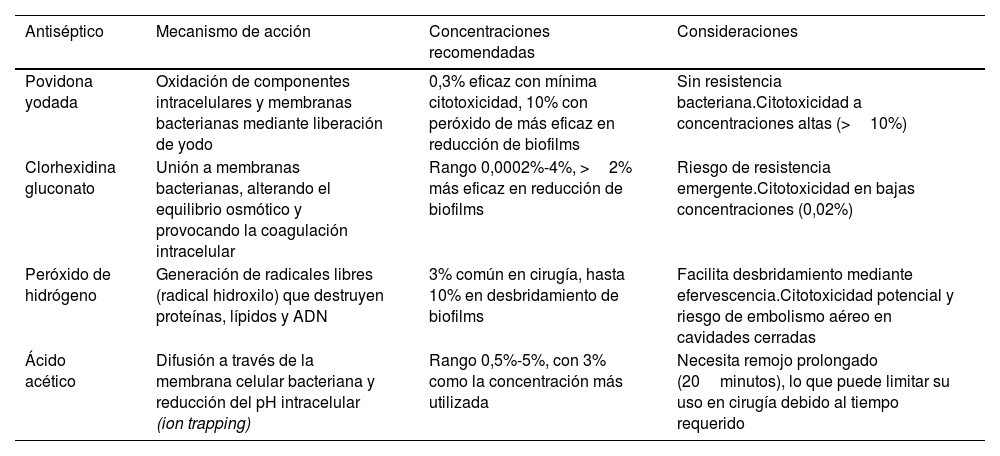
Soluciones antisépticasSi bien no hay consenso sobre la solución óptima, ni hay evidencia suficiente sobre el tiempo óptimo de riego y la combinación de soluciones. Existen varios estudios sobre la eficacia de diferentes soluciones antisépticas para eliminar bacterias del biofilm, y los autores de un trabajo reciente encontraron que la povidona yodada es la más efectiva eliminando MRSA, y las soluciones de ácido acético son más efectivas en varios otros organismos11. La povidona yodada diluida ha sido identificada como una solución de irrigación segura y económica, demostrando que reduce el riesgo de infección en la artroplastia primaria de rodilla, y también está incluida en múltiples protocolos para el tratamiento quirúrgico de la IPP12. Respecto a la forma de lavado, se sugiere primero hacer un lavado general pulsátil con aproximadamente 6litros de solución fisiológica al 0,9%, luego, en el caso de la povidona yodada, se dejan en la zona quirúrgica aproximadamente entre 500cc y 1litro de solución al 0,3%, dejándola actuar por entre 3 a 5minutos, para posteriormente realizar un nuevo lavado pulsátil de limpieza con 6litros de solución fisiológica; la presión sugerida del lavado es de aproximadamente 8 a 12PSI. En ciertos casos puede ser útil intercalar el lavado de povidona con peróxido de hidrógeno al 3% después del primer lavado, lo que ayudaría a oxidar la membrana celular bacteriana y puede ayudar a eliminar microorganismos más resistentes. La tabla 1 resume los principales antisépticos utilizados en la actualidad en cirugía ortopédica, y nos entrega además algunas consideraciones asociadas.
Resumen de los antisépticos más utilizados actualmente en traumatología, asociado a resumen de su mecanismo de acción, concentraciones recomendadas y algunas consideraciones que deben ser tomadas en cuenta al momento de utilizarlos
| Antiséptico | Mecanismo de acción | Concentraciones recomendadas | Consideraciones |
|---|---|---|---|
| Povidona yodada | Oxidación de componentes intracelulares y membranas bacterianas mediante liberación de yodo | 0,3% eficaz con mínima citotoxicidad, 10% con peróxido de más eficaz en reducción de biofilms | Sin resistencia bacteriana.Citotoxicidad a concentraciones altas (>10%) |
| Clorhexidina gluconato | Unión a membranas bacterianas, alterando el equilibrio osmótico y provocando la coagulación intracelular | Rango 0,0002%-4%, >2% más eficaz en reducción de biofilms | Riesgo de resistencia emergente.Citotoxicidad en bajas concentraciones (0,02%) |
| Peróxido de hidrógeno | Generación de radicales libres (radical hidroxilo) que destruyen proteínas, lípidos y ADN | 3% común en cirugía, hasta 10% en desbridamiento de biofilms | Facilita desbridamiento mediante efervescencia.Citotoxicidad potencial y riesgo de embolismo aéreo en cavidades cerradas |
| Ácido acético | Difusión a través de la membrana celular bacteriana y reducción del pH intracelular (ion trapping) | Rango 0,5%-5%, con 3% como la concentración más utilizada | Necesita remojo prolongado (20minutos), lo que puede limitar su uso en cirugía debido al tiempo requerido |
El cambio de campo quirúrgico después de haber realizado una correcta irrigación y desbridamiento es una práctica común, especialmente antes de la colocación de nuevos componentes protésicos. Esto busca reducir la carga bacteriana y minimizar el riesgo de fracaso. Sin embargo, no hay estudios directos que aborden la eficacia específica de esto, por lo que en estos casos la decisión suele quedar a discreción del cirujano. A pesar de la falta de evidencia, creemos que es una práctica que en equipos entrenados implica poco tiempo y costo, y que potencialmente puede reducir la carga bacteriana y, consecuentemente, disminuir el fracaso del procedimiento13.
Respecto al cambio de guantes, tampoco hay estudios que midan el efecto directo del cambio de guantes en la tasa de IPP o fracaso de DAIR, pero existen varios estudios de contaminación microbiológica y la tasa de perforación de los guantes, destacando una revisión sistemática del año 2019 desarrollada por Kim et al.14, quienes tras una exhaustiva revisión de la literatura sugieren cambiarse de guantes al menos una vez por hora, después de la instalación de campos quirúrgicos, antes de manipular los implantes y si se ve una perforación visible para reducir la contaminación, pues esto puede disminuir el riesgo de IPP.
Intercambio de componentes modularesEl intercambio del polietileno desempeña un rol crucial, ya que al retirarlo se obtiene una visualización mejorada y un campo de trabajo más óptimo para realizar un aseo más profuso en la cara posterior de la rodilla, así como también contribuye a la reducción de la carga bacteriana y del biofilm presente en los componentes. En cuanto a la evidencia científica en este campo, varios estudios respaldan la idea de que el recambio de componentes modulares puede contribuir significativamente a la disminución de las IPP, como lo evidenciaron Kim et al.15 en su estudio retrospectivo del año 2015. En este contexto también destaca la revisión de Lora-Tamayo et al.16, llevada a cabo de manera multicéntrica y que incluyó a 349 pacientes con IPP en cadera y rodilla causada por Staphylococcus aureus, donde destacó que el recambio modular redujo el riesgo de fracaso en un 33%. En este contexto, el intercambio del polietileno y el recambio de componentes modulares se presentan como intervenciones prometedoras, y sugerimos su práctica habitual.
Estrategias intraoperatorias en estudioAzul de metilenoEl azul de metileno es un colorante catiónico con capacidad para unirse a biofilm bacteriano. Esta unión posibilita que el tinte coloree las zonas que posean una mayor carga de biofilm, estableciéndose como una herramienta potencialmente beneficiosa para identificar las zonas con mayor carga bacteriana durante la cirugía.
Shaw et al.17 llevaron a cabo una evaluación del desbridamiento quirúrgico guiado por azul de metileno diluido (0,1%) en 16 pacientes con implantes de prótesis de rodilla durante el primer tiempo de una revisión en dos tiempos. Observaron que existía una carga biológica bacteriana aproximadamente nueve veces mayor, medida mediante reacción en cadena de la polimerasa (PCR), en las áreas teñidas con azul de metileno.
Por otro lado, se ha planteado la sospecha de que el azul de metileno podría tener efectos antibacterianos que podrían interferir con los cultivos microbianos. Un estudio in vitro mostró que concentraciones al 0,05% no afectan la capacidad de cultivo de microorganismos18.
Estos hallazgos sugieren un potencial papel del azul de metileno, ya que ofrece una ayuda visual durante el procedimiento.
UltrasonidoEl ultrasonido implica que una corriente eléctrica transfiera su energía a un sistema mecánico, convirtiéndola en vibraciones que generan ondas de ultrasonido. Estas ondas, a su vez, inducen vibraciones en el material objetivo, resultando en la liberación de partículas del mismo.
En la exploración de nuevas terapias se llevó a cabo un estudio in vitro para evaluar la eficacia en la eliminación de unidades formadoras de colonias de la superficie de un implante de titanio. Se compararon tres métodos: a)desbridado con lavado pulsátil; b)expuesto a ultrasonido, y c)expuesto a ambos. El ultrasonido demostró una reducción de aproximadamente siete órdenes de magnitud, mientras que el grupo que recibió la combinación logró erradicar por completo las bacterias viables del biofilm19.
Además, en un estudio prospectivo realizado por Ji et al.20, con 17 casos sometidos a DAIR sumado a ultrasonido, solo 3 pacientes (6,7%) experimentaron infecciones recurrentes durante un seguimiento promedio de 9meses. Cabe destacar que aún se requiere evidencia adicional sustancial antes de poder recomendar la sonicación de manera rutinaria en estos procedimientos, pero se muestra como una herramienta prometedora para futuras aplicaciones terapéuticas.
DAIR en 2 tiemposEl DAIR en 2 tiempos consiste en realizar un primer DAIR habitual y, después de algunos días (en general se habla de 5-7días en la literatura) repetir el procedimiento.
Los resultados obtenidos de diversos estudios, con relación a la realización de un doble DAIR, señalan tasas de éxito de entre el 75% al 90%, superando las tasas históricas de DAIR en un solo tiempo; Chung et al.5 recientemente confirmqron esto en un estudio retrospectivo que incluyó a 83 pacientes en el que lograron una tasa de éxito global del 86,7%, siendo del 89,6% en rodillas.
En el protocolo de Chung et al., durante la primera fase se realizaron cultivos y se retiraron todos los componentes modulares, los cuales fueron lavados y sumergidos en una solución antiséptica durante 3 a 5minutos (fig. 3). Luego se llevó a cabo un prolijo procedimiento de irrigación y desbridamiento, incluyendo sinovectomía radical, se reimplantó el polietileno previamente sumergido en solución antiséptica y se introdujeron perlas de cemento con antibiótico en dosis elevadas (2-3g de vancomicina, 3,6-4,8g de tobramicina y 2g de cefazolina; todas estas concentraciones están dadas por cada 40gramos de cemento que se utilicen) en la articulación antes de su cierre (fig. 4), para después dejar la rodilla con una inmovilizador ortopédico. Respecto a la cantidad de perlas, se sugiere que sean aproximadamente entre 2 a 3 dosis de cemento (80-120gramos), con perlas que tengan un diámetro entre 1 a 2centímetros; además, se recomienda utilizar un cemento de porosidad media, para no afectar la integridad del mismo al mezclarlo muchas veces con más de un antibiótico. En una segunda fase, aproximadamente de 5 a 7días después, se procedió con un segundo desbridamiento, se retiraron las perlas y se implantaron nuevos componentes modulares estériles. Los pacientes recibieron tratamiento antibiótico intravenoso y oral, junto con un protocolo estándar de rehabilitación postoperatoria.
Esta estrategia puede ofrecer tasas de éxito significativas en el manejo de las IPP. Sin embargo, es importante destacar que cada caso puede presentar variaciones y que la elección del protocolo debe considerar las características específicas del paciente y la naturaleza de la infección.
AntibioticoterapiaEl tratamiento antibiótico posterior a DAIR en casos de IPP ha sido objeto de debate mundial, principalmente en lo que respecta a la duración, el esquema y la vía de administración.
Generalmente se administra antibioterapia dirigida a patógenos específicos durante un período de 2 a 6semanas después del procedimiento DAIR. La Sociedad Estadounidense de Enfermedades Infecciosas (Infectious Diseases Society of America [IDSA]) sugiere una duración de 4 a 6semanas para pacientes con patógenos distintos a los estafilococos o cuando no se puede utilizar terapia combinada con rifampicina21. Por otro lado, el ICM recomienda un mínimo de 6semanas de terapia antibiótica7.
El consenso de éxito de tratamiento para IPP22, liderado por el Dr. Claudio Díaz, establece que el fallo de tratamiento en IPP se define por la persistencia o la recurrencia de la infección, la necesidad de una cirugía adicional relacionada con la infección o el fallecimiento del paciente como consecuencia directa o indirecta de la infección. Este consenso proporciona criterios claros y estandarizados para evaluar el éxito o el fracaso del tratamiento, permitiendo una comparación consistente entre distintos estudios y guías clínicas.
En este contexto, un ensayo clínico aleatorizado que incluyó a 60 pacientes dividió a los participantes en dos grupos: uno recibió tratamiento intravenoso durante 2semanas y el otro durante 6semanas, seguido de tratamiento oral, lo que completó un total de 12semanas de terapia antibiótica. Se observó una tasa de curación clínica del 71% y del 76%, respectivamente, en los dos grupos, sin encontrar diferencias estadísticamente significativas entre ellos23. La terapia antibiótica debe ser siempre indicada con relación a los cultivos obtenidos, y con respecto a la temporalidad, estos pueden partirse, empíricamente, una vez tomados los cultivos iniciales.
Por otro lado, algunos estudios respaldan la implementación de una terapia antibiótica de supresión a largo plazo, que se extiende durante al menos 6meses después del DAIR, demostrando una supervivencia protésica libre de infección a cinco años del 68,5% para el grupo de supresión de antibióticos y del 41,1% para el grupo de no supresión24.
La adición de rifampicina ha mostrado buenos resultados en infecciones por estafilococos9. El ICM recomienda combinaciones de antibióticos con rifampicina en infecciones por MRSA. Sin embargo, una revisión sistemática reciente no encontró beneficios en términos de mejorar las tasas de fracaso del tratamiento con la terapia complementaria con rifampicina, a pesar de su amplia difusión en la literatura25. Es por esto que es importante realizar un esfuerzo en la identificación del germen y el consecuente antibiograma para otorgar un esquema antibiótico específico.
En cuanto al uso de antibiótico intraóseo (IO), recientemente Kildow et al.26 publicaron sus resultados de DAIR suplementado con el uso de vancomicina IO y observaron altas tasas de éxito (sin recurrencia en el 92,3%) en infecciones agudas, pero bajo éxito en infecciones crónicas (44,4%); sin embargo, este estudio era una serie de casos retrospectiva, y no contaba con grupo control. La administración de antibióticos IO se puede realizar con relativa rapidez y seguridad en la tibia proximal.
Infecciones fúngicasLas infecciones por hongos son poco frecuentes, pero pueden ser muy graves. La escasa información disponible en la literatura ha impedido la formación de un consenso claro respecto al manejo óptimo de estas infecciones, siendo el recambio en dos tiempos el enfoque convencional habitual.
En términos generales, el DAIR ha sido asociado con una tasa de fracaso relativamente alta en casos de infecciones micóticas, con informes que sugieren tasas de falla que oscilan entre el 82% y el 100%7. No obstante, se han documentado casos aislados que han tenido éxito, todos los cuales requirieron un tratamiento antimicótico continuado durante un período de seis meses a un año después de la realización del DAIR27.
Recientemente se llevó a cabo una revisión sistemática que incluyó a 225 pacientes con IPP de cadera o rodilla con una infección fúngica. Se observó que la recurrencia de la infección afectó al 18,3% de los pacientes con IPP de rodilla, siendo más prevalente en casos de infección por Candida albicans (OR: 3,56). En comparación con el DAIR, la artroplastia de recambio en dos tiempos se mostró como un factor protector frente a la recurrencia de IPP en la rodilla (OR: 0,18)28. Estos resultados podrían explicarse en parte porque los pacientes con IPP fúngicas suelen presentar una condición inmunocomprometida, lo cual podría contribuir de manera significativa a la elevada tasa de fracasos en los tratamientos.
Fracaso DAIRFactores asociados a éxito o fracaso del DAIR (ICM)Factores asociados con el éxito en el tratamiento de las IPP agudas mediante DAIR:
- •
Recambio de los componentes modulares.
- •
Desbridamiento dentro de los primeros siete días.
- •
Añadir rifampicina al régimen de antibióticos después de tener germen y antiobiograma claro; tras unos 5-7días de tratamiento intravenoso, particularmente en estafilococos susceptibles, se sugiere combinar con una fluoroquinolona. Su principal función es su capacidad de atacar el biofilm.
- •
Tratamiento con fluoroquinolonas en casos de bacilos gramnegativos susceptibles.
Factores asociados al fracaso en el tratamiento de las IPP agudas mediante DAIR:
- •
Factores huésped: artritis reumatoide, edad avanzada, sexo masculino, insuficiencia renal crónica, cirrosis hepática y enfermedad pulmonar obstructiva crónica.
- •
Indicación protésica: fractura, prótesis cementada y revisión previa.
- •
Presentación: proteína C reactiva elevada, alto inóculo bacteriano y bacteriemia.
- •
Microorganismos causales: S.aureus, Enterococcus, K.pneumoniae, A.baumanii, P.aeruginosa y Enterobacter spp.
Tornero et al.29 publicaron la puntuación KLIC para predecir el fracaso del DAIR en la IPP aguda posquirúrgica y desarrollaron una estratificación de riesgo considerando la enfermedad renal crónica, cirrosis hepática, cirugía índice (revisión o fractura), cementación protésica y una proteína C reactiva >115mg/l. El fallo del DAIR se predice en un 100% cuando se tiene una puntuación preoperatoria superior a >6, y el 4,5% cuando se tiene una puntuación <2.
Posteriormente, Argenson et al.30 realizaron el mismo análisis en IPP hematógena aguda, publicando la puntuacion CRIME80, que considera la enfermedad pulmonar obstructiva crónica, la proteína C reactiva >150mg/l, la artritis reumatoide, la fractura como indicación de la prótesis, el sexo masculino, la retención de componentes móviles y una edad >80años, prediciendo un fracaso con una tasa que va desde el 22%, y que aumenta al 79% con una puntuación >4. A diferencia de la puntuación KLIC, la puntuación CRIME80 aún no ha sido validada en una cohorte externa de pacientes.
Según el consenso de Filadelfia, ambos sistemas de puntuación preoperatorios podrían utilizarse en la práctica clínica para seleccionar a los pacientes en los que estaría indicado de forma más exacta un DAIR.
Recientemente se está incluyendo la inteligencia artificial para el análisis y la predicción de falla de DAIR. Shohat et al. analizaron más de 1.000 pacientes que fueron sometidos a DAIR por IPP aguda, incluyendo también la variable del microorganismo, creando un algoritmo diagnóstico que tenía un buen poder discriminatorio para medir la tasa de éxito del DAIR; sin embargo, carece de validación externa de calidad28.
Opciones ante el fracaso del tratamientoDespués de enfrentar las complicaciones derivadas del fracaso del DAIR, la estrategia terapéutica que comúnmente se aconseja es proceder con una artroplastia de revisión en dos tiempos. Esta técnica implica, inicialmente, la extracción del implante infectado y la colocación de un espaciador de cemento con antibióticos, el cual puede ser articulado (sobre todo si se sospecha un largo tiempo con el espaciador puesto) o puede ser rígido (ideal en escenarios donde la segunda reintervención se planifica de manera precoz), seguido de un período de tratamiento con antibióticos inicialmente intravenosos y luego orales. Dicho espaciador libera la mayoría de su carga antibiótica durante las primeras 72horas, para seguir liberando, en menor cuantía, hasta aproximadamente la semana6. El segundo tiempo consiste en la implantación de una nueva prótesis una vez que se ha controlado la infección. Este enfoque en dos tiempos es recomendado con el fin de mejorar las posibilidades de erradicar la infección y asegurar el éxito a largo plazo de la artroplastia de revisión.
Existen estudios que señalan la posibilidad de que un fracaso inicial del DAIR puede estar asociado con una incidencia más elevada de lo previsto de complicaciones en la subsecuente artroplastia de revisión en dos tiempos. No obstante, un estudio retrospectivo reciente sobre este tema, de 750 pacientes, reportó resultados contrarios, indicando que la realización de un DAIR previo antes de una revisión en dos tiempos no incrementa el riesgo de fallo31.
RecomendacionesI. Evaluación y selección del paciente.
Como línea general, en nuestro grupo intentamos retener los componentes protésicos cada vez que sea posible, siempre y cuando se cumplan ciertas condiciones:
- A.
Infecciones agudas, consideradas antes de las 12 semanas desde la cirugía inicial, o hematógenas agudas (menos de 2semanas de síntomas).
- B.
Pacientes no inmunocomprometidos idealmente con microorganismo identificado y tratable.
- C.
Sin signos de aflojamiento de los componentes en el estudio imagenológico.
- D.
Sin compromiso importante de las partes blandas en la zona operatoria.
II. Procedimiento Double-DAIR.
Una vez que se ha optado por la alternativa de preservar los componentes, el tratamiento que hemos incorporado en los últimos años, siguiendo las recomendaciones del grupo Clínica Mayo, es el siguiente:
- A.
Realizar un aseo quirúrgico en dos tiempos, separados por 5-7días.
- B.
Llevar a cabo un desbridamiento quirúrgico agresivo y meticuloso.
- C.
Utilizar incisión previa más lateral para evitar complicaciones.
- D.
Tomar múltiples muestras para cultivo utilizando técnicas y medios que optimicen la identificación del patógeno.
- E.
Aplicar volúmenes de irrigación de al menos 9litros, con sistema de irrigación pulsátil y alta presión.
- F.
Utilizar soluciones antisépticas como povidona yodada o clorhexidina, manteniendo una «piscina de antiséptico» durante 3-5minutos (fig. 3).
- G.
Sustituir los componentes modulares (inserto) de la prótesis.
- H.
Instalación de un rosario con perlas de cemento con antibiótico dentro de la articulación (fig. 4).
- I.
Realizar un cierre prolijo.
- J.
Mantener la rodilla en el período intermedio con un inmovilizador en extensión.
- K.
Repetir el procedimiento 5-7días después, cambiando nuevamente el componente modular (inserto), retirando las perlas de cemento con antibiótico.
- L.
Es de suma importancia mencionar que el doble DAIR debe ser un procedimiento planificado. Según las recomendaciones entregadas anteriormente, este jamás debe ser utilizado como un segundo DAIR en el caso que ya hayamos tenido malos resultados con un primer DAIR.
III. Terapia antibiótica.
Respecto a la terapia antibiótica, como líneas generales recomendamos lo siguiente:
- A.
Basarse siempre en relación a los cultivos obtenidos, con supervisión de equipo de Infectología en el centro hospitalario.
- B.
Régimen antibiótico empírico instaurado luego de obtener cultivos de calidad; la recomendación en general es asociar una fluoroquinolona con una cefalosporina, aunque puede variar según el centro y la epidemiología infecciosa local.
- C.
Duración del tratamiento de 4 a 12semanas.
- D.
Considerar terapia de supresión a largo plazo según microbiología.
- E.
Infección fúngica
- 1.
Tenerla siempre en consideración como posible etiología.
- 2.
Enfoque de tratamiento más agresivo como el recambio en dos tiempos.
- 1.
IV. Fracaso de Double-DAIR
En caso de fracaso del procedimiento, recomendamos:
- A.
Identificar factores asociados.
- B.
Utilizar modelos de riesgo para predecir el éxito del DAIR y personalizar el manejo.
- C.
Preferir la revisión en dos tiempos tras un intento fallido de DAIR.
El manejo de las infecciones periprotésicas agudas de rodilla representa un desafío significativo que impacta tanto a los pacientes como a los sistemas de salud. A pesar de los avances en técnicas quirúrgicas y cuidados postoperatorios, las IPP de rodilla siguen siendo una preocupación relevante debido a su incidencia (primera causa de revisión tanto aguda como crónica), los costos asociados y las consecuencias devastadoras en la salud de nuestros pacientes.
El enfoque conocido como Desbridamiento, Antibióticos y Retención del Implante (DAIR) ha surgido como una estrategia clave en este contexto, especialmente cuando se implementa de forma aguda. No obstante, la eficacia del DAIR presenta una variabilidad considerable, y la selección cuidadosa de los pacientes, combinada con un desbridamiento quirúrgico meticuloso, se erigen como factores cruciales para alcanzar el éxito. Esta técnica tiene mejores resultados especialmente cuando tenemos un germen de baja virulencia identificado y cuando se realiza de manera precoz, así como también cuando el paciente presenta pocas comorbilidades. En contextos donde las condiciones no son las ideales, surge el concepto de «doble DAIR» como una estrategia innovadora que busca mejorar las tasas de éxito en el manejo de las infecciones periprotésicas agudas. La implementación del DAIR o del doble DAIR se debe llevar a cabo de manera esquemática y ordenada, considerando todos los elementos mencionados en el presente trabajo.
Nivel de evidenciaNivel de evidencia IV.
FinanciaciónNo existe ningún tipo de financiación para la realización del presente estudio
Consideraciones éticasEl presente trabajo es una revisión, donde no se incluyó información sensible de ningún tipo de paciente.
Conflicto de interesesNinguno de los autores presenta conflicto de intereses.