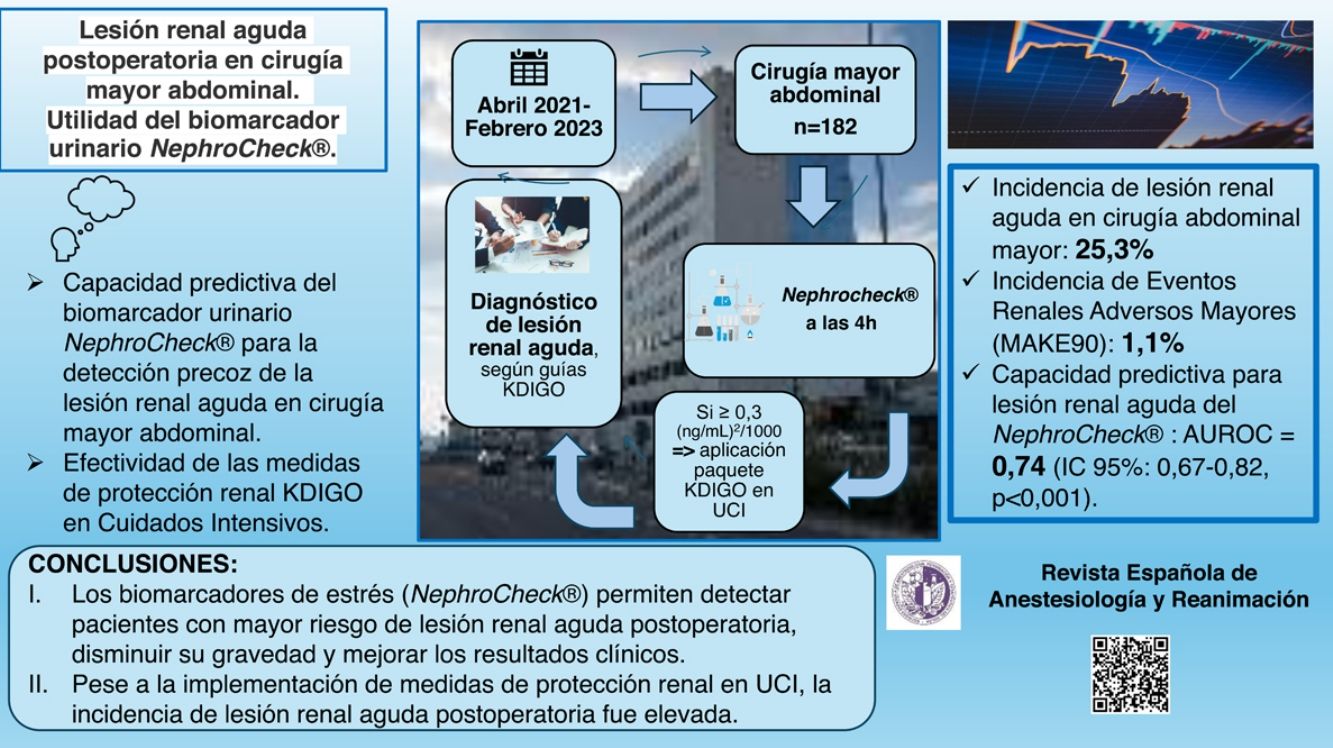
El biomarcador urinario [TIMP-2]×[IGFBP7] permite predecir la lesión renal aguda postoperatoria (LRA-PO). Nuestro estudio tuvo como objetivos evaluar la incidencia de LRA-PO en pacientes de riesgo renal sometidos a cirugía mayor abdominal e investigar el impacto de la implementación de medidas de optimización renal KDIGO en aquellos con estrés renal identificado por [TIMP-2]×[IGFBP7].
Materiales y métodosEstudio prospectivo en 182 pacientes sometidos a cirugía mayor abdominal. Se recogieron datos perioperatorios, niveles de [TIMP-2]×[IGFBP7] y la aplicación de estrategias de protección renal KDIGO en la UCI. Se identificaron predictores de LRA-PO mediante análisis multivariante.
ResultadosLa incidencia global de LRA-PO fue del 25,3%, alcanzando el 42,7% en los ingresados en UCI. [TIMP-2]×[IGFBP7] mostró una capacidad predictiva moderada (AUROC=0,74), con una incidencia de LRA-PO del 47,5% en pacientes con niveles elevados. A pesar de la implementación de medidas KDIGO en la UCI, la incidencia de LRA-PO en pacientes con [TIMP-2]×[IGFBP7] elevado fue del 65,6%. En el análisis multivariante, los principales predictores de LRA-PO fueron: un [TIMP-2]×[IGFBP7] elevado (OR=6,3; IC95%: 2,6-15,6; p<0,001), el sexo masculino (OR=6,1; IC95%: 1,9-19,6; p=0,002) y el ingreso en la UCI (OR=4,5; IC95%: 1,5-13,6; p=0,009).
ConclusionesLa LRA-PO es frecuente tras cirugía mayor abdominal, especialmente en pacientes ingresados en la UCI. El biomarcador [TIMP-2]×[IGFBP7] permite la identificación temprana de pacientes en riesgo, aunque la implementación de medidas KDIGO en la UCI no logró reducir significativamente su incidencia.
The urinary biomarker [TIMP-2]×[IGFBP7] enables the prediction of postoperative acute kidney injury (PO-AKI). Our study aimed to assess the incidence of PO-AKI in high-risk patients undergoing major abdominal surgery and to evaluate the impact of implementing KDIGO renal optimization measures in those with renal stress identified by [TIMP-2]×[IGFBP7].
Materials and methodsThis was a prospective study including 182 patients who underwent major abdominal surgery. Perioperative data, [TIMP-2]×[IGFBP7] levels, and the implementation of KDIGO renal protection strategies in the ICU were collected. Predictors of PO-AKI were identified through multivariate analysis.
ResultsThe overall incidence of PO-AKI was 25.3%, reaching 42.7% in ICU patients. [TIMP-2]×[IGFBP7] showed moderate predictive ability (AUROC=.74), with a PO-AKI incidence of 47.5% in patients with elevated levels. Despite the implementation of KDIGO measures in the ICU, the incidence of PO-AKI in patients with elevated [TIMP-2]×[IGFBP7] was 65.6%. In multivariate analysis, the main predictors of PO-AKI were elevated [TIMP-2]×[IGFBP7] (OR=6.3; 95%CI: 2.6-15.6; P<.001), male sex (OR=6.1; 95%CI: 1.9-19.6; P=.002), and ICU admission (OR=4.5; 95%CI: 1.5-13.6; P=.009).
ConclusionsPO-AKI is common after major abdominal surgery, particularly in ICU patients. The [TIMP-2]×[IGFBP7] biomarker allows for early identification of at-risk patients, although the implementation of KDIGO measures in the ICU did not significantly reduce its incidence.
La lesión renal aguda (LRA; en inglés, acute kidney injury [AKI]) es un síndrome caracterizado por un incremento de creatinina plasmática y/o un descenso de diuresis. Estos criterios funcionales han ido evolucionando desde la introducción en 2004 de la escala RIFLE, en 2007 los criterios Acute Kidney Injury Network (AKIN) y en 2012 los criterios Kidney Disease: Improving Global Outcomes (KDIGO) que unificaron las definiciones previas, estableciendo el estándar para la identificación y la estratificación de la LRA1-3.
La LRA es una complicación común tras una cirugía mayor, especialmente en pacientes con factores de riesgo1-4, asociándose con un aumento de mortalidad, insuficiencia renal crónica y coste hospitalario1,5.
La incidencia postoperatoria reportada en la literatura varía entre el 13% y el 50%, siendo superior tras cirugía con circulación extracorpórea y cirugía urológica1-8. Esta variación puede deberse a que pocos estudios evalúan simultáneamente creatinina y diuresis para el diagnóstico de la LRA1,4,6-8.
El manejo perioperatorio de la LRA está en debate debido en parte a la falta de uniformidad diagnóstica1,9. Los criterios KDIGO permiten identificar los pacientes con LRA, pero no detectan LRA subclínica1-3. Los biomarcadores de tipo funcional, como creatinina (CrS), diuresis y tasa de filtración glomerular (TFG), presentan limitaciones en sensibilidad y especificidad y permiten un diagnóstico tardío cuando se ha producido una pérdida significativa de la TFG, lo que retrasa la intervención y deriva en un posible daño irreversible1,3,8.
El descubrimiento y la validación de biomarcadores denominados de daño renal en pacientes de alto riesgo han supuesto un avance significativo1,3,7,8,10-12. Se incluyen la cistatinaC, la lipocalina asociada a gelatinasa de neutrófilos (NGAL), la molécula de lesión renal1 (KIM-1), la interleucina 18 (IL-18) y la π-glutatión S-transferasa (π-GST).
Recientemente, dos proteínas han mostrado resultados prometedores: inhibidor tisular de metaloproteinasa2 (TIMP2) y proteína ligadora del factor de crecimiento insulínico7 (IGFBP7), comercializadas bajo el nombre de NephroCheck® (BioMérieux España). La prueba mide las concentraciones urinarias de TIMP2 e IGFBP7 mediante inmunoanálisis de fluorescencia tipo sándwich. Estas proteínas, liberadas por el túbulo renal en respuesta a estímulos nocivos, detienen el ciclo celular en fase G1 para prevenir la división y la senescencia celular, mecanismo clave en la fisiopatología de la LRA3,7,10-14. Su elevación indica estrés celular en el túbulo renal y sugiere un alto riesgo de desarrollar LRA sin necesariamente reflejar daño estructural. El índice de riesgo AKIRisk® se calcula como [TIMP-2]×[IGFBP-7]/1.000, expresado en (ng/ml)2/1.000. Un valor superior a 0,3 (ng/ml)2/1.000 (AKIRisk positivo) indica riesgo elevado de LRA moderada a severa en las próximas 12horas, con alta sensibilidad y especificidad aceptable. En pacientes críticos, valores superiores a 2 (ng/ml)2/1.000 sugieren riesgo muy alto de LRA7,10,13,15. Su medición permite una intervención temprana, potencialmente evitando daños irreversibles y mejorando el pronóstico. Diversos autores consideran estos biomarcadores no de daño renal (como el NGAL y KIM-1) sino de estrés, ya que su elevación no implica necesariamente un pronóstico adverso si se implementan medidas preventivas precoces.
Estudios como PrevAKI (en cirugía cardíaca)6 y BigPAK (en cirugía mayor abdominal)7 han mostrado que el uso de TIMP2-IGFBP7 combinado con las estrategias preventivas de las guías KDIGO reduce la incidencia de LRA en pacientes de alto riesgo6,10,16,17. Sin embargo, la implementación de estas recomendaciones en la práctica clínica sigue siendo limitada3,10.
El objetivo principal de nuestro estudio fue determinar la incidencia global de LRA en pacientes con riesgo renal sometidos a cirugía mayor abdominal, incluyendo ingresados en la UCI y en planta, con el propósito de reflejar fielmente la práctica clínica habitual y evaluar la utilidad del biomarcador AKIRisk®. Asimismo, con el objetivo de reducir la incidencia de LRA-PO en pacientes con estrés renal, identificado mediante un AKIRisk positivo, analizamos el impacto de la implementación de medidas de optimización renal según las guías KDIGO en los pacientes ingresados en la UCI.
Como objetivos secundarios, evaluamos los factores de riesgo de LRA asociados al paciente y al periodo perioperatorio, y analizamos la morbimortalidad, incluyendo la incidencia de Eventos Renales Adversos Mayores a los 90 días (MAKE90), un compuesto que engloba mortalidad, necesidad de terapia de reemplazo renal continua y deterioro permanente de la función renal, definida como una reducción superior al 25% en la TFG estimada a los 90días.
Nuestra hipótesis planteaba que el uso del biomarcador TIMP-2×IGFBP7 para la detección temprana de LRA, junto con la aplicación de medidas postoperatorias de protección renal, podría mejorar el pronóstico de los pacientes sometidos a cirugía mayor abdominal.
Material y métodosRealizamos un estudio prospectivo observacional en pacientes con factores de riesgo renal sometidos a cirugía mayor abdominal. El protocolo del estudio fue aprobado por el comité de ética de nuestro centro (proyecto 2020.117) y se obtuvieron los consentimientos informados.
Criterios de inclusión y exclusiónLos criterios de inclusión, identificados en la consulta de preanestesia, fueron:
- a)
Mayores de 18 años.
- b)
Programados para cirugía mayor abdominal: abdominopélvica abierta o laparoscópica de cirugía general, urología o ginecología con duración prevista superior a dos horas, y
- c)
Con al menos un factor de susceptibilidad de LRA, según las guías KDIGO16: edad >65años, enfermedad renal crónica (ERC), hipertensión arterial, diabetes mellitus, cáncer, anemia, enfermedad crónica cardiopulmonar (cardiopatía isquémica, fibrilación auricular, insuficiencia cardiaca congestiva o enfermedad pulmonar obstructiva crónica) o hepática (cirrosis).
Excluimos pacientes con ERC estadio >3B (TFGe <30ml/min/1,73 m2), cirugía prevista o previa de nefrectomías y trasplantes, y aquellos que negaron participar en el estudio.
Procedimiento del estudioSe incluyeron todos los pacientes consecutivos del 7 de abril de 2021 al 23 de febrero de 2022. El ingreso postoperatorio en la UCI fue indicado por el anestesiólogo según el tipo de cirugía, evolución en quirófano y estado del paciente.
En todos los pacientes se solicitó un NephroCheck® en orina de sonda vesical a las 4horas de finalizar la intervención. Para su extracción se pinzó la sonda 15minutos para obtener orina, que fue analizada en el laboratorio central. Se consideró valor de AKIRisk >0,3 (ng/ml)2/1.000 (AKIRisk positivo) como alto riesgo de LRA en el postoperatorio inmediato, definido como las primeras 72horas postoperatorias. En los pacientes ingresados en la UCI se informó al anestesiólogo responsable de la UCI de aquellos con AKIRisk positivo para la aplicación de las medidas de optimización renal definidas por las guías KDIGO (paquete KDIGO)16-17, consistentes en: 1)normalización de la volemia (valorada mediante evaluaciones dinámicas de la respuesta a líquidos con prueba de elevación pasiva de piernas o mini-bolus de líquidos intravenosos); 2)estabilidad hemodinámica con normotensión (PAM ≥65mmHg con vasopresores, si requiere); 3)retirada y evitación de nefrotóxicos, y 4)control estricto de glucemia (entre 110-180mg/dl). Los pacientes ingresados en la UCI mantuvieron el sondaje vesical durante las primeras 72horas postoperatorias, mientras que, en los pacientes de planta, la mayoría tuvo retirada la sonda tras la toma del NephroCheck®. El seguimiento de la diuresis en planta se realizó cada 24horas mediante la recolección de orina espontánea en un recipiente. El manejo de los pacientes en planta estuvo a cargo de los equipos quirúrgicos, siguiendo el protocolo quirúrgico habitual, sin una aplicación sistemática del paquete KDIGO.
Diagnóstico y clasificación de LRALa LRA postoperatoria (LRA-PO) se diagnosticó según valores de creatinina basales y posquirúrgicos, y diuresis postoperatoria. Se consideraron basales los valores de creatinina preoperatoria más recientes en los 30días previos a la cirugía. Clasificamos los estadios de LRA-PO según las guías KDIGO (tabla 1)8,16.
Clasificación de daño renal agudo según las guías KDIGO
| Estadio | Creatinina sérica | Diuresis |
|---|---|---|
| 1 | 1,5-1,9 veces la basal, o | <0,5 ml/kg/h durante 6-12 h |
| Aumento Cr ≥ 0,3 mg/dl | ||
| 2 | 2-2,9 veces la basal | <0,5 ml/kg/h ≥ 12 h |
| 3 | ≥ 3 veces la basal, o | <0,3 ml/kg/h ≥ 24 h |
| Aumento Cr ≥ 4 mg/dl, o | Anuria durante ≥ 12 h | |
| Inicio de TDE, oen <18 años, disminución TFG <35 ml/min/1,73m2 |
Se recogieron variables demográficas, quirúrgicas y de función renal en el preoperatorio, en el intraoperatorio y en las primeras 72horas postoperatorias, así como el estadio de LRA y complicaciones a los 90días: disfunción renal permanente, necesidad de reemplazo renal y mortalidad.
Las variables preoperatorias incluyeron factores de riesgo para LRA: edad, ASA, sexo, hipertensión arterial (HTA), cardiopatía isquémica (CI), fibrilación auricular (FA), insuficiencia cardíaca (IC), enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), anemia, y el uso crónico de medicamentos nefrotóxicos (IECA/ARA-II, AINE y betabloqueantes). También se recogieron datos de función renal basal: creatinina (CrS), urea y tasa de filtración glomerular (MDRD).
Las variables intraoperatorias incluyeron: especialidad quirúrgica, tipo de cirugía, duración, urgencia y abordaje de la intervención, anestesia empleada, presencia de inestabilidad hemodinámica, necesidad de vasoactivos, fluidoterapia, diuresis y uso de nefrotóxicos.
Las variables postoperatorias registraron: estancia en la UCI, duración de la hospitalización, necesidad de monitorización invasiva, presencia de inestabilidad hemodinámica, uso de vasoactivos y transfusiones, fluidoterapia administrada, uso de fármacos nefrotóxicos y complicaciones postoperatorias (hemorragia, infecciones o sepsis). También se evaluaron parámetros hematológicos y de función renal (CrS y MDRD) al ingreso, a las 24 y a las 48horas; diuresis diaria en las primeras 72horas, AKIRisk (NephroCheck®) a las 4horas de la intervención, estadio de LRA y complicaciones mayores (MAKE90). Al ingreso en la UCI se calculó el valor de SOFA y SAPSIII.
Análisis estadísticoCalculamos un tamaño muestral de 152 pacientes para detectar una reducción relativa del 20% en la incidencia de LRA-PO (del 37% al 17%), que consideramos clínicamente significativa, con una potencia estadística del 80% y un nivel de significancia del 5% [Sample Size Calculator by Sean P. Kane en ClinCalc LLC]. La incidencia del 37% se obtuvo a partir de un análisis retrospectivo de pacientes ingresados en la UCI tras cirugía mayor abdominal en 2019 (previo a la pandemia), utilizando exclusivamente mediciones de creatinina para el diagnóstico de LRA.
Se analizó la normalidad de la distribución de las variables con la prueba de Kolmogorov-Smirnov. Las variables discretas se describen como frecuencia absoluta (n, %), las continuas como media +desviación estándar, y como mediana (rango intercuartílico) si no siguen una distribución normal. Las características basales y perioperatorias según la presencia de LRA o de AKIRisk positivo fueron analizadas utilizando las pruebas chi-cuadrado y t de Student o U de Mann-Whitney, según la distribución. La capacidad predictiva de LRA del AKIRisk positivo se evaluó mediante el área bajo la curva de características operativas del receptor (AUROC). Se realizaron dos análisis multivariantes mediante regresión logística binaria para evaluar la asociación entre LRA y AKIRisk positivo, considerando como variables independientes las variables clínicas con diferencias significativas en el análisis univariante. Las odds ratios (OR) se calcularon para cada variable, junto con sus intervalos de confianza del 95% (IC95%) y valores p. Se consideraron estadísticamente significativos valores de p<0,05. El análisis estadístico fue realizado con el programa SPSS v.20 (SPSS Inc., Chicago, IL, EE.UU.).
ResultadosSe incluyeron un total de 182 pacientes sometidos a cirugía mayor abdominal, de los cuales 82 ingresaron en la UCI. Sus características preoperatorias se muestran en la tabla 2 y en la tabla A1.
Datos preoperatorios globales y comparativos de pacientes con y sin lesión renal aguda postoperatoria (LRA-PO)
| Pre-op | Global(n=182) | No LRA-PO(n=136) | LRA-PO(n=46) | p |
|---|---|---|---|---|
| Datos antropométricos | ||||
| Edad (años) | 63,5+11,6 | 62,4+11,9 | 66,1+9,9 | 0,03 |
| Peso (kg) | 74,4+15,2 | 73,5+14,7 | 77,1+16,6 | 0,16 |
| Altura (cm) | 169,0+9,0 | 168,7+8,9 | 171,4+9,58 | 0,94 |
| IMC | 26,0+4,0 | 25,9+3,8 | 26,5+5,1 | 0,35 |
| Sexo masculino | 129 (70,9%) | 89 (65,4%) | 40 (87,0%) | 0,00 |
| ASA | 0,26 | |||
| 2 | 9 (4,9%) | 8 (5,8%) | 1 (2,2%) | |
| 3 | 161 (88,5%) | 121 (89%) | 40 (87,0%) | |
| 4 | 12 (6,6%) | 7 (5,1%) | 5 (10,9%) | |
| Tabaco | 0,45 | |||
| Sí | 21 (11,5%) | 17 (12,5%) | 4 (8,7%) | |
| Exfumador | 51 (0,3%) | 35 (25,7%) | 16 (34,8%) | |
| Comorbilidades | ||||
| HTA | 86 (42,3%) | 59 (43,4%) | 27 (58,7%) | 0,08 |
| C. isquémica | 13 (7,1%) | 10 (7,4%) | 3 (6,5%) | 1 |
| FA | 17 (9,3%) | 10 (7,4%) | 7 (15,2%) | 0,14 |
| ICC | 3 (1,6%) | 2 (1,5%) | 1 (2,2%) | 1 |
| DM | 26 (14,3%) | 18 (13,2%) | 8 (17,4%) | 0,47 |
| Obesidad | 26 (14,3%) | 16 (11,8%) | 10 (21,7%) | 0,14 |
| DLP | 59 (32,4%) | 44 (32,4%) | 15 (32,6%) | 1 |
| EPOC | 7 (3,8%) | 2 (1,5%) | 5 (10,9%) | 0,01 |
| SAHOS | 19 (10,4%) | 14 (10,3%) | 5 (10,9%) | 1 |
| Anemia | 45 (24,7%) | 28 (20,6%) | 17 (37%) | 0,03 |
| ERC | 11 (6%) | 4 (2,9%) | 7 (15,2%) | 0,00 |
| Medicación habitual | ||||
| IECA/ARA II | 56 (30,8%) | 39 (28,7%) | 17 (37%) | 0,36 |
| Diuréticos | 25 (13,7%) | 17 (12,5%) | 8 (17,4%) | 0,46 |
| AINE | 8 (4,4%) | 6 (4,4%) | 2 (4,3%) | 1 |
| BB | 23 (12,6%) | 13 (9,5%) | 10 (21,7%) | 0,04 |
| Analítica+F. renal | ||||
| CrS basal (mg/dl) | 0,8 (0,3) | 0,8 (0,27) | 0,9 (0,23) | 0,02 |
| Urea basal (mg/dl) | 36+14 | 33+10 | 43,9+20,8 | 0,09 |
| MDRD basal disminuido (ml/min/1,73 m2) | 9 (4,9%) | 3 (2,2%) | 6 (13,0%) | 0,00 |
| Hb basal (g/dl) | 14 (2,6) | 14,2 (2,4) | 13,5 (3) | 0,03 |
AINE: antiinflamatorios no esteroideos; ARAII: antagonistas de receptores de angiotensinaII; ASA: estado físico de la Sociedad Americana de Anestesiología; BB: betabloqueantes; C. isquémica: cardiopatía isquémica; CrS: creatinina plasmática; DLP: dislipemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; F. renal: función renal; FA: fibrilación auricular; Hb: hemoglobina; HTA: hipertensión; ICC: insuficiencia cardiaca congestiva; IECA: inhibidores de la enzima convertidora de angiotensina; MDRD: Modification of Diet in Renal Disease study disminuido ≤60ml/min/1,73m2; Pre-op: preoperatorio; SAHOS: síndrome de apneas-hipoapneas del sueño.
La incidencia de LRA-PO fue del 25,3%, con una distribución de 43 casos en estadio1, 2 en estadio2 y 1 en estadio3. De estos, el 10,9% presentaron LRA de tipo oligúrico.
Los pacientes con mayor incidencia de LRA-PO eran de mayor edad, predominantemente varones, y presentaban como comorbilidades preoperatorias: ERC, anemia, EPOC y tratamiento con betabloqueantes (tabla 2).
Eventos renales adversos importantes (MAKE90)La incidencia de MAKE90 fue del 1,1% (2/182), con una muerte y un caso de necesidad de depuración extrarrenal. No se produjeron pérdidas durante el seguimiento de 90días.
El único paciente que requirió depuración extrarrenal (KDIGO3) fue un shock séptico con reingreso en la UCI a los 8días de una pancreatectomía cefálica.
El paciente fallecido a los 16días del postoperatorio presentaba malnutrición severa y complicaciones infecciosas y metabólicas tras cirugía de reversión de bypass gástrico, con reingreso en la UCI por parada cardiorrespiratoria.
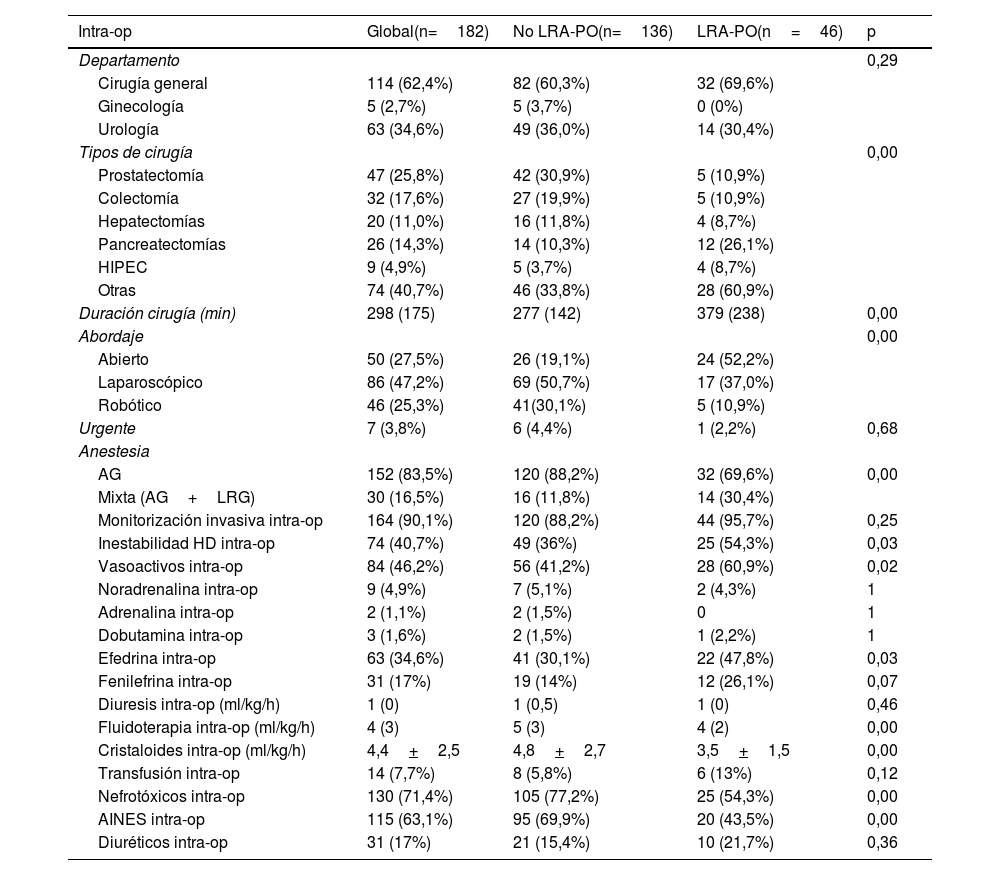
Características intraoperatorias y LRA-POSe muestran en la tabla 3 y en la tabla A2.
Datos intraoperatorios globales y comparativos de pacientes con y sin lesión renal aguda postoperatoria (LRA-PO)
| Intra-op | Global(n=182) | No LRA-PO(n=136) | LRA-PO(n=46) | p |
|---|---|---|---|---|
| Departamento | 0,29 | |||
| Cirugía general | 114 (62,4%) | 82 (60,3%) | 32 (69,6%) | |
| Ginecología | 5 (2,7%) | 5 (3,7%) | 0 (0%) | |
| Urología | 63 (34,6%) | 49 (36,0%) | 14 (30,4%) | |
| Tipos de cirugía | 0,00 | |||
| Prostatectomía | 47 (25,8%) | 42 (30,9%) | 5 (10,9%) | |
| Colectomía | 32 (17,6%) | 27 (19,9%) | 5 (10,9%) | |
| Hepatectomías | 20 (11,0%) | 16 (11,8%) | 4 (8,7%) | |
| Pancreatectomías | 26 (14,3%) | 14 (10,3%) | 12 (26,1%) | |
| HIPEC | 9 (4,9%) | 5 (3,7%) | 4 (8,7%) | |
| Otras | 74 (40,7%) | 46 (33,8%) | 28 (60,9%) | |
| Duración cirugía (min) | 298 (175) | 277 (142) | 379 (238) | 0,00 |
| Abordaje | 0,00 | |||
| Abierto | 50 (27,5%) | 26 (19,1%) | 24 (52,2%) | |
| Laparoscópico | 86 (47,2%) | 69 (50,7%) | 17 (37,0%) | |
| Robótico | 46 (25,3%) | 41(30,1%) | 5 (10,9%) | |
| Urgente | 7 (3,8%) | 6 (4,4%) | 1 (2,2%) | 0,68 |
| Anestesia | ||||
| AG | 152 (83,5%) | 120 (88,2%) | 32 (69,6%) | 0,00 |
| Mixta (AG+LRG) | 30 (16,5%) | 16 (11,8%) | 14 (30,4%) | |
| Monitorización invasiva intra-op | 164 (90,1%) | 120 (88,2%) | 44 (95,7%) | 0,25 |
| Inestabilidad HD intra-op | 74 (40,7%) | 49 (36%) | 25 (54,3%) | 0,03 |
| Vasoactivos intra-op | 84 (46,2%) | 56 (41,2%) | 28 (60,9%) | 0,02 |
| Noradrenalina intra-op | 9 (4,9%) | 7 (5,1%) | 2 (4,3%) | 1 |
| Adrenalina intra-op | 2 (1,1%) | 2 (1,5%) | 0 | 1 |
| Dobutamina intra-op | 3 (1,6%) | 2 (1,5%) | 1 (2,2%) | 1 |
| Efedrina intra-op | 63 (34,6%) | 41 (30,1%) | 22 (47,8%) | 0,03 |
| Fenilefrina intra-op | 31 (17%) | 19 (14%) | 12 (26,1%) | 0,07 |
| Diuresis intra-op (ml/kg/h) | 1 (0) | 1 (0,5) | 1 (0) | 0,46 |
| Fluidoterapia intra-op (ml/kg/h) | 4 (3) | 5 (3) | 4 (2) | 0,00 |
| Cristaloides intra-op (ml/kg/h) | 4,4+2,5 | 4,8+2,7 | 3,5+1,5 | 0,00 |
| Transfusión intra-op | 14 (7,7%) | 8 (5,8%) | 6 (13%) | 0,12 |
| Nefrotóxicos intra-op | 130 (71,4%) | 105 (77,2%) | 25 (54,3%) | 0,00 |
| AINES intra-op | 115 (63,1%) | 95 (69,9%) | 20 (43,5%) | 0,00 |
| Diuréticos intra-op | 31 (17%) | 21 (15,4%) | 10 (21,7%) | 0,36 |
AG: anestesia general; HIPEC: Hyperthermic IntraPeritoneal Chemotherapy; Intra-op: intraoperatorio; LRG: locorregional.
La incidencia de LRA-PO fue mayor en pacientes sometidos a cirugías más prolongadas, con anestesia general como única técnica, requerimiento de monitorización invasiva, abordaje abierto, episodios de inestabilidad hemodinámica, necesidad de vasoactivos, mayor restricción de fluidos y menor diuresis intraoperatoria.
Las pancreatectomías y las cistectomías tuvieron la mayor incidencia de LRA-PO.
Características postoperatorias y LRA-POSe muestran en la tabla 4 y en la tabla A3.
Datos postoperatorios globales y comparativos de pacientes con y sin lesión renal aguda postoperatoria (LRA-PO)
| Post-op | Global(n=182) | No LRA-PO(n=136) | LRA-PO(n=46) | p |
|---|---|---|---|---|
| Ingreso post-op en UCI | 82 (45,1%) | 47 (34,6%) | 35 (76,1%) | 0,00 |
| Monitorización invasiva post-op | 80 (44%) | 46 (33,8%) | 34 (73,9%) | 0,00 |
| SOFA ingreso UCI | 1 (3) | 0 (2) | 1 (3) | 0,11 |
| SAPS III ingreso UCI | 35,7+10,7 | 35,4+11,4 | 36+9,8 | 0,8 |
| Fluidoterapia POST-OP (ml/kg/h) | ||||
| 24 h | 1,1 (0,8) | 1,1 (0,6) | 1,4 (1) | 0,02 |
| 48 h | 0,9 (0,5) | 0,9 (0,5) | 1,1 (0,7) | 0,09 |
| 72 h | 0,7 (0,4) | 0,6 (0,5) | 0,8 (0,5) | 0,08 |
| Inestabilidad HD post-op | 16 (8,8%) | 7 (5,1%) | 9 (19,6%) | 0,00 |
| Vasoactivos post-op | 13 (7,1%) | 7 (5,1%) | 6 (13%) | 0,09 |
| Transfusión post-op | 21 (11,5%) | 9 (6,6%) | 12 (26,1%) | 0,00 |
| Diuréticos post-op | 0,00 | |||
| Bolo | 55 (30,2%) | 34 (25%) | 21 (45,7%) | |
| Pc | 12 (6,6%) | 5 (3,7%) | 7 (15,2%) | |
| Nefrotóxicos post-op | 161 (88,5%) | 126 (92,6%) | 35 (76,1%) | 0,00 |
| AINE post-op | 158 (86,8%) | 124 (91,2%) | 34 (73,9%) | 0,00 |
| Complicaciones post-op | 27 (14,8%) | 13 (9,5%) | 14 (30,4%) | 0,00 |
| Hemorragia post-op | 19 (10,4%) | 9 (6,6%) | 10 (21,7%) | 0,00 |
| Infección/sepsis post-op | 11 (6%) | 4 (2,9%) | 7 (15,2%) | 0,00 |
| Analítica, Hb (g/dl) | ||||
| Ingreso UCI | 11,8+2,1 | 11,9+1,9 | 11,7+2,3 | 0,63 |
| 24 h | 12 (3) | 12 (2) | 11 (4) | 0,00 |
| 48 h | 11 (3) | 11 (3) | 9 (4) | 0,00 |
| Datos F. renal,Cr (mg/dl) | ||||
| Ingreso | 0,9 (0,4) | 0,8 (0,3) | 1,1 (0,4) | 0,00 |
| 24 h | 0,8 (0,3) | 0,8 (0,3) | 1,2 (0,5) | 0,00 |
| 48 h | 0,9+0,3 | 0,7+0,2 | 1+0,3 | 0,00 |
| MRDR disminuido | ||||
| Ingreso | 13 (7,1%) | 2 (1,5%) | 11 (23,9%) | 0,00 |
| 24 h | 19 (10,4%) | 4 (2,9%) | 15 (32,6%) | 0,00 |
| 48 h | 11 (6%) | 2 (1,5%) | 9 (19,6%) | 0,02 |
| Diuresis POST-OP (ml/kg/h) | ||||
| 24 h | 1,5 (1) | 1,4 (1,1) | 1,6 (1) | 1 |
| 48 h | 1,2 (0,6) | 1,2 (0,6) | 1,1 (0,6) | 0,3 |
| 72 h | 1,4+0,5 | 1,4+0,5 | 1,3+0,6 | 0,09 |
| NEPHROCHEK, (ng/ml)2/1.000) | 0,17 (0,3) | 0,12 (0,23) | 0,4 (0,37) | 0,00 |
| AKIRisk positivo (> 0,3 (ng/ml)2/1.000) | 61 (33,5%) | 32 (23,5%) | 29 (63%) | 0,00 |
| TDE post-op | 1 (0,5%) | 0 | 1 (2,2%) | 0,25 |
| LRA-PO oligúrico | 5 (2,7%) | 0 | 5 (10,9%) | 0,25 |
| Outcomes | ||||
| CrS 90 d (mg/dl) | 0,8 (0,3) | 0,8 (0,3) | 0,9 (0,4) | 0,04 |
| MAKE 90 | ||||
| CrS > 25% basal | 0 | 0 | ||
| TDE 90 | 0 | 1 (2,2%) | 0,25 | |
| Mortalidad 90 días | 0 | 1 (2,2%) | 0,25 | |
| Estancia en UCI (días) | 1 (1) | 1 (1) | 2 (2) | 0,00 |
| Estancia en hospital (días) | 6 (5,2) | 5 (3,7) | 8,5 (10) | 0,00 |
CrS 90 d: creatinina plasmática a los 90 días; HD: hemodinámica; LRA-PO: lesión renal aguda postoperatoria; MAKE 90: Major Adverse Kidney Events a los 90 días; PC: perfusión continua; Post-op: postoperatorio; SAPS: Simplified Acute Physiology Score; SOFA: Sequential Organ Failure Assessment; TDE: técnica de depuración extrarrenal; UCI: unidad de cuidados intensivos.
La incidencia de LRA-PO fue mayor en los pacientes ingresados en la UCI, con inestabilidad hemodinámica y necesidad de vasoactivos y hemocomponentes, tratados con diuréticos, y aquellos con complicaciones postoperatorias. Estos pacientes tuvieron mayor estancia en la UCI y hospitalaria.
AKIRisk positivo y LRA-PO (fig. 1)De los 61 pacientes con AKIRisk positivo, el 47,5% desarrollaron LRA-PO, en comparación con el 14,0% con AKIRisk negativo. La sensibilidad global del AKIRisk positivo fue del 63%, con una especificidad del 76%, un valor predictivo positivo (VPP) del 48% y un valor predictivo negativo (VPN) del 86%.
Entre los 32 pacientes con AKIRisk positivo ingresados en la UCI, la incidencia de LRA-PO fue del 65,6%, significativamente mayor que la observada en los pacientes con AKIRisk positivo hospitalizados en planta (27,6%).
Asimismo, en los pacientes con AKIRisk negativo, la incidencia de LRA-PO fue superior en la UCI (28%), en comparación con planta (4,2%). En la UCI, el AKIRisk positivo mostró una sensibilidad del 60%, una especificidad del 77%, un VPP del 66% y un VPN del 72%.
El valor absoluto de [TIMP-2]×[IGFBP7] mostró una capacidad discriminativa moderada para LRA-PO, con un AUROC de 0,74 (IC95%: 0,67-0,82, p<0,001). Solo tres pacientes presentaron un valor de [TIMP-2]×[IGFBP7] >2 (ng/ml)2/1.000, indicativo de muy alto riesgo de LRA, de los cuales dos desarrollaron LRA-PO.
Análisis multivariante de la LRA-POEl análisis multivariante identificó como predictores significativos de LRA-PO el AKIRisk positivo, sexo masculino e ingreso en la UCI (tabla 5).
Análisis multivariante de los factores asociados a LRA-PO y a AKIRisk positivo en el postoperatorio de cirugía mayor abdominal
| Variable | OR | IC 95% | p |
|---|---|---|---|
| LRA-PO | |||
| AKIRisk positivo (Sí) | 6,32 | 2,56-15,59 | <0,001 |
| Sexo (varón) | 6,12 | 1,91-19,62 | 0,002 |
| Ingreso en UCI (Sí) | 4,46 | 1,47-13,59 | 0,009 |
| Edad (años) | 1,04 | 0,99-1,08 | 0,07 |
| Cirugía abierta (Sí) | 0,52 | 0,18-1,50 | 0,23 |
| Duración cirugía (minutos) | 1,00 | 0,99-1,00 | 0,42 |
| AKIRisk positivo | |||
| Cirugía abierta (Sí) | 7,03 | 2,63-18,76 | <0,001 |
| Fibrilación auricular (Sí) | 5,03 | 1,41-17,93 | 0,01 |
| Edad (años) | 0,97 | 0,94-1,00 | 0,15 |
| Sexo (varón) | 1,29 | 0,58-2,85 | 0,53 |
| Ingreso en UCI (Sí) | 2,69 | 0,93-7,7 | 0,06 |
| Duración cirugía (minutos) | 1,00 | 0,99-1,00 | 0,33 |
Los 82 pacientes ingresados en la UCI presentaban diferencias significativas en el tipo de cirugía y comorbilidades comparados con los ingresados en planta (tabla A4). Además, mostraban un peor estado físico (ASA4: 12% vs. 2%), mayor prevalencia de ERC (11% vs. 0%), HTA (56,1% vs. 40%) y FA (17,1% vs. 3%). Y fueron más frecuentemente sometidos a cirugía abierta (54,9% vs. 5%), con cirugía más prolongada (455± 216 vs. 259±90minutos), menor uso de cristaloides intraoperatorios (4,4±3,4 vs. 5,3±2,1ml/kg/h), mayor transfusión de hemocomponentes (14,6% vs. 2%) y uso de vasoactivos (64,6% vs. 31%).
Factores asociados a AKIRisk positivoLas variables perioperatorias asociadas a AKIRisk positivo fueron: presencia de FA, antecedente tabáquico y cirugía abierta bajo anestesia general sin locorregional (tabla A5). Pancreatectomías y colectomías fueron las intervenciones con mayor frecuencia de AKIRisk positivo.
El análisis multivariante identificó cirugía abierta y FA como predictores significativos de AKIRisk positivo (tabla 5).
DiscusiónNuestros principales hallazgos fueron los siguientes:
- a)
La incidencia de LRA-PO en pacientes sometidos a cirugía abdominal mayor fue elevada (25,3%) y significativamente mayor en ingresados en la UCI (42,7%).
- b)
Un AKIRisk positivo mostró una capacidad predictiva moderada para la detección precoz de LRA-PO, con un AUROC=0,74, respaldando su utilidad como biomarcador de riesgo.
- c)
A pesar de la implementación de medidas de protección renal según las guías KDIGO en la UCI, los pacientes con AKIRisk positivo presentaron una alta incidencia de LRA-PO (65,6%). Sin embargo, estas estrategias podrían haber contribuido a atenuar la gravedad de la disfunción renal, lo que sugiere la necesidad de optimizar su aplicación o complementarlas con intervenciones adicionales.
La incidencia de LRA-PO tras cirugía abdominal está en aumento, probablemente debido al envejecimiento poblacional, las comorbilidades y cirugías más agresivas2,4,8,18. En nuestro estudio, la incidencia global fue del 25,3%, consistente con lo reportado en la literatura, con una baja proporción de casos moderados a graves (KDIGO2-3: 6,5%).
Comparar nuestros resultados con otros estudios es complejo debido a la heterogeneidad de las poblaciones y variables analizadas. El estudio más amplio, EPIS-AKI4, evaluó la incidencia, los factores de riesgo y los desenlaces de la LRA-PO tras cirugía mayor (no solo abdominal), sin diferenciar entre pacientes ingresados en la UCI o en planta. De los 3.170 pacientes incluidos, 571 (29,4%) desarrollaron LRA-PO. Sin embargo, este estudio no proporciona datos específicos sobre la incidencia de LRA-PO en subtipos de cirugía abdominal mayor ni sobre estrategias de manejo específico.
En nuestro estudio, la incidencia de LRA-PO fue casi cuatro veces mayor en los pacientes ingresados en la UCI (42,7%) en comparación con planta (11%), a pesar de la implementación de medidas de optimización renal. Esto probablemente se deba al tipo de cirugía más agresiva y mayor comorbilidad en los pacientes de la UCI. Estudios previos, como el BigPAK7, han demostrado que la aplicación de medidas KDIGO puede reducir la incidencia de LRA-PO. Sin embargo, las diferencias en las características poblacionales, en el tipo de cirugía, en el manejo intraoperatorio y en las estrategias postoperatorias podrían explicar las discrepancias en los resultados.
Si bien la baja mortalidad en nuestra cohorte no permitió detectar diferencias significativas en eventos renales mayores en los pacientes con LRA-PO (en línea con estudios previos)6,7, observamos que la función renal se normalizó a los 90días en estos pacientes, asemejándose a la de aquellos que no desarrollaron LRA-PO. Esto sugiere que la detección temprana y un manejo adecuado podrían prevenir o retrasar la progresión a ERC. No obstante, no debemos subestimar el impacto de la LRA, incluso en estadio1, ya que se ha asociado con un mayor riesgo de ERC, eventos cardiovasculares, mortalidad, reingresos hospitalarios y disminución de la calidad de vida19.
Factores de riesgo de LRA-POLas variables preoperatorias asociadas a LRA-PO, como edad avanzada, sexo masculino, EPOC, anemia y ERC, coinciden con lo reportado2,8,9,12,20,21.
En el intraoperatorio, una perfusión y una oxigenación adecuadas son fundamentales para reducir la incidencia de la LRA8,9. Observamos que las cirugías más prolongadas, abiertas, con fluidoterapia restrictiva y mayor inestabilidad hemodinámica se asociaron con mayor riesgo de LRA-PO, en concordancia con la literatura previa8,9,12,20,21. En particular, la cirugía abierta fue el abordaje quirúrgico con mayor incidencia de LRA-PO, probablemente debido a su mayor complejidad y mayor pérdida de fluidos.
Los pacientes que desarrollaron LRA-PO presentaron con mayor frecuencia: ingreso en UCI, AKIRisk positivo y episodios de inestabilidad hemodinámica, lo que conllevó un aumento en la necesidad de transfusiones, ventilación mecánica, diuréticos y el desarrollo de complicaciones postoperatorias.
En el análisis multivariante, los factores más fuertemente asociados con la LRA-PO fueron el sexo masculino, el ingreso en la UCI y un AKIRisk positivo.
Utilidad del AKIRisk y del paquete KDIGOLa presencia de un AKIRisk positivo se correlacionó con el desarrollo de LRA-PO, en línea con estudios previos3,7,10,11,13. En nuestro estudio, el 63% de los pacientes que desarrollaron LRA-PO presentaron un AKIRisk positivo, aunque la mayoría correspondían al estadio1, lo que concuerda con la evidencia existente7-9.
Entre los biomarcadores disponibles, TIMP-2×IGFBP7ha demostrado un desempeño sólido en la predicción de LRA-PO. Gunnerson et al.22 reportaron un AUC de 0,84 (IC95%: 0,76-0,90) para la predicción de LRA-PO moderada a grave en las primeras 12horas postoperatorias. Asimismo, Gocze et al.23 encontraron que TIMP-2×IGFBP7 mejora significativamente la evaluación del riesgo de LRA en pacientes quirúrgicos de alto riesgo, con un AUC de 0,85 para cualquier estadio de LRA y de 0,83 para la necesidad temprana de terapia de reemplazo renal. En pacientes sometidos a cirugía cardíaca, su sensibilidad para predecir LRA ha sido reportada en aproximadamente el 77%24. Estas diferencias sugieren que, aunque TIMP-2×IGFBP7 es una herramienta valiosa en la predicción de LRA-PO, su sensibilidad varía según el tipo de cirugía, siendo mayor en cirugía abdominal mayor.
El AKIRisk positivo se ha consolidado como una herramienta temprana para la identificación de pacientes con estrés renal, permitiendo la implementación precoz de medidas preventivas6,12,13,17,25,26. Sin embargo, en nuestra cohorte de pacientes en la UCI con AKIRisk positivo, la aplicación del paquete de medidas KDIGO no parece reducir significativamente la incidencia de LRA-PO. La ausencia de un grupo control —cuya exclusión de las medidas KDIGO consideramos no ética— limita nuestra capacidad para evaluar con certeza su eficacia. No obstante, estas intervenciones parecen haber contribuido a reducir la gravedad de la LRA-PO, dado que solo el 6,5% de los casos progresaron a estadios KDIGO2-3. La efectividad limitada de las medidas KDIGO en nuestra población podría explicarse por varios factores: 1)inicio tardío de la optimización renal; 2)ausencia de consulta nefrológica temprana; 3)presencia de disfunción renal preexistente al inicio de la implementación del paquete KDIGO, o 4)factores de optimización renal no contemplados en las recomendaciones KDIGO. En este sentido, la congestión tisular y orgánica, incluyendo la congestión renal, ha cobrado relevancia como factor de riesgo en el desarrollo de LRA-PO. Su evaluación mediante ecografía (VExUS) podría representar una estrategia clave para reducir su incidencia6,27,28. Es posible que la administración de fluidoterapia sin considerar el grado de congestión renal haya generado sobrecarga hídrica, exacerbando la congestión tisular y renal, comprometiendo la perfusión renal y agravando la isquemia.
En cuanto a otros biomarcadores, un metaanálisis identificó que la NGAL urinaria presenta una mayor precisión diagnóstica para LRA-PO en pacientes no críticos25, aunque su rendimiento ha sido menos consistente en pacientes quirúrgicos. Por otro lado, la cistatinaC sérica ha mostrado la mayor precisión diagnóstica entre varios biomarcadores para la predicción de LRA-PO tras cirugía mayor, con un valor de HSROC del 82%26. No obstante, la rápida capacidad de respuesta de TIMP-2×IGFBP7 y su efectividad en la detección temprana de LRA-PO la posicionan como una herramienta valiosa en el manejo perioperatorio. La combinación de biomarcadores de daño renal, como NGAL urinario corregido por creatinina, podría mejorar la capacidad predictiva del AKIRisk, al permitir la detección temprana de daño renal intraoperatorio o postoperatorio25.
Nuestro estudio refleja la práctica clínica habitual en cirugía abdominal mayor, donde la decisión de ingreso en la UCI se basa en criterios clínicos independientes, como el tipo de cirugía, la evolución intraoperatoria y el estado hemodinámico postoperatorio, sin relación con la inclusión en el estudio. Aunque reconocemos que en los pacientes manejados en planta no fue posible monitorizar la diuresis completa cada 6horas ni aplicar las medidas KDIGO de forma sistemática, decidimos incluirlos para proporcionar una visión global de la incidencia de LRA-PO. Consideramos que estos datos aportan información relevante, a pesar de sus limitaciones, y pueden ser útiles para futuras estrategias de mejora en el manejo perioperatorio.
LimitacionesEste estudio presenta varias limitaciones. Su diseño observacional unicéntrico puede limitar la generalización de los hallazgos. Además, la heterogeneidad entre los pacientes ingresados en la UCI y manejados en planta, donde no se aplicó de manera sistemática el paquete KDIGO ni se pudo registrar la diuresis cada 6-12horas, podría dificultar una evaluación precisa del desarrollo de LRA-PO en este subgrupo. No obstante, esta diferencia refleja la práctica clínica real, y consideramos que la inclusión de ambos grupos ofrece una visión más amplia y representativa de la incidencia global de LRA-PO en cirugía mayor abdominal.
Si bien utilizamos los valores de corte aceptados de Nephrocheck®, estos pueden variar según la población estudiada11,14,15, lo que podría afectar la precisión del biomarcador en nuestro contexto. La falta de un grupo control en la UCI que no recibiera el paquete KDIGO, debido a consideraciones éticas, limita la capacidad de evaluar con precisión el impacto de estas intervenciones.
Otra limitación es la falta de recogida de ciertas variables clínicas relevantes, como albuminuria, sedimento urinario, marcadores sistémicos de inflamación o estrategias de optimización preoperatoria, lo que podría introducir factores de confusión.
Por último, aunque se aplicaron protocolos estandarizados, la variabilidad en la práctica clínica entre anestesiólogos y la experiencia individual en la implementación del protocolo KDIGO podrían haber influido en los resultados, generando heterogeneidad en el manejo perioperatorio de los pacientes.
ConclusiónLa incidencia de LRA-PO en pacientes sometidos a cirugía mayor abdominal fue elevada, afectando al 25,3% de los casos. La utilización de biomarcadores de estrés renal permite identificar a pacientes con mayor riesgo de LRA-PO y podría ser una herramienta útil para seleccionar a aquellos que más se beneficiarían de estrategias de optimización renal, con el objetivo de reducir la gravedad de LRA-PO y mejorar los resultados clínicos.
A pesar de la implementación de las medidas de protección renal KDIGO en la UCI, la incidencia de LRA-PO en estos pacientes siguió siendo considerablemente alta. Sin embargo, estas intervenciones podrían haber contribuido a mitigar la progresión a estadios más avanzados. Estos hallazgos subrayan la necesidad de mejorar las estrategias de prevención y manejo de LRA-PO, especialmente en poblaciones vulnerables.
Se requieren estudios multicéntricos, prospectivos y aleatorizados para validar estos resultados y optimizar las estrategias de intervención.
FinanciaciónEl presente trabajo ha sido financiado por fondos propios del Departamento de Anestesia y Cuidados Intensivos. Clínica Universidad de Navarra.
Conflicto de interesesAusencia de conflicto de intereses.
A Jorge María Núñez Córdoba por su asesoramiento estadístico, y a las enfermeras de Anestesia (URPA) y Cuidados Intensivos de la Clínica Universidad de Navarra por su ayuda en la recogida de datos.











![Lesión renal aguda postoperatoria (LRA-PO) y AKIRisk positivo (Nephr. ↑=[TIMP-2]×[IGFBP7] >0,3 (ng/ml)2/1.000). Lesión renal aguda postoperatoria (LRA-PO) y AKIRisk positivo (Nephr. ↑=[TIMP-2]×[IGFBP7] >0,3 (ng/ml)2/1.000).](https://static.elsevier.es/multimedia/00349356/0000007200000007/v1_202507300530/S0034935625001288/v1_202507300530/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


