A diferencia de otras enfermedades reumáticas, la gota es una enfermedad rara en mujeres en edad fértil. Debido al escaso número de casos disponibles para el estudio, la información actual se basa, principalmente, en reportes de casos.
ObjetivoDescribir las características y el desarrollo del embarazo en mujeres con gota.
MétodosUna búsqueda sistemática de literatura fue realizada en las bases de datos PubMed, Lilacs, Ebsco y Embase, desde la fecha de inclusión hasta agosto del 2016. Se incluyó a pacientes que cumplieron con la definición de gota según los criterios de la American Rheumatism Association y que tenían la descripción de su seguimiento durante el embarazo. Cada embarazo se trató como una observación independiente para el análisis. A partir de los artículos finalmente seleccionados, se extrajeron los desenlaces materno-fetales.
ResultadosLa búsqueda identificó 125 artículos potencialmente relevantes, después de la revisión de texto completo, 12 artículos cumplieron los criterios de inclusión. Se describen 23 embarazos que resultaron en 16 (69,5%) nacimientos vivos, 5 (21,7%) abortos, una (4,3%) interrupción del embarazo y en un caso (4,3%) no se describió el desenlace. No se reportaron muertes maternas. Dos recién nacidos fallecieron después del parto. No se documentaron malformaciones congénitas. Las complicaciones maternas más frecuentes fueron la insuficiencia renal, la anemia, la preeclampsia y la uremia posparto.
ConclusionesLa gota durante el embarazo no es común, pero se sabe que ocurre. Mientras que la mayoría de las mujeres con gota tuvieron bebés sanos, presentaban un mayor riesgo de tener complicaciones maternas.
Unlike other rheumatic diseases, gout is rare in women of childbearing age. Due to the low number of cases available for the study, current information is based mainly on case reports.
ObjectiveTo describe the characteristics and the outcome of the pregnancy of women with gout.
MethodsA systematic literature search was undertaken by the investigators in the PubMed and Embase databases, from the inclusion date to August 2016. Patients were included if they met the definition of gout according to the American Rheumatism Association criteria, and that they had the description of its follow-up during the pregnancy. Data collection and analysis: Each pregnancy was treated as a separate observation for analysis. The maternal and foetal-neonatal outcomes data were extracted from the articles finally selected
ResultsThe search identified 125 potentially relevant articles, but after a full-text review only 12 articles met the inclusion criteria. Of the 23 pregnancies described, there were 16 (69.5%) live births, 5 (21.7%) were aborted, in one (4.3%), the pregnancy was terminated, and in one case report (4.3%) there was no description on the term of pregnancy. No maternal deaths were reported. Two babies died a few hours after birth. Congenital malformations were not described in any case report. The most frequent maternal complications were renal damage, anaemia, preeclampsia, and postpartum uraemia.
ConclusionsGout during pregnancy is not common, but it is known to occur. While the majority of women with gout delivered healthy infants, they were at increased risk of having maternal complications.
El embarazo en mujeres con enfermedades reumáticas puede ser un reto para los médicos encargados de su atención, debido a que la frecuencia y las complicaciones durante el embarazo varían entre las distintas enfermedades reumáticas. Además, puede ser necesario el cambio en el tratamiento de la paciente que planea un embarazo, con el objetivo de emplear medicamentos que mantengan el control de la enfermedad en la madre y que se consideren seguros para el feto.
La gota es una enfermedad debida a la formación y la precipitación de cristales de urato en las articulaciones o en los tejidos blandos. Los estudios epidemiológicos han confirmado que es una enfermedad infrecuente en las mujeres (prevalencia del 0,04-5%)1,2 y, generalmente, ocurre después de la menopausia. Es una enfermedad rara en mujeres en edad fértil, su incidencia entre los 25 y 44 años es de 1,6 casos por 10.000 pacientes año (IC del 95% 1,1-2,1)3. Los estudios sobre el efecto de la gota en el embarazo son escasos y en su mayoría son reportes de casos. Debido a la escasez de casos para su estudio se desconocen muchos aspectos de la interrelación de esta asociación y de cuál es el tratamiento óptimo de esta enfermedad en el embarazo. Nuestro objetivo es describir las características clínicas, la evolución y el tratamiento de la gota durante el embarazo y el puerperio, mediante la presentación de un caso de nuestra institución, más 22 embarazos publicados.
Pacientes y métodosSe realizó el reporte de un caso de nuestra institución, junto con una revisión sistemática en las bases de datos: PubMed, Lilacs, Ebsco y Embase, desde su origen hasta agosto de 2016. La estrategia de búsqueda incluyó las palabras clave: «gout», «premenopause» «pregnancy», «hyperuricemia», «women», «female», «gouty arthritis», «gouty nephropathy». Se restringió la búsqueda a artículos publicados en inglés y español. Las publicaciones fueron consideradas como la fuente de información primaria; sin embargo, se buscaron referencias adicionales en las referencias bibliográficas de los artículos seleccionados y de la literatura gris sobre este tema.
El proceso de selección se realizó en 2 fases: la primera se aplicó a los títulos y resúmenes; la segunda fase se aplicó a los textos completos. Las publicaciones que no se podían excluir sobre la base del título y el resumen se incluyeron para la revisión de texto completo. Se incluyeron las publicaciones en las cuales los pacientes cumplían la definición de gota de acuerdo con los criterios de la Asociación Americana de Reumatología y que contaran con la descripción de su seguimiento durante el embarazo.
De cada publicación se obtuvo: edad, número de embarazos, la presencia o ausencia de ataque agudo de gota durante el embarazo, el tratamiento empleado durante el embarazo y el puerperio, comorbilidades y el desenlace materno-fetal. Los desenlaces maternos evaluados fueron: el parto por cesárea, inducción del parto, hipertensión gestacional o preeclampsia, hemorragia durante el embarazo o posparto y uremia posparto. Los desenlaces fetales incluyeron: parto pretérmino (< 37 semanas de gestación [SDG]), retraso del crecimiento intrauterino, anomalías congénitas y la mortalidad perinatal. Cada embarazo fue considerado como una unidad de análisis. Los resultados obtenidos se presentan en forma del número absoluto de casos y su porcentaje (n [%]), y la media ± desviación estándar (valor mínimo-valor máximo).
ResultadosMujer de 30 años a la cual se conocía sana hasta el inicio de su primer embarazo. A las 13 SDG inició de forma súbita artritis del tobillo izquierdo y limitación para caminar, la cual fue tratada con paracetamol 1,5g/día y cedió en un lapso de 2 semanas. A las 15 SDG presentó de forma súbita artritis del tobillo derecho e hiperuricemia (9,1mg/dl), se trató con paracetamol 1,5g/día y alopurinol 300mg/día.
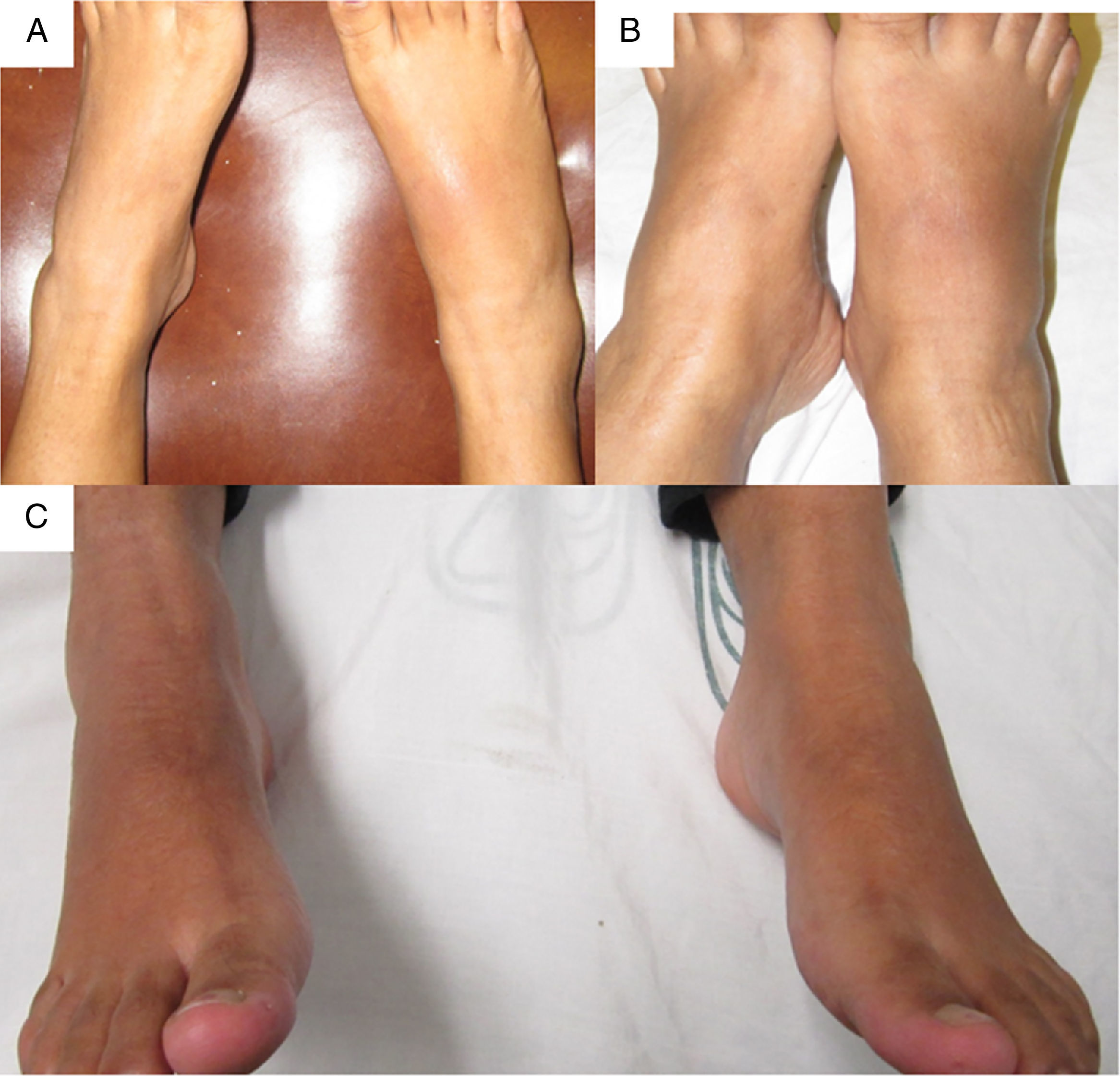
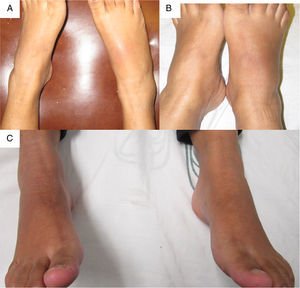
Fue referida a las 17 SDG a la consulta de reumatología por persistir con la artritis del tobillo. En su valoración inicial, negó cuadros previos de dolor articular/artritis o tener conocimiento de las alteraciones en la función renal; su padre padecía gota. En el examen físico se documentó dificultad para caminar, artritis del tobillo derecho, inflamación y eritema del tarso derecho con dolor intenso a la movilización (fig. 1A); ausencia de tofos; no presentaba afección de manos, carpos ni codos, y su índice de masa corporal fue de 22. En los estudios de laboratorio (tabla 1) destacaban: anemia leve (hemoglobina 10,4g/dl), leve elevación de la creatinina (1,2mg/dl), factor reumatoide negativo e hiperuricemia de 9,1mg/dl. Se indicó reposo, aplicación de hielo en la región afectada y se inició tratamiento con prednisona (1mg/kg/día) y paracetamol 2g/día por una semana; el alopurinol se interrumpió por el riesgo de teratogenicidad. A las 20 SDG persistía con dolor intenso a nivel del tobillo derecho (fig. 1 B), por lo cual se infiltraron 4mg de dexametasona intraarticular con resolución de los síntomas (fig. 1 C); en la ecografía renal se reportaron riñones de tamaño disminuido, ausencia de quistes o litos.
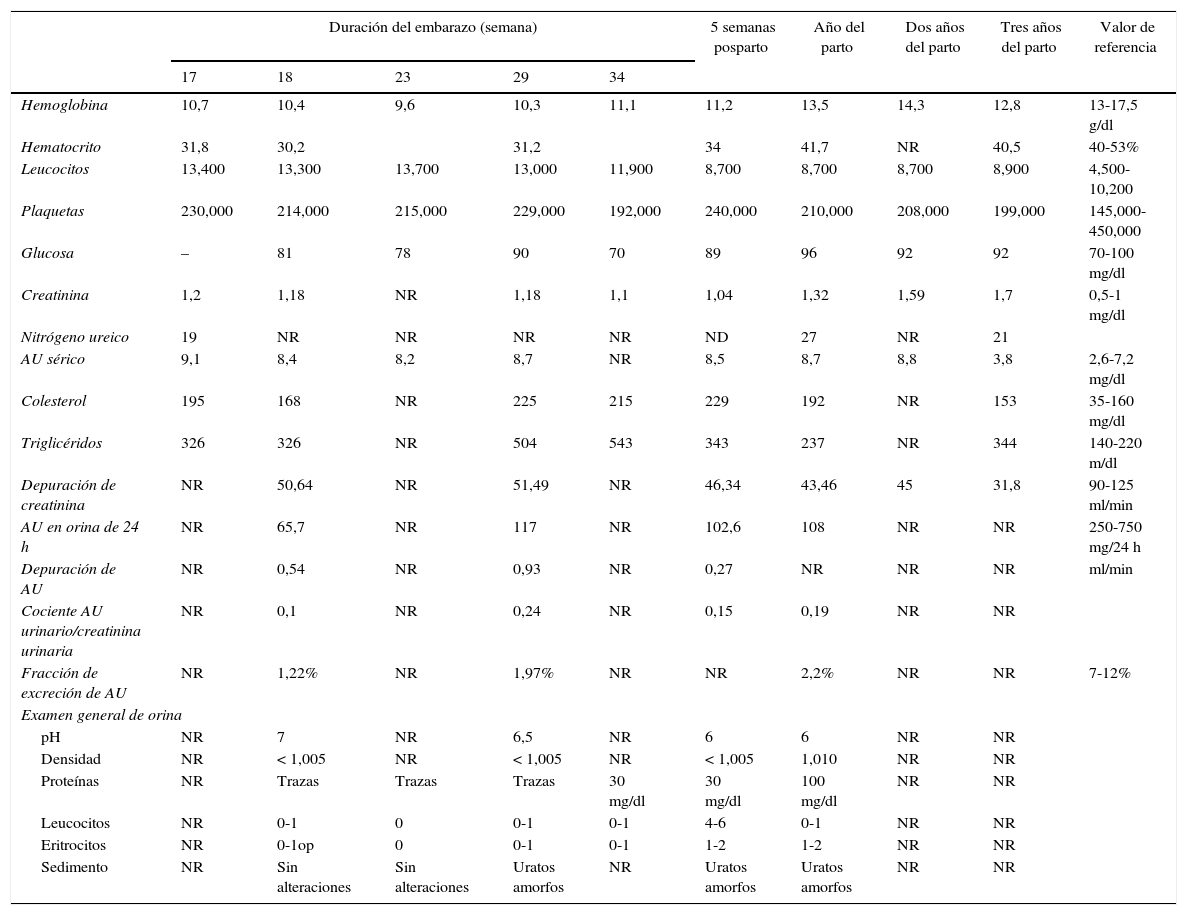
Resultados de laboratorio durante y después del embarazo del caso presentado
| Duración del embarazo (semana) | 5 semanas posparto | Año del parto | Dos años del parto | Tres años del parto | Valor de referencia | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 17 | 18 | 23 | 29 | 34 | ||||||
| Hemoglobina | 10,7 | 10,4 | 9,6 | 10,3 | 11,1 | 11,2 | 13,5 | 14,3 | 12,8 | 13-17,5 g/dl |
| Hematocrito | 31,8 | 30,2 | 31,2 | 34 | 41,7 | NR | 40,5 | 40-53% | ||
| Leucocitos | 13,400 | 13,300 | 13,700 | 13,000 | 11,900 | 8,700 | 8,700 | 8,700 | 8,900 | 4,500-10,200 |
| Plaquetas | 230,000 | 214,000 | 215,000 | 229,000 | 192,000 | 240,000 | 210,000 | 208,000 | 199,000 | 145,000-450,000 |
| Glucosa | – | 81 | 78 | 90 | 70 | 89 | 96 | 92 | 92 | 70-100 mg/dl |
| Creatinina | 1,2 | 1,18 | NR | 1,18 | 1,1 | 1,04 | 1,32 | 1,59 | 1,7 | 0,5-1 mg/dl |
| Nitrógeno ureico | 19 | NR | NR | NR | NR | ND | 27 | NR | 21 | |
| AU sérico | 9,1 | 8,4 | 8,2 | 8,7 | NR | 8,5 | 8,7 | 8,8 | 3,8 | 2,6-7,2 mg/dl |
| Colesterol | 195 | 168 | NR | 225 | 215 | 229 | 192 | NR | 153 | 35-160 mg/dl |
| Triglicéridos | 326 | 326 | NR | 504 | 543 | 343 | 237 | NR | 344 | 140-220 m/dl |
| Depuración de creatinina | NR | 50,64 | NR | 51,49 | NR | 46,34 | 43,46 | 45 | 31,8 | 90-125 ml/min |
| AU en orina de 24 h | NR | 65,7 | NR | 117 | NR | 102,6 | 108 | NR | NR | 250-750 mg/24 h |
| Depuración de AU | NR | 0,54 | NR | 0,93 | NR | 0,27 | NR | NR | NR | ml/min |
| Cociente AU urinario/creatinina urinaria | NR | 0,1 | NR | 0,24 | NR | 0,15 | 0,19 | NR | NR | |
| Fracción de excreción de AU | NR | 1,22% | NR | 1,97% | NR | NR | 2,2% | NR | NR | 7-12% |
| Examen general de orina | ||||||||||
| pH | NR | 7 | NR | 6,5 | NR | 6 | 6 | NR | NR | |
| Densidad | NR | < 1,005 | NR | < 1,005 | NR | < 1,005 | 1,010 | NR | NR | |
| Proteínas | NR | Trazas | Trazas | Trazas | 30 mg/dl | 30 mg/dl | 100 mg/dl | NR | NR | |
| Leucocitos | NR | 0-1 | 0 | 0-1 | 0-1 | 4-6 | 0-1 | NR | NR | |
| Eritrocitos | NR | 0-1op | 0 | 0-1 | 0-1 | 1-2 | 1-2 | NR | NR | |
| Sedimento | NR | Sin alteraciones | Sin alteraciones | Uratos amorfos | NR | Uratos amorfos | Uratos amorfos | NR | NR | |
AU: ácido úrico; NR: no reportado.
A las 23 SDG presentó artritis del tobillo izquierdo; en el uroanálisis se documentó indicios de proteínas; fue tratada con 80mg de acetato de metilprednisolona intramuscular en dosis única y se inició colchicina 1mg/día, ibuprofeno 200mg cada 6 h por razón necesaria y prednisona 10mg/día, con lo cual se logró la remisión de la artritis. Por recomendación del médico ginecoobstetra suspendió la prednisona y colchicina a las 34 SDG. A las 37,3 SDG por vía cesárea se obtuvo un recién nacido masculino de 2.900g, talla 48cm, Apgar 9/9, test Silverman-Anderson 0. A las 24 h después del parto, la madre presentó artritis en el tobillo derecho, que se trató con ketorolaco 30mg por vía intravenosa cada 8 h, con mejoría sintomática y continuó con prednisona 5mg/día. A las 3 semanas posparto refirió mejoría de los síntomas articulares, la radiografía simple de pies sin alteraciones; se reinició colchicina 1mg/día y alopurinol 300mg/día con evolución clínica favorable. En el primer año posterior al parto presentó 3 ataques agudos de gota asociados a incumplimiento terapéutico. El hijo se encontró clínicamente saludable a los 3 años de seguimiento.
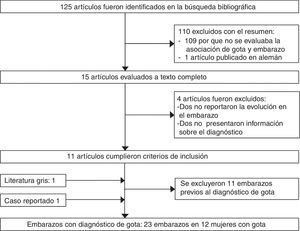
En la revisión bibliográfica se identificaron 125 publicaciones potencialmente relevantes. Se excluyeron 110 publicaciones con la revisión del título y el resumen, 11 artículos fueron seleccionados con la revisión del texto, así como un artículo identificado de la literatura gris (fig. 2).
Se documentaron 34 embarazos publicados en 12 mujeres (fig. 2), el caso de una paciente fue publicado por 2 autores, por lo que se describen ambas publicaciones en forma conjunta (Weingold4 publicó la evolución de los primeros 7 embarazos y Batt et al.5 publicaron los últimos 3 embarazos). Seis mujeres tuvieron únicamente un embarazo, 3 tuvieron 2 embarazos, 2 tuvieron 6 y una mujer tuvo 10 embarazos. Once embarazos ocurrieron en 5 pacientes antes del diagnóstico de la gota y 23 embarazos se produjeron en 12 pacientes con el diagnóstico de gota establecido (tabla 2). La tasa de supervivencia fetal (81,8% vs. 69,5%) fue mayor previo al diagnóstico de gota (tabla 3). En 8 mujeres se diagnosticó gota primaria y en 4 casos se consideró una causa secundaria (síndrome de seudo-Bartter6, un caso con sospecha de la enfermedad de von Gierke7, un caso con nefropatía hiperuricémica juvenil familiar8 y en otro caso no se concluyó una etiología9).
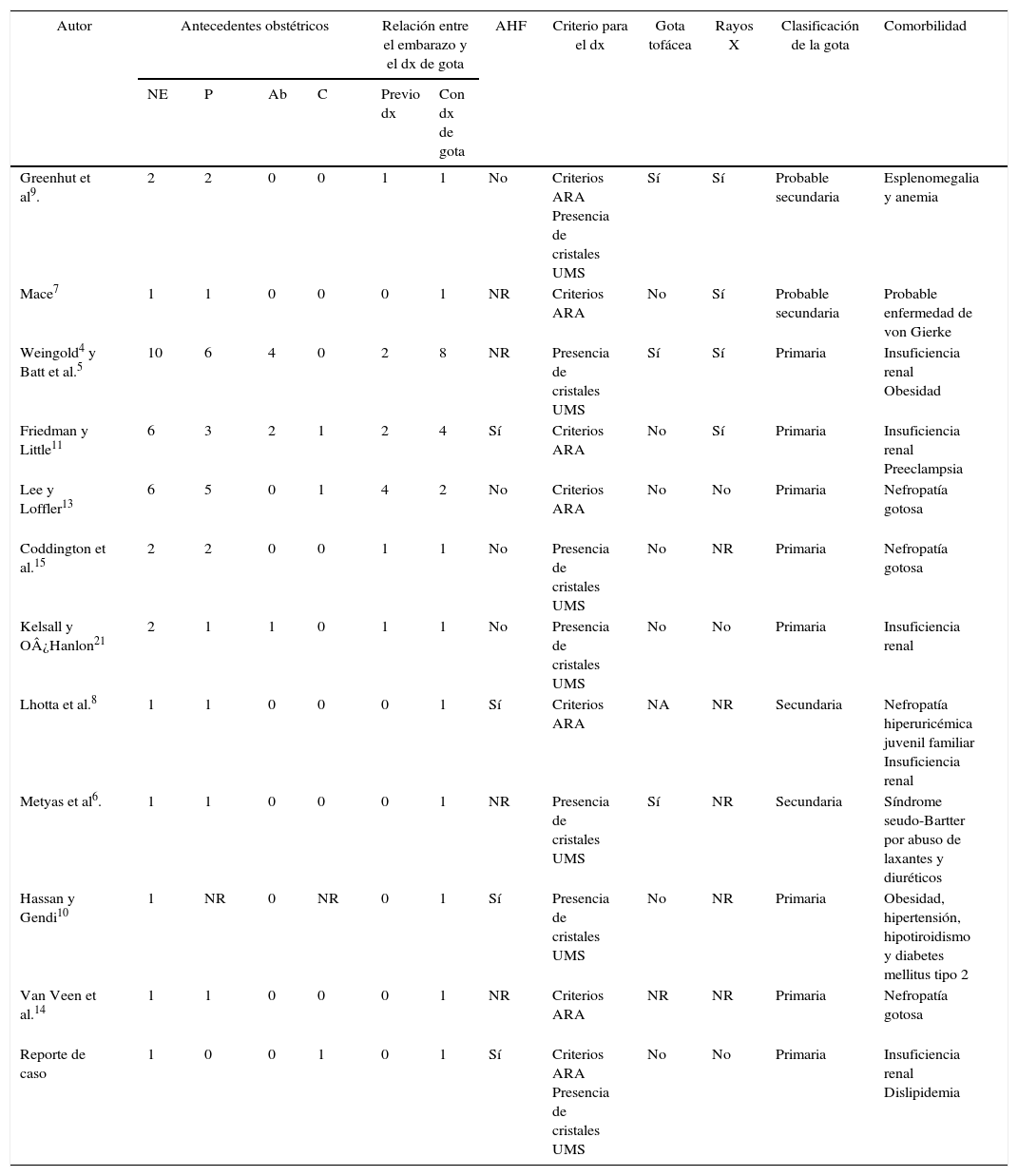
Características y desenlaces de los embarazos en mujeres con diagnóstico de gota
| Autor | Antecedentes obstétricos | Relación entre el embarazo y el dx de gota | AHF | Criterio para el dx | Gota tofácea | Rayos X | Clasificación de la gota | Comorbilidad | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NE | P | Ab | C | Previo dx | Con dx de gota | |||||||
| Greenhut et al9. | 2 | 2 | 0 | 0 | 1 | 1 | No | Criterios ARA Presencia de cristales UMS | Sí | Sí | Probable secundaria | Esplenomegalia y anemia |
| Mace7 | 1 | 1 | 0 | 0 | 0 | 1 | NR | Criterios ARA | No | Sí | Probable secundaria | Probable enfermedad de von Gierke |
| Weingold4 y Batt et al.5 | 10 | 6 | 4 | 0 | 2 | 8 | NR | Presencia de cristales UMS | Sí | Sí | Primaria | Insuficiencia renal Obesidad |
| Friedman y Little11 | 6 | 3 | 2 | 1 | 2 | 4 | Sí | Criterios ARA | No | Sí | Primaria | Insuficiencia renal Preeclampsia |
| Lee y Loffler13 | 6 | 5 | 0 | 1 | 4 | 2 | No | Criterios ARA | No | No | Primaria | Nefropatía gotosa |
| Coddington et al.15 | 2 | 2 | 0 | 0 | 1 | 1 | No | Presencia de cristales UMS | No | NR | Primaria | Nefropatía gotosa |
| Kelsall y O¿Hanlon21 | 2 | 1 | 1 | 0 | 1 | 1 | No | Presencia de cristales UMS | No | No | Primaria | Insuficiencia renal |
| Lhotta et al.8 | 1 | 1 | 0 | 0 | 0 | 1 | Sí | Criterios ARA | NA | NR | Secundaria | Nefropatía hiperuricémica juvenil familiar Insuficiencia renal |
| Metyas et al6. | 1 | 1 | 0 | 0 | 0 | 1 | NR | Presencia de cristales UMS | Sí | NR | Secundaria | Síndrome seudo-Bartter por abuso de laxantes y diuréticos |
| Hassan y Gendi10 | 1 | NR | 0 | NR | 0 | 1 | Sí | Presencia de cristales UMS | No | NR | Primaria | Obesidad, hipertensión, hipotiroidismo y diabetes mellitus tipo 2 |
| Van Veen et al.14 | 1 | 1 | 0 | 0 | 0 | 1 | NR | Criterios ARA | NR | NR | Primaria | Nefropatía gotosa |
| Reporte de caso | 1 | 0 | 0 | 1 | 0 | 1 | Sí | Criterios ARA Presencia de cristales UMS | No | No | Primaria | Insuficiencia renal Dislipidemia |
Ab: número de abortos; AHF: antecedentes familiares de gota; ARA: American Rheumatism Association; C: número de cesáreas; dx: diagnóstico; NP: número de embarazos; NR: no reportado; P: número de partos; UMS: urato monosódico.
Desenlace de los embarazos de acuerdo con la relación con el diagnóstico de gota
| Previo al diagnóstico n (%) | Durante o después del diagnóstico n (%) | Total n (%) | |
|---|---|---|---|
| Abortos | 2 (18,2) | 5 (21,7) | 7 (20,58) |
| Partos | 9 (81,8) | 14 (60,86) | 23 (67,64) |
| Cesárea | 0 | 2 (8,69) | 2 (5,88) |
| Interrupción del embarazo | 0 | 1 (4,34) | 1 (2,94) |
| No reportado | 0 | 1 (4,34) | 1 (2,94) |
| Total | 11 (100) | 23 (100) | 34 (100) |
Debido a que es conocido que los desenlaces del embarazo antes y después del diagnóstico de las enfermedades reumáticas están asociados con diferentes resultados, en el análisis se excluyeron los embarazos que ocurrieron previos al diagnóstico de gota, para evaluar el efecto de la enfermedad en el embarazo. Se describen 23 embarazos, los cuales resultaron en 16 (69,5%) nacidos vivos, 5 (21,7%) abortos, un (4,3%) aborto terapéutico y en un caso (4,3%) no se describió su desenlace (tabla 3). La edad media en el momento del embarazo fue de 30,6 ± 3,69 años (mínimo 23, máximo 37), en 4 casos existió el antecedente heredofamiliar de gota. De los resultados de laboratorio disponibles (anexo, material suplementario): la media del ácido úrico (AU) fue 9,18 ± 1,6mg/dl (6,5-12), hemoglobina 10,35 ± 1,6g/dl (9-13,9), depuración de creatinina 36,8 ± 15,2ml/min (17-63), nitrógeno ureico en sangre 46,48 ± 26,1mg/dl (12-96) y la velocidad de sedimentación globular de 37 ± 16mm/h (24-55).
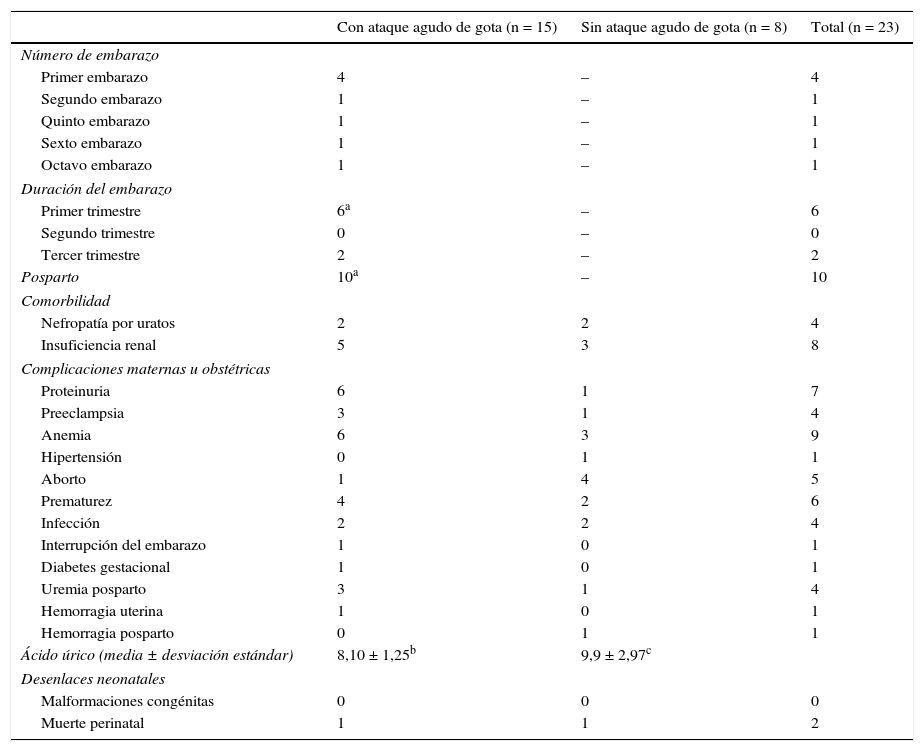
En 2 mujeres la artritis durante el embarazo fue la manifestación inicial de la gota. En 8 embarazos se presentó un ataque agudo de gota entre las 7 SDG hasta una semana antes del parto; en 4 casos la artritis gotosa ocurrió durante el primer embarazo. En 10 embarazos se presentó la exacerbación de la artritis en el posparto en un lapso entre las 18 h y los 11 meses después del parto. En las mujeres que presentaron ataque agudo de gota durante el embarazo fue más frecuente la presencia de proteinuria, hipertensión y uremia posparto (tabla 4). No se reportaron muertes maternas ni malformaciones fetales. Una paciente presentó 2 muertes neonatales4; en su cuarto embarazo, el recién nacido obtenido mediante parto pélvico falleció a las 15 h por hipoxia neonatal y hemorragia subaracnoidea; y en el séptimo embarazo, el neonato falleció a los 4 días por dificultad respiratoria asociada a la enfermedad de membrana hialina4.
Desenlaces maternos-fetales de 23 embarazos en mujeres con gota clasificados según la presencia/ausencia de ataque agudo de gota durante el embarazo o puerperio
| Con ataque agudo de gota (n = 15) | Sin ataque agudo de gota (n = 8) | Total (n = 23) | |
|---|---|---|---|
| Número de embarazo | |||
| Primer embarazo | 4 | – | 4 |
| Segundo embarazo | 1 | – | 1 |
| Quinto embarazo | 1 | – | 1 |
| Sexto embarazo | 1 | – | 1 |
| Octavo embarazo | 1 | – | 1 |
| Duración del embarazo | |||
| Primer trimestre | 6a | – | 6 |
| Segundo trimestre | 0 | – | 0 |
| Tercer trimestre | 2 | – | 2 |
| Posparto | 10a | – | 10 |
| Comorbilidad | |||
| Nefropatía por uratos | 2 | 2 | 4 |
| Insuficiencia renal | 5 | 3 | 8 |
| Complicaciones maternas u obstétricas | |||
| Proteinuria | 6 | 1 | 7 |
| Preeclampsia | 3 | 1 | 4 |
| Anemia | 6 | 3 | 9 |
| Hipertensión | 0 | 1 | 1 |
| Aborto | 1 | 4 | 5 |
| Prematurez | 4 | 2 | 6 |
| Infección | 2 | 2 | 4 |
| Interrupción del embarazo | 1 | 0 | 1 |
| Diabetes gestacional | 1 | 0 | 1 |
| Uremia posparto | 3 | 1 | 4 |
| Hemorragia uterina | 1 | 0 | 1 |
| Hemorragia posparto | 0 | 1 | 1 |
| Ácido úrico (media ± desviación estándar) | 8,10 ± 1,25b | 9,9 ± 2,97c | |
| Desenlaces neonatales | |||
| Malformaciones congénitas | 0 | 0 | 0 |
| Muerte perinatal | 1 | 1 | 2 |
En los embarazos que terminaron en aborto se observó una notable ausencia de artritis gotosa al término del embarazo. Cinco abortos ocurrieron de forma espontánea entre los 2 y 5 meses de gestación, y solamente en un caso se presentó ataque de gota durante el embarazo. Sin embargo, no se contó con información disponible de la evolución o los estudios de laboratorio durante estos embarazos.
No se siguió un tratamiento como estándar en los casos descritos; en algunos casos incluso no se empleó ningún tratamiento durante el embarazo. En los casos en los cuales se prescribió tratamiento, los medicamentos más comúnmente empleados fueron la colchicina (n =7 [27%]) y el probenecid (n = 7 [27%]). En 3 casos se empleó el alopurinol durante el embarazo (anexo, material suplementario), sin inducir malformaciones fetales.
La asociación de gota y embarazo se relacionó con complicaciones maternas: insuficiencia renal (n = 8 [34,7%]), preeclampsia (n =4 [17,3%]), prematurez (n = 6 [26%]), infección (n = 4 [17,3%]), anemia (n = 9 [39,1%]), hemorragia obstétrica (n = 2 [8,6%]) y la uremia posparto (n = 4 [17,3%]). En 6 embarazos fue necesaria una hemotransfusión. Dos casos presentaron insuficiencia renal aguda; en un caso se consideró asociada a nefropatía por uratos complicada por preeclampsia severa y en el otro caso fue secundaria a una nefropatía perdedora de sal10. En 6 embarazos fue necesaria la inducción del parto (26,08%) debido a las complicaciones maternas. En un caso fue necesaria una cesárea debido al fracaso de la inducción del parto. Un embarazo fue concebido como resultado del fallo de la anticoncepción y por el antecedente de complicaciones potencialmente fatales en el embarazo previo, y por la presencia de la exacerbación de la artritis durante las primeras 8 SDG se indicó aborto terapéutico a las 11 SDG con realización de histerectomía. Esta misma paciente presentó artritis gotosa tras la interrupción del embarazo11.
DiscusiónA diferencia de otras enfermedades reumáticas, pocos trabajos se han enfocado en la evaluación de la gota durante el embarazo. El caso descrito presentó una manifestación inicial rara ya que su primer cuadro de artritis fue durante su primer embarazo, con múltiples recaídas durante la gestación pero con respuesta a la combinación de glucocorticoides y colchicina. En nuestra paciente no se encontró una causa secundaria de la gota, el cociente AU urinario/creatinina urinaria < 1 no apoya la hiperproducción de AU ni que la afección renal esté asociada a una nefropatía aguda por uratos. La hiperuricemia con una baja fracción excretada de AU indica hiperuricemia asociada a la insuficiencia renal.
La hiperuricemia durante el embarazo es una alteración inespecífica, es mucho más común durante el embarazo que la gota. Las principales causas incluyen: preeclampsia, insuficiencia renal, deshidratación severa, hígado graso agudo del embarazo, toxinas y alcoholismo. La hiperuricemia es un requisito previo, pero por sí sola no es suficiente para la aparición de la artritis gotosa. Es necesario que junto a la hiperuricemia se presenten otros factores, entre los que destacan: predisposición genética, obesidad, uso de diuréticos, cirugías y la insuficiencia renal crónica. A pesar de que la herencia se ha implicado fuertemente en pacientes premenopáusicas con gota12, únicamente en 4 mujeres se documentó un antecedente heredofamiliar.
Los complejos cambios adaptativos que se producen durante el embarazo pueden producir un cuadro clínico variable de la gota. Lee y Loeffler informaron una influencia benéfica del embarazo sobre los síntomas articulares13. Weingold4 reportó el caso de una paciente que permaneció libre de síntomas sin tratamiento durante 2 embarazos, pero con exacerbación de la artritis en el posparto. Las hipótesis propuestas para explicar la mayor frecuencia de la artritis en el posparto más que durante el embarazo fueron: los altos niveles de estrógenos durante el embarazo protegen a la madre contra un ataque agudo de gota13,14; al aumento de la producción de AU relacionado con la hematopoyesis después de una hemorragia en el parto o posparto; al proceso de reabsorción de los tejidos hipertrofiados; el trauma de tejidos, y el excesivo catabolismo proteico4,15. Estas observaciones generaron interés sobre la influencia del embarazo en los niveles de AU. Durante el embarazo normalmente los niveles de AU disminuyen, por el incremento de su excreción urinaria, haciendo menos probable un ataque de gota. Esto se debe a las adaptaciones fisiológicas del embarazo, incluyendo: hemodilución, hiperperfusión renal debido al aumento del volumen plasmático, aumento de la tasa de filtración glomerular del 30 al 50% en el primer trimestre, la cual se mantiene hasta la semana 36. La concentración media estimada de AU durante el primer trimestre es de 2,72 ± 0,62mg/dl, en el segundo trimestre de 2,60 ± 0,54mg/dl y durante el tercer trimestre alcanza los valores de la mujer no embarazada (4-6mg/dl)16,17.
Además, se ha reportado que durante el primer embarazo pueden aumentar los niveles séricos de AU18; en esta serie, la mayor parte de los casos descritos de artritis gotosa se presentaron durante el primer embarazo. Los factores de riesgo maternos descritos en la hiperuricemia durante el embarazo en mujeres normotensas incluyen: ser primigesta, una menor edad materna, un aumento de peso excesivo y la disminución de la tasa de filtración glomerular18. Los mecanismos por los cuales se produce hiperuricemia en el primer embarazo permanecen desconocidos.
En la mayoría de los casos incluidos las comorbilidades podrían haber favorecido el desarrollo de la artritis gotosa, especialmente la insuficiencia renal. Los riñones desempeñan un papel importante en la regulación de los niveles séricos de AU y el grado de insuficiencia renal es un factor de riesgo independiente para el desarrollo de gota19. El mecanismo más comúnmente implicado en la hiperuricemia es una alteración de la excreción renal del AU, debido a la reducción de la filtración glomerular, el aumento de la resorción tubular o la disminución de la secreción tubular de AU20. Considerando que la mayoría de los casos (7 de los 8 casos) con ataque agudo de gota durante el embarazo se presentaron en mujeres con insuficiencia renal crónica y que la exacerbación de la artritis en el posparto fue más frecuente en las pacientes con uremia posparto5, la insuficiencia renal fue un factor importante en el desarrollo de la artritis durante el embarazo y el puerperio. Esto puede ser debido a que la disminución en la tasa de filtración glomerular puede favorecer un incremento en los niveles séricos del AU y que estas fluctuaciones son las que desencadenan la artritis. En este sentido, Batt et al.5 demostraron que el mantenimiento de la función renal junto con el tratamiento con colchicina y probenecid evitó la exacerbación en el posparto.
La preeclampsia per se es asociada a hiperuricemia, lo cual puede contribuir al incrementó del AU durante el embarazo. La hiperuricemia relacionada con la preeclampsia puede ser debida a una reducción en la eliminación renal de uratos, al aumento de su reabsorción en el túbulo proximal, daño renal asociado a la hipertensión y a la hiperactividad de la enzima xantina oxidasa en la placenta16,17. Así mismo, la hiperuricemia materna es uno de los factores predictivos de la gravedad de la preeclampsia. Las complicaciones potencialmente fatales en los casos descritos fueron debidas a una insuficiencia renal aguda5,11; en estas 2 pacientes la preeclampsia fue notable, con una recuperación de los niveles de función renal previos al embarazo y una mejoría clínica rápida en el posparto, por lo que estas complicaciones fueron asociadas más a la preeclampsia superpuesta que a la nefropatía gotosa.
Las mujeres con gota previa al embarazo son propensas a un ataque agudo de gota durante el embarazo o el puerperio, a menos que se realicen medidas preventivas. La forma de presentación de la artritis gotosa en el embarazo o el puerperio ha cambiado con el tiempo, probablemente debido a las mejoras en la atención médica. En las publicaciones previas a los 90, la mayoría de los casos de artritis se presentaron durante el posparto y solo en 2 de los 17 embarazos se presentó un ataque agudo durante el embarazo, lo que inicialmente indicó que el embarazo podría tener una influencia favorable al disminuir los síntomas articulares. Por el contrario, en los casos publicados después de los 90 la mayoría de los casos se presentaron durante el embarazo y en ningún caso en el posparto. En nuestro caso, la paciente presentó artritis en el posparto debido a la suspensión del tratamiento establecido durante el embarazo.
El tratamiento de la gota durante el embarazo y el puerperio puede ser un reto para el médico debido a que existe información limitada sobre la seguridad de los medicamentos normalmente empleados en su tratamiento y a la presencia de comorbilidades que pueden influir en la toma de las decisiones terapéuticas. En general, el tratamiento de la gota durante el embarazo debe estar enfocado en la vigilancia y el mantenimiento de la función renal, la evaluación y el tratamiento de las comorbilidades, la prevención del ataque agudo y en el tratamiento de las exacerbaciones de gota si se presentan durante el embarazo o el puerperio. Dado que es aconsejable evitar el uso de medicamentos, es recomendable el uso de las medidas no farmacológicas: reposo, aplicar hielo en la articulación afectada, dieta saludable y mantener una adecuada hidratación. En ninguno de los casos publicados existió evidencia de la recomendación de las medidas no farmacológicas.
Si es necesario un tratamiento farmacológico, se deberá evaluar el medicamento de acuerdo con las indicaciones y comorbilidades de la paciente, así como a la relación riesgo/beneficio. La exposición no intencional a los fármacos puede ocurrir fácilmente en casos de embarazos no planeados y los pacientes y sus médicos requerirán información sobre el uso de los medicamentos durante el embarazo. La mayoría de los fármacos empleados en el tratamiento de la gota están clasificados en la categoría C de la Food and Drugs Administration (FDA) para su uso en el embarazo. En los casos descritos no hubo evidencia de efectos tóxicos materno-fetales de la colchicina, el probenecid, el alopurinol y los glucocorticoides.
El tratamiento farmacológico de la gota se divide en 2 categorías principales: los medicamentos para el alivio sintomático durante un ataque agudo de gota y los medicamentos para disminuir los niveles de AU. Los principales agentes terapéuticos para el tratamiento de ataques agudos son: los antiinflamatorios no esteroideos (AINE), los glucocorticoides y la colchicina.
A pesar de que los AINE son considerados de primera línea para el tratamiento del ataque agudo de gota, únicamente en 3 casos fueron empleados (aspirina13, indometacina21 e ibuprofeno en el reporte actual). Su uso durante el embarazo puede inducir eventos adversos materno-fetales. Hay datos contradictorios sobre si los AINE aumentan el riesgo de aborto, lo que indica que deben utilizarse con precaución en los primeros 2 trimestres y no deben ser prescritos después de 30 SDG por el riesgo de cierre prematuro del conducto arterioso22,23. De los AINE, aunque no exentos de riesgos, el ibuprofeno y el naproxeno no parecen ser teratogénicos durante el primer trimestre (categoría B de la FDA)24. Algunos autores han indicado que el ibuprofeno es el medicamento de elección en los casos de ataques de gota durante el embarazo25,26.
La colchicina es considerada un fármaco de primera elección en la profilaxis de la artritis gotosa, pero de segunda elección en el tratamiento del ataque agudo de gota. La colchicina fue empleada tanto para el tratamiento del ataque agudo de gota como para su profilaxis en los casos estudiados. La mayor experiencia de su uso durante el embarazo proviene de las mujeres tratadas de fiebre mediterránea familiar y enfermedad de Behçet, donde los resultados indican que su administración antes o durante el embarazo no se asocia a resultados adversos26-28. En el contexto de la mujeres embarazadas, la indicación de colchicina puede ser recomendable en dosis de 1,2-1,5mg/día una semana antes del parto para prevenir la exacerbación en el posparto y se recomienda mantenerla durante el puerperio5,6. En las mujeres con insuficiencia renal crónica se debe emplear en dosis menores, por el riesgo de presentar eventos adversos neuromusculares. En general, en los sujetos con tasa de filtración glomerular ≤ 30ml/min se recomienda iniciar con una dosis de 0,3mg/día y en los casos con una tasa de filtración glomerular ≥ 30ml/min no se requiere ajuste de la dosis29.
En pacientes con insuficiencia renal, los fármacos de elección para el tratamiento del ataque agudo de gota son los glucocorticoides, especialmente en pacientes con contraindicaciones para los AINE y colchicina. La prednisona, la prednisolona y la metilprednisolona no atraviesan la barrera placentaria, y no se han descrito efectos graves cuando son usados en dosis ≤ 30mg de prednisona o su equivalente durante el embarazo30. Las inyecciones intraarticulares de glucocorticoides son recomendadas en los casos de artritis de 1 o 2 articulaciones29. En nuestro caso, y en un caso publicado6, la infiltración intraarticular logró la remisión de la artritis.
Para el tratamiento de la hiperuricemia, el probenecid 0,5g 3 veces al día es el fármaco de elección para la disminución del AU; los datos disponibles no indican ninguna evidencia de efectos teratogénicos cuando se usa en el embarazo (categoría B de la FDA)25,31. El probenecid se metaboliza por vía hepática y se excreta principalmente en la orina. En sujetos con insuficiencia renal leve (filtración glomerular ≥ 50ml/min) no es necesario el ajuste de dosis, pero en pacientes con una filtración glomerular ≤ 30ml/min no es eficaz y debe evitarse29,31. Debido a que el alopurinol es estructuralmente similar a las xantinas, existe teóricamente la posibilidad de que se incorpore a los ácidos nucleicos del embrión. En los casos descritos el alopurinol se utilizó durante el embarazo en 2 casos14,15 y durante el primer trimestre en otros 2, sin reportarse efectos adversos. Sin embargo, es conocida la posible teratogenicidad del alopurinol32 y se recomienda evitar su uso, en especial, en el primer trimestre. La administración de alopurinol no justifica la interrupción del embarazo, pero el tratamiento se debe cambiar a probenecid y es recomendable una evaluación ecográfica fetal detallada25,26. Existe información limitada del uso del febuxostat durante el embarazo en humanos y, actualmente, se considera contraindicado su uso.
Las limitaciones inherentes a la calidad de los datos que se pueden derivar de estudios retrospectivos constituyen la principal limitación de este estudio. La gota en el embarazo es una condición poco común y las publicaciones se basan en reporte de casos con datos limitados para su comparación, las diferencias en el tiempo de evaluación de las publicaciones hacen difícil la generalización (nivel de evidencia: iii33). En cuanto al resultado de los embarazos se debe mencionar que 6 de las 12 publicaciones incluidas fueron publicadas entre los años 1950 y 1960, un período con una mayor morbilidad obstétrica que en la actualidad. Del mismo modo que no se puede descartar un sesgo de publicación, ya que los artículos publicados recientemente incluyen solo a las pacientes con ataque agudo de gota durante el embarazo. No hay recomendaciones basadas en la evidencia para el tratamiento de la gota en el embarazo y el puerperio. Las recomendaciones de este estudio se basan en la información disponible (grado de recomendación: C33).
En nuestro mejor conocimiento, esta es la primera revisión sistemática que evalúa la asociación de la gota y el embarazo. Una declaración definitiva acerca de la interacción potencial de la gota y el embarazo no se puede hacer sobre la base de los casos citados. Se necesitan más estudios para confirmar el efecto de la gota en el embarazo. Sobre la base de lo descrito anteriormente, el tratamiento de elección para los ataques agudos de gota durante el embarazo serían el ibuprofeno o naproxeno, y en pacientes con insuficiencia renal crónica los glucocorticoides, para el tratamiento de la hiperuricemia el probenecid, y la colchicina para prevenir ataques agudos de gota durante el embarazo o después del parto.
Finalmente, podemos concluir que la gota es una enfermedad rara en las mujeres en edad reproductiva. Sin embargo, debe constituir un diagnóstico diferencial de la artritis en las mujeres embarazadas. Una relación concluyente entre la gota y las complicaciones durante el embarazo no puede establecerse debido al número limitado de casos disponibles; los datos limitados sobre los casos descritos y las diferencias en el tiempo de evaluación de las publicaciones, hacen difícil su generalización. Mientras que la mayoría de las mujeres con gota tienen recién nacidos sanos, las madres están en mayor riesgo de presentar complicaciones, lo que indica que el embarazo debe ser vigilado estrechamente.
Aspectos éticosSe obtuvo el consentimiento escrito de la paciente para la publicación de este informe de caso. El manuscrito no contiene estudios clínicos ni datos que pudieran identificar a la paciente.
Conflicto de interesesLos autores no tienen conflictos de interés que declarar.