El síndrome antifosfolipídico (SAF) se caracteriza por la presencia de trombosis y enfermedad obstétrica. Para su clasificación, se precisa cumplir criterios clínicos y serológicos, no siempre presentes en todos los pacientes.
ObjetivosAnalizar la validez diagnóstica de los criterios clasificatorios de SAF publicados en 2023 por la American College of Rheumatology (ACR) junto a la European Alliance of Associations for Rheumatology (EULAR) y comparar con los criterios de Sídney de 2006 en las gestantes de nuestra unidad con sospecha de SAF.
Material y métodosEstudio observacional retrospectivo de cohortes basado en el seguimiento de 754 gestaciones por la Unidad de Enfermedades Autoinmunes del Servicio de Medicina Interna del Hospital Universitario Miguel Servet de Zaragoza, desde enero de 2007 hasta diciembre de 2022. Se recogieron variables demográficas, inmunológicas y obstétricas de cada gestación. Se consideró como gold standard el diagnóstico de sus médicos especialistas. Se calculó la sensibilidad, la especificidad, los valores predictivos positivo y negativo, y el área bajo la curva (AUC), para los criterios de Sídney y ACR/EULAR, considerando significativo un valor de p<0,05.
ResultadosLos criterios de clasificación ACR/EULAR de 2023 presentaron una sensibilidad del 17,47% (AUC: 0,583), frente a un 74,70% (AUC: 0,871) de los criterios de Sídney.
DiscusiónLos nuevos criterios ACR/EULAR 2023 son más complejos, por la incorporación de nuevas evidencias en el síndrome antifosfolipídico; sin embargo, en cuanto a resultados encontramos una sensibilidad claramente inferior en los nuevos criterios, en concordancia con los hallazgos de otros estudios.
ConclusionesEl diagnóstico del SAF continúa siendo un desafío, debido a su naturaleza multifactorial, alta prevalencia de trombosis y morbilidad obstétrica en la población, heterogeneidad de los AAF y ausencia de un gold standard. Los resultados de nuestro estudio sugieren un peor rendimiento diagnóstico de los criterios ACR/EULAR comparados con los criterios de Sídney para la clasificación de SAF obstétrico, por lo que son necesarios más estudios para confirmar estos hallazgos.
Antiphospholipid antibody syndrome (APS) is characterized by the presence of thrombosis and obstetric pathology.
ObjectiveTo analyze the diagnostic validity of the FAS classification criteria published in 2023 by the American College of Rheumatology (ACR) together with the European Alliance of Associations for Rheumatology (EULAR) and to compare them with the 2006 Sydney criteria in pregnant women with suspected APS.
Material and methodsRetrospective observational cohort study based on the follow-up of 754 pregnancies by the Autoimmune Diseases Unit of the Miguel Servet University Hospital in Zaragoza. The diagnosis of its specialist doctors was considered to be gold-standard. Sensitivity, specificity, positive and negative predictive values, and area under the curve (AUC) were calculated for the Sydney and ACR/ELAR criteria, with a value of P<.05.
ResultsThe 2023 ACR/EULAR classification criteria had a sensitivity of 17.47% (AUC: 0.583) compared to 74.70% (AUC: 0.871) for the Sydney criteria.
DiscussionThe new ACR/EULAR 2023 criteria are more complex due to the incorporation of new evidence in antiphospholipid syndrome; However, in terms of results, we found a clearly lower sensitivity in the new criteria in agreement with the findings of other studies.
ConclusionsThe diagnosis of APS continues to be a challenge, due to its multifactorial nature, high prevalence of thrombosis and pregnancy morbidity in the population, Broad range of antiphospholipid antibody and the absence of a gold-standard. The results of our study suggest a worse diagnostic performance of the ACR/EULAR criteria compared to the Sydney criteria for the classification of obstetric APS, so further studies are needed to confirm these findings.
El síndrome antifosfolipídico (SAF) se considera la trombofilia adquirida autoinmune más frecuente, y afecta sobre todo a mujeres en edad fértil. Se caracteriza por la aparición de trombosis de repetición y morbilidad obstétrica.
Las complicaciones del SAF obstétrico consisten en pérdidas gestacionales precoces, que son la complicación más frecuentes, y se observan en la mayoría de las mujeres con SAF obstétrico (aproximadamente un 54%) incluidas en el European Registry on Obstetric Antiphospholipid Syndrome[1]. Otras complicaciones más tardías son la preeclampsia, la insuficiencia placentaria e incluso la muerte fetal como consecuencia de la disfunción placentaria. Con un manejo adecuado, más del 70% de las embarazadas con SAF lograrán un embarazo exitoso [2].
El SAF puede ser primario o asociado a otra enfermedad autoinmune subyacente, principalmente al lupus eritematoso sistémico (LES), donde aparece hasta en un 30-40% de estos pacientes.
La primera descripción de la enfermedad se remonta a los años 80 como síndrome asociado al LES por la presencia de anticuerpos antifosfolipídicos (AAF). Hasta 1999 no se establecieron los primeros criterios clasificatorios, denominados de Sapporo. En 2006, tras el hallazgo de nuevos AAF, se proponen los criterios de Sídney [3], con base en 2 aspectos fundamentales: los criterios clínicos y analíticos, siendo obligatorio la existencia de al menos uno de los criterios de cada grupo para el diagnóstico definitivo de SAF. Incluyen los anticuerpos antiβ2-glicoproteína I (anti-β2-GPI) como diagnósticos de la enfermedad y en el ámbito obstétrico con la adición de preeclampsia, eclampsia e insuficiencia placentaria [3,4].
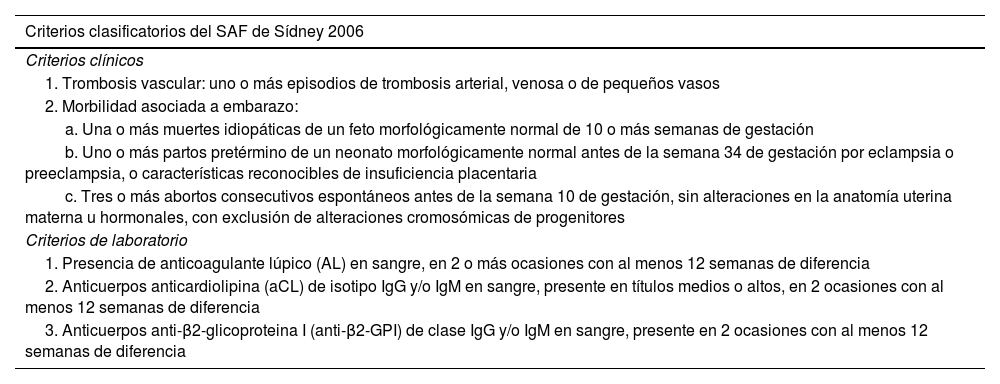
En criterios clínicos se incluyen 2 apartados, la trombosis vascular y la morbilidad obstétrica y, por otro, los criterios de laboratorio, expuestos en la tabla 1.
Criterios clasificatorios de Sídney 2006 para el síndrome antifosfolipídico
| Criterios clasificatorios del SAF de Sídney 2006 |
|---|
| Criterios clínicos |
| 1. Trombosis vascular: uno o más episodios de trombosis arterial, venosa o de pequeños vasos |
| 2. Morbilidad asociada a embarazo: |
| a. Una o más muertes idiopáticas de un feto morfológicamente normal de 10 o más semanas de gestación |
| b. Uno o más partos pretérmino de un neonato morfológicamente normal antes de la semana 34 de gestación por eclampsia o preeclampsia, o características reconocibles de insuficiencia placentaria |
| c. Tres o más abortos consecutivos espontáneos antes de la semana 10 de gestación, sin alteraciones en la anatomía uterina materna u hormonales, con exclusión de alteraciones cromosómicas de progenitores |
| Criterios de laboratorio |
| 1. Presencia de anticoagulante lúpico (AL) en sangre, en 2 o más ocasiones con al menos 12 semanas de diferencia |
| 2. Anticuerpos anticardiolipina (aCL) de isotipo IgG y/o IgM en sangre, presente en títulos medios o altos, en 2 ocasiones con al menos 12 semanas de diferencia |
| 3. Anticuerpos anti-β2-glicoproteina I (anti-β2-GPI) de clase IgG y/o IgM en sangre, presente en 2 ocasiones con al menos 12 semanas de diferencia |
SAF: síndrome antifosfolipídico.
En cuanto a los AAF mejor caracterizados encontramos 3 tipos: los anticuerpos anticardiolipina (IgG o IgM), los anti-β2-GPI IgG o IgM, y el anticoagulante lúpico (AL). Estos deben de aparecer positivos en 2 determinaciones, con una separación de 12 semanas, para poder tener valor diagnóstico [4]. También se conocen otros anticuerpos, que no forman parte de los criterios clasificatorios del SAF: antiprotrombina, antifosfatidilserina y antifosfatidil-etanolamina, entre otros [3,4].
En ocasiones, la positividad de los AAF puede encontrarse durante la evaluación de otra EAS, pérdidas gestacionales tempranas, un tiempo parcial de tromboplastina activado alargado o un resultado falso positivo en test de sífilis, sin clínica compatible, lo que condiciona el diagnóstico al juicio profesional del clínico que lo valora [5].
No solo existen manifestaciones derivadas del estado protrombótico, si no que encontramos otras manifestaciones no-criterio[6].
En cuanto a la clasificación de los pacientes con sospecha de SAF diferenciamos 3 grupos principales: SAF seropositivos con clínica compatible, SAF seronegativos con clínica compatible, no-criterio SAF aquellos que no cumplen criterios clasificatorios, pero poseen rasgos clínicos/serológicos, distinguiendo 3 subgrupos: subgrupo A (clínica sugestiva y serología no concluyente), subgrupo B (manifestaciones clínicas clasificatorias con serología no concluyente) y subgrupo C (clínica no concluyente, serología positiva) [7].
Ante la necesidad de unos criterios clasificatorios que incluyeran la heterogeneidad del espectro clínico del SAF, 2 entidades, como el ACR y la EULAR han desarrollado unos nuevos criterios mediante un método científico riguroso. La metodología consistió, en primer lugar, en generar un pool de ítems revisando la literatura y evidencia hasta la fecha; en segundo lugar, redujeron esos ítems, seleccionando aquellos con alta sensibilidad, especificidad, fiabilidad y factibilidad y, por último, ordenaron en dominios (6 criterios clínicos y 2 de laboratorio), y finalmente se validó [8] (anexo 1 del material suplementario. Criterios ACR/EULAR).
Establecen como criterios de entrada la presencia de uno o más criterios clínicos documentados y al menos un test positivo AFF. Posteriormente, establecen 2 dominios, el clínico y el de laboratorio, en el que adjudican una serie de puntuaciones en función de su relevancia. Es importante puntualizar que no se tendrá en cuenta como positivo aquella manifestación que pueda ser explicada por otra enfermedad subyacente.
Se clasifica como SAF para fines de investigación, si se cumplen al menos 3 puntos o más de dominios clínicos y 3 puntos o más de dominios de laboratorio. Además, se evalúa la estratificación del riesgo de eventos macrovasculares y microvasculares, la morbilidad en el embarazo y la trombocitopenia.
En el aspecto de laboratorio pasan a cuantificarse los títulos de anticuerpos y se diferencian los subtipos, obteniéndose 2 niveles (moderado y alto) [8].
En cuanto al dominio clínico, encontramos 6 subapartados: tromboembolismo venoso y trombosis arterial (anexo 1-D1,2 del material suplementario y anexo 2 del material suplementario); afectación microvascular (anexo 1-D3 del material suplementario); afectación obstétrica (anexo 1-D4 del material suplementario); valvulopatía cardiaca (anexo 1-D5 del material suplementario); afectación hematológica (anexo 1-D6 del material suplementario).
Con respecto al dominio de laboratorio, distingue y pondera la positividad a un solo AAF, 2 o 3. Encontramos 2 subapartados: AL positivo una determinación o persistente y, por otro lado, anticardiolipina (aCL)/anti-β2-GPI positivos. Separando los isotipos IgG e IgM y según título alto o moderado de uno o ambos otorgando diferentes niveles de riesgo (anexo 1-D7,8 del material suplementario).
Objetivos- •
Evaluar la capacidad de los nuevos criterios clasificatorios desarrollados por ACR/EULAR para el diagnóstico del síndrome antifosfolipídico.
- •
Comparar el estatus de SAF de las gestantes de nuestra unidad con los criterios clasificatorios de Sídney respecto a los ACR/EULAR.
Estudio observacional retrospectivo, de tipo cohortes históricas, basado en el seguimiento de 826 gestaciones en la Unidad de Enfermedades Autoinmunes del Servicio de Medicina Interna del Hospital Universitario Miguel Servet, Zaragoza. El seguimiento se realizó desde 1 de enero de 2007 hasta el 31 de diciembre de 2022. El estudio fue autorizado por el Comité Ético y de Investigación Clínica de Aragón.
Criterios de inclusiónGestantes con clínica sugestiva de EAS o con alguna determinación de AAF positivo (826 gestaciones).
Criterios de exclusiónDificultad o imposibilidad de realizar el seguimiento por parte de la unidad, datos incompletos o pendiente de resultados. Con una población final de estudio de 754 gestaciones.
Las variables estudiadas se recogen en la visita presencial con la paciente o a través de su historia clínica electrónica (HCE).
Variables estudiadasPartos; abortos; trombosis previas; edad gestacional al parto; estado fetal al nacimiento; anticuerpos antifosfolípidos (AL, aCL, anti-β2-GPI); preeclampsia; eclampsia o síndrome HELLP durante la gestación.
Variables resultadoLos criterios clasificatorios de Sídney 2006 y los ACR/EULAR 2023.
Análisis estadísticoLas variables cuantitativas se describieron mediante frecuencia, media, desviación estándar, valores mínimo y máximo, y las variables cualitativas mediante porcentajes.
Para las técnicas de evaluación de las pruebas diagnósticas, se utilizaron sensibilidad (S), especificidad (E), valor predictivo positivo y negativo (VPP y VPN). Para comparar la validez de pruebas diagnósticas se utilizaron las curvas ROC. Se consideraron diferencias significativas con p<0,05.
Para la recogida de datos se utilizó Microsoft Access® 2007, de Microsoft Redmond, Washington, EE. UU. Para el análisis de estos se utilizó el editor de datos SPSS® Statistics for Windows, v.25.0. IBM Corp, Armonk, NY, EE. UU.
ResultadosEn cuanto a las características sociodemográficas de la población de estudio, la edad media de las gestantes era de 35,16±4,95 años, con una duración media del embarazo de 34,06±10,89 semanas (media ± desviación estándar).
En la clasificación clínica vamos a poder diferenciar las gestaciones en función de su perfil de AAF, estableciendo 6 categorías, como podemos ver en la tabla 2.
Estatus antifosfolipídico de las gestantes
| Descripción | Frecuencia | Porcentaje | |
|---|---|---|---|
| APA+ | Gestantes con AAF positivas sin clínica de SAF | 153 | 20,3 |
| NEGATIVE | Gestantes AAF negativas y sin clínica | 176 | 23,34 |
| SNAPS | SAF seronegativo (clínica sugestiva de SAF, AAF negativos) | 63 | 8,35 |
| OAPS | SAF obstétrico (clínica obstétrica y cumple criterios AAF) | 122 | 16,2 |
| OMAPS | Morbilidad obstétrica asociada a SAF (clínica obstétrica y AAF que no cumple criterios) | 196 | 26,0 |
| TAPS | SAF trombótico (AAF positivos con clínica trombótica) | 44 | 5,8 |
| Total | 754 | 100 |
AAF: anticuerpos antifosfolipídicos; SAF: síndrome antifosfolipídico.
En cuanto a la situación serológica de las gestantes, el AL era positivo (278 casos, un 36,87%), los anticuerpos anticardiolipina (aCL) fueron positivos, IgG 183 casos, 24,27% y la IgM 116 casos, 15,38%, y en menor porcentaje los anticuerpos anti-β2-GPI, la IgG 66 casos, un 8,75% y la IgM 38 casos, un 5,04%.
El 84,62% (638 casos) de las gestaciones finalizaron con recién nacido vivo, sin embargo, se registraron manifestaciones obstétricas: tasa de abortos 11,01% (83 casos), 14 casos (1,86%) pérdida fetal entre las semanas 10 y 22 de gestación, 2 embarazos ectópicos, una interrupción voluntaria de embarazo y un recién nacido muerto. La complicación vascular gestacional más frecuente fue el crecimiento intrauterino retardado (CIR) con el 12% y preeclampsia con el 7%.
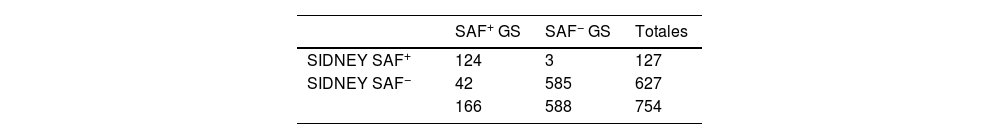
Según los criterios de Sídney, objetivamos 2 grupos que cumplen criterios, los SAF clínicos 278 casos (36,87%) y los SAF analíticos 263 casos (34,88%). Por otro lado, 476 y 491 que no cumplen criterios (63,13 y 65,12%, respectivamente), para un total de 127 casos de SAF positivo.
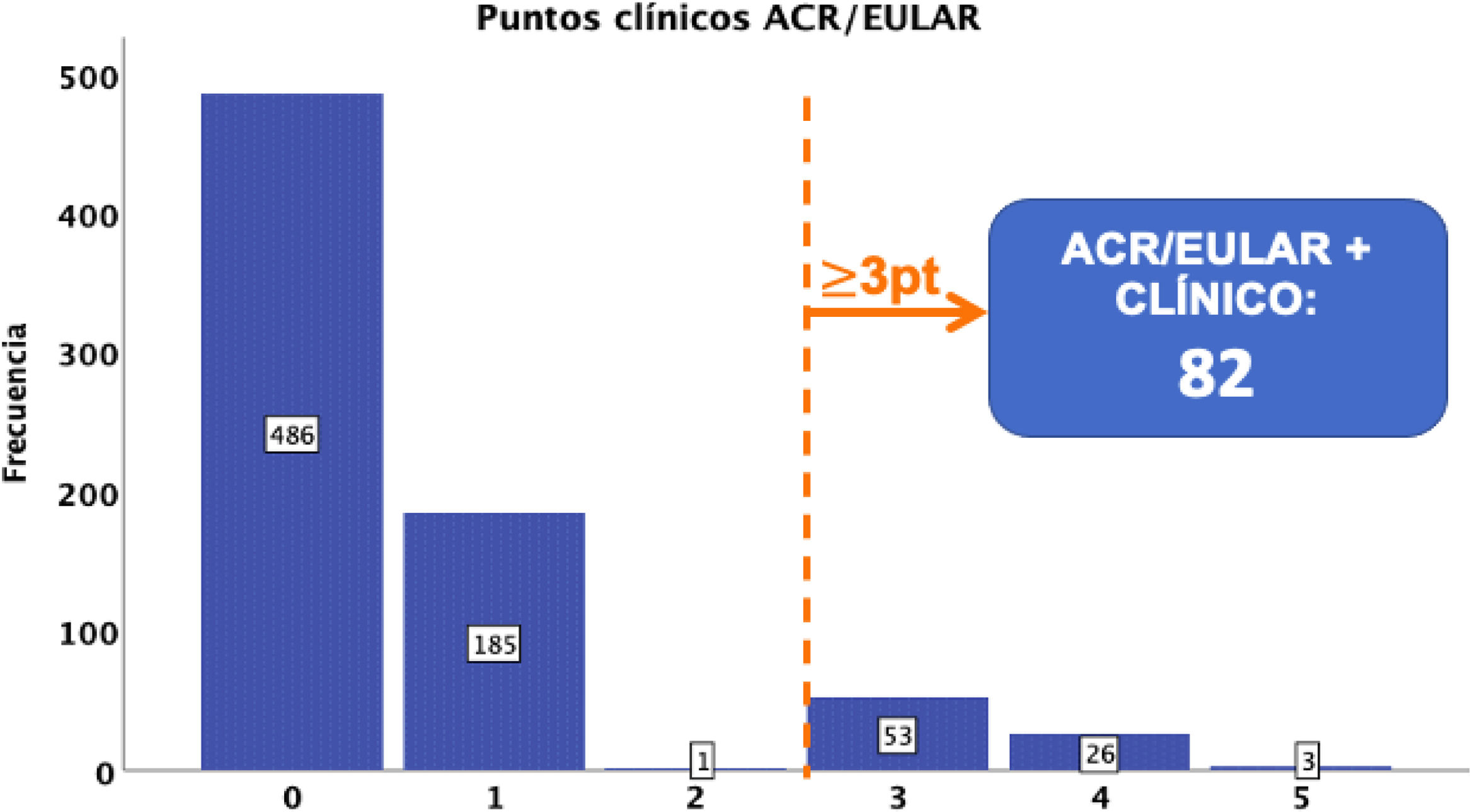
En cuanto a los criterios ACR/EULAR, clínicamente se descartaron un total de 486 gestaciones sin clínica relacionada, y se obtuvo un total de 82 casos según los criterios ACR/EULAR (fig. 1).
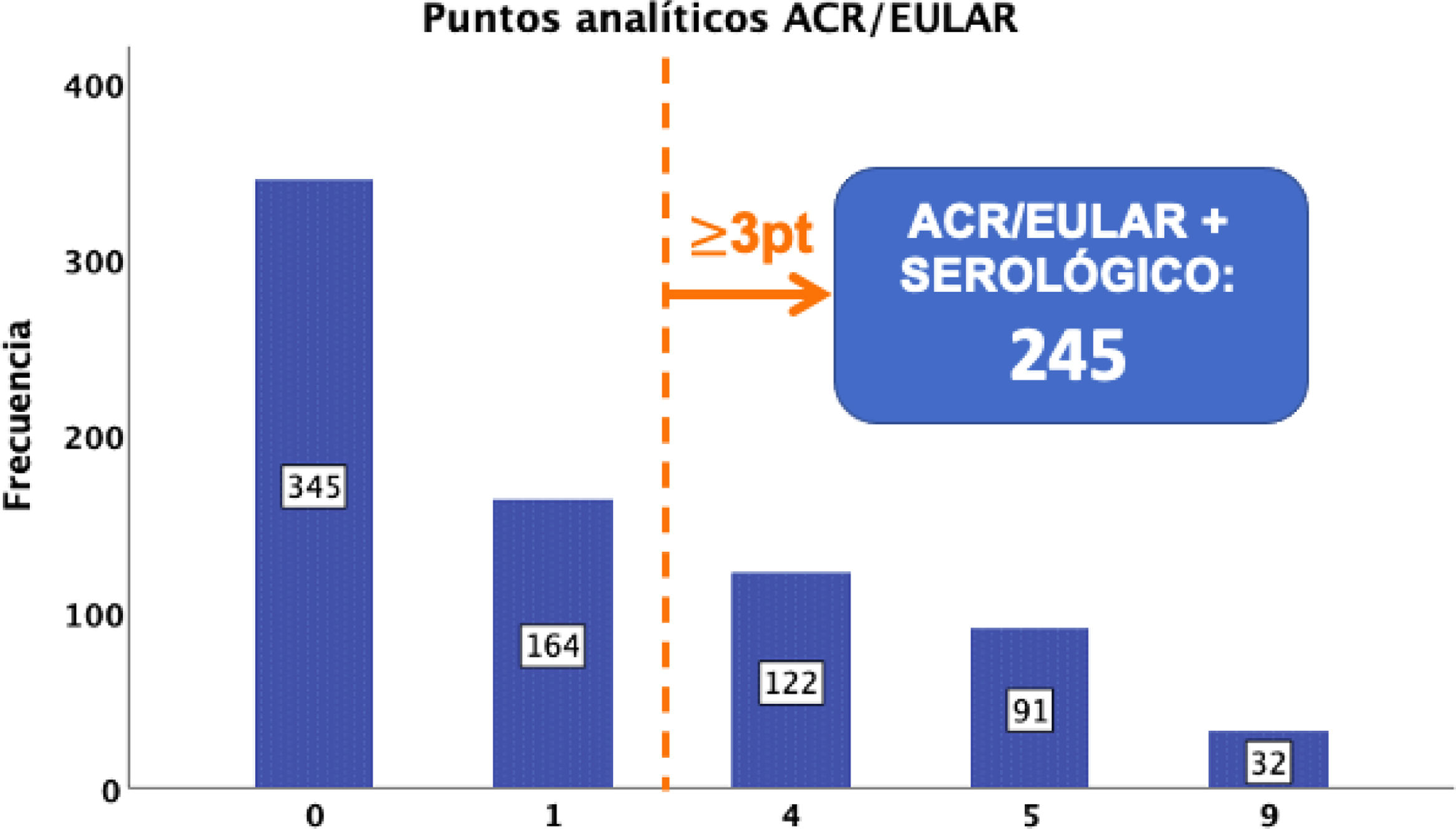
Desde el punto de vista analítico, obtuvimos un total de 245 casos con una puntuación superior a 3 puntos (fig. 2).
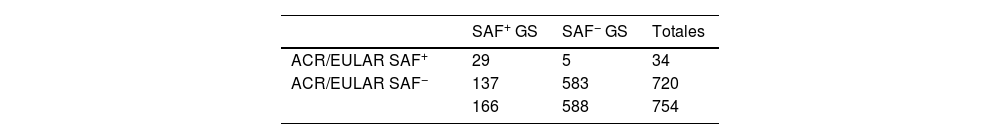
Por tanto, se registraron 34 casos positivos con criterios clínicos y analíticos.
Se consideró como gold standard la clasificación SAF según los médicos especialistas encargados del seguimiento de las gestantes.
Se procedió a realizar las correspondientes tablas 2 × 2 para comparar la validez de ambos criterios (tablas 3 y 4).
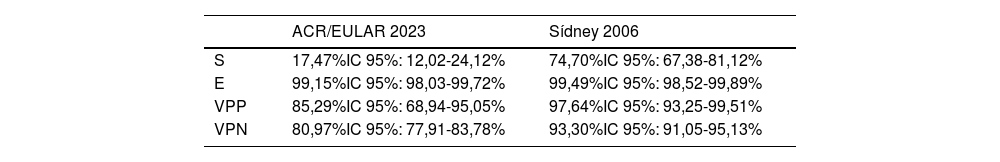
En la siguiente tabla comparativa (tabla 5) se observa que la sensibilidad de los criterios ACR/EULAR 2023 fue del 17,47 frente al 74,70% en los criterios de Sídney 2006. En el campo de la especificidad, ambos criterios son muy específicos, y en cuanto al VPP y VPN se observan resultados superiores en los criterios de Sídney.
Comparativa de parámetros y validez de criterios Sídney 2006 y ACR/EULAR 2023 vs. gold standard (especialista)
| ACR/EULAR 2023 | Sídney 2006 | |
|---|---|---|
| S | 17,47%IC 95%: 12,02-24,12% | 74,70%IC 95%: 67,38-81,12% |
| E | 99,15%IC 95%: 98,03-99,72% | 99,49%IC 95%: 98,52-99,89% |
| VPP | 85,29%IC 95%: 68,94-95,05% | 97,64%IC 95%: 93,25-99,51% |
| VPN | 80,97%IC 95%: 77,91-83,78% | 93,30%IC 95%: 91,05-95,13% |
E: especificidad; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
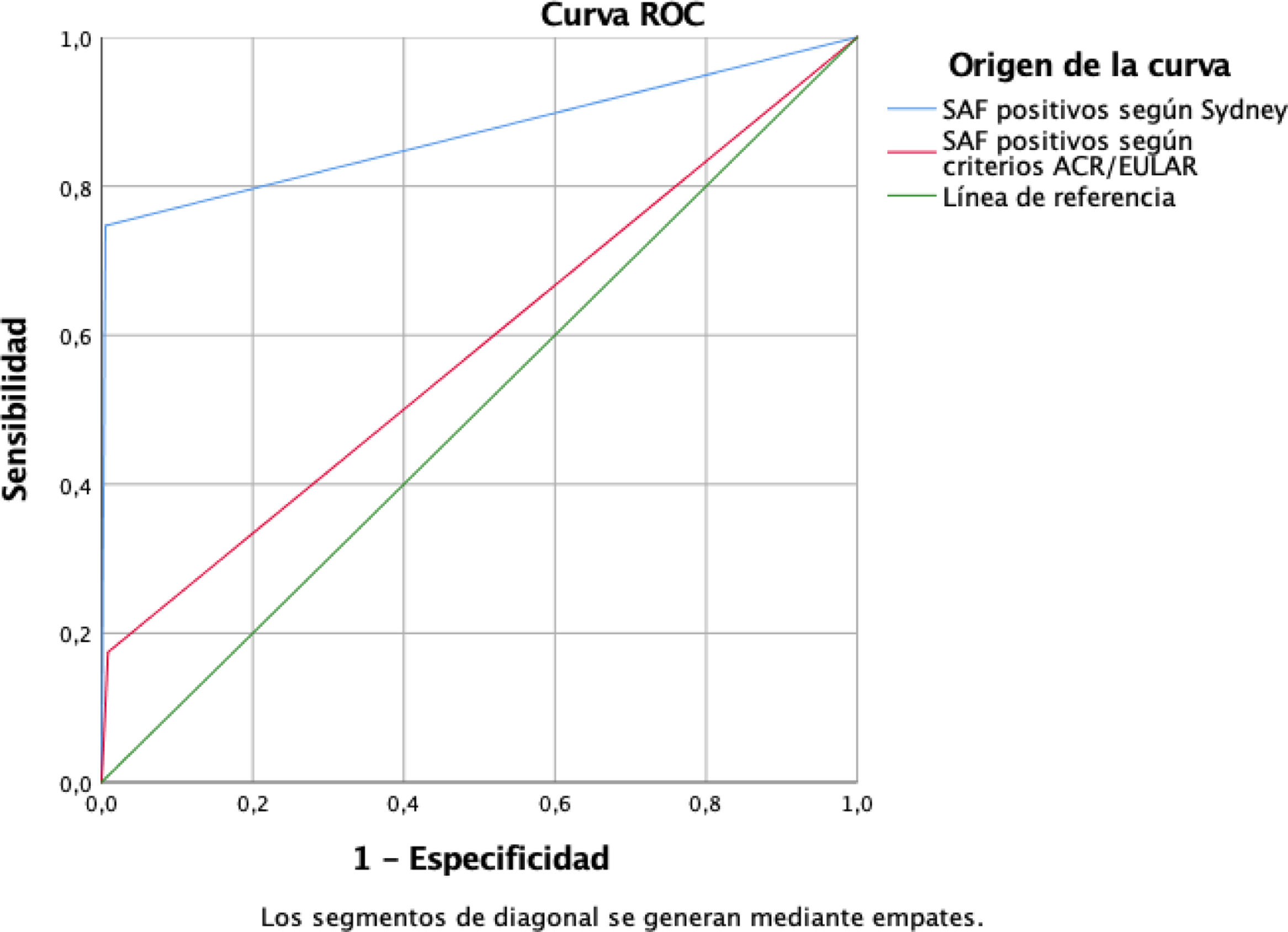
En el gráfico de la curva ROC (fig. 3), se determinó un área bajo la curva de 0,871 (IC 95%: 0,831-0,911) en el caso de los criterios de Sídney y de 0,583 (IC 95%: 0,530-0,636) en ACR/EULAR.
DiscusiónEl propósito del presente estudio era aplicar los nuevos criterios clasificatorios ACR/EULAR 2023 para el SAF en nuestra muestra de gestantes con sospecha de SAF, categorizadas según su perfil serológico y comparar la validez de los nuevos criterios frente a los empleados hasta el momento [3,9,10].
Mientras que los criterios diagnósticos se basan en clínica y pruebas complementarias con el fin de guiar el tratamiento con base en el riesgo, los criterios clasificatorios tienen como objetivo establecer un grupo más homogéneo, con el fin de investigación [11].
Los nuevos criterios ACR/EULAR 2023 añaden complejidad por la incorporación de nuevas evidencias en el SAF [12], sin embargo, nuestro estudio señala una sensibilidad claramente inferior en los nuevos criterios, en concordancia con los hallazgos en una cohorte asiática [13], lo cual sugiere que estos criterios tienen menor validez respecto a los de Sídney.
El diagnóstico del SAF continúa siendo un gran desafío, debido a su naturaleza multifactorial, alta prevalencia de trombosis y morbilidad obstétrica en la población, así como heterogeneidad de los AAF. Debe destacarse que en los nuevos criterios se da un menor peso a los anticuerpos de tipo IgM. El riesgo trombótico de los anticuerpos aCL y anti-β2-GPI IgM, en comparación con los IgG, según revisiones de la literatura, el isotipo IgG se correlacionaba más significativamente con eventos trombóticos [14] y la positividad de IgM se asociaba con la morbilidad obstétrica [15], lo cual puede explicar la disparidad de rendimiento en las pruebas y que por tanto afecte a la clasificación del SAF obstétrico). La ausencia de un gold standard para evaluar de manera efectiva nuevas herramientas para su diagnóstico [8,12]. La presencia de clínica obstétrica o positividad de AAF fue común en nuestra muestra, no obstante, solo obtuvimos un total de 34 casos ACR/EULAR positivos. Los criterios clasificatorios pueden orientar en la valoración de AAF positivo, con el fin de evitar el sobrediagnóstico.
En cuanto a limitaciones del estudio, se trata de un estudio unicéntrico, retrospectivo de tipo cohortes históricas. Además, al no existir un gold standard para el diagnóstico de SAF obstétrico, se utilizó la impresión diagnóstica de los médicos especialistas de la unidad de EAS del servicio de medicina interna.
Consideramos que estos criterios deberían ser revisados con mayor profundidad mediante estudios comparativos, sobre todo a nivel obstétrico, ya que aspectos que son clasificatorios según criterios de Sídney (tres abortos consecutivos y perdida fetal), en los ACR/EULAR se requieren otras manifestaciones para cumplir el criterio clínico. Esto conlleva que un amplio grupo de gestantes no cumpla criterios clasificatorios y su manejo terapéutico pueda ser diferente.
Por lo tanto, los nuevos criterios deberían estar abiertos a un mayor perfeccionamiento, a medida que su empleo haga ganar experiencia y se conozca más acerca de la biología subyacente de esta enfermedad, lo que fomentaría el desarrollo de nuevas herramientas diagnósticas y terapéuticas [10].
Conclusiones- 1.
El diagnóstico de SAF es un proceso complejo dada la heterogeneidad de la enfermedad tanto clínica como serológica que lo dificulta, no así la clasificación que pretende homogeneizar los pacientes con SAF para investigación.
- 2.
Los criterios clasificatorios de SAF propuestos por la ACR/EULAR 2023 han mostrado unos resultados de validez diagnóstica inferiores en nuestra muestra, destacando una menor sensibilidad respecto a los criterios de Sídney 2006, lo cual va en consonancia con otros estudios.
- 3.
El gold standard en cuanto al diagnóstico y tratamiento es la opinión del experto, por lo que se debe valorar el riesgo-beneficio de iniciar un tratamiento, ya que se ha visto que mujeres que no cumplen los criterios clasificatorios de SAF también se benefician de su tratamiento.
- –
Laura Vela Valle: Metodología, redacción y revisión del trabajo.
- –
Jorge Perbech Larraz: Base de datos, análisis de los datos, gráficos y tablas.
- –
Margarita Míriam Lesta Colmenero: Revisión bibliográfica.
- –
María Patricia Solana Hidalgo: Redacción de los resultados.
- –
Borja del Carmelo Gracia Tello: Metodología (diseño de estudio).
- –
Mercedes Pilar Pérez Conesa y Luis Sáez Comet: Conceptualización del trabajo (objetivos e hipótesis).
Los pacientes cuyos datos pertenecen a la base de datos habían firmado previamente un consentimiento informado entregado en las consultas de UEAS del HUMS (anexo 1 del material suplementario).
El investigador no ha tenido acceso a datos que pudiesen identificar a los pacientes, sino que se trabajó a partir de una base de datos con los pacientes anonimizados previamente.
Como se trata de un estudio observacional y retrospectivo, no se ha influido de ninguna manera en el tratamiento farmacológico de los pacientes.
Además, el proyecto cuenta con la aprobación por parte del Comité Ético de Investigación Clínica de Aragón (CEICA) (anexo 2 del material suplementario), que consideró que el estudio se planteó de acuerdo a los requisitos del Real Decreto 957/2020 del 3 de noviembre, el cual regula los estudios observacionales con medicamentos de uso humano; y que se cumplían los requisitos de idoneidad; así como que es adecuado el uso de los datos por contar con permiso y los medios apropiados para su uso; emitiendo un dictamen favorable a favor del estudio.
Inteligencia artificialNo se ha empleado ningún tipo de inteligencia artificial en el estudio.
FinanciaciónNo hubo financiación de ningún tipo ni pública ni privada para la realización del estudio.
Conflicto de interesesLos autores del artículo declaran no tener ningún conflicto de intereses que puedan influir en la objetividad del trabajo.