En las últimas décadas, la prevalencia del lupus eritematoso sistémico (LES) se ha incrementado gracias a la detección temprana y al impacto de las nuevas terapias en la sobrevida de los afectados. Hasta el 90% de ellos tendrá signos histopatológicos de afección renal en los primeros 3 años de la enfermedad, pero la nefritis lúpica (NL) de relevancia clínica aparecerá en el 50% de los casos, afectando la función renal y la mortalidad. A pesar de las estrategias terapéuticas agresivas, el pronóstico de los pacientes con NL sigue siendo desfavorable, principalmente debido al alto riesgo de progresión a enfermedad renal crónica terminal (10-20%) y de mortalidad por todas las causas.
ObjetivoDescribir los factores de riesgo clínicos e inmunológicos de un grupo de pacientes con lupus, comparando características clínicas y serológicas en relación con el compromiso renal, a fin de establecer posibles asociaciones.
Materiales y métodosEstudio de corte transversal en el que se incluyeron 87 pacientes con LES. Se analizaron variables clínicas e inmunológicas. Los análisis bivariado y multivariados se realizaron utilizando la presencia de nefritis como desenlace.
ResultadosLa prevalencia de NL fue del 59%. Las variables asociadas significativamente fueron hipertensión arterial (OR: 3,1; IC 95%: 1,02-9,40), edad de aparición del lupus menor de 25 años (OR: 2,7; IC 95%: 1,08-6,73), presencia de livedo reticularis (OR: 4,1; IC 95%: 1,09-15,7), anti-DNA positivo (OR: 2,9; IC 95%: 1,18-7,24) y niveles bajos de complemento (OR: 4,0; IC 95%: 1,64-10,2).
ConclusionesLas anormalidades en el sedimento urinario fueron la manifestación renal más común, en tanto que el inicio lúpico antes de los 25 años parece incrementar el riesgo de desarrollar nefritis. Se requieren futuras investigaciones que den una mejor explicación a las asociaciones encontradas.
In recent decades, the prevalence of systemic lupus erythematosus (SLE) has increased thanks to early detection and the impact of new therapies on the survival of those affected. Up to 90% will have histopathological signs of kidney disease in the first 3 years of the disease, but lupus nephritis of clinical relevance will appear in 50% of cases, affecting kidney function and mortality. Despite aggressive therapeutic strategies, the prognosis of patients with LN remains unfavourable, mainly due to the high risk of progression to end-stage renal disease (10%-20%) and mortality from all causes.
ObjectiveTo describe the clinical and immunological risk factors of a group of patients with lupus, comparing clinical and serological characteristics in relation to renal involvement to establish possible associations.
Materials and methodsCross-sectional study in which 87 patients with SLE were included. Clinical and immunological variables were analysed. Bivariate and multivariate analyses were performed using the presence of nephritis as an outcome.
ResultsThe prevalence of lupus nephritis was 59%. The significantly associated variables were arterial hypertension (OR 3.1, 95% CI 1.02-9.40), age of onset of lupus less than 25 years (OR 2.7, 95% CI 1.08-6.73), the presence of reticular livedo (OR 4.1, 95% CI 1.09-15.7), positive anti-DNA (OR 2.9, 95% CI 1.18-7.24) and low levels of complement (OR 4.0, 95% CI 1.64-10.2.).
ConclusionsUrinary sediment abnormalities were the most common renal manifestation and lupus debut before the age of 25 seems to increase the risk of developing nephritis. Future research is required for a better explanation of the associations found.
La nefritis lúpica (NL) es una manifestación frecuente del lupus eritematoso sistémico (LES), caracterizada por proteinuria en rango variable, cuyo espectro clínico abarca desde formas asintomáticas asociadas con microhematuria hasta síndrome nefrótico y fallo renal1,2. La lesión renal puede ser consecuencia de glomerulonefritis provocada por complejos inmunes, enfermedad túbulo intersticial o afectación vascular. Aunque se calcula que hasta el 90% de los pacientes tendrá signos histopatológicos de afección renal, la nefritis de relevancia clínica aparecerá en el 50% de los casos, dentro de los primeros 3 años de la enfermedad3. Hasta en la mitad de los casos es descubierta durante la monitorización seriada de orina en pacientes asintomáticos, siendo la proteinuria su sello distintivo y el principal biomarcador de tamización4,5.
Estudios previos han relacionado la menor edad al inicio del LES, el sexo masculino y la etnia no caucásica como factores asociados con la presencia de NL6–8. A pesar de estrategias terapéuticas agresivas, el pronóstico de los pacientes con NL sigue siendo desfavorable, principalmente debido al alto riesgo de progresión a enfermedad renal crónica terminal (10-20%) y de mortalidad por todas las causas9. El objetivo de este estudio es describir las características y los posibles factores clínicos asociados con la NL en una población monocéntrica de pacientes con LES asistidos en un hospital de Argentina.
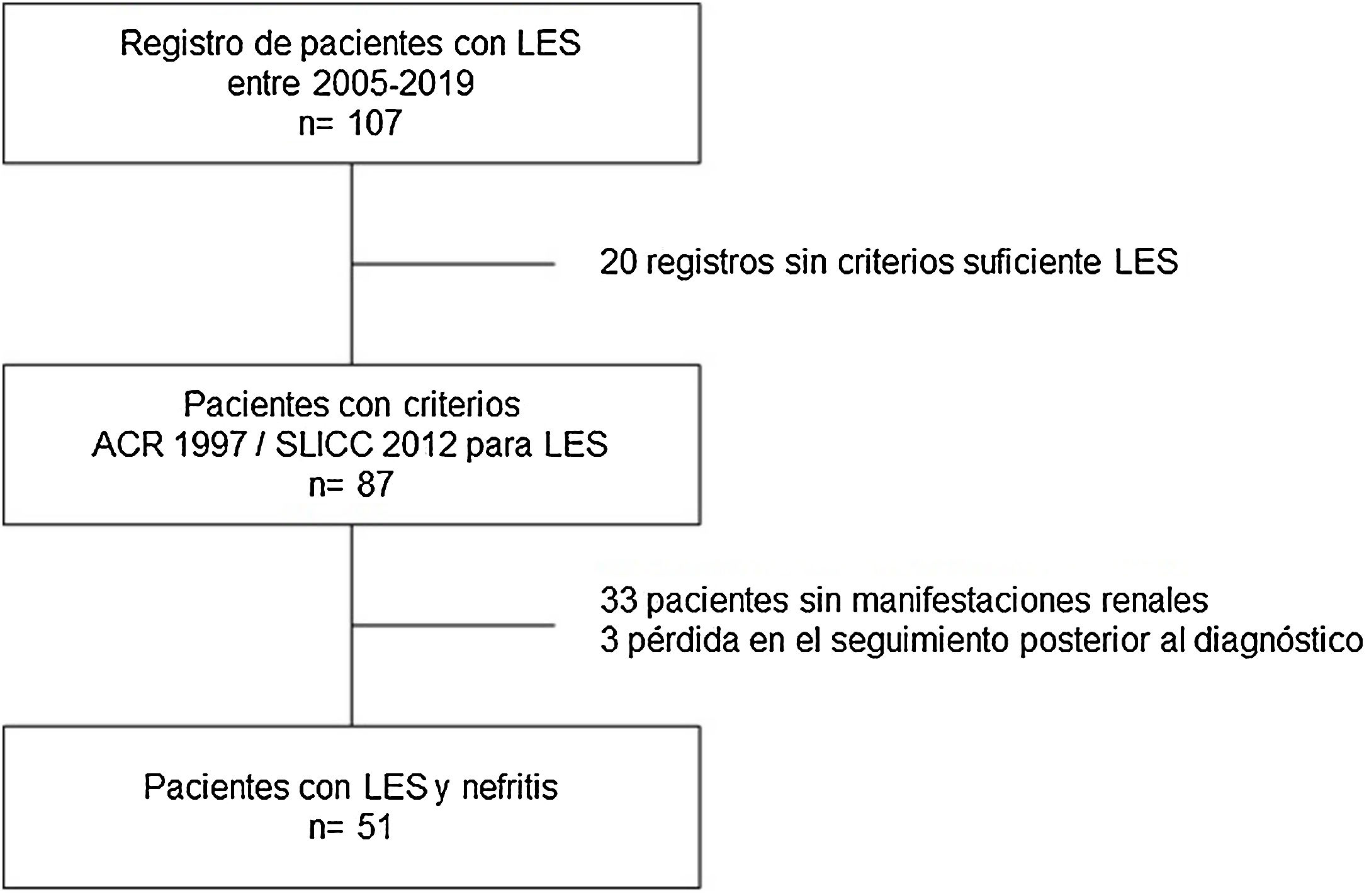
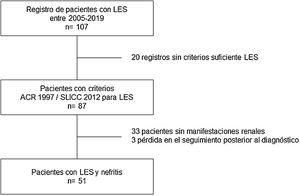
Materiales y métodosDiseño del estudioEstudio descriptivo de corte transversal de pacientes adultos con LES asistidos entre el 2005 y el 2019 en la unidad de enfermedades autoinmunes del Hospital Privado de Comunidad, Mar del Plata, Argentina. Durante la valoración, un médico con experiencia en el manejo de pacientes con LES fue el responsable de registrar la información en una base de datos. Se analizaron variables sociodemográficas, clínicas e inmunológicas. Los datos analizados fueron tomados de los reportes de historias clínicas, se excluyeron pacientes sin criterios ARC 1997 o SLICC 2012 para LES, gestantes, menores de 18 años y pacientes con nefropatía previa al diagnóstico de lupus10,11. Además, los pacientes con información insuficiente relacionada con el desenlace en estudio también fueron excluidos (fig. 1).
Consideraciones éticasEste estudio fue aprobado por el Consejo Institucional de Revisión de Estudios de Investigación (CIREI) y se obtuvo el consentimiento informado de los pacientes.
Variables sociodemográficasSe incluyeron edad en años al momento del diagnóstico de LES, sexo biológico y grupo étnico, de acuerdo con la autodefinición del paciente según sus padres y 4 abuelos.
Variables clínicas e inmunológicasEn cuanto a las variables clínicas, se consideraron las manifestaciones extrarrenales, las comorbilidades y el tratamiento recibido. Se evaluaron las siguientes manifestaciones: en piel y mucosas (rash malar, alopecia, lesiones discoides, úlceras orales, livedo reticularis, fenómeno de Raynaud, púrpura, fotosensibilidad); musculoesqueléticas (artralgia/artritis, necrosis ósea avascular, mialgias/miositis, artropatía de Jaccoud); oculares (síndrome sicca, trastornos visuales); respiratorias (pleuritis, neumonitis lúpica, hemorragia/vasculitis pulmonar, enfermedad pulmonar intersticial, hipertensión pulmonar); manifestaciones cardiovasculares (pericarditis, valvulopatía, vasculitis, trombosis vascular, hipertensión arterial); neuropsiquiátricas (los 19 síndromes asociados al LES)12; gastrointestinales (serositis, hepatitis, enteropatía); hematológicas (anemia hemolítica, leucopenia, linfopenia, trombocitopenia, púrpura trombocitopénica trombótica, síndrome hemofagocítico, síndrome antifosfolípidos) y renales: (al menos uno de los siguientes criterios: proteinuria persistente [proteinuria >0,5g/día, >3+ en test de tiras reactivas], creatinina persistentemente elevada y presencia de sedimento activo [cilindros celulares o granulares])13. La excreción de proteínas en orina >0,5g/día se consideró anormal, en tanto que un valor de >3,5g/día se consideró proteinuria en rango nefrótico. Esta última, asociada con hipoalbuminemia y edemas, se reconoció como síndrome nefrótico, mientras que una depuración de creatinina <60ml/min/1,73m2 (por CKD-EPI) o la presencia de daño renal por 3 meses o más se consideró enfermedad renal crónica.
A los pacientes con deterioro de la función renal o alguno de los criterios previamente descritos se les solicitó biopsia renal, y los hallazgos se clasificaron según los criterios de la ISN/RPS 2003, por estudio de luz e inmunofluorescencia14. Los índices de actividad y cronicidad, la atrofia tubular y la fibrosis intersticial fueron extraídos de los reportes de enfermedad contenidos en las historias clínicas, calculados con base en el sistema de clasificación del NIH. Se categorizó el grado de fibrosis intersticial y atrofia tubular en variables politómicas (ninguna a leve: <25% del intersticio afectado; moderada: 25-50% y severa: >50%)15.
Se analizaron las siguientes variables serológicas: anticuerpos antinucleares (ANA), anticuerpos nucleares extraíbles totales ENA (anti-Ro/SSa, anti-La/SSb, anti-Sm, anti-Scl-70 y anti-U1 RNP), anti-DNA, niveles de complemento (C3 y C4), niveles significativos de anticuerpos IgM/IgG anticardiolipina y B2-glicoproteína (>40UI/ml), test de Coombs y anticoagulante lúpico. Se registraron las siguientes variables de tratamiento: uso de corticoides, prednisona o equivalentes a dosis bajas (<7,5mg/día), dosis intermedias (7,5-30mg/día) y dosis altas (>30mg/día), pulsos de corticoides16, o el uso de inmunosupresores administrados por un mínimo de 3 meses, tales como hidroxicloroquina, azatioprina, ciclofosfamida, micofenolato mofetil, metotrexato, rituximab, belimumab u otro.
Análisis estadísticoPara el análisis descriptivo se tuvieron en cuenta medidas de tendencia central y de distribución de las variables en estudio. Aquellas de naturaleza cuantitativa y con una distribución normal se expresan mediante medias, con su respectiva desviación estándar, y las de distribución no normal mediante medianas con su rango intercuartílico respectivo. Las variables cualitativas se presentan en proporciones. Para el análisis bivariado de las variables categóricas se empleó el test de Chi-cuadrado, y el test de Fisher para el análisis de los casos en los cuales la frecuencia del evento es menor de la esperada. Para las variables cuantitativas con distribución normal se empleó la prueba de la t de Student, mientras que en el caso de las variables cuantitativas con distribución no normal se optó por la prueba U de Mann-Whitney. Se seleccionaron las potenciales variables de riesgo de acuerdo con criterios estadísticos y clínicos, en tanto que, para identificar el efecto de los confundidores, la interacción y la mediación se realizó una regresión logística binaria. Se presentan las odds ratio (OR) de las variables de riesgo, con su respectivo intervalo de confianza, empleando un nivel de significación estadística de p<0,05. El análisis se llevó a cabo con el paquete estadístico SPSS® Statistics versión 25.
ResultadosDurante el periodo de estudio se registraron 87 casos de LES, de los cuales el 90% (78) fueron mujeres, con una razón de sexos de 8,6:1. La autodenominación étnica más frecuente fue mestiza (33%), seguida por caucásica (29%). La edad promedio al momento del diagnóstico fue 32±16 años. El 74% de los casos presentó al menos una enfermedad concomitante. Con relación a las manifestaciones sistémicas, las más comunes fueron las cutáneas, las musculoesqueléticas, las hematológicas y las renales. Dentro de las manifestaciones cutáneas, las más frecuentes fueron: rash malar (51%), fotosensibilidad (44%), fenómeno de Raynaud (44%) y alopecia (37%). En el perfil inmunológico destaca la frecuencia de los ANA, los anti-DNA y el consumo de complemento C3/C4. Las características generales de la población se describen en la tabla 1.
Características generales de la población (n=87)
| Sociodemográficas | n (%) |
|---|---|
| Sexo | |
| Femenino | 78 (90) |
| Masculino | 9 (10) |
| Edad al diagnóstico en años; media (DE) | 32 (16) |
| Enfermedad concomitante | 64 (74) |
| Enfermedad tiroidea autoinmune | 23 (26) |
| Osteoporosis | 15 (17) |
| Dislipidemia | 14 (16) |
| Diabetes mellitus | 4 (5) |
| Eventos cardiovasculares | 6 (7) |
| Otras | 2 (3) |
| Manifestaciones sistémicas | |
| Cutáneas | 75 (86) |
| Musculoesqueléticas | 74 (85) |
| Hematológicas | 56 (64) |
| Renales | 51 (59) |
| Cardiovasculares | 36 (41) |
| Neuropsiquiátricas | 36 (41) |
| Oculares | 30 (35) |
| Respiratorias | 24 (28) |
| Perfil de autoinmunidad | |
| ANA | 78 (90) |
| Complemento bajo | 61 (70) |
| Anti-DNA | 55 (63) |
| Tratamientos | |
| Corticoides | 79 (91) |
| Hidroxicloroquina | 74 (85) |
| Azatioprina | 37 (43) |
| Micofenolato mofetil | 26 (30) |
| Ciclofosfamida | 22 (25) |
| Metotrexato | 13 (15) |
ANA: anticuerpos antinucleares; DE: desviación estándar.
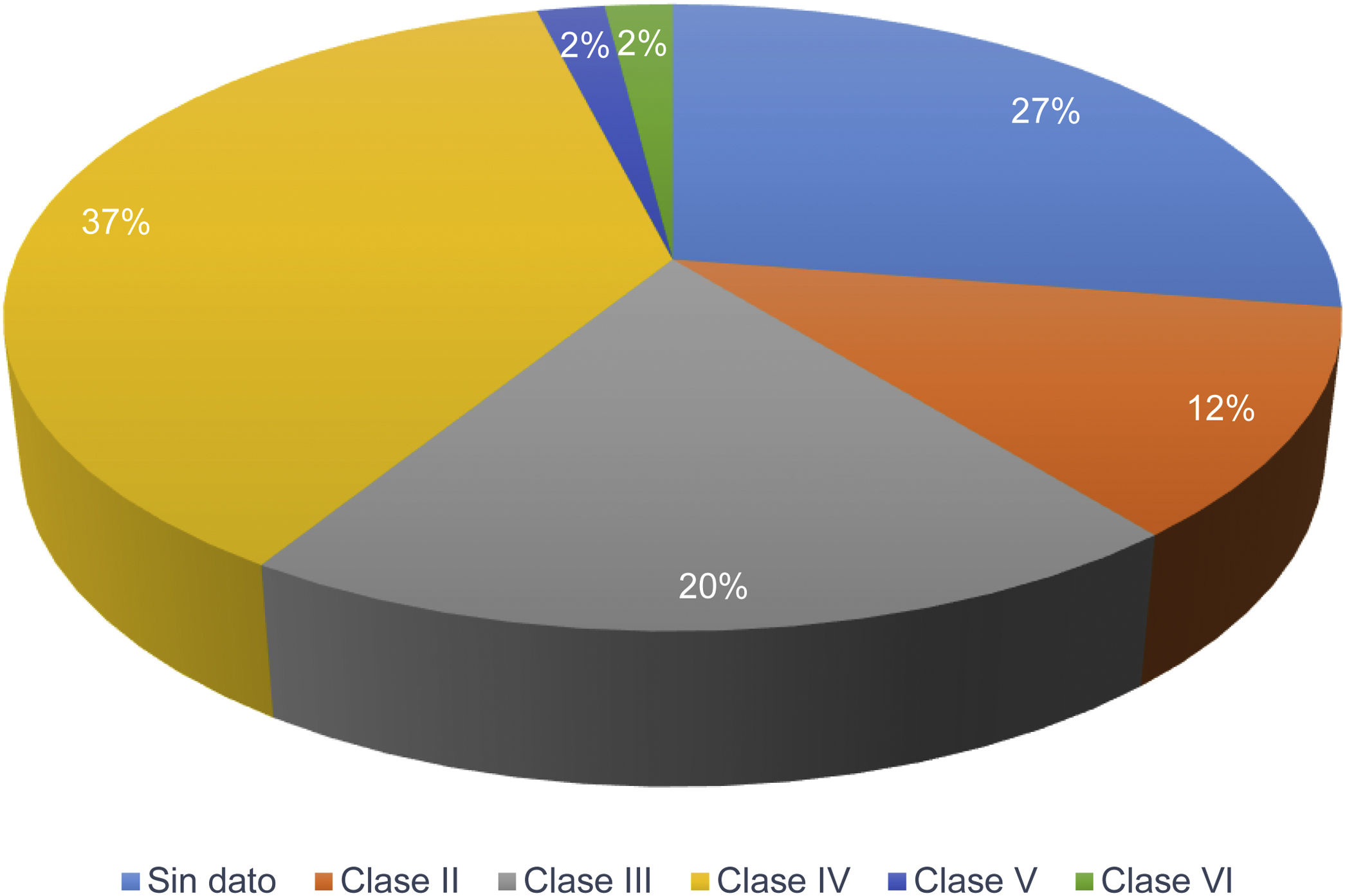
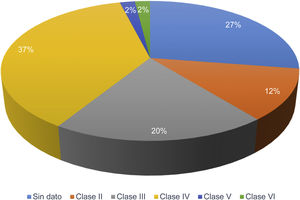
De los 87 pacientes con LES, 51 (59%) desarrollaron NL, de los cuales el 86% fueron mujeres. La mediana de edad al momento del diagnóstico de LES fue de 25 años (IQR=20), dentro de los cuales 22 (43%) tenían una edad de menor de 25 años. Las características bioquímicas e histopatológicas principales de este subgrupo se resumen en la tabla 2. El 18% comenzó con insuficiencia renal aguda y el 45% desarrolló enfermedad renal crónica (ERC). Se obtuvo el informe de biopsia renal en 37 (72%) de los afectados, a partir de los registros clínicos. La distribución del tipo de lesión histopatológica fue: nefritis proliferativa difusa (clase IV) en el 37% de los pacientes, seguido por nefritis proliferativa focal (clase III) en el 20%, NL mesangial clase II en el 12%, NL clase V en el 2% y VI en el 2% (fig. 2). Si bien, a todos los pacientes con algún tipo de compromiso renal se les solicitó biopsia renal, solo se pudieron rescatar los reportes de 32 pacientes (72%). Dentro de las causas para la no realización figuran: la negativa del paciente a la realización del procedimiento: 6 (42%), falta de cobertura de salud para el procedimiento: 7 (50%) y contraindicación absoluta: 1 (8%).
Características bioquímicas e histopatológicas en pacientes con NL (n=51)
| Parámetros hematológicos y serológicos | n (%) |
| Leucopenia (<4×109/l) | 24 (47) |
| Linfopenia (linfocitos <1.500/l) | 23 (45) |
| Trombocitopenia (<100×109/l) | 7 (14) |
| ANA positivo | 46 (90) |
| Anti-DNA positivo | 38 (75) |
| C3, mediana, (RIQ), mg/dl | 78 (55-102) |
| C4, mediana, (RIQ), mg/dl | 15 (8-18) |
| Parámetros renales | |
| Cr(s), mediana (RIQ), mg/dl | 0,87 (0,73-1,16) |
| TFGe, media, (DE), ml/min/1,73m2 | 84 (33,5) |
| Proteinuria, mediana (RIQ), mg/24h | 787 (382-2.030) |
| Sedimento urinario patológico | 47 (92) |
| Clasificación patológica ISN/RPS | |
| Clase II | 6 (12) |
| Clase III | 10 (20) |
| Clase IV | 37 (37) |
| Clase V | 1 (2) |
| Clase VI | 1 (2) |
| SB | 14 (27) |
| Índice de actividad, mediana, (RIQ) | 3 (2-7) |
| Índice de cronicidad, mediana, (RIQ) | 1 (0-3) |
| Fibrosis intersticial | |
| Ninguna a leve (<25%) | 27 (53) |
| Moderada (25-50%) | 10 (20) |
| Severa (>50%) | — |
| Atrofia tubular | |
| Ninguna a leve (<25%) | 27 (53) |
| Moderada (25-50%) | 9 (18) |
| Severa (>50%) | 1 (2) |
ANA: anticuerpos antinucleares; Cr(s): creatinina sérica; DE: desviación estándar; NL: nefritis lúpica; RIQ: rango intercuartílico; SB: sin reporte de biopsia; TFGe: tasa de filtración glomerular estimada.
Los datos son presentados como media±desviación estándar o n (%).
Respecto a la terapia con corticoides, se encontró que se prescribieron dosis altas de prednisona en más de la mitad de los casos (51%), lo que requirió el uso de pulsos endovenosos en algún momento de la evolución de la enfermedad en el 50%. La HCQ fue el segundo fármaco más utilizado, seguido por AZA (43%), MFM (30%) y CFM (25%). El uso de fármacos biológicos fue del 2%. En los casos de NL con lesión histopatológica clase III y IV, dentro del esquema de tratamiento se requirieron al menos 4 fármacos, incluyendo siempre un corticoide.
Análisis de factores asociados con nefritis lúpicaDentro de las variables clínicas, la edad menor de 25 años, la presencia de livedo reticular, la hipertensión arterial, la presencia de anti-DNA positivo y el consumo del complemento estuvieron asociados con la presencia de NL, con una asociación estadísticamente significativa. No se encontró asociación entre el sexo y la afectación renal (tabla 3).
Factores de riesgo asociados con NL
| Factor | OR | IC 95% | Valor de p |
|---|---|---|---|
| Edad (<25 años)a | 2,7 | 1,08-6,73 | 0,025 |
| Livedo reticular | 4,1 | 1,09-15,77 | 0,027 |
| Hipertensión arterial | 3,1 | 1,02-9,40 | 0,040 |
| Anti-DNA positivo | 2,9 | 1,18-7,24 | 0,019 |
| C3 bajo | 4,0 | 1,64-10,20 | 0,002 |
| C4 bajo | 3,8 | 1,40-10,48 | 0,007 |
LES: lupus eritematoso sistémico; NL: nefritis lúpica.
Nuestro estudio incluyó 87 pacientes con LES, dentro de los cuales el 59% desarrolló NL; tanto su distribución por sexo como la edad promedio al momento del diagnóstico de LES fueron relativamente similares a las publicadas previamente en Argentina y Latinoamérica17,18. Fenotipos agresivos de la enfermedad pueden expresarse con mayor frecuencia en los varones. En la cohorte GLADEL se observó mayor prevalencia de NL en varones (58,5 vs. 44,2%; p=0,004)19. En nuestro estudio no se encontraron diferencias significativas en la prevalencia de NL entre ambos sexos (56,4 vs. 77,7%; p=0,218), lo que podría estar explicado por la baja proporción de pacientes masculinos reclutados. Respecto a la edad de inicio del LES, se ha descrito la edad temprana como un factor pronóstico para la aparición del compromiso renal20. En nuestra cohorte se observó que el comienzo del LES antes de los 25 años se asocia a un riesgo 2,7 veces mayor de desarrollar nefritis.
Las anormalidades en el sedimento urinario como la microhematuria y los cilindros celulares fueron las manifestaciones renales más comunes. Dado que su presencia suele ser asintomática, presenta real importancia realizar una monitorización sistemática de orina en pacientes asintomáticos o durante la evaluación por una recaída lúpica. En la mayoría de los casos, las manifestaciones renales ocurren durante la evolución de la enfermedad, cuando el diagnóstico de lupus ya se ha establecido (5,3 vs. 51,7%, respectivamente, en la cohorte GLADEL)18. La detección de NL en estadios tempranos o asintomáticos podría implicar mejores resultados tras la aplicación de tratamiento inmunosupresor.
Por otro lado, nuestros datos mostraron una asociación estadística significativa entre la presencia de NL y la ocurrencia de livedo reticular e hipertensión arterial como síntomas en la evolución del LES, con independencia del tiempo de aparición. En el lupus, la livedo reticular puede ser un signo de la presencia de anticuerpos antifosfolipídicos21. En nuestra cohorte no se encontraron diferencias significativas entre los pacientes que presentaron livedo reticular y anticuerpos anticardiolipina IgG positivos (52,9 vs. 47,1%; p=0,085). El mecanismo fisiopatológico subyacente que explica la alta prevalencia de la hipertensión arterial en los pacientes lúpicos no está dilucidado. Aunque el daño glomerular y la disfunción del endotelio vascular renal son probables contribuyentes, la hipertensión también puede estar presente en pacientes sin compromiso renal. Se han propuesto varios mecanismos para esta asociación22.
La NL típicamente se desarrolla temprano en el curso de la enfermedad, generalmente dentro de los primeros 6-36 meses23; por tanto, la búsqueda activa de marcadores de lesión renal debería ser una constante en la práctica clínica, con el subsecuente estudio histopatológico en quienes se sospeche el compromiso renal24,25.
En conclusión, es posible afirmar que la cohorte analizada de pacientes con NL, por sus características demográficas y clínicas, es una población similar a la de otras áreas geográficas, y que tanto la búsqueda sistemática como el reconocimiento temprano de la lesión renal son estrategias sencillas que pueden determinar el desenlace clínico, en términos de morbilidad.
LimitacionesLas limitaciones del presente estudio derivan principalmente de las relacionadas con el diseño transversal y la pérdida de datos relacionada con las biopsias renales. Aunque los hallazgos nos permiten la generación de hipótesis, están limitados a la hora de establecer causalidad y asociación temporal, de manera que, aun cuando hubiera sido interesante evaluar la evolución a enfermedad renal crónica, ese tipo de análisis no es metodológicamente correcto. Podría existir la presencia tanto de sesgos de selección o información, como de confusión, debido al origen de los datos analizados, registros de una base de datos.
FinanciaciónNinguna entidad proporcionó financiación económica para la realización del estudio y la preparación del artículo.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses para la elaboración de este artículo.