La sarcoidosis es una enfermedad granulomatosa crónica, que se ha relacionado con la exposición a antígenos ambientales entre los que se incluye el contacto previo con agentes infecciosos y variedad de partículas orgánicas e inorgánicas. Existe una forma de presentación aguda de esta enfermedad que cursa con hallazgos clínicos estereotípicos denominada síndrome de Löfgren. Nosotros presentamos un caso de una paciente con todos los hallazgos característicos de este síndrome.
Sarcoidosis is a chronic granulomatous disease that has been linked to exposure to certain environmental antigens, including previous contact with infectious agents, and a variety of other organic and inorganic particles. There is an acute form of presentation of this disease that courses with stereotypical clinical findings known as Löfgren's syndrome. A case is presented of a female patient with all the characteristic features of this syndrome.
La sarcoidosis es una enfermedad multisistémica, de etiología desconocida, caracterizada por la formación de granulomas no caseificantes en diferentes tejidos corporales, de los cuales los más frecuentemente afectados son los ganglios linfáticos y los pulmones1. Su etiología no está por completo entendida; se sabe que la exposición a diferentes tipos de material particulado orgánico e inorgánico, y a antígenos microbianos, está relacionada con la formación de los granulomas2. Una forma de presentación aguda de esta entidad, caracterizada por la intercurrencia de adenopatías pulmonares hiliares, eritema nudoso y artralgias, se conoce como síndrome de Löfgren. Este afecta a ambos sexos en proporción similar (55% hombres, 45% mujeres), con una mayor incidencia para ambos sexos entre los 30 y los 40 años de edad, y con un segundo pico en las mujeres de entre 45 y 65 años3. En Colombia, en 1977, un reporte de 51 casos de sarcoidosis describió 27 casos en hombres y 24 en mujeres; solo se documentó un caso de una mujer que inició con hallazgos compatibles con síndrome de Löfgren4. A continuación, describimos el caso de una paciente que se presentó con hallazgos característicos de esta entidad a nuestro servicio.
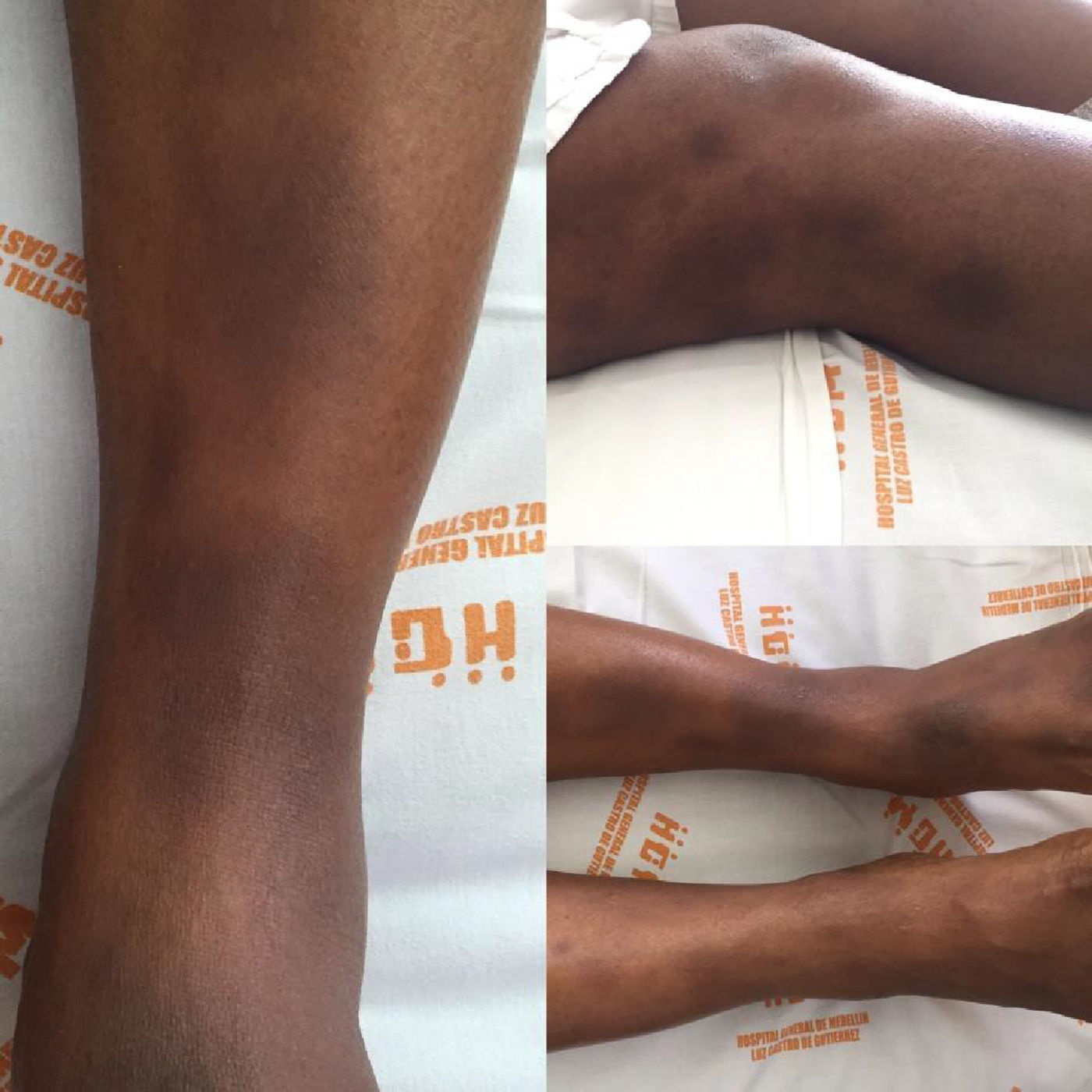
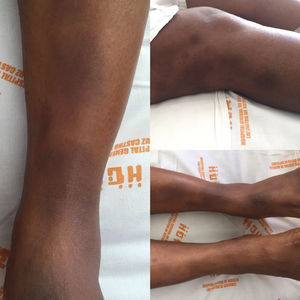
Reporte de casoMujer de 34 años de edad de raza negra con antecedente personal de hidradenitis supurativa en el 2008, quien ahora consulta por cuadro clínico de 15 días de evolución consistente en osteomialgias generalizadas, artralgias de tipo inflamatorio en muñecas, codos, rodillas y tobillos, que posteriormente se asocia a oligoartritis de muñeca derecha y ambos tobillos. Simultáneamente con fiebre objetiva de hasta 39°C y nódulos eritematosos dolorosos en miembros inferiores por debajo de las rodillas y de localización pretibial. Al examen físico se aprecia artritis de tobillo izquierdo y múltiples nódulos eritematosos dolorosos a la palpación en miembros inferiores, en región pretibial, los cuales tienden a confluir (fig. 1).
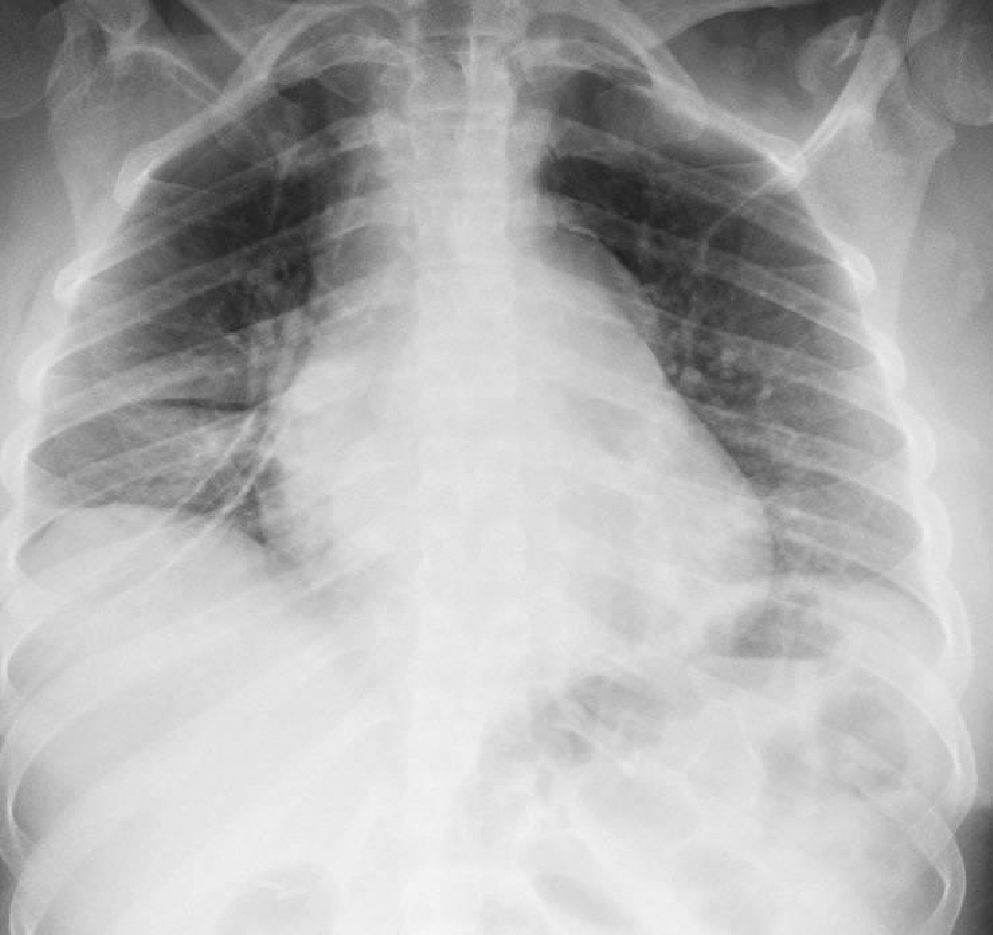
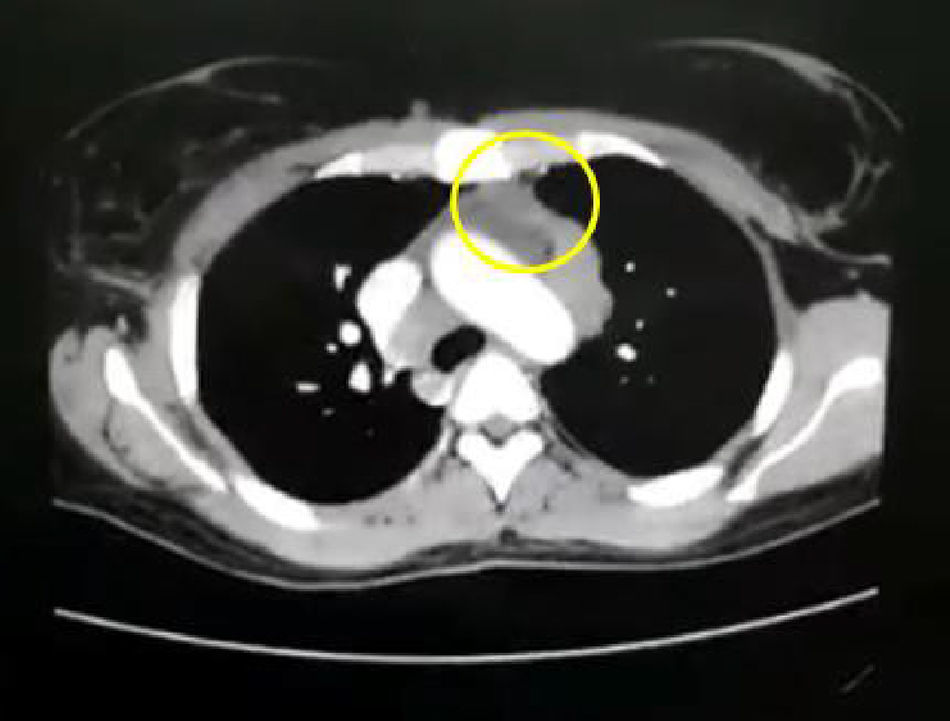
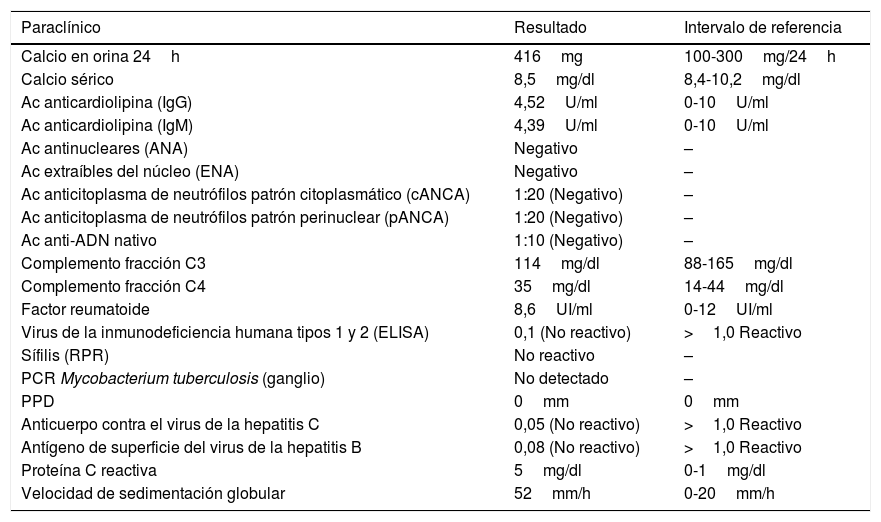
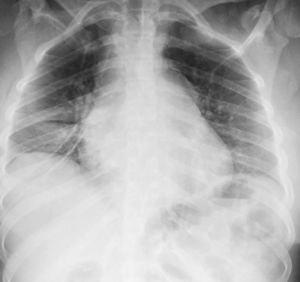
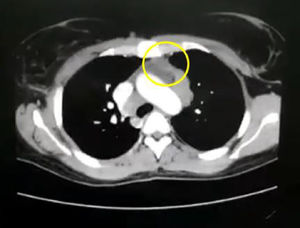
En los paraclínicos, como únicos hallazgos relevantes se encuentra un ensanchamiento del mediastino observado en rayosX de tórax (fig. 2), secundario a múltiples adenopatías de localizaciones paratraqueales, hiliares derechas, paraesofágicas y en estación 6, descritas en tomografía de tórax (fig. 3), e hipercalciuria correspondiente a un valor de 416mg en 24h. Se descartan otros procesos autoinmunes con negatividad para anticuerpos anticardiolipina IgG e IgM, anticuerpos antinucleares (ANA), anticuerpos extraíbles del núcleo (ENA), anticuerpos anticitoplasma de neutrófilos (ANCA) tinción perinuclear y citoplasmática, anticuerpos antiácido desoxirribonucleico (anti-ADN) nativo, y factor reumatoide. Se excluyen también enfermedades infecciosas como virus de la inmunodeficiencia humana (VIH), sífilis y virus de las hepatitis B y C (tabla 1).
Resultados de exámenes de laboratorio
| Paraclínico | Resultado | Intervalo de referencia |
|---|---|---|
| Calcio en orina 24h | 416mg | 100-300mg/24h |
| Calcio sérico | 8,5mg/dl | 8,4-10,2mg/dl |
| Ac anticardiolipina (IgG) | 4,52U/ml | 0-10U/ml |
| Ac anticardiolipina (IgM) | 4,39U/ml | 0-10U/ml |
| Ac antinucleares (ANA) | Negativo | – |
| Ac extraíbles del núcleo (ENA) | Negativo | – |
| Ac anticitoplasma de neutrófilos patrón citoplasmático (cANCA) | 1:20 (Negativo) | – |
| Ac anticitoplasma de neutrófilos patrón perinuclear (pANCA) | 1:20 (Negativo) | – |
| Ac anti-ADN nativo | 1:10 (Negativo) | – |
| Complemento fracción C3 | 114mg/dl | 88-165mg/dl |
| Complemento fracción C4 | 35mg/dl | 14-44mg/dl |
| Factor reumatoide | 8,6UI/ml | 0-12UI/ml |
| Virus de la inmunodeficiencia humana tipos 1 y 2 (ELISA) | 0,1 (No reactivo) | >1,0 Reactivo |
| Sífilis (RPR) | No reactivo | – |
| PCR Mycobacterium tuberculosis (ganglio) | No detectado | – |
| PPD | 0mm | 0mm |
| Anticuerpo contra el virus de la hepatitis C | 0,05 (No reactivo) | >1,0 Reactivo |
| Antígeno de superficie del virus de la hepatitis B | 0,08 (No reactivo) | >1,0 Reactivo |
| Proteína C reactiva | 5mg/dl | 0-1mg/dl |
| Velocidad de sedimentación globular | 52mm/h | 0-20mm/h |
Ac: anticuerpo; ELISA: enzyme-linked immunosorbent assay; PCR: polymerase chain reaction; PPD: purified protein derivative; RPR: rapid plasma reagin.
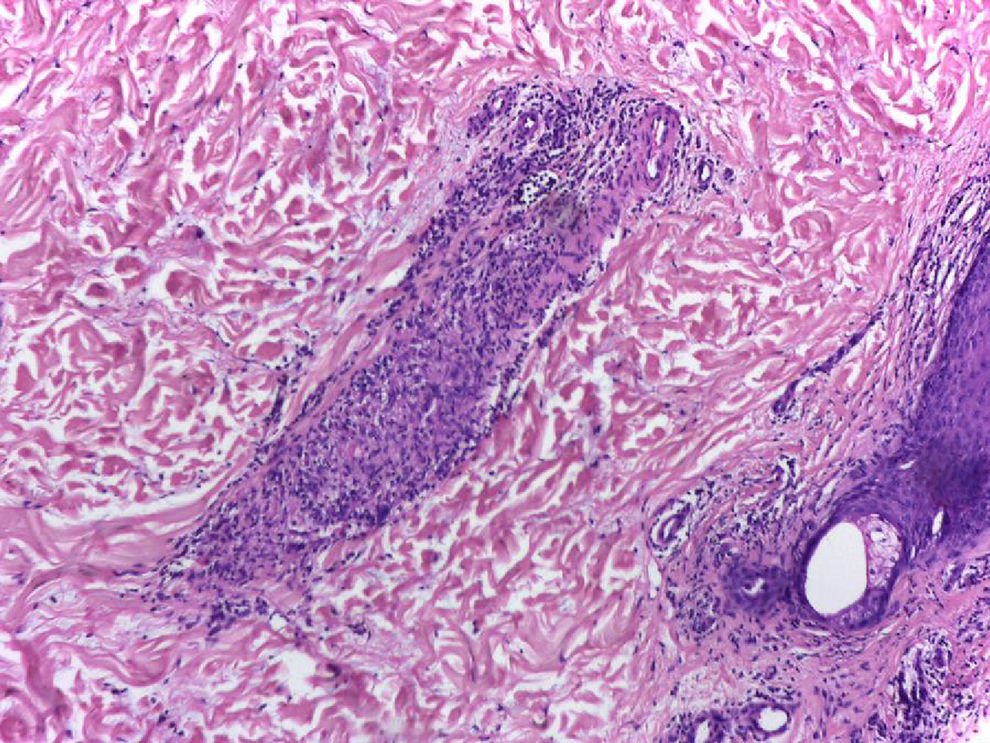
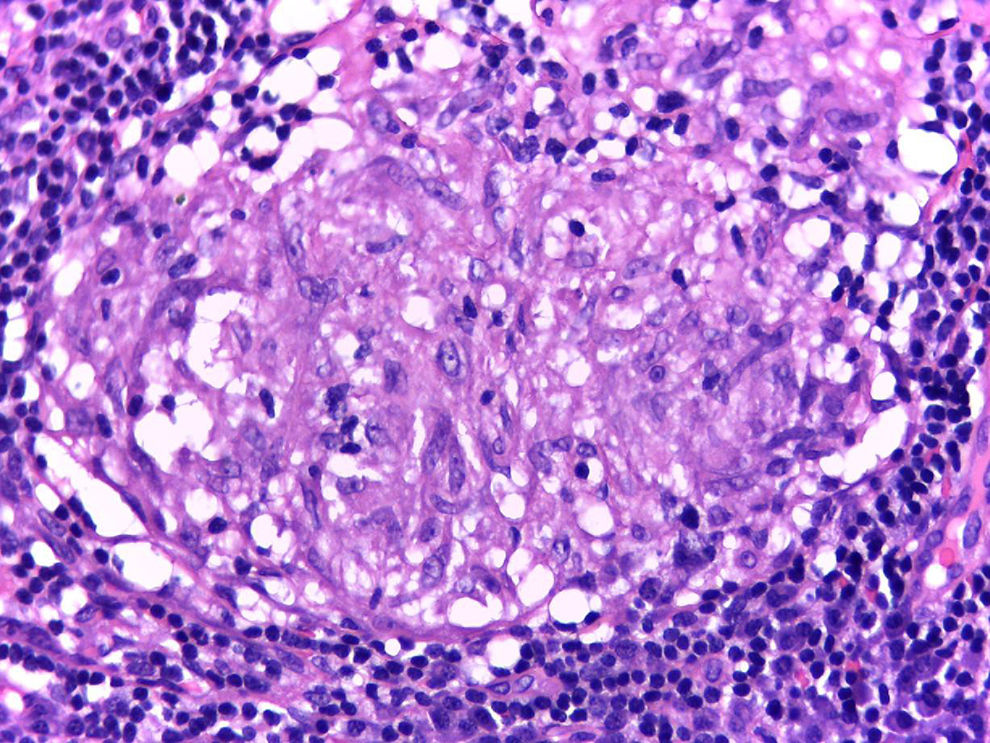
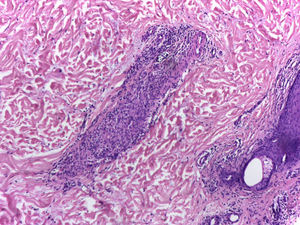
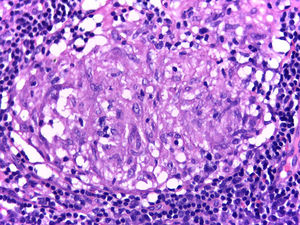
Se realiza biopsia de piel que reporta proceso inflamatorio de localización septal en tejido celular subcutáneo, caracterizado por acúmulo de linfocitos, plasmocitos y células gigantes multinucleadas, además de escasos polimorfonucleares neutrófilos, hallazgos acordes con eritema nudoso (fig. 4). Posteriormente, se reseca adenopatía del mediastino por toracoscopia, en la cual se observa inflamación granulomatosa crónica sin necrosis de caseificación (fig. 5); ambas enfermedades con estudios negativos para infecciones y neoplasias, confirmando así el diagnóstico de síndrome de Löfgren.
Durante la hospitalización se decide iniciar manejo con colchicina y cloroquina, tanto para controlar los síntomas de la paciente como para mejorar la hipercalciuria. Debido a la evolución satisfactoria, se decide dar de alta adicionando esteroides a su tratamiento.
DiscusiónLa sarcoidosis es una enfermedad de difícil diagnóstico debido a los posibles diferenciales con características clínicas similares, a la ausencia de una prueba diagnóstica específica y a las diferentes condiciones que pueden presentar hallazgos similares en la histopatología. Dentro de los posibles diferenciales encontramos etiologías que puedan causar una reacción granulomatosa (incluyéndose infecciones por micobacterias, hongos, malignidad, enfermedad inflamatoria intestinal, granulomatosis con poliangeítis, linfogranulomatosis, arteritis de células gigantes, lupus eritematoso, poliarteritis nudosa, granulomatosis eosinofílica con poliangeítis, entre otras)2,5. Se debe indagar por exposición a partículas ocupacionales y ambientales para excluir entidades como la beriliosis, que puede pasar desapercibida en el 40% de los casos, y otras entidades como la silicosis y la asbestosis6. La interacción con aerosoles orgánicos juega un papel muy importante a la hora de descartar otras enfermedades, pues esto es potencial causante de la neumonitis de hipersensibilidad, ocasionando así síntomas respiratorios similares a los de la sarcoidosis6.
Aunque no hay estudios específicos para realizar el diagnóstico de sarcoidosis, se han desarrollado pruebas para intentar excluir otras causas o para evaluar la actividad de la enfermedad. La enzima convertidora de angiotensina está elevada en el 60% de los pacientes con sarcoidosis de presentación aguda y en el 10% con sarcoidosis crónica. Además, niveles superiores a 2 veces el límite normal disminuyen la probabilidad de enfermedades, como causas neoplásicas (linfoma)7. Desafortunadamente, la falta de especificidad y sensibilidad de dicha prueba8, adicionado al polimorfismo del gen que sintetiza esta enzima, ha causado que no sea útil como prueba de tamiz6.
Una de las formas agudas que puede presentar esta enfermedad es el síndrome de Löfgren, originalmente descrito por Löfgren y Lundback en 19529. Típicamente incluye concurrentemente eritema nudoso (forma más frecuente en las mujeres)1, el cual fue reportado en el 58% de los pacientes estudiados en una serie de casos en el Hospital Universitario de Karolinska en Suecia; artralgias inflamatorias, las cuales estaban asociadas al eritema nudoso en el 79,8% de los pacientes de esta serie; y adenopatías hiliares bilaterales, encontradas en el 100% de los pacientes con presentación aguda10. Al encontrarse los elementos que configuran el síndrome, la especificidad para el diagnóstico de sarcoidosis es de hasta el 95%11; sin embargo, este diagnóstico es de exclusión y no representa la única causa identificable de eritema nudoso, siendo, en la mayoría de los casos, idiopático12. La tríada puede estar presente desde el inicio en el 60% de los casos, las recurrencias son poco frecuentes (17%) y generalmente no hay compromiso grave de órganos, por lo que se considera una forma relativamente benigna de la presentación de sarcoidosis13,14.
El eritema nudoso es una forma de paniculitis neutrofílica de etiología no completamente entendida; no obstante, se le ha vinculado al depósito de complejos inmunes en las venas de los septos de la grasa subcutánea15. Se ha descrito su vinculación a sarcoidosis como una variación genética de locus de LTA/TNF, en población caucásica del estudio ACCESS16.
La sarcoidosis, por su parte, es una enfermedad granulomatosa sistémica, de etiología no completamente entendida. Se ha propuesto que, al ser los pulmones, los ojos y la piel los órganos más afectados, hay una asociación entre antígenos transportados por el aire y la génesis de la enfermedad. Al parecer, diversos agentes infecciosos y agentes orgánicos o inorgánicos tienen la capacidad de depositar antígenos no degradables que inducen una respuesta contra antígenos propios. Lo anterior causaría activación de las células T por células presentadoras de antígenos, con posterior reclutamiento de macrófagos que al compactarse forman los granulomas de células epiteloides1. Se han vinculado a los antígenos de Mycobacterium tuberculosis como potenciales agentes causantes de sarcoidosis17, aunque en esta paciente no se demostró infección por la misma. Por lo anterior, siempre se deben realizar estudios para descartar infección activa por tuberculosis que pueda simular la enfermedad o contraindicar inmunosupresión. Generalmente, se han propuesto la prueba de derivado proteico purificado (PPD) o pruebas de liberación de interferón gamma (IGRA)5 como parte del tamizaje. Sin embargo, se ha encontrado que los péptidos ESAT-6 y KatG de las micobacterias inducen mayor producción de interferón gamma por las células T comparado con la PPD18, y en diferentes series se han reportado falsos negativos de la PPD frente al IGRA que sugieren un estado de anergia hacia estos derivados proteicos en la enfermedad19,20, con un rendimiento del IGRA que parece no ser afectado por el tratamiento ni la actividad de la sarcoidosis21,22, por lo que la literatura sugiere que en caso de tamización para tuberculosis se prefiera el IGRA antes que la PPD.
Un hallazgo asociado importante, documentado en nuestra paciente, fue la hipercalciuria. Esta se puede encontrar entre el 40 y el 62% de los casos de sarcoidosis; la hipercalcemia es menos frecuente y suele ser asintomática, afectando alrededor del 5% de los pacientes23,24. Los trastornos del calcio en el contexto de la sarcoidosis al parecer son favorecidos por la conversión de 25 hidroxivitamina-D en 1.25 hidroxivitamina-D, por la expresión de alfa 1 hidroxilasa en los granulomas. Se ha propuesto también la presencia de un péptido similar a la paratohormona originado de igual manera en los granulomas24,25.
El tratamiento de la sarcoidosis depende de la gravedad de las manifestaciones y de los órganos comprometidos26. Cuando la afección es principalmente cutánea, están indicados los esteroides y el tacrolimús tópicos. A medida que se considere que haya mayor impacto sistémico, se pueden utilizar medicamentos inmunomoduladores (cloroquina, hidroxicloroquina) e inmunosupresores (prednisona, metotrexato, azatioprina, micofenolato mofetilo), e incluso fármacos biológicos antifactor de necrosis tumoral (adalimumab, infliximab)26,27, siendo estos últimos reservados para pacientes con sarcoidosis pulmonar o extrapulmonar que no han respondido a tratamientos previos28,29. En el caso de la hipercalciuria, generalmente, el manejo se ha basado en esteroides y antimaláricos30, los cuales fueron administrados a nuestra paciente. Además, se ha descrito el uso de colchicina en pacientes que presenten síndrome de Löfgren y eritema nudoso28.
La importancia de este reporte radica en atraer la atención del clínico hacia una enfermedad poco frecuente como es la sarcoidosis y, en el contexto de esta, el síndrome de Löfgren. En estos casos se puede impactar de forma favorable en la salud del paciente con una terapéutica basada en medicamentos básicos3, con una respuesta clínica satisfactoria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Sebastián Herrera Uribe, médico reumatólogo del Hospital General de Medellín, por las facilidades para la investigación del caso y aportes clínicos.