El tumor de células gigantes óseo (TCG) es una entidad benigna, caracterizada por crecimiento local agresivo y enfermedad metastásica rara. La incidencia en el esqueleto inmaduro reportada es menor al 10% (1,8-10,6%). Pocas series reportan TCG en el esqueleto inmaduro. En nuestro país, la incidencia global y la incidencia del TCG en pacientes esqueléticamente inmaduros es desconocida. Presentamos una serie de 11 casos que demuestra sus características demográficas, tratamiento y seguimiento.
MétodosEntre los años 2000 y 2014, un total de 11 de 77 pacientes tratados y seguidos en nuestra institución por TCG presentaron inmadurez esquelética en el momento del diagnóstico. Se realizó un análisis retrospectivo. Todos tuvieron confirmación histológica de TCG y en todos los casos se revisaron radiografías, tomografía computarizada de tórax, gammagrafía ósea y resonancia magnética de la región comprometida. Se determinó madurez esquelética si se presentaban fisis abiertas en el momento del diagnóstico. La media de seguimiento fue 6,6 años (rango de 2 a 10 años)
ResultadosUn total de 8 niñas y 3 niños comprometidos por TCG, con una media de edad de 14,8 años en el momento del diagnóstico. Nuestra incidencia de TCG en pacientes esqueléticamente inmaduros fue del 7%. El compromiso fue alrededor de la rodilla en 8 casos, de los cuales 4 en fémur distal y 4 en tibia proximal, 2 en húmero proximal y 1 en un metatarsiano. Todos los pacientes fueron tratados con aloinjertos; 9 recibieron aloinjertos estructurales y 2, aloinjerto osteocondral. Un paciente recibió denosumab. Siete de 11 pacientes no presentaron complicaciones. Tres presentaron complicaciones: una recurrencia local, uno requirió retiro de material de osteosíntesis y el tercero se presentó con una fractura. El paciente que recibió aloinjerto osteocondral presentó una fractura traumática, que consolidó sin necesidad de manejo quirúrgico.
DiscusiónEl TCG en pacientes esqueléticamente inmaduros es raro y plantea un reto para el cirujano. La incidencia en nuestra práctica es similar a la reportada en la bibliografía. Se logró una reconstrucción exitosa en la gran mayoría de pacientes, con una recurrencia local en solo un caso. La reconstrucción con aloinjertos se presenta como un buen método de tratamiento con resultados exitosos. La modalidad de nuestro estudio limita nuestra capacidad de evaluar efectividad y la baja incidencia en este grupo etario limita el número de casos presentados. Un estudio prospectivo que adicionalmente tenga en consideración aspectos como discrepancia de longitud, recurrencia local y escalas funcionales podría servir para mejorar nuestro conocimiento acerca del impacto del tratamiento en esta población.
Nivel de evidencia clínicaNivel IV.
Giant cell tumours (GCT) of the bone are benign and consist of aggressive local growth with rare metastatic disease. Its reported incidence in the immature skeleton is less than 10%, ranging from 1.8% to 10.6%. Few GCT series have been reported in the immature skeleton. In our ¿country?, the overall incidence and impact of GCT in these patients is unknown. A series of 11 cases is presented, demonstrating their demographic characteristics, treatment, and follow-up.
MethodsBetween the year 2000 and 2014, out of a total of77 patients with GCT, 11 of them presented with skeletal immaturity at the time of diagnosis. These patients were treated and followed-up in our institution. A retrospective analysis was performed. All patients had histologically confirmed GCT, and in all cases a review was made of the X-rays, chest CT and, bone scans, and MRI scans of the compromised region. Skeletal maturity was determined if there was open physes at the time of diagnosis. The mean follow-up was 6.6 years (range 2 to 10 years)
ResultsA total of 8 females and 3 males, with a mean age of 14.8 years at the time of diagnosis, presented with a GCT. The incidence of GCT in the skeletally immature patient was 7%. The compromised site was: around the knee in 8 cases, of which 4 were in the distal femur and 4 in the proximal tibia, with two in the proximal humerus and one in a metatarsal. All patients were treated with allografts. Nine received structural allografts and two osteochondral allografts. One patient received denosumab. Seven out of the 11 patients had no complications. Three did have complications. One had a local recurrence, one required removal of hardware material, and a third presented with a fracture. The patient treated with osteochondral allograft presented with a traumatic fracture, which consolidated without surgical management.
DiscussionGCT in the skeletally immature patient is rare, and poses a challenge for the surgeon. The impact on our practice is similar to that reported in the literature. In our series, successful reconstruction was achieved in the majority of patients, with one local recurrence. Allograft reconstruction is a good method of treatment, with successful results. The modality of our study limits our ability to assess effectiveness, and the low incidence in this age group limits the number of cases presented. A prospective study could further consider other aspects, such as length discrepancy and local recurrence, and functional scales could improve our knowledge about the impact of treatment in this population.
Evidence levelIV.
Las lesiones óseas ricas en células gigantes incluyen tanto procesos reactivos como neoplasias benignas y malignas, y se caracterizan por presentar células gigantes multinucleadas similares a los osteoclastos1. Estas células están presentes en una variedad de lesiones óseas, que incluyen, entre otras, el granuloma reparativo de células gigantes, el quiste óseo aneurismático, el condroblastoma, los tumores pardos por hiperparatiroidismo, los osteosarcomas telangiectásicos, así como el tumor de células gigantes óseo2.
El tumor de células gigantes óseo (TCG) es una neoplasia benigna, localmente agresiva, con potencial maligno, de causa desconocida, compuesto por células mononucleares que están inmersas entre numerosas células gigantes multinucleadas similares a osteoclastos3,4. Generalmente se localiza en las metáfisis y epífisis de huesos largos, y es localmente destructivo. A pesar de ser benigno, puede llegar a ocasionar metástasis pulmonares en el 4%, así como excepcionalmente presentarse de forma metacrónica y multicéntrica5. Existe una forma maligna que es mas frecuente después de recurrencias o postirradiacion6. El TCG se presenta típicamente en personas con edades entre 20 y 40 años, es raro en niños y adolescentes, y en pacientes mayores de 65 años, y presenta una predilección por el sexo femenino de 1,2:1. Su incidencia es aproximadamente del 5% de todos los tumores óseos en Estados Unidos y del 20% de todos los tumores benignos óseos, con incidencias reportadas mayores en países asiáticos7, y desconocida en nuestro país. Ha sido reportado en todos los huesos. Sin embargo, sus localizaciones más frecuentes son la región metafisoepifisaria del fémur distal, tibia proximal y radio distal.
Existen muy pocas series y reportes de caso que presentan TCG en niños y adolescentes debido a su baja frecuencia en este grupo etario, lo que hace que su tratamiento en esta población esté basado principalmente en la experiencia en pacientes adultos. La incidencia reportada de grandes centros de referencia, en pacientes esqueléticamente inmaduros con diagnóstico de TCG esté entre el 1,8 y el 10,6%7–9. En nuestro país, la incidencia general del TCG, así como la incidencia de TCG en pacientes esqueléticamente inmaduros es desconocida.
Presentamos una serie de 11 pacientes diagnosticados con TCG que demostraron inmadurez esquelética en el momento del diagnóstico, sus características demográficas, tratamiento y seguimiento.
Materiales y métodosSe realizó una búsqueda retrospectiva de todos los pacientes tratados y seguidos en nuestra institución entre los años 2000 y 2014 por diagnóstico de TCG. Se encontró un total de 77 pacientes con diagnóstico de TCG, de los cuales 11 presentaban inmadurez esquelética en el momento del diagnóstico y se realizó un análisis retrospectivo de estos pacientes. Todos los pacientes tuvieron confirmación histológica de TCG; en todos los casos se revisaron las imágenes disponibles (radiografías, TC de tórax, gammagrafía ósea y RM de la región comprometida).
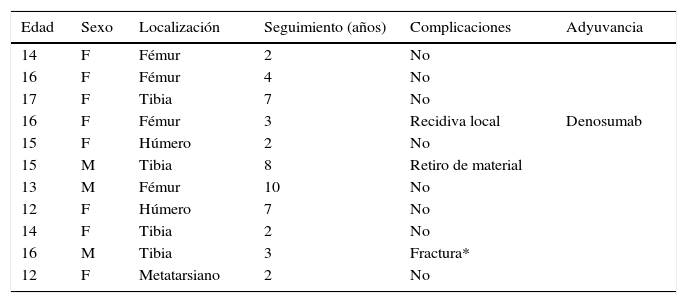
Se determinó madurez esquelética si presentaban fisis abiertas en el momento del diagnóstico en la radiografía. Se presentan las características en la tabla 1. Ninguno de los pacientes presentó TCG multicéntrico en el momento del diagnóstico, ni metacrónico durante el seguimiento. No se evaluó ningún desenlace funcional.
Características de los pacientes
| Edad | Sexo | Localización | Seguimiento (años) | Complicaciones | Adyuvancia |
|---|---|---|---|---|---|
| 14 | F | Fémur | 2 | No | |
| 16 | F | Fémur | 4 | No | |
| 17 | F | Tibia | 7 | No | |
| 16 | F | Fémur | 3 | Recidiva local | Denosumab |
| 15 | F | Húmero | 2 | No | |
| 15 | M | Tibia | 8 | Retiro de material | |
| 13 | M | Fémur | 10 | No | |
| 12 | F | Húmero | 7 | No | |
| 14 | F | Tibia | 2 | No | |
| 16 | M | Tibia | 3 | Fractura* | |
| 12 | F | Metatarsiano | 2 | No |
* Se expone en los resultados que el paciente que presentó fractura del aloinjerto fue manejado de forma exitosa mediante tratamiento conservador ortopédico sin necesidad de reintervenciones quirúrgicas.
El estudio fue considerado sin riesgo por el comité de ética institucional y fue aprobado, con lo que cumplía así con lo establecido en la Resolución 8430 de 1993 del Ministerio de Salud de la República de Colombia en lo referente a normas técnicas y administrativas para la investigación en salud.
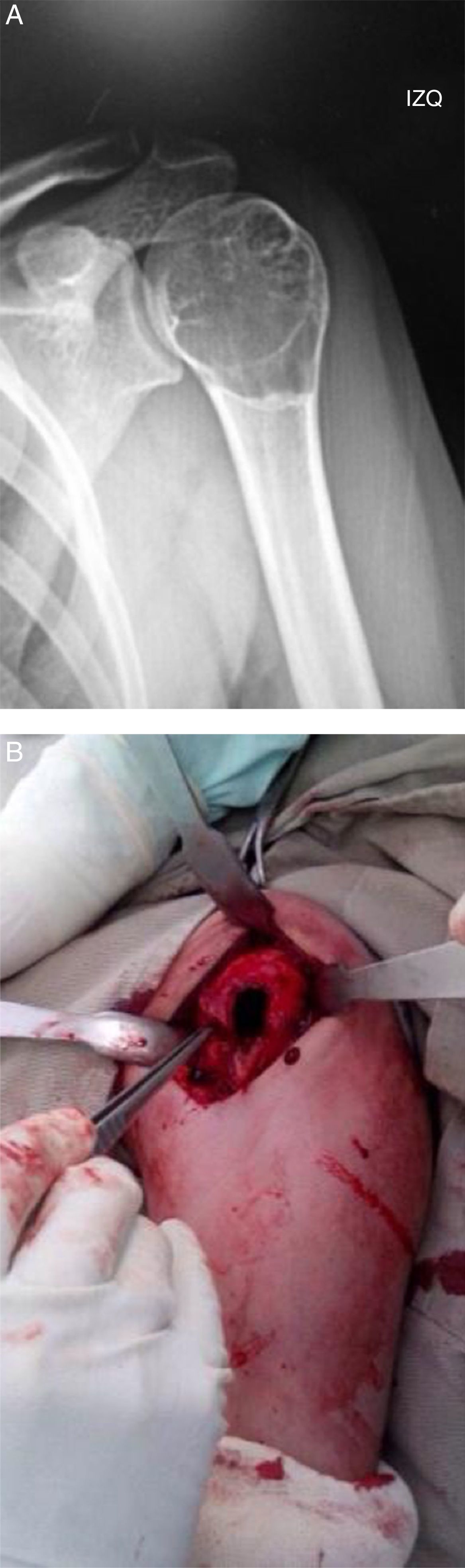
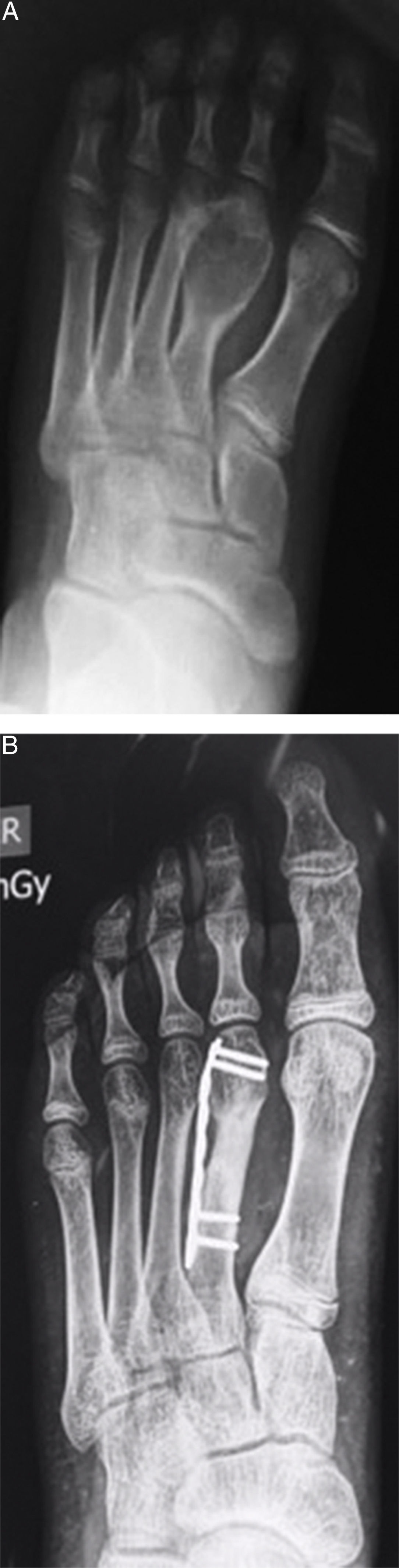
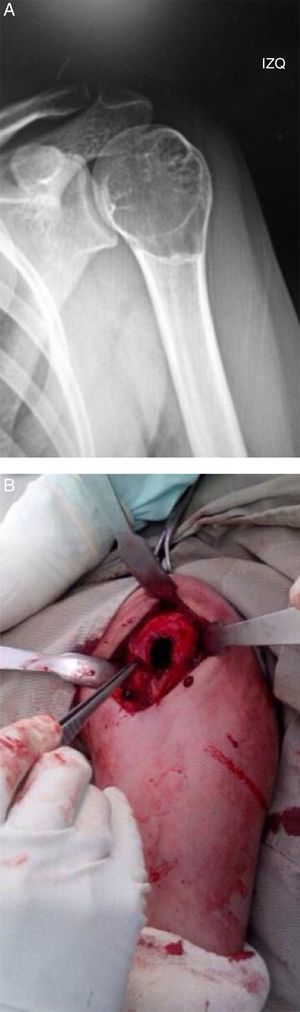
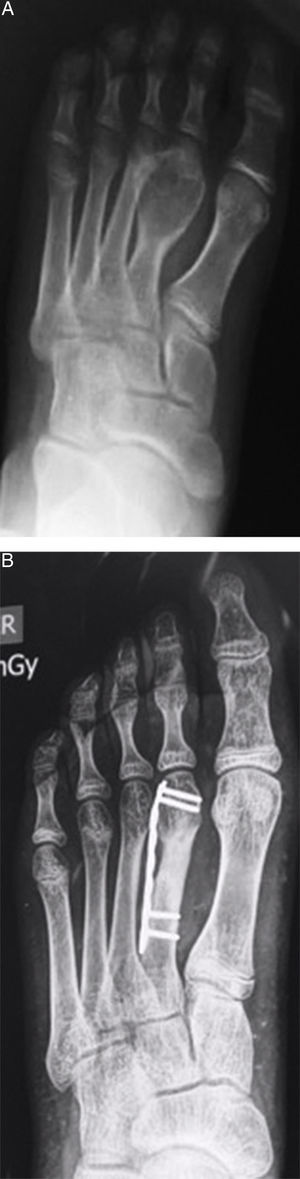
ResultadosSe obtuvo una incidencia del 7,7% de TCG en pacientes esqueléticamente inmaduros (11 de 77 pacientes). Un total de 8 niñas y 3 niños comprometidos por TCG, con una media de edad de 14,8 años (de 12 a 17). El sitio de compromiso fue, en 8 casos, alrededor de la rodilla, de los cuales 4 en fémur distal y 4 en tibia proximal, y 2 en húmero proximal (fig. 1) y 1 en un metatarsiano (fig. 2).
En todos los pacientes se realizó tratamiento estandarizado consistente en abordaje de la lesión con exposición mediante ventana ósea, curetaje extendido con fresado de alta velocidad y adyuvancia local con nitrógeno líquido, más aplicación de aloinjerto óseo para llenado de la cavidad (fig. 1B)10–12.
En nuestra serie, 10 de 11 pacientes se presentaron en estadio II de Campanacci y 1 en estadio III. Ninguno de los pacientes en nuestro estudio presentó metástasis pulmonares ni compromiso multicéntrico. Se presentaron 3 complicaciones: el paciente que recibió reconstrucción con aloinjerto osteocondral de tibia proximal presentó como complicación fractura del aloinjerto a los 7 meses de la aplicación, que se manejó de forma ortopédica. Un paciente presentó una recidiva local y recibió manejo con denosumab durante la recidiva, y un paciente requirió retiro de material de osteosíntesis por dolor postoperatorio. Se requirió revisión histológica extrainstitucional en 1 caso, lo que confirmó el diagnóstico de TCG.
No se encontraron diferencias clínicamente significativas en las extremidades tratadas comparadas con las contralaterales en cuanto a dismetría o deformidad angular.
DiscusiónUno de los criterios que se tienen en cuenta en la aproximación diagnóstica frente a tumores óseos, aparte de las características radiológicas y clínicas, es la edad de los pacientes. Cuando un tumor se presenta fuera del rango de edad esperado, su diagnóstico se dificulta. El TCG óseo tiene predilección por grupos etarios entre los 20 y los 40 años. Sin embargo, puede presentarse en pacientes niños y adolescentes.
La incidencia en nuestro estudio de TCG en pacientes esqueléticamente inmaduros es del 7,7%, lo que está dentro de los rangos reportados en la bibliografía. Lichtenstein, en su tratado de tumores óseos de 1959, planteó que las probabilidades están muy en contra de cualquiera que se aventure a diagnosticar un tumor de células gigantes en un niño o adolescente5. Sin embargo, 2 años más tarde, en 1961 Sherman y Richard publicaron el primer caso de TCG óseo del radio distal en un niño de 15 años13.
Posteriormente existen varios reportes de casos aislados de TCG óseo en niños, entre ellos el publicado por Peison en 1976 de una niña de 14 años con TCG en la metáfisis del radio distal, donde además se plantea por primera vez la hipótesis de que el TCG óseo surge en la metáfisis y permanece asintomático durante algún tiempo por la restricción de la metáfisis por la placa de crecimiento y que, una vez que esta presenta cierre, la lesión se expande hacia la epífisis y se vuelve sintomática14.
Picci publicó la primera serie de 6 casos de TCG óseo en pacientes esqueléticamente inmaduros, con una incidencia del 1,8%, donde también pone de manifiesto el compromiso principalmente metafisario y plantea en este lugar su origen.
Puri reportó en 2007 una nueva serie de casos de TCG en pacientes niños y adolescentes, y demostró una incidencia del 6% de todos los TCG en esta población. Reportó también una incidencia mayor de TCG óseo en todos los grupos etarios en pacientes asiáticos comparados con la población caucásica.
Se han planteado también condiciones como la etnicidad o el nivel socioeconómico como factores importantes que pueden alterar la edad en que se presenta el cierre fisario y tener consecuencias en la edad de presentación de este tipo de tumores15,16.
Un reto en el tratamiento de pacientes de estas edades con tumores cercanos a la fisis es la repercusión sobre el crecimiento y posibles deformidades angulares que se derivan de su manejo. Sin embargo, la mayoría de estos pacientes, para el TCG óseo en niños y adolescentes, están cercanos a la madurez esquelética con un bajo potencial residual de crecimiento. En el seguimiento clínico no encontramos alteraciones en cuanto a dismetría o deformidad, posiblemente porque todos los pacientes estaban cercanos al cierre fisario.
Nuestro estudio tuvo como limitación que no incluimos evaluación funcional, que limita la posibilidad de recomendar este tipo de tratamiento sobre algún otro. Sin embargo, el tratamiento presentado es el tratamiento convencional del TCG.
En los últimos años se ha incluido entre los medios de tratamiento del TCG al denosumab, un anticuerpo monoclonal humano que inhibe al RANK ligando. Las células gigantes similares a osteoclastos, así como las células estromales del TCG, expresan RANKL y son responsables de la agresividad osteolítica del tumor17,18. El denosumab ha demostrado inhibir los osteoclastos por la vía RANK/RANKL, por lo que se ha propuesto como medio para inhibir la actividad de células gigantes, similares a osteoclastos, en el TCG. En los estudios clínicos, su aplicación ha demostrado la eliminación histopatológica de células gigantes y la estabilización radiológica. Inicialmente se usa en casos de TCG irresecable o recurrente, o en los casos en que la cirugía conlleve mayor comorbilidad19,20. A pesar de lo prometedor de sus efectos, aún existen muchas preguntas sin responder especialmente en cuanto a su uso crónico, sus efectos en el esqueleto inmaduro o la duración de sus efectos. La dosis óptima, así como los efectos a largo plazo del denosumab en población joven afectada por TCG aún están por definirse21,22.
El TCG en pacientes esqueléticamente inmaduros es raro y plantea un reto para el cirujano. La incidencia en nuestra práctica es similar a la reportada en la bibliografía. Se logró una reconstrucción exitosa en la gran mayoría de pacientes, con una recurrencia local en solo un caso. La reconstrucción con aloinjertos se presenta como un buen método de tratamiento con resultados exitosos. La modalidad de nuestro estudio limita nuestra capacidad de evaluar la efectividad y la baja incidencia en este grupo etario limita el número de casos presentados. Un estudio prospectivo que adicionalmente tenga en consideración aspectos como discrepancia de longitud, recurrencia local y escalas funcionales podría servir para mejorar nuestro conocimiento acerca del impacto del tratamiento en esta población.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNingún autor presenta conflicto de intereses.