El síndrome de spasticity plus (SSP) es un conglomerado de síntomas clínicos que se ha propuesto recientemente como una opción diagnóstica en pacientes con enfermedad desmielinizante. Su diagnóstico puede ayudar a evitar la polimedicación en estos pacientes y a mejorar la gestión de la sintomatología a largo plazo.
ObjetivoRealizar un estudio retrospectivo para identificar el número de pacientes de la consulta de enfermería que podrían ser compatibles con el SSP, analizando una ventana temporal desde el 2002 hasta el 2022.
MétodosSe registraron los síntomas compatibles con SSP al inicio y al final de la ventana temporal, así como el número de tratamientos sintomáticos que se pautaron en ambos momentos.
ResultadosEn el 100% de los casos analizados se cumplían criterios de SSP, asociando a la espasticidad el dolor (90%), rigidez (83,3%), fatiga (75%) y trastornos de vejiga (43,3%). El número de tratamientos aumentó con el tiempo, de 1,4 a 3,9 de media; el THC:CBD fue uno de los más frecuentemente utilizados (88,9% lo utilizó). No se ha encontrado correlación entre el número de síntomas registrados al inicio y el número de tratamientos sintomáticos registrados al final del periodo de análisis, ni tampoco entre el número de tratamientos y la discapacidad física.
ConclusionesEl SSP es fácilmente detectable en la consulta y debería ser más e diagnosticado con más frecuencia para proporcionar al paciente una gestión individualizada de sus síntomas, con tratamientos a medio y largo plazo que mejoren su calidad de vida.
Spasticity plus syndrome (SSP) is a clinical diagnosis based on the presence of a compendium of symptoms that has been suggested recently in patients with demyelinating disease. Using this diagnosis might help to avoid polimedication and to offer a better symptomatology management in long-term patients.
ObjectiveThe aim of this study is to retrospectively analyze the number of cases compatible with a SSP diagnostic in our nurse clinical-consultancy.
MethodologyWe analyzed a time-window from 2002 till 2022 and we included cases compatible with SSP at those 2time-points as well as the number of symptomatic treatments prescribed also in both time-points.
ResultsAll cases in the databased were compatible with SSP and also associated pain (90%), rigidity (83.3%), fatigue (75%) and bladder problems (43.3%). An increase in symptomatic treatments was stated (from 1.4 to 3.9 at the end of the temporal window of analysis), and THC:CBD was prescribed in 88.9% of them. There was no correlation between number of symptoms at the beginning and number of symptomatic treatments at the end of the time-window. No correlation either was found between number of symptomatic treatments and physical disability.
ConclusionsSSP is relatively easy to be diagnosed in our consultancy and it should be more frequently stated as it will offer the opportunity to individual management of symptoms and treatments for our patients that could impact their quality of life in the long-term.
Un síndrome clínico se define como la combinación de signos o síntomas que conforman una entidad clínica distinta indicativa de una enfermedad o trastorno. Habitualmente, se considera que estos signos o síntomas tienen una fisiopatología común o próxima, o bien responden a un mismo tratamiento, directa o indirectamente, a pesar de que las manifestaciones clínicas puedan ser variadas1.
En pacientes con esclerosis múltiple (EM), la espasticidad es un síntoma frecuente, que se define como un trastorno motor caracterizado por un reflejo exagerado de flexión muscular dependiente de la velocidad, resultado de una alteración del procesamiento intraespinal del input aferente primario2. La espasticidad se asocia a otros síntomas propios de la enfermedad, como la fatiga, el dolor, los trastornos de control de esfínteres o del sueño, que impactan negativamente en la calidad de vida. Esta circunstancia ocasiona pacientes con EM polimedicados debido a la necesidad de manejar varios síntomas de forma simultánea, además de recibir su tratamiento modificador de la enfermedad para la EM. Esto genera una situación clínica de difícil manejo, con un aumento de posibles efectos secundarios derivados de la polimedicación y una gestión más compleja de la adherencia de los pacientes1.
Los síntomas de la espasticidad están interrelacionados con el tono muscular y son mediados, en gran parte, en las mismas zonas del tronco encefálico. El tratamiento de la espasticidad con tetrahidrocannabinol (THC:CBD) se ha asociado a una mejora de otros síntomas o funciones presentes en la EM. Por eso se propone un manejo de toda esta sintomatología con el menor número de tratamientos posibles, centrándose en el efecto positivo del uso de THC:CBD en varios de ellos1.
El síndrome de spasticity plus (SSP) se define como la existencia de un conjunto de síntomas asociados a la espasticidad como son la espasticidad y/o espasmos-calambres y/o dolor y/o disfunción vesical y/o trastornos del sueño y/o fatiga y /o temblor, que se relacionan entre sí y que podrían tener una etiología común en el sistema cannabinoide1. Los receptores de cannabinoides CB1 y CB2 se distribuyen en el sistema nervioso central de manera irregular, con una gran acumulación en el tronco encefálico, donde están mediadas funciones como la espasticidad, el sueño, el control de las funciones de la vejiga y el dolor3. Estos síntomas concurrentes podrán tener una influencia sinérgica en medidas conductuales, funcionales y de calidad de vida, por lo que se propone un abordaje conjunto en lugar de individual y con tratamientos relacionados con los receptores cannabinoides4.
El objetivo de este estudio era identificar el número de casos que cumplen criterios de SSP en la consulta de enfermería de práctica avanzada en EM de nuestro hospital. Además, se buscaba identificar la sintomatología más frecuente en la SSP, el número de tratamientos sintomáticos y de casos tratados con THC:CBD.
MétodosEl estudio es un diseño observacional retrospectivo en el que se reclutó a pacientes con diagnóstico de EM según la práctica clínica habitual de la Unidad de Enfermedades Desmielinizantes de nuestro hospital.
El estudio ha sido presentado y aprobado por el Comité Ético de Investigación Médica del Área 1 del Hospital General Universitario Gregorio Marañón. El proyecto cumple con los requisitos del Real Decreto 957/2020, de 3 de noviembre, por el que se regulan los estudios observacionales y con medicamentos de uso humano. El estudio cumplió con la definición de investigación sin interés comercial según lo establecido en el párrafo e) del artículo 2.2 del RD 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamento, los comités de ética de la investigación con medicamentos y el Registro Español de Estudios Clínicos. La confidencialidad, el tratamiento, la comunicación y la cesión de los datos de carácter personal de todos los sujetos participantes se ajustó a lo dispuesto en la Ley Orgánica de Protección de Datos de carácter personal 03/2018 de 5 de diciembre, incluyendo la disposición adicional 17 de dicha ley, y en el Reglamento General de Protección de Datos 2016/679.
Se recogió información de forma retrospectiva de las historias clínicas de los pacientes sobre las variables neurológicas. Se codificó el fenotipo de EM, el grado de discapacidad física medida con el Expanded dissability status scale (EDSS) y el número de síntomas que presentan asociada a la EM, en concreto, la presencia o no de espasticidad, rigidez, dolor, trastornos del sueño, alteraciones de vejiga, fatiga y alteraciones en la función sexual. Se registró también el número de tratamientos sintomáticos en uso. Toda esta información se recopiló en una base de datos en la que la información fue recogida de forma pseudoanonimizada para su posterior análisis.
Se incluyó en el registro a los pacientes con diagnóstico de EM en cualquier fenotipo de la enfermedad que pertenecían a la Unidad de Enfermedades Desmielinizantes del Hospital General Universitario Gregorio Marañón, que presentaban espasticidad y recibían tratamiento farmacológico por ello, según criterio clínico del neurólogo responsable del paciente, entre los años 2002 y 2022. Como criterio de exclusión se estableció el no estar diagnosticado de enfermedad desmielinizante a pesar de estar diagnosticado de espasticidad y estar en tratamiento por ello.
Los datos recogidos en la base de datos se analizaron estadísticamente con el programa Prism 8. Se realizó un estudio descriptivo de las variables tanto cualitativas como cuantitativas utilizando porcentajes, medias, medianas y desviaciones típicas. Se realizó un análisis inferencial de las variables cuantitativas utilizando el estadístico de Spearman para evaluar la correlación entre dichas variables. Se tomó como nivel de confianza para los estadísticos el valor de 95%.
ResultadosSe registraron retrospectivamente 68 casos de personas que presentaron síntomas de espasticidad en su evolución desde el 2002 hasta el 2022. De todos ellos se eliminaron 8 casos: 7 porque no tenían diagnóstico de enfermedad desmielinizante y uno debido a fallecimiento. Se reclutaron 60 pacientes para el análisis de datos.
La distribución por género fue muy equilibrada (53% mujeres). El 95% fueron casos con diagnóstico de EM en sus diferentes fenotipos (12,3% remitente-recurrente [EMRR]; 63,2% secundaria progresiva [EMSP] y 24,5% primaria progresiva [EMPP]), pero también se registraron 2casos de neuromielitis óptica (NMO) y una mielitis longitudinalmente extensa. La mediana del grado de discapacidad física medida con la EDSS fue de 6,5 (rango: 2,5-8).
Se registraron tan solo un 36% de casos que estaban en el momento del corte de datos en tratamiento con un fármaco modificador de la enfermedad (13 casos con diagnóstico de EMSP, 5 con EMPP, 2 NMO y 2 EMRR); los más frecuentes eran con azatioprina (6), rituximab (5) y ocrelizumab (4).
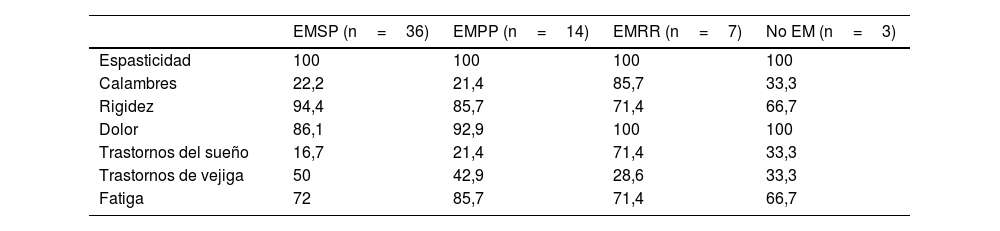
Todos los pacientes cumplieron criterios de SSP y asociaban dolor (90%), rigidez (83,3%), fatiga (75%) y trastornos de vejiga (43,3%) como síntomas más frecuentes de la espasticidad (tabla 1). La media de síntomas que se añadieron a la espasticidad fue de 3,5. Los síntomas iniciales del SSP más frecuentes fueron espasticidad (23,3%), polisintomatología, que incluyó la espasticidad (26,7%), y el dolor (20%).
Porcentajes de síntomas presentes según fenotipos de la enfermedad
| EMSP (n=36) | EMPP (n=14) | EMRR (n=7) | No EM (n=3) | |
|---|---|---|---|---|
| Espasticidad | 100 | 100 | 100 | 100 |
| Calambres | 22,2 | 21,4 | 85,7 | 33,3 |
| Rigidez | 94,4 | 85,7 | 71,4 | 66,7 |
| Dolor | 86,1 | 92,9 | 100 | 100 |
| Trastornos del sueño | 16,7 | 21,4 | 71,4 | 33,3 |
| Trastornos de vejiga | 50 | 42,9 | 28,6 | 33,3 |
| Fatiga | 72 | 85,7 | 71,4 | 66,7 |
EMPP: esclerosis múltiple primariamente progresiva; EMPS: esclerosis múltiple secundariamente progresiva; EMRR: esclerosis múltiple remitente recurrente; No EM: sin esclerosis múltiple.
En cuanto a los distintos fenotipos de la enfermedad, los datos mostraron cómo en las formas no progresivas (EMRR y no EM) el segundo síntoma que apareció en el 100% de los casos asociado a espasticidad fue el dolor. En el caso de los fenotipos progresivos, la rigidez y el dolor fueron los que más se asociaron a la espasticidad en EMSP (94,4 y 86,1%), a lo que se añadió la fatiga en los fenotipos EMPP (85,7, 92,9 y 85,7%, respectivamente) (tabla 1).
En cuanto al tratamiento farmacológico sintomático, la media registrada fue de 1,4 fármacos en el momento inicial, que aumentó a 3,9 en el momento del corte de datos. Durante la evolución, el 85% de los casos aumentaron el número de fármacos sintomáticos y tan solo 5 casos disminuyeron en número de tratamientos sintomáticos con los años. Al dividir los pacientes según el número de tratamientos sintomáticos que estaban recibiendo en la visita de corte, se objetivó que la discapacidad física fue algo mayor en el grupo que recibió entre 5 y 9 fármacos sintomáticos (moda EDSS=7) frente a los que recibieron menos (entre 1 y 4, con moda de EDSS=6,5) sin llegar a ser estadísticamente significativa esta diferencia (p=0,1).
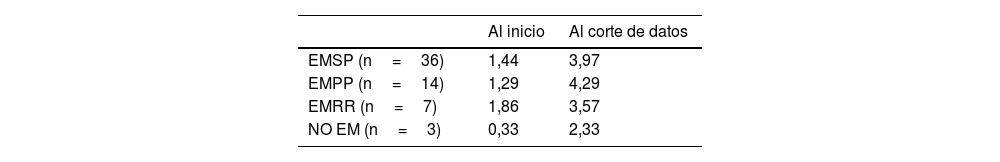
Al analizar el número de tratamientos al inicio del registro según el fenotipo, se observó que los pacientes con EMRR fueron los que presentaron un mayor número de tratamientos sintomáticos como media (1,86) y los casos que no eran EM los que menos (0,33). En cuanto al número de tratamientos sintomáticos que tomaban en el momento del corte final de la muestra, fueron los pacientes con fenotipos progresivos los que presentaron una media mayor de tratamientos (4,29 para EMPP y 3,97 para EMSP) (tabla 2).
media de tratamientos sintomáticos por fenotipos al inicio y al corte de datos de la muestra
| Al inicio | Al corte de datos | |
|---|---|---|
| EMSP (n=36) | 1,44 | 3,97 |
| EMPP (n=14) | 1,29 | 4,29 |
| EMRR (n=7) | 1,86 | 3,57 |
| NO EM (n=3) | 0,33 | 2,33 |
EMPP: esclerosis múltiple primariamente progresiva; EMPS: esclerosis múltiple secundariamente progresiva; EMRR: esclerosis múltiple remitente recurrente; No EM: sin esclerosis múltiple.
El 88,3% de los casos de este estudio fueron tratados con THC:CBD en algún momento del seguimiento y tan solo al 5% se les pautó al inicio de los síntomas. Cuando la espasticidad fue uno de los síntomas de inicio, el tratamiento con THC:CBD se tardó en pautar una media de 4 años. Al 11,7% de los pacientes se les retiró el THC:CBD a lo largo del periodo de seguimiento del estudio.
No se encontró correlación estadísticamente significativa entre el número de síntomas que presentaron los pacientes al inicio del registro y el número de tratamientos farmacológicos que tomaban en el momento del corte de la muestra (r=0,12; p=0,38). Tampoco se encontró relación estadísticamente significativa entre el número de tratamientos sintomáticos administrados y la discapacidad física de los pacientes en el momento del corte de la muestra (r=0,19; p=0,15).
Discusión y conclusionesEl análisis retrospectivo de los pacientes que han presentado espasticidad a lo largo de la enfermedad mostró que la existencia del SSP es muy frecuente en la evolución en pacientes diagnosticados de enfermedades desmielizantes principalmente progresivas, que asocian con mucha frecuencia los síntomas de dolor, espasticidad y fatiga.
Una conclusión de este trabajo es la existencia de polifarmacoterapia en los casos de SSP. Se observó que el número de tratamientos sintomáticos aumenta drásticamente con la evolución de los síntomas y que son muy pocos los casos en los que se reduce el número de tratamientos sintomáticos con la evolución de la enfermedad. El tratamiento con THC:CBD, si bien no se ha pautado al inicio, se ha utilizado con mucha frecuencia en estos casos. Nuestro estudio no evalúa la suspensión del THC:CBD en relación con la eficacia de los síntomas, sino el número de pacientes que, después de la ventana de 20 años de seguimiento, han abandonado el tratamiento (el 11,7%). En este sentido, no podemos replicar los datos del 55,6% de abandono de tratamiento, principalmente por ineficacia, que ofrecen los registros italianos5.
En este estudio, el tratamiento con THC:CBD se inició en un porcentaje de casos muy bajo al comienzo de los síntomas (tan solo en el 5%) y se tardó en pautar a los pacientes con espasticidad una media de 4 años. Este hecho está condicionado por la propia ficha técnica del fármaco6, que especifica que el THC:CBD está indicado para casos de espasticidad moderada/grave debida a EM que no han respondido previamente a otros antiespásticos. Esto puede producir un retraso en la administración de un fármaco que clínicamente puede mejorar la sintomatología del SSP en hasta el 33,19% de los casos tras 18 meses de tratamiento5. Esta eficacia clínica sumada a la evidencia de la relación entre el SSP y el sistema endocannabinoide7 debería ayudar a la indicación más temprana de este tratamiento en los casos de SSP.
Los datos muestran que, en una ventana de seguimiento de 20 años, se aumentan tanto el número de síntomas que componen el SSP como el número de fármacos sintomáticos que se administran para su tratamiento. Al no encontrar una relación entre la discapacidad física y el número de tratamientos sintomáticos administrados en los pacientes con SSP, se podría decir que estas variables podrían estar en relación con la propia evolución de la enfermedad y no con una relación directa entre el SSP y el empeoramiento evolutivo de los pacientes. Sin embargo, es necesario realizar más investigación al respecto para descartar esta relación que, al menos intuitiva y clínicamente, se observa en nuestros pacientes.
En nuestra muestra se reporta el dolor como síntoma que forma parte del SSP de una manera general, sin una medición estandarizada sino como reporte clínico del neurólogo en su exploración. En la literatura médica, este es el síntoma más frecuentemente asociado a la espasticidad: en el 38,4% en el momento inicial de los síntomas5 y en el 17% según reporta la enfermería especializada en EM sobre las quejas subjetivas de sus pacientes en consulta8. En este estudio se encuentra que el dolor se asocia a la espasticidad hasta en el 90% de los participantes, y se señala, además, que la presencia de dolor es un signo característico en fenotipos no progresivos (EMRR y NMO), en contraposición a lo que presentan los fenotipos progresivos, que con mayor frecuencia asocian fatiga en EMPP y rigidez en EMSP. Esta relación podría ser una ayuda adicional en un futuro para el diagnóstico diferencial de fenotipos de EM en el complejo momento transicional de una forma recurrente remitente a la fase progresiva secundaria.
Siendo importante el dolor como síntoma muy relacionado con la espasticidad, también resulta controvertido el especificar este concepto. En la propuesta original1 se establece como parte del SSP la presencia de dolor, pero otros estudios especifican también la neuralgia del trigémino como signo que tener en cuenta para el posible diagnóstico de SSP5. En la literatura médica se han propuesto hasta 9 tipos diferentes de dolor que se asocian específicamente con la EM, desde el signo de Lhermitte o la cefalea hasta el dolor musculoesquelético9. El dolor es un síntoma importante por registrar, pero quizás estudios posteriores validen la necesidad de realizar distinciones con relación al tipo de dolor que puedan ayudar a afinar el diagnóstico.
Como limitación principal, encontramos un posible sesgo de reclutamiento de la muestra de este estudio. El cribado de inclusión de casos se realizó con base en los pacientes que estuvieron en tratamiento con THC:CB a causa de la presencia de espasticidad en algún momento de la ventana de análisis propuesta para este estudio. Es razonable anticipar que se han podido perder casos de posible diagnóstico de SSP debido a que en su evolución presentaran espasticidad de manera inicial pero no se les pautara TCH:CB, por lo que puede que no estuvieran en nuestro registro. Este método es distinto al del estudio de Patti et al. en Italia, en el que se incluyó a los pacientes que iniciaron tratamiento con THC:CBD5. Igualmente, el criterio de incluir pacientes según la presencia inicial de espasticidad como síntoma podría haber dejado fuera de la caracterización del SSP a todos aquellos que comenzaron con otro síntoma de los que componen el síndrome, como los problemas urológicos o la fatiga, ambos muy prevalentes en esta entidad.
En nuestro caso no se han podido recoger en el total de pacientes incluidos, algunos síntomas como son las alteraciones en la función sexual y el estado anímico. En general, estos síntomas son recogidos en pocas ocasiones en la historia clínica de los pacientes y podrían suponer un aumento de la prevalencia diagnóstica de este síndrome si se registrase en el futuro.
El análisis principal de este estudio retrospectivo se basa en el número de síntomas y tratamientos sintomáticos administrados que se han registrado en la historia clínica de los pacientes que cumplían criterios de inclusión. Sin embargo, no se ha recogido información sobre la eficacia de estos tratamientos sobre los síntomas de SSP, dato este de gran importancia clínica para el futuro manejo de estos pacientes, tal y como muestra el registro italiano5.
Una limitación en el diagnóstico de este síndrome es su propia descripción. Los autores que proponen este síndrome1 indican una serie de síntomas que han de presentarse para cumplir el diagnóstico, pero revisiones posteriores aún debaten sobre la inclusión o no de algunos síntomas, como el temblor10 o la debilidad11.
Otra limitación de este estudio es la definición de espasticidad que se ha utilizado como criterio de inclusión de los participantes. Al ser un estudio retrospectivo, se considera la presencia de síntoma siempre que el neurólogo la incluya en la historia clínica como parte de su exploración neurológica, pero no se ha utilizado de manera sistemática ninguna medida de espasticidad de las propuestas en la clínica o la investigación (por ejemplo, la escala de Ashworth para la espasticidad asociada a la EM12 o la escala numérica para la medición de la espasticidad13), lo que puede dificultar la validez del diagnóstico de SSP en la práctica clínica habitual.
Necesitamos más evidencia sobre el efecto del tratamiento sintomático temprano de pacientes con espasticidad para objetivar el efecto sobre la evolución de la sintomatología. Para ello, es importante identificar los signos más frecuentes que ayuden al diagnóstico temprano.
Este estudio indica que el diagnóstico de SSP retrospectivo es muy frecuente y, por tanto, sería de interés clínico realizarlo prospectiva y tempranamente, dadas las repercusiones en el manejo de la polisintomatología y su impacto en la percepción de las personas con EM sobre su calidad de vida.
FinanciaciónEste trabajo no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo obtuvo el premio del Comité Científico a la segunda mejor comunicación oral organizado por la SEDENE 2022.