Las medidas de salud autopercibidas complementan los parámetros clínicos para medir la eficacia. En este estudio se evalúa el uso de cuestionarios para la medida de salud desde la óptica del propio paciente como parámetro clínico, incluyendo aquellos que miden la calidad de vida relacionada con la salud (CVRS), y la frecuencia de inclusión de medidas relacionadas con los costes directos e indirectos en el diseño de los ensayos clínicos y de los estudios postautorización. Además, se mide la validez interna de los protocolos y si existe relación entre la calidad metodológica en el diseño del estudio y la inclusión de resultados notificados por el paciente (RNP).
Material y métodosEstudio observacional retrospectivo de los protocolos pertenecientes a ensayos clínicos (EC) y estudios postautorización aprobados por el Comité Ético de Investigación Clínica del centro (2008-2010). Se recogieron datos relativos a: la especialidad médica, patología, calidad metodológica (cuestionario de Jadad, 0-5), inclusión en los objetivos de RNP y/o de costes directos o indirectos. Para aquellos EC que incluían medidas de CVRS, se analizó el tipo de cuestionario utilizado. Para aquellos que no la analizaban, se consideró la pertinencia de su inclusión.
ResultadosSe analizaron un total de 70 protocolos (59 EC y 11 estudios postautorización), 37 (52,8%) de los cuales incluyeron resultados notificados por el paciente, 3 (4,3%) como variable primaria. El análisis de datos por áreas terapéuticas puso de manifiesto que endocrinología, neurología, digestivo y cardiología fueron las áreas donde los RNP fueron analizados en mayor proporción. La puntuación media de la validez interna fue de 2,8, observándose una mayor calidad metodológica en los protocolos con mayor inclusión de RNP. Únicamente 13 (22%) EC y 2 (18,2%) estudios postautorización incluyeron variables económicas.
ConclusionesLa aparición de variables económicas en los ensayos clínicos y estudios postautorización evaluados ha sido baja, en cambio, en más de la mitad de los protocolos revisados se han incluido instrumentos para medir resultados notificados por los pacientes, lo que refleja la importancia de estos parámetros en la valoración de la eficacia de los tratamientos con medicamentos, si bien su uso todavía no es sistemático.
Patient-reported outcome (PRO) measures complement traditional biomedical outcome measures. The purpose of this study was to evaluate the use of PRO measures including health-related quality of life (HRQoL) questionnaires as a measurement of efficacy and the frequency of inclusion of economic variables related to direct and indirect costs in the design of clinical trials and phase IV observational studies. Moreover, for the trials quality score were measured, and if there were any relationship between the quality study design score and the PRO inclusion.
Material and methodsRetrospective observational study of the clinical trials and phase IV observational studies approved by a Clinical Research Ethics Committee (2008-2010). We gathered data concerning general aspects including medical specialty, pathology, methodological quality based on Jadad scale (0-5), inclusion of PRO and economic variables. For clinical trials including HRQoL measurements, we analysed the type of questionnaire in use. Where there were no HRQoL measurements, we analysed if their inclusion would have been proper or not.
ResultsA total of 70 protocols (59 CTs and 11 phase IV observational studies) were analysed; 37 (52.8%) included PRO measures, and 3 protocols (4.3%) used them as a primary endpoint. Data analysis by therapeutic area showed that PRO measures were most commonly studied in the fields of endocrinology, neurology, digestive diseases, and cardiology. The average quality score for the trials was 2.8. The trials with more PRO inclusion in their end points had a significantly higher quality score. Only 13 (22%) clinical trials and 2 (18.2%) phase IV observational studies included economic variables.
ConclusionsThe emergence of economic variables in clinical trials and phase IV observational studies evaluated was low, however, more than half of the revised protocols have included PRO measures, reflecting the importance of these parameters in the assessment of the effectiveness of drug treatments, although its use is still not systematic.
La mejora de la calidad de vida relacionada con la salud (CVRS) de los pacientes debería ser objetivo prioritario de toda intervención terapéutica. No solo es importante prolongar la vida, sino que esta prolongación debe estar acompañada de unas condiciones razonablemente buenas. Este hecho cobra especial importancia en las enfermedades crónicas, para las cuales no existe una curación total y donde el objetivo del tratamiento es atenuar o eliminar síntomas, evitar complicaciones y mejorar el bienestar de los pacientes, los cuales, a partir de su propia perspectiva, deben ser los que definan las prioridades sobre las diferentes opciones terapéuticas que se les ofrecen1,2.
El hecho de que en múltiples afecciones y en distintos grupos de pacientes, la correlación entre los marcadores analíticos y funcionales y la CVRS percibida por estos sea baja1, y que las medidas de calidad de vida puedan informar acerca del pronóstico, utilizándose para predecir la supervivencia, como en el caso de los pacientes con cáncer, propicia que los ensayos clínicos (EC) incluyan entre sus objetivos la evaluación de la mejora de la CVRS y que los resultados notificados por el paciente (RNP o PRO, de patient reported outcomes) se hayan convertido en una herramienta relevante al valorar cualquier tipo de intervención sanitaria o tratamiento3,4.
Por otro lado, el aumento de la esperanza de vida, los mayores requerimientos de salud (en cantidad y calidad) por parte de los ciudadanos y las nuevas opciones terapéuticas conllevan optimizar la gestión de los recursos existentes, siempre limitados, para obtener los mayores beneficios posibles5.
Dentro del campo de la evaluación económica de tecnologías sanitarias y entre los posibles usos de las medidas de salud autopercibida, particularmente las implicadas en medir la CVRS, se observa que, además de medir la salud desde la perspectiva del paciente, este tipo de medidas puede servir para identificar áreas de la salud o poblaciones en las que es necesario asignar más recursos sanitarios, y predecir qué pacientes deberían ser monitorizados o seguidos de alguna forma especial porque van a incurrir en una mayor utilización de recursos y mayor gasto sanitario. Asimismo, y junto con otros instrumentos, las medidas de salud autopercibida pueden ser de ayuda para los decisores sanitarios a la hora de seleccionar alternativas terapéuticas más eficientes, es decir, qué tratamientos presentan un mejor perfil coste-utilidad y, por tanto, deberían ser de uso prioritario a la hora de recomendarlos en las guías terapéuticas y protocolos asistenciales6.
No es inusual que se requiera una evaluación económica de medicamentos a las compañías farmacéuticas como paso previo a la fijación de precio o a la financiación pública de los nuevos fármacos. Los primeros países en utilizar la evaluación económica en sus decisiones de política farmacéutica fueron Australia y Canadá. Desde entonces, esta política ha sido acogida por varios países (aunque con cierta variabilidad) como Dinamarca, Finlandia, Países Bajos, Noruega, Reino Unido, Portugal, Irlanda y Bélgica, entre otros7,8. Actualmente, en la gran mayoría de los países de la Unión Europea las decisiones en política farmacéutica (fijación de precio, discusión del nivel de financiación pública, inclusión en guías farmacoterapéuticas, etc.) se basan, fundamentalmente, en 3 tipos de datos: a) el valor terapéutico que aporta el nuevo medicamento (efectividad clínica, calidad de vida, satisfacción de los pacientes, cumplimiento terapéutico, etc.); b) los datos de coste-efectividad versus las alternativas más usuales en la práctica médica diaria, y c) los análisis del impacto presupuestario resultante de la comercialización del nuevo medicamento9. Las compañías farmacéuticas tratan de desarrollar fármacos con un perfil de coste-efectividad adecuado, para lo cual desarrollan estudios farmacoeconómicos desde las primeras fases de desarrollo clínico de los fármacos.
Por tanto, cada vez más se valora el que un nuevo medicamento aporte, además de eficacia, seguridad y calidad, otros valores terapéuticos, tales como una mayor CVRS y grado de satisfacción para el paciente y una mayor efectividad clínica. Por este motivo, el objetivo del presente estudio consiste en determinar cómo resulta de habitual en los protocolos de los EC y de los estudios postautorización la inclusión de medidas de salud percibidas por el propio paciente. Asimismo, se mide la validez interna de los protocolos, se analiza si existe relación entre una mayor calidad metodológica en el diseño del estudio y una mayor inclusión de resultados notificados por el paciente y si la inclusión de cuestionarios para medir la CVRS ha resultado apropiada. Además, se ha registrado en los estudios revisados la frecuencia de aparición de medidas relacionadas con los costes directos e indirectos.
Material y métodosDos evaluadores, de forma sistemática, realizaron la revisión de los protocolos de los EC y estudios postautorización observacionales prospectivos con carácter de EC (con tratamiento de EC, Orden SAS/3470/2009) activos en el hospital, desde 2008 hasta 2010. Ante la aparición de discrepancias se consultó la opinión de un tercero. De cada protocolo se registró: la fase del EC, la patología, el área, la existencia de variables económicas utilizadas para medir costes atribuidos a la enfermedad (definidas como tal en el diseño de los protocolos revisados), los instrumentos o cuestionarios utilizados en la medida de la CVRS y otros RNP y se observó si se incluían en los objetivos primarios y/o secundarios.
Un ensayo controlado y aleatorizado puede estar sometido a múltiples sesgos potenciales, los cuales pueden afectar el grado de credibilidad y relevancia de sus resultados, comprometiendo la validez interna del propio ensayo. Diferentes factores como son el proceso de aleatorización, el enmascaramiento, las pérdidas de seguimiento o la potencia estadística de la prueba, condicionan la calidad del diseño y la validez del ensayo. En el presente estudio, para evaluar la calidad de los EC, se ha aplicado el cuestionario de Jadad10 (escala validada e introducida recientemente por las autoridades sanitarias11 como instrumento en la evaluación de novedades terapéuticas). Con este cuestionario se puede obtener una puntuación comprendida entre 0 y 5, de manera que a mayor puntuación, mayor calidad metodológica. Se ha analizado en qué áreas se registran protocolos con mayor calidad metodológica, en cuáles se ha descrito una mayor inclusión de RNP, y si existe relación entre la mayor inclusión de medidas de salud autopercibida por el paciente y la calidad metodológica de los protocolos estudiados, mediante la correlación de Pearson.
Instrumentos para medir la calidad de vida relacionada con la saludLa CVRS se evalúa mediante cuestionarios diseñados específicamente para ello y que reflejan el punto de vista del paciente. Estos instrumentos suelen estar formados por preguntas cerradas adaptadas al idioma y cultura del paciente evaluado, deben disponer de propiedades métricas demostradas y contener preguntas relativas a todas las dimensiones relevantes para la enfermedad o el tratamiento que se desee evaluar (funcionamiento físico, dolor, percepción general de la salud, función sexual, grado de satisfacción con la vida, etc.)12,13.
En el presente estudio se han clasificado los cuestionarios de medida de la CVRS según la propuesta por Guyatt et al., según los cuales, estos instrumentos se dividen en genéricos y específicos14. Los cuestionarios genéricos incluyen la mayoría de las dimensiones ya mencionadas, permiten las comparaciones entre enfermedades y se utilizan para medir la calidad de vida general de la población. Los cuestionarios específicos se utilizan para evaluar la calidad de vida asociada a enfermedades concretas, o a ciertos subgrupos de individuos, y proporcionan alta sensibilidad ante cambios clínicos14.
La inclusión de cuestionarios de CVRS en los EC se ha considerado apropiada si aporta datos realmente relevantes, como es el caso de ensayos y estudios en los que la intervención se realiza en pacientes con patologías crónicas, en aquellos en los que el tratamiento es paliativo, en los que de antemano se conoce que con frecuencia producen efectos adversos o en aquellos donde las enfermedades cursan sin sintomatología y los tratamientos son fundamentalmente preventivos, como es el caso de la hipertensión arterial1,6,15.
Criterios de inclusiónSe consideró que en un protocolo de un EC o estudio postautorización se incluían instrumentos para la medida de la salud autopercibida por el paciente si la medición de este parámetro se reflejaba en los objetivos del EC o estudio postautorización. Además, se consideró que el instrumento medía la CVRS si estaba descrito como tal en las bases de datos ProQolid16, BiblioPRO de la Unidad de Investigación en Servicios Sanitarios del IMIM-Hospital del Mar17 o en artículos indexados en Medline/PubMed.
Criterios de exclusiónSe excluyeron como medidas de calidad de vida relacionada con la salud, aquellas cuyo registro era realizado por el personal sanitario, aquellas cuya evaluación no apareciera en los objetivos del protocolo y aquellas cuya frecuencia de evaluación no estuviera descrita en el diseño del estudio.
La pérdida de salud provoca costes que repercuten en el paciente y en la sociedad. Para abordar los estudios de evaluación económica de medicamentos, los costes se clasifican en directos, indirectos e intangibles. En el presente estudio se registraron y cuantificaron las variables o ítems empleados en la obtención de los mismos. Se consideró que en un protocolo se incluía el estudio de costes atribuidos a la enfermedad, si su medición se reflejaba en los objetivos del EC o estudio postautorización.
ResultadosDe un total de 70 protocolos revisados, se encontraron 59 EC (15 fase II y 44 fase III) y 11 estudios postautorización.
Por áreas, 30 pertenecían a oncología, 11 a hematología, 7 a medicina interna, 7 a endocrinología, 7 a neumología, 3 a cardiología, 2 a dermatología, uno a digestivo y 2 a neurología. Las patologías estudiadas fueron (número): cáncer de pulmón (13), DM2 (6), VIH (6), cáncer colorrectal (5), EPOC (5), cáncer de mama (4), mieloma múltiple y síndrome mielodisplásico (3), linfomas no hodgkinianos (LNH) (3), leucemia linfática crónica (LLC) (3), carcinoma de cabeza y cuello (2), cáncer de próstata (2), asma (2) y otros (16).
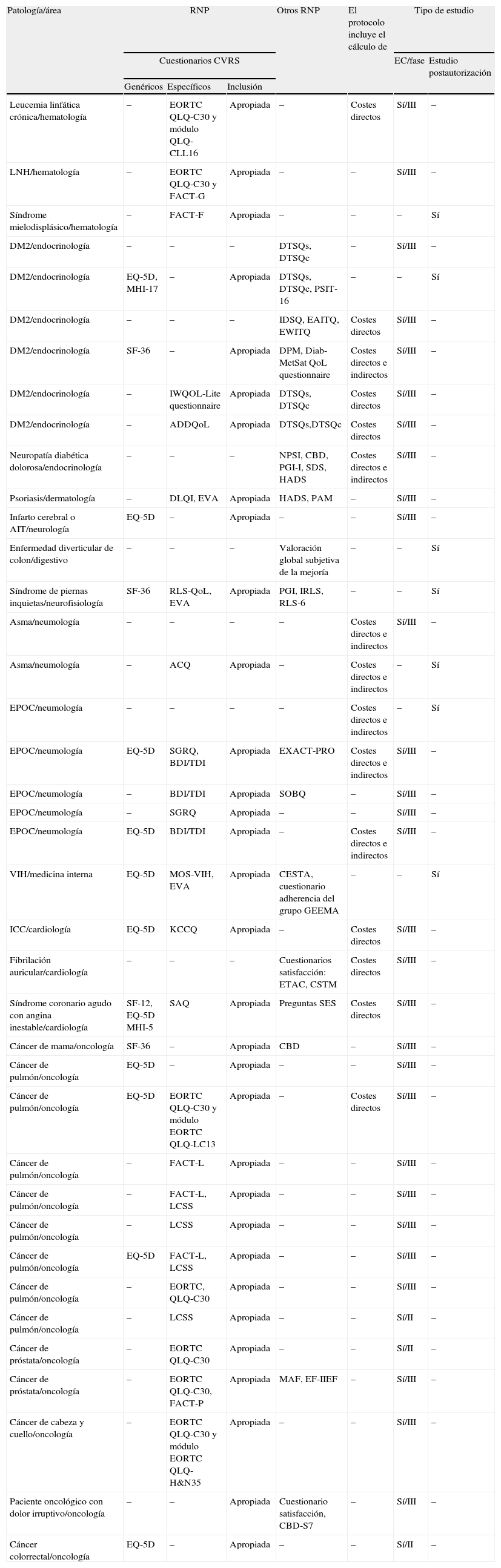
Se registraron RNP en 37 protocolos (52,8%), 31 EC (26 de los cuales presentaron cuestionarios de CVRS) y 6 estudios postautorización (5 de los cuales presentaron cuestionarios de CVRS) (tabla 1).
Descripción de los protocolos con resultados notificados por el paciente y con el registro de las medidas para el cálculo de costes directos y/o indirectos
| Patología/área | RNP | Otros RNP | El protocolo incluye el cálculo de | Tipo de estudio | |||
| Cuestionarios CVRS | EC/fase | Estudio postautorización | |||||
| Genéricos | Específicos | Inclusión | |||||
| Leucemia linfática crónica/hematología | – | EORTC QLQ-C30 y módulo QLQ-CLL16 | Apropiada | – | Costes directos | Sí/III | – |
| LNH/hematología | – | EORTC QLQ-C30 y FACT-G | Apropiada | – | – | Sí/III | – |
| Síndrome mielodisplásico/hematología | – | FACT-F | Apropiada | – | – | – | Sí |
| DM2/endocrinología | – | – | – | DTSQs, DTSQc | – | Sí/III | – |
| DM2/endocrinología | EQ-5D, MHI-17 | – | Apropiada | DTSQs, DTSQc, PSIT-16 | – | – | Sí |
| DM2/endocrinología | – | – | – | IDSQ, EAITQ, EWITQ | Costes directos | Sí/III | – |
| DM2/endocrinología | SF-36 | – | Apropiada | DPM, Diab-MetSat QoL questionnaire | Costes directos e indirectos | Sí/III | – |
| DM2/endocrinología | – | IWQOL-Lite questionnaire | Apropiada | DTSQs, DTSQc | Costes directos | Sí/III | – |
| DM2/endocrinología | – | ADDQoL | Apropiada | DTSQs,DTSQc | Costes directos | Sí/III | – |
| Neuropatía diabética dolorosa/endocrinología | – | – | – | NPSI, CBD, PGI-I, SDS, HADS | Costes directos e indirectos | Sí/III | – |
| Psoriasis/dermatología | – | DLQI, EVA | Apropiada | HADS, PAM | – | Sí/III | – |
| Infarto cerebral o AIT/neurología | EQ-5D | – | Apropiada | – | – | Sí/III | – |
| Enfermedad diverticular de colon/digestivo | – | – | – | Valoración global subjetiva de la mejoría | – | – | Sí |
| Síndrome de piernas inquietas/neurofisiología | SF-36 | RLS-QoL, EVA | Apropiada | PGI, IRLS, RLS-6 | – | – | Sí |
| Asma/neumología | – | – | – | – | Costes directos e indirectos | Sí/III | – |
| Asma/neumología | – | ACQ | Apropiada | – | Costes directos e indirectos | – | Sí |
| EPOC/neumología | – | – | – | – | Costes directos e indirectos | – | Sí |
| EPOC/neumología | EQ-5D | SGRQ, BDI/TDI | Apropiada | EXACT-PRO | Costes directos e indirectos | Sí/III | – |
| EPOC/neumología | – | BDI/TDI | Apropiada | SOBQ | – | Sí/III | – |
| EPOC/neumología | – | SGRQ | Apropiada | – | – | Sí/III | – |
| EPOC/neumología | EQ-5D | BDI/TDI | Apropiada | – | Costes directos e indirectos | Sí/III | – |
| VIH/medicina interna | EQ-5D | MOS-VIH, EVA | Apropiada | CESTA, cuestionario adherencia del grupo GEEMA | – | – | Sí |
| ICC/cardiología | EQ-5D | KCCQ | Apropiada | – | Costes directos | Sí/III | – |
| Fibrilación auricular/cardiología | – | – | – | Cuestionarios satisfacción: ETAC, CSTM | Costes directos | Sí/III | – |
| Síndrome coronario agudo con angina inestable/cardiología | SF-12, EQ-5D MHI-5 | SAQ | Apropiada | Preguntas SES | Costes directos | Sí/III | – |
| Cáncer de mama/oncología | SF-36 | – | Apropiada | CBD | – | Sí/III | – |
| Cáncer de pulmón/oncología | EQ-5D | – | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | EQ-5D | EORTC QLQ-C30 y módulo EORTC QLQ-LC13 | Apropiada | – | Costes directos | Sí/III | – |
| Cáncer de pulmón/oncología | – | FACT-L | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | – | FACT-L, LCSS | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | – | LCSS | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | EQ-5D | FACT-L, LCSS | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | – | EORTC, QLQ-C30 | Apropiada | – | – | Sí/III | – |
| Cáncer de pulmón/oncología | – | LCSS | Apropiada | – | – | Sí/II | – |
| Cáncer de próstata/oncología | – | EORTC QLQ-C30 | Apropiada | – | – | Sí/II | – |
| Cáncer de próstata/oncología | – | EORTC QLQ-C30, FACT-P | Apropiada | MAF, EF-IIEF | – | Sí/III | – |
| Cáncer de cabeza y cuello/oncología | – | EORTC QLQ-C30 y módulo EORTC QLQ-H&N35 | Apropiada | – | – | Sí/III | – |
| Paciente oncológico con dolor irruptivo/oncología | – | – | Apropiada | Cuestionario satisfacción, CBD-S7 | – | Sí/III | – |
| Cáncer colorrectal/oncología | EQ-5D | – | Apropiada | – | – | Sí/II | – |
ACQ: Asthma Control Questionnaire; ADDQoL: Audit of Diabetes Dependent Quality of Life; AIT: accidente isquémico transitorio; BDI/TDI: Baseline and Transition Dyspnea Indexes; CBD (-S7, subescala de 7 apartados) o BPI: Cuestionario Breve del Dolor o Brief Pain Inventory; CESTA: Cuestionario Español de Satisfacción con el Tratamiento Antirretroviral; CGI: Clinical Global Impression; CSTM: Cuestionario de Satisfacción con el Tratamiento con Medicamentos; DLQI: Dermatology Life Quality Index; DM2: diabetes mellitus tipo 2; DPM: Diabetes Prediction Model; DTSQc: Diabetes Treatment Satisfaction Questionnaire change version; DTSQs: Diabetes Treatment Satisfaction Questionnaire status version; EAITQ: Expectations About Insulin Therapy Questionnaire; EF-IIEF: Erectile Function domain-International Index of Erectile Function; EORTC QLQ-C30: European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire Core-30; EPOC: enfermedad pulmonar obstructiva crónica; EQ-5D: EuroQOL 5D; ETAC: Estudio psicométrico que evalúa la satisfacción con el Tratamiento Anticoagulante; EVA: escala visual analógica; EWITQ: Experience With Insulin Therapy Questionnaire; EXACT-PRO: EXAcerbations of Chronic pulmonary disease Tool, Patient-Reported Outcome; FACT: Functional Assessment of Cancer Therapy-Fatigue (FACT-F)-General (FACT-G)-Lung cancer module (FACT-L)-Prostate module (FACT-P); HADS: Hospital Anxiety and Depression Scale; IDSQ: Insulin Delivery System Questionnaire; IRLS: International Restless Legs Scale; IWQOL-Lite: Impact of Weight on Quality of Life Lite questionnaire; KCCQ: Kansas City Cardiomyopathy Questionnaire; LCSS: Lung Cancer Symptom Scale; LLC: leucemia linfática crónica; LNH: linfoma no Hodgkin; MAF: Multidimensional Assessment of Fatigue; MHI: Mental Health Inventory; MHI-5 y MHI-17: versiones con 5 y 17 ítems, respectivamente, del Mental Health Inventory; Módulo de la EORTC QLQ-CLL16: Quality of life Questionnaire chronic leucemia; Módulo de la EORTC QLQ-H&N35: Quality of life Questionnaire Head and Neck cancer; Módulo de la EORTC QLQ-LC13; MOS-HIV: Medical Outcomes Study HIV health survey; NPSI: Neuropathic Pain Symptom Inventory; PAM: Patient Activation Measure; PASI: Psoriasis Area and Severity Index; PGA: Patient Global Assessment; PgGI: Patient Global Impressions; PSIT: Patient Satisfaction with Insulin Therapy questionnaire; Quality of life Questionnaire Lung Cancer; RLS-6: Restless Legs Syndrome-6 scale; RLSQoL: Restless Legs Syndrome Quality of Life questionnaire; RNP: resultados notificados por el paciente; SAQ: Seattle Angina Questionnaire; SDS: Self-Rating Depression Scale; SES: Socioeconomic Status questionnaire; SF-36: Short Form health survey, 36 ítems; SF-12: versión con 12 ítems del SF-36; SGRQ: St. George's Respiratory Questionnaire; SOBQ: San Diego Shortness of Breath Questionnaire.
Se descartó el índice Karnofsky (Karnofsky Performance Scale), el cuestionario simplificado ECOG (Eastern Cooperative Oncology Group), el CGI (Clinical Global Impressions) y el cuestionario PAA (para la evaluación de las actividades del paciente) por tratarse de escalas cumplimentadas por el médico, por lo que aunque proveían de información relevante para la prognosis, no ocurría así para los detalles relacionados con la calidad de vida del paciente.
Se ha observado que en todos los protocolos donde aparecen cuestionarios utilizados en la medición de la CVRS, su inclusión ha sido apropiada. Las patologías estudiadas en los protocolos en los que no se incluyó ningún RNP (n=33) fueron: LLC (2), LNH (2), mieloma múltiple (2), IR (1), asma (1), EPOC (1), VIH (5), HTA (1), cáncer de mama (3), cáncer de pulmón avanzado (5), cáncer de cabeza y cuello (1), cáncer colorrectal (4), adenocarcinoma metastásico de origen desconocido (1), cáncer urotelial (1), pacientes oncológicos portadores de catéter venoso central (1), pacientes en tratamiento anticoagulante tras cirugía (1) y dermatofitosis (1).
Se incluyeron los parámetros satisfacción y CVRS en los objetivos primarios de 3 protocolos (uno en psoriasis, otro en neuropatía diabética dolorosa y otro en VIH) y en los objetivos secundarios de 37 protocolos. Estos parámetros se midieron con cuestionarios específicos en 12 protocolos, con cuestionarios genéricos en 7 protocolos y con específicos y genéricos en 17 protocolos.
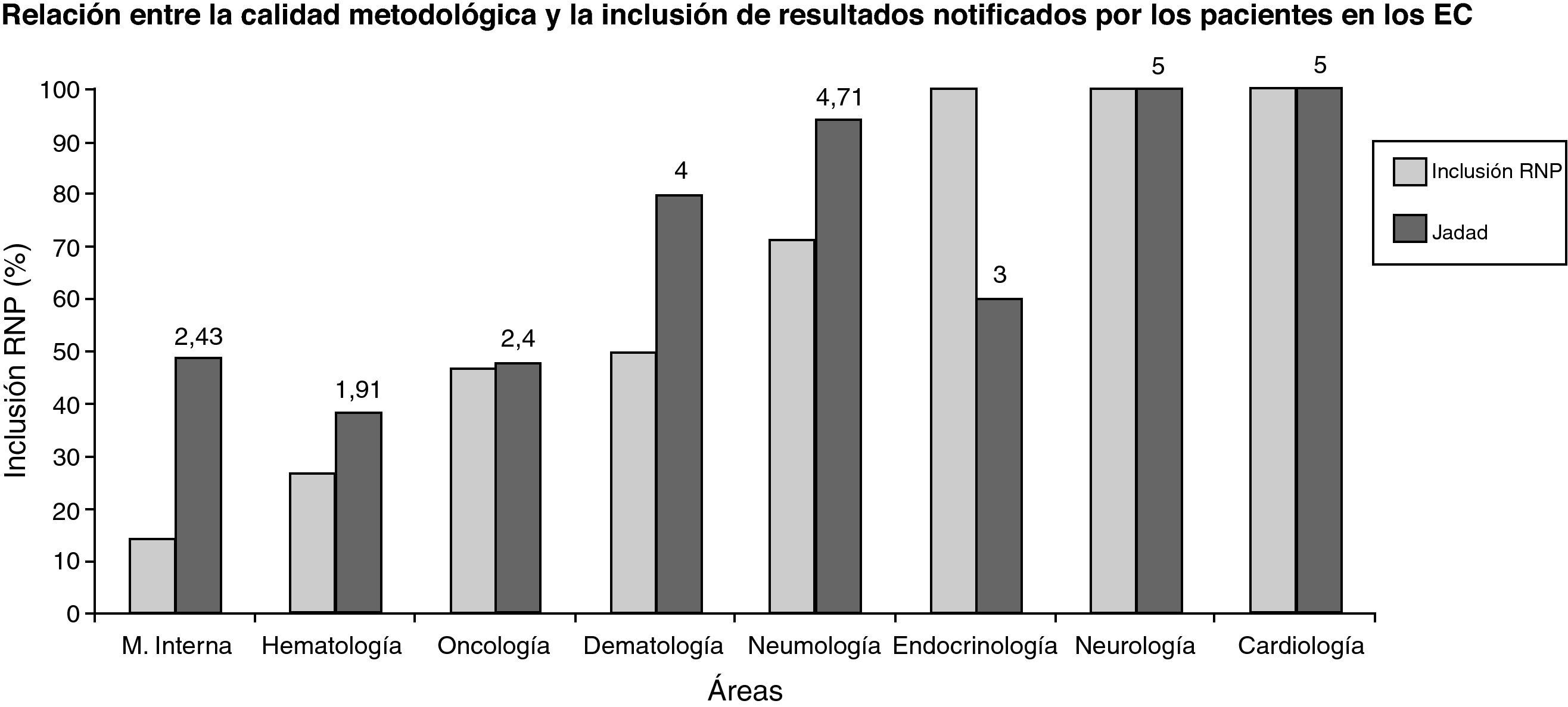
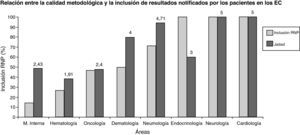
Por último, se describieron RNP en el 100% de los protocolos pertenecientes a endocrinología, neurología, digestivo y cardiología, en el 71% de los pertenecientes a neumología, en el 50% de los pertenecientes a dermatología, en el 47% de los relativos a oncología, en el 27% de los relativos a hematología y en el 14% de los relativos a medicina interna.
En cuanto a la validez interna de los EC evaluados, se obtuvo una puntuación media de: 5±0 en cardiología; 5±0 en neurología; 4,71±0,76 en neumología; 4,0±1,4 en dermatología; 3,0±1,15 en endocrinología; 3,0 en digestivo; 2,4±1,5 en oncología; 2,43±1,51 en medicina interna y 1,91±1,38 en hematología. En las áreas que han obtenido una mayor inclusión de resultados notificados por el paciente se ha observado una mayor calidad metodológica (correlación de Pearson positiva y significativa, con un nivel de p de 0,05) (fig. 1).
Se registraron variables económicas relacionas con los costes atribuidos a la enfermedad (directos e indirectos) en 13 EC (todos ellos de fase III) y en 2 estudios postautorización, descritos en la tabla 2.
Descripción cualitativa de las medidas relacionadas con los costes directos e indirectos registradas en los protocolos analizados
| Costes directos |
| Reacciones adversas con el tratamiento que requirieron hospitalizaciones |
| Número de visitas al médico en la consulta no programadas (Atención Primaria y/o Especializada) |
| Número de visitas del médico al domicilio no programadas |
| Número de visitas ambulatorias no programadas |
| Número de visitas a urgencias |
| Número de ingresos hospitalarios y duración de los mismos |
| Número de ingresos en la Unidad de Cuidados Intensivos y duración de los mismos |
| Número de llamadas a profesionales sanitarios (incluido el investigador) que no estén especificadas en el protocolo |
| Número de tests de laboratorio de análisis clínicos y otro tipo de pruebas diagnósticas no programadas |
| Número de veces que se ha utilizado la medicación de rescate para revertir la hipoglucemia |
| Dosis de insulina administrada (junto con el tratamiento con el fármaco del estudio) necesaria para ajustar la glucemia |
| Número de veces que el paciente se determina los niveles de glucemia por motivos ajenos al estudio |
| Tratamiento (dosis y número de días) para tratar las exacerbaciones de la EPOC |
| Número y tipo de intervenciones realizadas al paciente con LLC desde el inicio del estudio (transfusiones de sangre, trasplante de médula ósea, etc.) |
| Medicación del estudio administrada |
| Costes indirectos |
| Días de trabajo perdidos por el paciente |
| Días de trabajo perdidos por el cuidador principal |
EPOC: enfermedad pulmonar obstructiva crónica; LLC: leucemia linfática crónica.
Por áreas, los protocolos que incluyeron variables económicas fueron: 5 de neumología (que incluyeron tanto variables para medir los costes directos, como los indirectos); 5 de endocrinología (en todos se registraron variables para medir los costes directos y solo en 2 se registraron medidas de los costes indirectos) y 3 de cardiología, uno de oncología y otro en hematología con el 100% de medidas de costes directos.
DiscusiónYa en 1948, la Organización Mundial de la Salud fue pionera en el futuro desarrollo de la CVRS al definir salud como «un estado de completo bienestar físico, psíquico y social y no meramente la ausencia de enfermedad». Posteriormente, en 1991 se crea el WHO Quality of Life Project, demostrando así la importancia de esta disciplina18. Asimismo, la FDA con respecto a la autorización de la comercialización de un medicamento, tiene en cuenta el efecto favorable del mismo en la calidad de vida, y ha desarrollado una guía para la industria acerca de la utilización de los RNP como soporte a nuevas autorizaciones de medicamentos19.
Previo al análisis de los resultados de un EC y a la obtención de conclusiones sobre la utilidad práctica del nuevo fármaco, se deben analizar su fortaleza y calidad. Los estudios de CVRS deberían llevarse a cabo en EC de elevada calidad metodológica1. Esta consideración se ha cumplido en los protocolos pertenecientes a las áreas de cardiología, neumología y dermatología, poniendo de manifiesto que no existen defectos metodológicos graves y que, por tanto, sus conclusiones son totalmente válidas; se observa cómo a mayor inclusión de RNP se obtiene una mayor validez interna del estudio, hecho que concuerda con los hallazgos de Kong et al.20, los cuales muestran en su estudio que existe una relación significativa entre la mayor calidad de los ensayos analizados y la mayor inclusión de medidas de CVRS en los objetivos primarios de los estudios. En áreas como oncología, hematología y medicina interna (VIH) se ha obtenido una puntuación menor al aplicar el cuestionario de Jadad, generalmente como consecuencia de que estos estudios son abiertos, por la dificultad que entraña en pacientes que han sufrido distintos fracasos al tratamiento, el instaurar de forma ciega nuevos esquemas con citostáticos o antirretrovirales.
En casi la mitad de los protocolos se han hallado cuestionarios para medir la CVRS (44,3%). En el 60% de aquellos en los que se han hallado estos instrumentos se ha observado la inclusión de cuestionarios específicos, en una pequeña parte (un 16%) la inclusión de instrumentos genéricos, y solo en un 22% se registraron cuestionarios genéricos más específicos, situación recomendada para poder detectar mínimos cambios debidos al tratamiento y a su vez poder realizar comparaciones entre grupos o evaluar diferentes tratamientos en enfermedades distintas1,20.
En aproximadamente la totalidad de los protocolos donde no aparecieron cuestionarios de CVRS (95%) hubiera sido apropiada su inclusión, por tratarse, generalmente, de EC con pacientes cuya patología era crónica o cuyo tratamiento producía con frecuencia reacciones adversas (medicamentos citostáticos). No deja de ser paradójica la baja aparición de RNP en estudios con pacientes infectados por el VIH (solo en uno de 6 protocolos), patología en la que se suele tener en cuenta, por su importancia, la valoración subjetiva del paciente en la práctica clínica habitual21.
En nuestro estudio, se observa una mayor inclusión de instrumentos para evaluar la CVRS que en el realizado por San Miguel et al. (44,3 versus 28,5%) debido seguramente a que estos últimos incluyen en su investigación protocolos más antiguos. Además, estos autores también encuentran que el uso de estos cuestionarios todavía no es sistemático en los EC22. Entre los beneficios que genera la investigación de la CVRS, además de como medida adicional en la evaluación de la eficacia o efectividad de los diferentes tratamientos, se encuentran la predicción de la evolución de la enfermedad y la utilización en el análisis coste-utilidad3,23,24. Este análisis, basado en los años de vida ajustados por calidad (AVAC), se ha convertido en uno de los tipos de evaluación económica más utilizado y es recomendado como método de elección por algunos sistemas nacionales de salud, como el NICE6,25. Para poder estimar los AVAC son necesarias las escalas de utilidad como la escala visual analógica (EVA). Además, también es posible calcular valores de utilidad con el cuestionario genérico EQ-5D y a través del SF-36 y del IIEF de función eréctil realizando diversos procedimientos6. En el presente estudio se ha registrado en menos de la mitad de los análisis con RNP (40,5%) la utilización de cuestionarios adecuados para obtener medidas de utilidad: 29,7% con EQ-5D, 8,1% con EVA, 8,1% con el cuestionario SF-36 y en el 50% de los protocolos donde la patología estudiada era el cáncer de próstata, el IIEF.
Dentro del campo de la evaluación económica, los ensayos en fase III son generalmente, antes de la comercialización de un medicamento, la última oportunidad para realizar un análisis de costes, el cual ofrece información acerca de los recursos empleados al comparar distintas opciones terapéuticas. Estos análisis no son novedosos, ya en 1998 se llevó a cabo en artritis reumatoide, con el ensayo COBRA, una evaluación coste-utilidad de una terapia combinada frente a sulfasalazina en monoterapia26. Sin embargo, las condiciones ideales bajo las que se realizan los EC afectan a las estimaciones de eficacia, toxicidad, utilización de recursos sanitarios y al impacto económico real del medicamento, y por lo tanto se hace necesario medir la efectividad con estudios postautorización observacionales27,28. Por este motivo, diferentes autores abogan por el diseño de protocolos más naturalísticos en los EC fase III, ya que cada vez más países precisan, previamente a la comercialización de los medicamentos, de la realización de evaluaciones farmacoeconómicas29. En nuestro estudio, la inclusión de variables económicas ha sido baja, tanto en los EC (22%) como en los estudios postautorización (18%), mostrando que pese a la importancia del tema, su uso tampoco es extensivo, al igual que encuentran San Miguel et al.22 (13,6%).
Los resultados de este trabajo se deben interpretar teniendo en cuenta que el estudio se ha realizado en un único centro y, por tanto, en hospitales que incluyan otras especialidades o disciplinas en las que se hayan introducido con mayor o menor aceptación los estudios acerca de la CVRS, como sería el caso de pediatría30, podrían verse modificados los porcentajes hallados en el presente trabajo, lo que provoca que a nivel de especialidad se puedan realizar generalizaciones, no ocurriendo así a nivel de hospital.
La investigación en CVRS, aunque abundante, es relativamente joven. Y todavía no ha sido establecido ningún patrón oro que utilicen todos los investigadores de manera consistente12. Sin embargo, el envejecimiento progresivo de la población y el aumento de terapias cada vez más costosas para el tratamiento de enfermedades crónicas provoca que aspectos en la evaluación de las tecnologías sanitarias, distintos a la eficacia y/o seguridad, como son la investigación de resultados en salud y la evaluación económica, reciban mayor atención en el curso de los EC, si bien su uso aún no está generalizado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.