La Comisión de Farmacia y Terapéutica (CFT) evalúa peticiones de usos fuera de indicación con un modelo de informe abreviado. El objetivo fue realizar un análisis descriptivo de esta actividad y estudiar la tasa de autorizaciones.
Material y métodosEstudio descriptivo de los informes de la CFT del hospital entre septiembre de 2009 y abril de 2011. Se analizó tipo de fármaco por grupo terapéutico y por tipo de dispensación, indicación y servicio peticionario. Además, se estudió la decisión final adoptada como variable principal y porcentaje de solicitudes aprobadas según características del medicamento evaluado, indicación solicitada, alternativas usadas, evidencia y coste, como resultados secundarios.
ResultadosDe un total de 51 solicitudes analizadas, un 60,8% fueron medicamentos de uso hospitalario y un 54,9% citostáticos. Destacaron las indicaciones oncohematológicas (43,2%) y autoinmunes (35,3%). Los servicios con más peticiones fueron Hematología (11 peticiones aprobándose el 72,7%), Oncología y Pediatría (10 peticiones aprobándose el 50% para ambas).
Se aprobaron el 60,8% de las peticiones. De las no autorizadas, 11 no agotaron las alternativas terapéuticas y 8 no presentaban evidencia suficiente para ser aceptadas. El 47,1% de los medicamentos solicitados tenían un coste/paciente entre 10.000-100.000 euros aprobándose el 58,3% (coste por tratamiento completo si tenía duración definida o coste por año en tratamientos crónicos).
ConclusiónHay una gran actividad de la CFT que crece con los años. La mayoría de las solicitudes son de fármacos de uso hospitalario, sobre todo de citostáticos por Oncohematología.
Existe una alta tasa de autorización con una alta variabilidad según servicio y tipo de evidencia. La diferencia, entre aprobados y no aprobados respecto al coste sigue una lógica de coste-efectividad.
The Pharmacy and Therapeutics Committee (PTC) evaluates the requests for off-label uses with an abbreviated report format. The aim of this study is to perform a descriptive analysis of this activity and to study the rate of approvals.
Material and MethodsA descriptive study was performed on the PTC reports in a tertiary hospital between September 2009 and April 2011. The type of drug by treatment group and by type of dispensing, indication and requesting department was analysed. The final decision adopted was studied as the primary outcome, and the percentage of requests approved according to the characteristics of the drug evaluated, indication requested, alternatives used, evidence and cost, as secondary outcomes.
ResultsA total of 51 applications were analysed, of which 60.8% were drugs for hospital use and 54.9% cytostatic. The most requested indications were the onco-haematological (43.2%) and autoimmune (35.3%). Haematology was the department that made most requests (11 requests with 72.7% approved), Oncology and Paediatrics (both with 10 requests, with 50% approved).
Almost two-thirds (60.8%) of the requests were approved. Of those that were not approved, 11 had not used up the therapeutic alternatives, and 8 had no evidence. Just under half (47.1%) of the drugs requested had a cost/patient between 10,000-100,000 euros,of which 58.3% were approved (cost per course of treatment if it had a defined period, or cost of treatment per year for chronic treatment).
ConclusionThere is an increase in the activity of the PTC that is growing over the years. Most applications focus on drugs for hospital use and cytostatic drugs by Onco-haematology.
There is a high rate of approval by the PTC, and high variability in the percentage of approval depending on the department and the evidence of use. The difference between approved and unapproved requests followed a logic of cost-effectiveness.
El uso de medicamentos en indicaciones no contempladas en ficha técnica, internacionalmente conocido como off-label, es una situación relativamente frecuente1 y puede consistir tanto en el uso en una indicación distinta a la aprobada, como en el uso en la misma indicación pero en distinta población de pacientes2, por ejemplo pacientes pediátricos, uso con diferente dosis, duración de tratamiento o vía de administración, o bien su aplicación en patologías muy graves que carecen de alternativas eficaces tras la obtención de resultados clínicos beneficiosos en fases intermedias de investigación3.
Esta situación puede tener diversas causas. Habitualmente existe una cierta demora entre la publicación de los resultados de la investigación clínica y la autorización de una nueva indicación por las agencias reguladoras4. También puede ser el caso que determinados grupos de pacientes excluidos en ensayos clínicos deben ser tratados5 o bien el desinterés del fabricante en registrar la indicación por motivos económicos. Las agencias reguladoras solo pueden registrar indicaciones si lo solicita el fabricante. De esta manera, hay medicamentos para los que existen fuertes evidencias de eficacia pero para los que el fabricante no desea registrar la indicación, bien porque el medicamento es antiguo y por tanto de bajo precio, porque se va a utilizar en muy pocos pacientes o porque su uso tiene otras implicaciones6.
En España, desde que el 21 de julio de 2009 entrara en vigor el Real Decreto 1015/20097 por el que se regula la disponibilidad de medicamentos en situaciones especiales, la utilización de medicamentos en indicaciones no aprobadas pasa a ser una responsabilidad del médico y su paciente quien deberá dar su consentimiento informado. Sin embargo, la norma establece que para aquellos facultativos que trabajen en el seno de instituciones sanitarias la utilización en indicaciones no aprobadas deberá someterse a los protocolos asistenciales existentes8. Por ello, en la mayoría de los hospitales españoles la Comisión de Farmacia y Terapéutica (CFT) ha asumido la autorización de estos usos, bien en forma de protocolos o bien mediante autorizaciones individualizadas9. La CFT es una institución que tiene una tradición de más de 50 años en la selección de medicamentos en el hospital y se ha ido adaptando a las necesidades de selección de medicamentos en cada momento10.
El objetivo de este trabajo fue analizar los usos fuera de indicación para pacientes individuales evaluados por la CFT del Hospital Universitario Virgen del Rocío en el periodo septiembre 2009-abril 2011.
Material y métodosLa CFT del Hospital Universitario Virgen del Rocío estudia las peticiones de uso de medicamentos fuera de indicación para pacientes individuales siguiendo el siguiente procedimiento: se inicia el proceso cuando el clínico contacta con el Servicio de Farmacia quien realiza una evaluación de las evidencias disponibles y una propuesta de autorización o denegación que se detalla en un modelo de informe abreviado. Este informe se somete a decisión de una comisión permanente de 7 de los miembros permanentes de la CFT que tomará la decisión en 48 horas. Los criterios de evaluación son: análisis de la evidencia disponible para ese fármaco y esa indicación, análisis de la adecuación de la situación clínica del paciente a las evidencias disponibles, existencia de alternativas con indicación aprobada, existencia de alternativas con indicación no aprobada pero con mayor peso de evidencia, análisis de impacto económico.
En el Hospital Universitario Virgen del Rocío (HUVR) se ha considerado que el método anterior es aplicable a cualquier indicación no aprobada en el centro, independientemente de que sea o no una indicación aprobada oficialmente en España. En el caso de no autorizadas en España, se requerirá el consentimiento informado ya que es imprescindible un estricto cumplimiento de la Ley de autonomía del paciente11.
Se consultaron todos los informes de la CFT del periodo comprendido entre septiembre de 2009 y abril 2011.
Por un lado, se describió el tipo de fármaco (grupo farmacoterapéutico y categoría de dispensación), indicación (considerando el tipo de patología, similitud con la aprobada y si se trataba de un medicamento no incluido en la guía farmacoterapéutica del hospital o un off-label), y considerando el servicio que lo solicitaba.
Por otro lado, la recogida de datos fue orientada hacia la decisión final adoptada (SÍ/NO y motivo) en función de las características del medicamento evaluado (categoría de dispensación), indicación solicitada (área patológica, similitud en indicación aprobada y off-label), alternativas (si las había y si se usaron), evidencia (si la hay, tipo de evidencia) y coste.
Como resultado principal se consideró el porcentaje de autorizaciones y su distribución con respecto a algunas de sus variables (servicio y categoría legal del medicamento) siendo los resultados secundarios el tipo de evidencia aportada, quien la aportó y el coste por paciente.
El coste se calculó por tratamiento completo porque se encontraba definido en el 47,1% de los casos mientras que en el resto, puesto que se trataba de tratamientos crónicos se considera coste de tratamiento por año.
Todos los datos fueron recogidos y codificados por 2 investigadoras trabajando de forma conjunta y las discrepancias se resolvieron con un tercer investigador. Además se contó con una revisión externa por parte de la CFT.
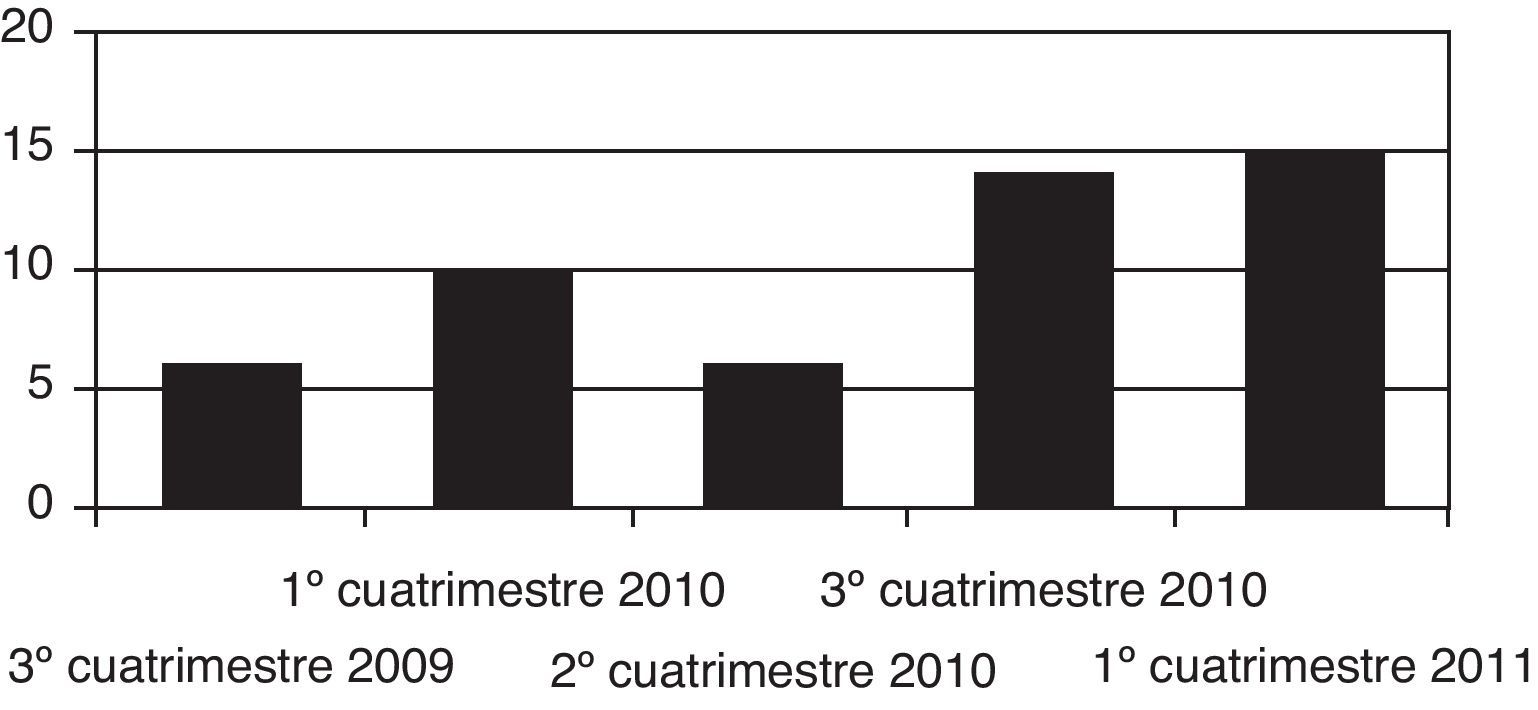
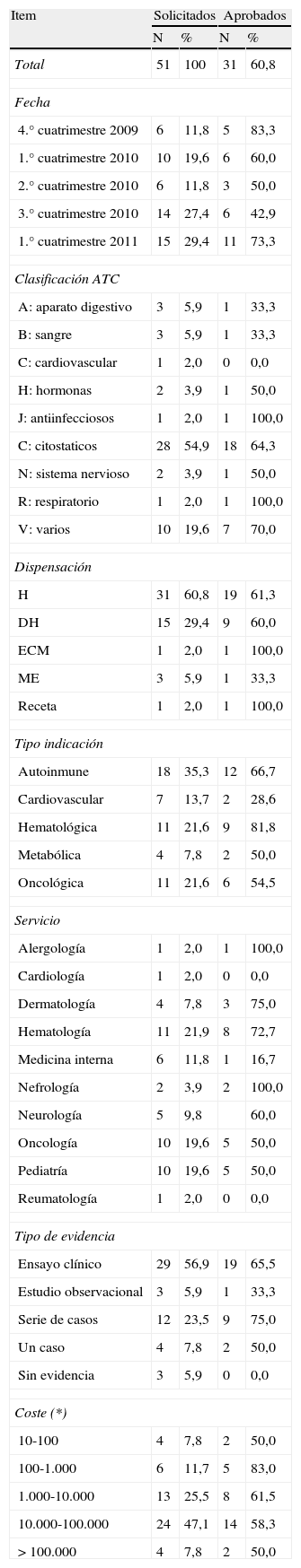
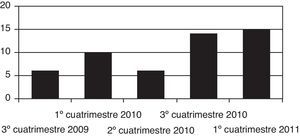
ResultadosSe identificaron un total de 51 informes, de los cuáles 6 correspondieron a 2009, 30 a 2010 y 15 informes a 2011 (fig. 1). La distribución según los distintos aspectos estudiados (clasificación ATC, tipo de indicación, categoría de dispensación, servicio solicitante, tipo de evidencia aportada y coste) y la decisión de la CFT para cada uno de los casos se resumen en la tabla 1.
Distribución de las solicitudes según los diferentes aspectos y decisión de la CFT
| Item | Solicitados | Aprobados | ||
| N | % | N | % | |
| Total | 51 | 100 | 31 | 60,8 |
| Fecha | ||||
| 4.° cuatrimestre 2009 | 6 | 11,8 | 5 | 83,3 |
| 1.° cuatrimestre 2010 | 10 | 19,6 | 6 | 60,0 |
| 2.° cuatrimestre 2010 | 6 | 11,8 | 3 | 50,0 |
| 3.° cuatrimestre 2010 | 14 | 27,4 | 6 | 42,9 |
| 1.° cuatrimestre 2011 | 15 | 29,4 | 11 | 73,3 |
| Clasificación ATC | ||||
| A: aparato digestivo | 3 | 5,9 | 1 | 33,3 |
| B: sangre | 3 | 5,9 | 1 | 33,3 |
| C: cardiovascular | 1 | 2,0 | 0 | 0,0 |
| H: hormonas | 2 | 3,9 | 1 | 50,0 |
| J: antiinfecciosos | 1 | 2,0 | 1 | 100,0 |
| C: citostaticos | 28 | 54,9 | 18 | 64,3 |
| N: sistema nervioso | 2 | 3,9 | 1 | 50,0 |
| R: respiratorio | 1 | 2,0 | 1 | 100,0 |
| V: varios | 10 | 19,6 | 7 | 70,0 |
| Dispensación | ||||
| H | 31 | 60,8 | 19 | 61,3 |
| DH | 15 | 29,4 | 9 | 60,0 |
| ECM | 1 | 2,0 | 1 | 100,0 |
| ME | 3 | 5,9 | 1 | 33,3 |
| Receta | 1 | 2,0 | 1 | 100,0 |
| Tipo indicación | ||||
| Autoinmune | 18 | 35,3 | 12 | 66,7 |
| Cardiovascular | 7 | 13,7 | 2 | 28,6 |
| Hematológica | 11 | 21,6 | 9 | 81,8 |
| Metabólica | 4 | 7,8 | 2 | 50,0 |
| Oncológica | 11 | 21,6 | 6 | 54,5 |
| Servicio | ||||
| Alergología | 1 | 2,0 | 1 | 100,0 |
| Cardiología | 1 | 2,0 | 0 | 0,0 |
| Dermatología | 4 | 7,8 | 3 | 75,0 |
| Hematología | 11 | 21,9 | 8 | 72,7 |
| Medicina interna | 6 | 11,8 | 1 | 16,7 |
| Nefrología | 2 | 3,9 | 2 | 100,0 |
| Neurología | 5 | 9,8 | 60,0 | |
| Oncología | 10 | 19,6 | 5 | 50,0 |
| Pediatría | 10 | 19,6 | 5 | 50,0 |
| Reumatología | 1 | 2,0 | 0 | 0,0 |
| Tipo de evidencia | ||||
| Ensayo clínico | 29 | 56,9 | 19 | 65,5 |
| Estudio observacional | 3 | 5,9 | 1 | 33,3 |
| Serie de casos | 12 | 23,5 | 9 | 75,0 |
| Un caso | 4 | 7,8 | 2 | 50,0 |
| Sin evidencia | 3 | 5,9 | 0 | 0,0 |
| Coste (*) | ||||
| 10-100 | 4 | 7,8 | 2 | 50,0 |
| 100-1.000 | 6 | 11,7 | 5 | 83,0 |
| 1.000-10.000 | 13 | 25,5 | 8 | 61,5 |
| 10.000-100.000 | 24 | 47,1 | 14 | 58,3 |
| > 100.000 | 4 | 7,8 | 2 | 50,0 |
ECM: especial control médico; H: uso hospitalario; DH: diagnóstico hospitalario; ME: medicamento extranjero; (*): coste en euros.
Un 70,6% (36) de las peticiones la realizaron hombres y 29,4% (15) mujeres.
La decisión de la CFT fue favorable más veces que desfavorable. De las 51 peticiones se aprobaron 31 (60,8%). El 25,8% se aprobaron tras agotar las alternativas posibles, un 48,4% por presentar evidencia aceptable sobre la indicación off-label y un 25,8% por ambas razones. También hay que remarcar que de los 31 informes aprobados, en 11 de ellos la evidencia disponible era baja (serie de casos y casos), pero no disponían prácticamente de otras alternativas.
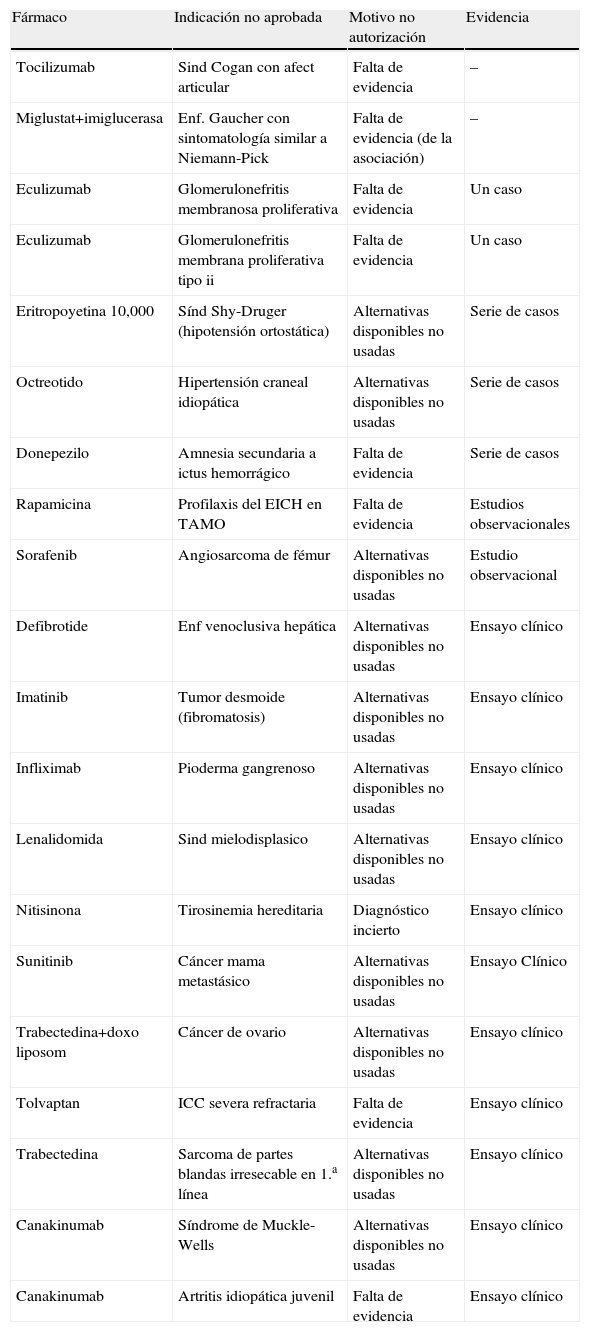
De las no autorizadas, 11 (55%) no agotaron las alternativas terapéuticas identificadas por la comisión en el momento de la petición, 8 (40%) por falta de evidencia y 1 (5%) por diagnóstico incierto. Cabe destacar que en 7 (35%) casos no autorizados la evidencia era de muy baja calidad (serie de casos, un caso o ninguno).
De las 11 (55%) peticiones en las que se aportaron ensayos clínicos y no se autorizaron, hay que remarcar que 8 (73%) no se aprobaron por no agotar las alternativas disponibles para la indicación solicitada y 2 de ellos (18%) porque el ensayo clínico aportado no demostraba la suficiente evidencia de eficacia (tabla 2).
Medicamentos no autorizados para su uso off-label, motivo y evidencia disponible sobre su eficacia
| Fármaco | Indicación no aprobada | Motivo no autorización | Evidencia |
| Tocilizumab | Sind Cogan con afect articular | Falta de evidencia | – |
| Miglustat+imiglucerasa | Enf. Gaucher con sintomatología similar a Niemann-Pick | Falta de evidencia (de la asociación) | – |
| Eculizumab | Glomerulonefritis membranosa proliferativa | Falta de evidencia | Un caso |
| Eculizumab | Glomerulonefritis membrana proliferativa tipo ii | Falta de evidencia | Un caso |
| Eritropoyetina 10,000 | Sínd Shy-Druger (hipotensión ortostática) | Alternativas disponibles no usadas | Serie de casos |
| Octreotido | Hipertensión craneal idiopática | Alternativas disponibles no usadas | Serie de casos |
| Donepezilo | Amnesia secundaria a ictus hemorrágico | Falta de evidencia | Serie de casos |
| Rapamicina | Profilaxis del EICH en TAMO | Falta de evidencia | Estudios observacionales |
| Sorafenib | Angiosarcoma de fémur | Alternativas disponibles no usadas | Estudio observacional |
| Defibrotide | Enf venoclusiva hepática | Alternativas disponibles no usadas | Ensayo clínico |
| Imatinib | Tumor desmoide (fibromatosis) | Alternativas disponibles no usadas | Ensayo clínico |
| Infliximab | Pioderma gangrenoso | Alternativas disponibles no usadas | Ensayo clínico |
| Lenalidomida | Sind mielodisplasico | Alternativas disponibles no usadas | Ensayo clínico |
| Nitisinona | Tirosinemia hereditaria | Diagnóstico incierto | Ensayo clínico |
| Sunitinib | Cáncer mama metastásico | Alternativas disponibles no usadas | Ensayo Clínico |
| Trabectedina+doxo liposom | Cáncer de ovario | Alternativas disponibles no usadas | Ensayo clínico |
| Tolvaptan | ICC severa refractaria | Falta de evidencia | Ensayo clínico |
| Trabectedina | Sarcoma de partes blandas irresecable en 1.a línea | Alternativas disponibles no usadas | Ensayo clínico |
| Canakinumab | Síndrome de Muckle-Wells | Alternativas disponibles no usadas | Ensayo clínico |
| Canakinumab | Artritis idiopática juvenil | Falta de evidencia | Ensayo clínico |
En el 72,5% de los casos la bibliografía fue aportada por el peticionario y en el resto por la comisión.
El coste asociado fue muy alto en la mayoría de los casos. El 80% de las solicitudes suponen un coste por paciente mayor de 1.000 euros por tratamiento completo o por año y el 55% un coste mayor de 10.000€.
Así mismo, se analizó el porcentaje de medicamentos aprobados en la CFT con respecto al coste. Para costes entre 10-1.000 € se aprobaron 7 de cada 10 peticiones (70%), entre 1.000-100.000 € se aprobaron 22 de 37 peticiones (59,5%) y, para costes por encima de 100.000 € se aprobaron 2 de 4 solicitudes (50%).
La suma del cálculo del impacto presupuestario de los medicamentos aprobados ascendió a 843.057 €. Los tratamientos finalmente rechazados, en el caso de que se hubieran aprobado, hubieran supuesto un gasto de 915.385 €. Uno de los fármacos evaluados tiene un coste muy alto (eculizumab 240.000 €). Su inclusión en el cálculo podría distorsionar los datos. Por ello, el cálculo del impacto presupuestario teórico de los medicamentos aprobados excluyendo este fármaco es de 603.057 € mientras que el coste evitado teórico de los no aprobados asciende a 435.385 €.
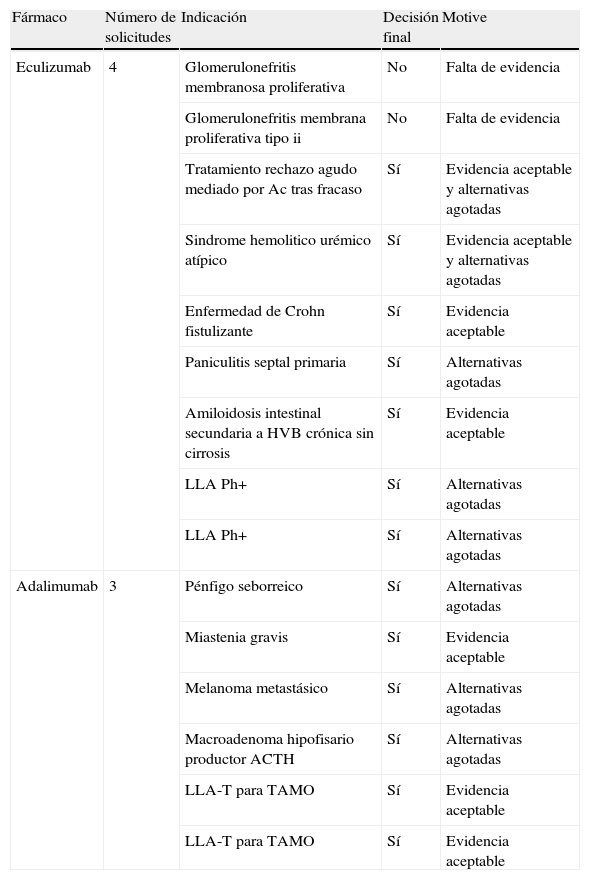
En la tabla 3 se muestran algunos de los fármacos solicitados con más frecuencia, su indicación y el motivo de la decisión adoptada por la CFT.
Solicitudes de fármacos más frecuentes, indicaciones y decisión final adoptada por la Comisión de Farmacia y Terapéutica
| Fármaco | Número de solicitudes | Indicación | Decisión final | Motive |
| Eculizumab | 4 | Glomerulonefritis membranosa proliferativa | No | Falta de evidencia |
| Glomerulonefritis membrana proliferativa tipo ii | No | Falta de evidencia | ||
| Tratamiento rechazo agudo mediado por Ac tras fracaso | Sí | Evidencia aceptable y alternativas agotadas | ||
| Sindrome hemolitico urémico atípico | Sí | Evidencia aceptable y alternativas agotadas | ||
| Enfermedad de Crohn fistulizante | Sí | Evidencia aceptable | ||
| Paniculitis septal primaria | Sí | Alternativas agotadas | ||
| Amiloidosis intestinal secundaria a HVB crónica sin cirrosis | Sí | Evidencia aceptable | ||
| LLA Ph+ | Sí | Alternativas agotadas | ||
| LLA Ph+ | Sí | Alternativas agotadas | ||
| Adalimumab | 3 | Pénfigo seborreico | Sí | Alternativas agotadas |
| Miastenia gravis | Sí | Evidencia aceptable | ||
| Melanoma metastásico | Sí | Alternativas agotadas | ||
| Macroadenoma hipofisario productor ACTH | Sí | Alternativas agotadas | ||
| LLA-T para TAMO | Sí | Evidencia aceptable | ||
| LLA-T para TAMO | Sí | Evidencia aceptable |
A continuación, citamos ejemplos de fármacos para los cuáles se han emitido informes, que por su peculiaridad nos han resultado especialmente interesantes, aunque algunos no aparecen en la tabla anterior, dado que se solicitaron solamente en una ocasión.
Un ejemplo es el sirólimus tópico solicitado por Dermatología para los angiofibromas faciales de la esclerosis tuberosa. Tras agotar la alternativa posible (resección, criocirugía, dermoabrasión, láser) y analizar la evidencia disponible (un caso) se decide aprobar por considerar una evidencia aceptable en un trastorno sin otra elección. El coste anual es de 2.730 euros.
Por otro lado, se analizó la petición de omalizumab por Alergología para la profilaxis de una nueva reacción anafiláctica por picadura de avispa tras agotar la única alternativa con inmunoterapia específica. Se autorizó después de analizar series de casos y considerarlo como evidencia aceptable.
Finalmente, cabe destacar el caso de eculizumab en el síndrome hemolítico urémico atípico, el cual tras evaluar los ensayos clínicos disponibles con buenos resultados y agotar las alternativas (plasmaféresis) se autorizó por la CFT. El coste ascendió a 240.656 euros.
DiscusiónHasta el momento este es el primer estudio que analiza las autorizaciones de uso fuera de indicación de un hospital español tras la modificación legislativa que supuso el decreto sobre disponibilidad de medicamentos en situaciones especiales7. Este trabajo muestra una actividad importante de evaluación12 que crece a lo largo del estudio con la disminución lógica del periodo vacacional correspondiente al segundo cuatrimestre 2010.
El método de evaluación a través de un grupo reducido de miembros de la comisión de farmacia y en base a un informe de evaluación abreviado permite suficiente agilidad para dar una respuesta rápida a casos de tratamiento a veces relativamente urgentes, a la vez que garantiza una decisión basada en las mejores evidencias disponibles13 y la relación coste-efectividad y preserva los aspectos éticos relacionados con esta decisión14.
La mayoría de las solicitudes se centran en Oncohematología y Pediatría, de ahí que los medicamentos más solicitados sean citostáticos, seguidos de los inmunosupresores con utilidad en la plétora de enfermedades autoinmunes existentes. Los medicamentos anti-TNF y anti-Interleukinas están también entre los más solicitados.
La preponderancia de las indicaciones oncohematológicas coincide con otros estudios15 y puede tener su origen en la rápida difusión de los resultados de investigación en esta disciplina y la tendencia creciente a tratar a los pacientes cada vez con más líneas de tratamiento y mediante combinaciones de medicamentos mientras que las agencias de registro aprueban la comercialización de los mismos para solo algunas indicaciones y esquemas de combinación16. El uso de medicamentos en indicaciones no aprobadas en pediatría es bien conocido17 y deriva del escaso número de ensayos clínicos que se realizan incluyendo población pediátrica y la subsiguiente falta de autorizaciones por las agencias de registro18.
Se ha identificado una tasa de autorización relativamente alta en nuestro centro. Se aprueban más peticiones de las que se rechazan. Esto puede deberse a un posible disciplina de los clínicos que solo solicitarían aquellos tratamientos más justificados, a la vez de que, al tratarse de un hospital de tercer nivel que recibe pacientes de referencia en muchas patologías poco prevalentes, estos se encuentran en situaciones clínicas refractarias a los tratamientos de elección disponibles. Esta autodisciplina en la solicitud podría explicar también la diferente tasa de aprobación entre los distintos servicios peticionarios.
Entre las causas de denegación destaca en más de la mitad de los casos que no se habían agotado alternativas disponibles. Incluso existiendo buena evidencia para la propuesta, esta se deniega por existir alternativas con indicación aprobada, mejor evidencia y/o menor coste. Este aspecto remarca la importancia de no evaluar la indicación solicitada de manera aislada sino en el contexto de las alternativas existentes para ese caso.
Otro hallazgo relevante es una cierta diferencia en la tasa de aprobación/rechazo según el coste medio del tratamiento, aunque esta diferencia no es muy acentuada. Como era previsible, los tratamientos con más impacto presupuestario tienen menor porcentaje de autorización, puesto que, precisamente por su coste solo se justificarían en el caso de inexistencia de alternativas o que estas hubieran sido utilizadas previamente en el paciente o que tuvieran aún más coste.
El impacto presupuestario en términos absolutos es muy importante y concordante con otros estudios19. El coste de tratamiento de los 32 pacientes autorizados excede los seiscientos mil euros. Por otro lado los tratamientos denegados hubieran supuesto un coste de cuatrocientos mil euros, lo que da idea de la importancia que tiene esta actividad para la gestión del hospital. Es decir, la no utilización de medicamentos en situaciones para las que no hay evidencias o bien existen alternativas mejores o menos costosas, supone no exponer a nuestros pacientes a tratamientos sin base científica a la vez que supone un gasto evitado muy importante para el centro.
La principal limitación de este estudio radica en su carácter unicéntrico por lo que las conclusiones puede que no sean extrapolables a otros hospitales, dado que los condicionantes organizativos y culturales en la evaluación de la indicación de tratamientos pueden variar mucho de unos centros a otros. Igualmente hubiera sido deseable evaluar el impacto en salud de los tratamientos autorizados y relacionarlo con el importante esfuerzo económico que el hospital realiza en tratar un número tan reducido de pacientes. Sin embargo tamaño empeño excedía los objetivos de nuestro trabajo.
Este trabajo analiza las peticiones de medicamentos en usos fuera de indicación excepcionales para pacientes individuales. En nuestro hospital, sin embargo, aquellos usos fuera de indicación que se pretendan incorporar a protocolos de tratamiento de series amplias de pacientes se evalúan por la Comisión de Farmacia mediante un procedimiento normal, el mismo que se utiliza para las indicaciones aprobadas. En el futuro sería necesario que los servicios de salud establecieran mecanismos para evaluar y, en su caso, autorizar o denegar determinados usos fuera de indicación muy comunes en el medio hospitalario de forma centralizada para evitar evaluaciones repetidas en cada centro e inequidad en su financiación. El programa Medicare en EE. UU. tiene establecidos sistemas para financiación de determinados usos fuera de indicación de evidencia contrastada. Igualmente el Servicio Andaluz de Salud ha establecido una comisión para la homogeneización de estos usos en su ámbito competencial20.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A María Atienza Amores, Emilia Barrot Cortés, Francisco Javier Bautista Paloma, Juan Manuel Blanco Hidalgo, Ana Casas Fernández de Tejerina, Javier Dapena Fernández, Francisco Dominguez Abascal, Elena Hevia Álvarez, Rocío García Carbonero, Javier Jiménez Jiménez, Mª Ángeles Martínez Maestre, Ramiro Núñez Vázquez, Diego Rangel Sousa, Federico Relimpio Astolfi, Nieves Romero Domínguez, Bernardo Santos Ramos, Alfonso Soto Moreno, Jaime Torelló Iserte y Jose Manuel Varela Aguilar, como miembros de la Comisión de Farmacia y Terapéutica del Hospitalaria Universitario Virgen del Rocío por su trabajo y colaboración.