Identificar los riesgos en la elaboración de citostáticos intravenosos de forma proactiva, priorizarlos y establecer medidas de mejora en la seguridad de los procedimientos utilizados.
Material y métodosSe utilizó la metodología «análisis modal de fallos y efectos». Un equipo multidisciplinar identificó los modos de fallo del proceso a través de tormenta de ideas. Se evaluó el impacto asociado a cada modo de fallo con el número de prioridad de riesgo (NPR), en el que intervienen 3 variables: ocurrencia, gravedad y detectabilidad. Se establecieron medidas de mejora para todos los modos de fallo identificados; se consideraron críticos aquellos con un NPR>100. Se calculó también el NPR final (teórico) que se obtendría con las medidas propuestas y se rediseñó el proceso.
ResultadosSe identificaron un total de 34 modos de fallo. El NPR inicial acumulado fue de 3022 (rango: 3-252), y tras las acciones recomendadas el NPR final fue de 1292 (rango: 3-189). Se obtuvieron puntuaciones de NPR>100 en 13 modos de fallo; solo el subproceso de dispensación estuvo exento de puntos críticos (NPR>100). Se consiguió una reducción del NPR final >50% en 9 modos de fallo.
ConclusionesEsta metodología de análisis de riesgo prospectiva nos permite priorizar los puntos débiles del sistema para optimizar el empleo de recursos y conseguir una mejora sustancial en la seguridad de la elaboración de citostáticos mediante la introducción del doble chequeo y el etiquetado de productos intermedios.
To proactively identify risks in the preparation of intravenous cytostatic drugs, and to prioritise and establish measures to improve safety procedures.
Material and methodsFailure Mode Effect Analysis methodology was used. A multidisciplinary team identified potential failure modes of the procedure through a brainstorming session. The impact associated with each failure mode was assessed with the Risk Priority Number (RPN), which involves three variables: occurrence, severity, and detectability. Improvement measures were established for all identified failure modes, with those with RPN>100 considered critical. The final RPN (theoretical) that would result from the proposed measures was also calculated and the process was redesigned.
ResultsA total of 34 failure modes were identified. The initial accumulated RPN was 3022 (range: 3-252), and after recommended actions the final RPN was 1292 (range: 3-189). RPN scores >100 were obtained in 13 failure modes; only the dispensing sub-process was free of critical points (RPN>100). A final reduction of RPN>50% was achieved in 9 failure modes.
ConclusionsThis prospective risk analysis methodology allows the weaknesses of the procedure to be prioritised, optimize use of resources, and a substantial improvement in the safety of the preparation of cytostatic drugs through the introduction of double checking and intermediate product labelling.
La seguridad del paciente es un tema prioritario para los servicios sanitarios y con gran repercusión pública a raíz de diversos estudios llevados cabo en las últimas 2 décadas. Estos estudios situaban los errores médicos como la séptima causa de muerte en Estados Unidos, con una cifra entre 44.000 y 98.000 muertes al año, por delante incluso de patologías como el sida, el cáncer de mama o los accidentes de tráfico1. La seguridad del sistema de utilización de los medicamentos se contempla como una de las áreas fundamentales por la frecuencia, la gravedad y la evitabilidad de los errores de medicación2. Este hecho ha sido constatado en el Estudio Nacional de Efectos Adversos Ligados a la Hospitalización (ENEAS), cuyos hallazgos indican que el 37,4% de los acontecimientos adversos detectados en pacientes ingresados estaban causados por medicamentos, de los que el 34,8% eran prevenibles3.
Los citostáticos pertenecen a la lista de «medicamentos de alto riesgo» del Institute for Safe Medication Practices (ISMP); son medicamentos que, cuando se utilizan incorrectamente, presentan una gran probabilidad de causar daños graves o incluso mortales a los pacientes4. Esta lista fue confeccionada a partir de un sistema voluntario de notificación de errores de medicación y de una encuesta realizada a más de 350 profesionales sanitarios, en la que los citostáticos intravenosos fueron los medicamentos más frecuentemente considerados de alto riesgo (98%), por delante de las sales concentradas de potasio intravenoso4. En un estudio más reciente se llegó a estimar que los errores de medicación relacionados con la quimioterapia provocaban hasta 500 muertes anuales, y que solo se comunicaban el 3% de ellos5. Por ello, todas las organizaciones insisten es la necesidad de establecer procedimientos explícitos para mejorar la seguridad en el manejo de estos medicamentos, y una de las estrategias clave propuestas es el desarrollo de programas de gestión de riesgos6.
Dentro de las estrategias más comunes para la evaluación de riesgos se encuentra el análisis modal de fallos y efectos (AMFE), una metodología muy útil para valorar los fallos potenciales en el diseño y la provisión de servicios. A diferencia del análisis de causa raíz (ACR), que se utiliza de forma reactiva una vez ocurrido un evento adverso para identificar los agentes causales, el AMFE es usado de forma proactiva, para intentar identificar los eventos adversos que pueden tener lugar como consecuencia de los fallos potenciales7. Se trata de un modelo que proporciona una forma estructurada para cuantificar los efectos de posibles fallos, permitiendo priorizar las acciones encaminadas a minimizarlos o eliminarlos a través del número de prioridad de riesgo (NPR). El principal objetivo del AMFE es disminuir o eliminar la ocurrencia de errores, aumentar su detectabilidad (visibilidad) y minimizar sus consecuencias, planteamiento que coincide con los principios básicos de seguridad propuestos para los medicamentos de alto riesgo8.
La metodología AMFE empezó a utilizarse en los años setenta en el ámbito de la industria (automovilística, aeroespacial y nuclear), y en la década de los noventa su uso se extendió al sector sanitario9. Un signo de este proceso de maduración fue la inclusión en 2001, por parte de la Joint Commission on Accreditation of Healthcare Organizations, de un estándar que implicaba realizar anualmente un programa proactivo para la identificación de riesgos para la seguridad del paciente. En nuestro entorno la aplicación de la metodología AMFE se ha incluido dentro de programas de acreditación como el empleado por la Agencia de Calidad Sanitaria de Andalucía10 y de herramientas como el Cuestionario de Autoevaluación de la Seguridad del Sistema de Utilización de los Medicamentos en los Hospitales11.
Se ha utilizado en campos complejos y de alto riesgo, como la radioterapia, la oncología, la pediatría, los cuidados críticos, la diálisis o la transfusión12-16, pero la metodología AMFE es un instrumento dinámico que debe actualizarse y modificarse para dar respuesta a los cambios en los procesos, y estos cambios han sido especialmente pronunciados en el proceso de elaboración de quimioterapia. La aplicación de esta metodología al ámbito sanitario en España es reciente17-19. Nuestro trabajo forma parte de un programa global de gestión de riesgos que aborda diferentes áreas de la Unidad de Gestión Clínica (UGC) de Farmacia Hospitalaria.
El principal objetivo de nuestro estudio es la identificación de riesgos en la elaboración de citostáticos intravenosos de forma proactiva, su priorización y el establecimiento de medidas de mejora en la seguridad de los procedimientos utilizados.
Material y métodosPara llevar a cabo el análisis de los posibles riesgos se empleó la metodología AMFE, ya mencionada anteriormente. A continuación se describe detalladamente el procedimiento de trabajo desarrollado durante la realización de este estudio.
El primer paso del AMFE fue el establecimiento del equipo multidisciplinar encargado de realizar dicho análisis. En el grupo de trabajo se incluyeron las siguientes figuras:
- -
Asesor experto en metodología AMFE.
- -
Coordinador o líder de grupo encargado de la organización de las reuniones y de garantizar el correcto funcionamiento del equipo.
- -
Personas con experiencia y conocimientos de la unidad y del procedimiento objeto del AMFE.
- -
Personas con experiencia y conocimientos de la unidad pero con una menor vinculación al procedimiento objeto del AMFE.
Uno o varios de los anteriores roles podían recaer en un mismo miembro del equipo. Se decidió no incluir en el equipo a personal ajeno a la unidad, por tratarse de la evaluación de un proceso interno.
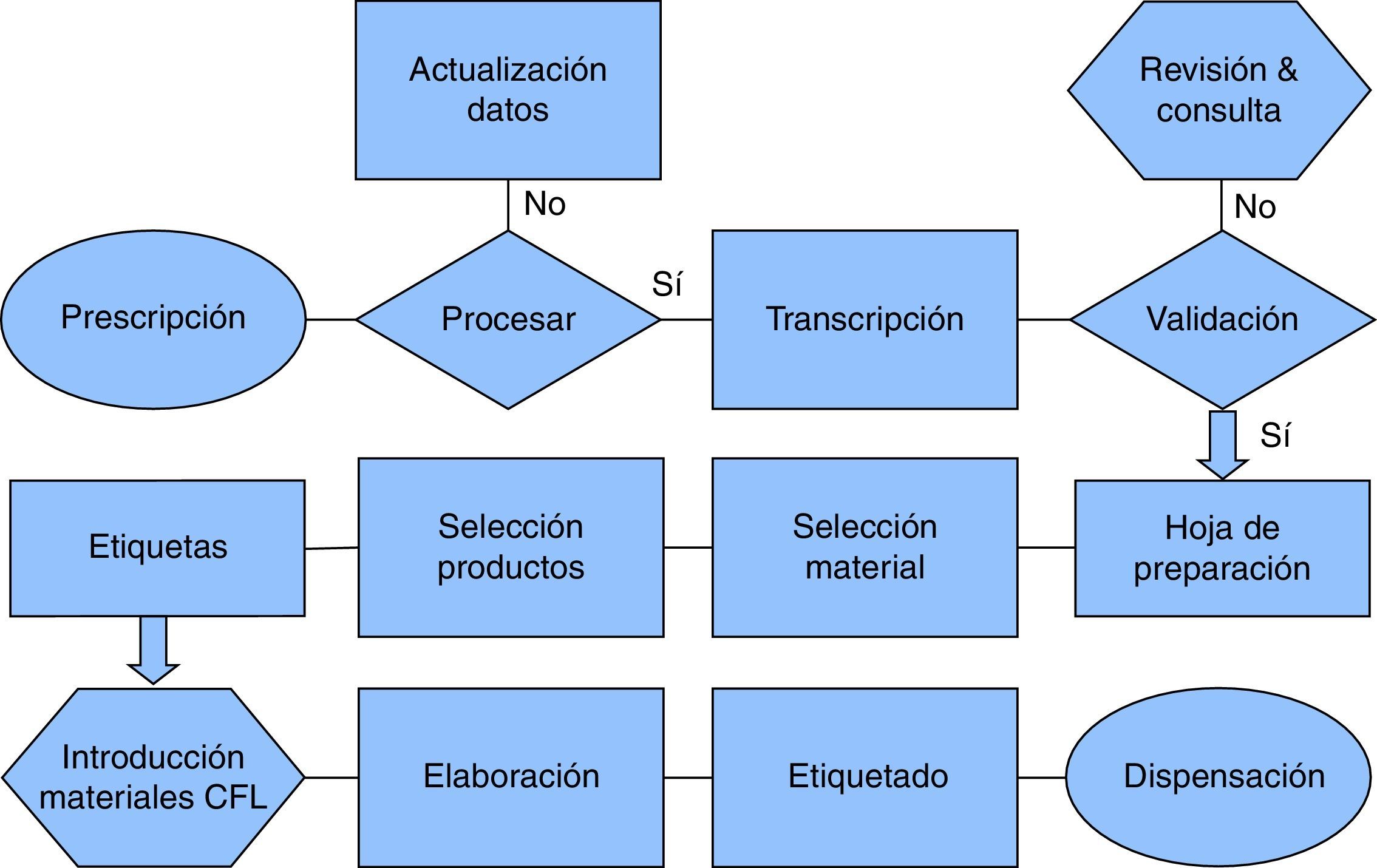
Se estableció una definición del proceso a evaluar y una descripción de los componentes. Este paso permitió una mayor comprensión del proceso a evaluar por parte del equipo y consistió en delimitar claramente el proceso y describir todos y cada uno de los subprocesos que lo integran. En la definición de este proceso fueron claves las aportaciones del personal de la unidad (responsable de área, residente, técnico, enfermero y auxiliares). Para facilitar esta tarea se diseñó un diagrama de flujo, que permitió simplificar el proceso y dividirlo en sus respectivos subprocesos fundamentales.
Al tratarse de un proceso complejo, para facilitar el trabajo se analizaron de forma independiente cada uno de los subprocesos descritos en el diagrama de flujo. Para cada uno de ellos se identificaron los diferentes modos de fallo potenciales; se entendió por modo de fallo potencial toda forma en que fuera posible que un servicio o proceso falle. Del mismo modo, se identificaron las causas que podían originar los diferentes modos de fallo, así como los efectos que podrían tener en el paciente y/o sistema en caso de producirse. Para esta tarea se utilizó la técnica de la tormenta de ideas o brainstorming, en su versión oral, que se desarrolló en diferentes fases:
- -
Fase de generación de ideas, en la que cada miembro del grupo aportó sus ideas sin ningún tipo de censura por parte del resto del equipo.
- -
Fase de clarificación, con la que se pretendía garantizar que todos los miembros del equipo comprendían claramente cada una de las aportaciones.
- -
Fase de evaluación, llevada a cabo para eliminar las repeticiones y aportaciones fuera del ámbito tratado, así como para agrupar aportaciones afines.
Para calcular el impacto asociado a cada modo de fallo potencial se utilizó el número de prioridad de riesgo (NPR), obtenido mediante una ecuación en la que intervienen 3 variables:
- -
Gravedad o impacto en el paciente y/o en el servicio (G).
- -
Ocurrencia o probabilidad de ocurrir (O).
- -
Detectabilidad o probabilidad de detectarlo en caso de ocurrir (D).
A continuación se muestra la ecuación que permitió obtener este NPR:
Para asignar una puntuación numérica a la gravedad, a la probabilidad de ocurrir y a la capacidad de detección de cada uno de los modos de fallo identificados se usaron las Escalas de valoración de Gravedad, Ocurrencia y Detectabilidad proporcionadas por el Ministerio de Sanidad y Consumo (tabla 1), que contemplan una puntuación de 1 a 10 para cada una de las variables.
Escalas de valoración
| Valoración | Gravedad (G) | Ocurrencia (O) | Detectabilidad (D) |
|---|---|---|---|
| 1 | Sin efecto | Casi nunca | Casi segura |
| 2 | Muy leve | Remota | Muy alta |
| 3 | Leve | Muy leve | Alta |
| 4 | Mínimo | Leve | Moderadamente alta |
| 5 | Moderado | Baja | Media |
| 6 | Significativo | Media | Baja |
| 7 | Mayor | Moderadamente alta | Leve |
| 8 | Extremo | Alta | Muy leve |
| 9 | Serio | Muy Alta | Remota |
| 10 | Peligroso | Casi segura | Casi imposible |
Fuente: adaptado de Gestión de Riesgos y Mejora de la Seguridad del Paciente. Tutorial y Herramientas de Apoyo. Agencia de Calidad del SNS. Ministerio de Sanidad y Consumo.
Se establecieron medidas de mejora para todos los modos de fallo identificados, aunque se consideraron puntos de especial interés aquellos con un NPR por encima de 100. Se calculó para estos puntos críticos el porcentaje de reducción de NPR y se consideró que las medidas de mejora serían especialmente útiles en aquellos con una reducción teórica por encima del 50%. Estas medidas de mejora se incorporaron al proceso, finalizando así el re-diseño del mismo.
ResultadosEl equipo estuvo formado por un total de 9 personas: un farmacéutico responsable del área de elaboración de citostáticos, un farmacéutico experto en la técnica AMFE, un farmacéutico residente, un farmacéutico coordinador del grupo, 3 enfermeras del área de estudio, la supervisora y el director de la UGC de Farmacia Hospitalaria. Esta multidisciplinariedad y diferente grado de experiencia tuvo como objeto aprovechar la sinergia del grupo y garantizar la presencia de diferentes puntos de vista. Se llevaron a cabo un total de 3 reuniones de 4-5h cada una a lo largo de un periodo de 2meses. A estas reuniones acudieron todos los miembros del grupo.
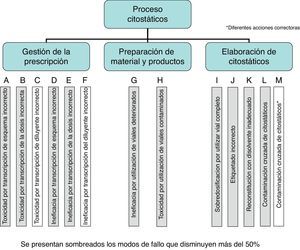
Inicialmente se estableció un diagrama de flujo (fig. 1) que permitió obtener una visión general del entorno a analizar. En él se podía visualizar el flujo de trabajo, los documentos utilizados y las decisiones a tomar en cada paso. Para simplificar el trabajo del grupo se consideraron 4 subprocesos: gestión de la prescripción, preparación de materiales y productos, elaboración del citostático y dispensación.
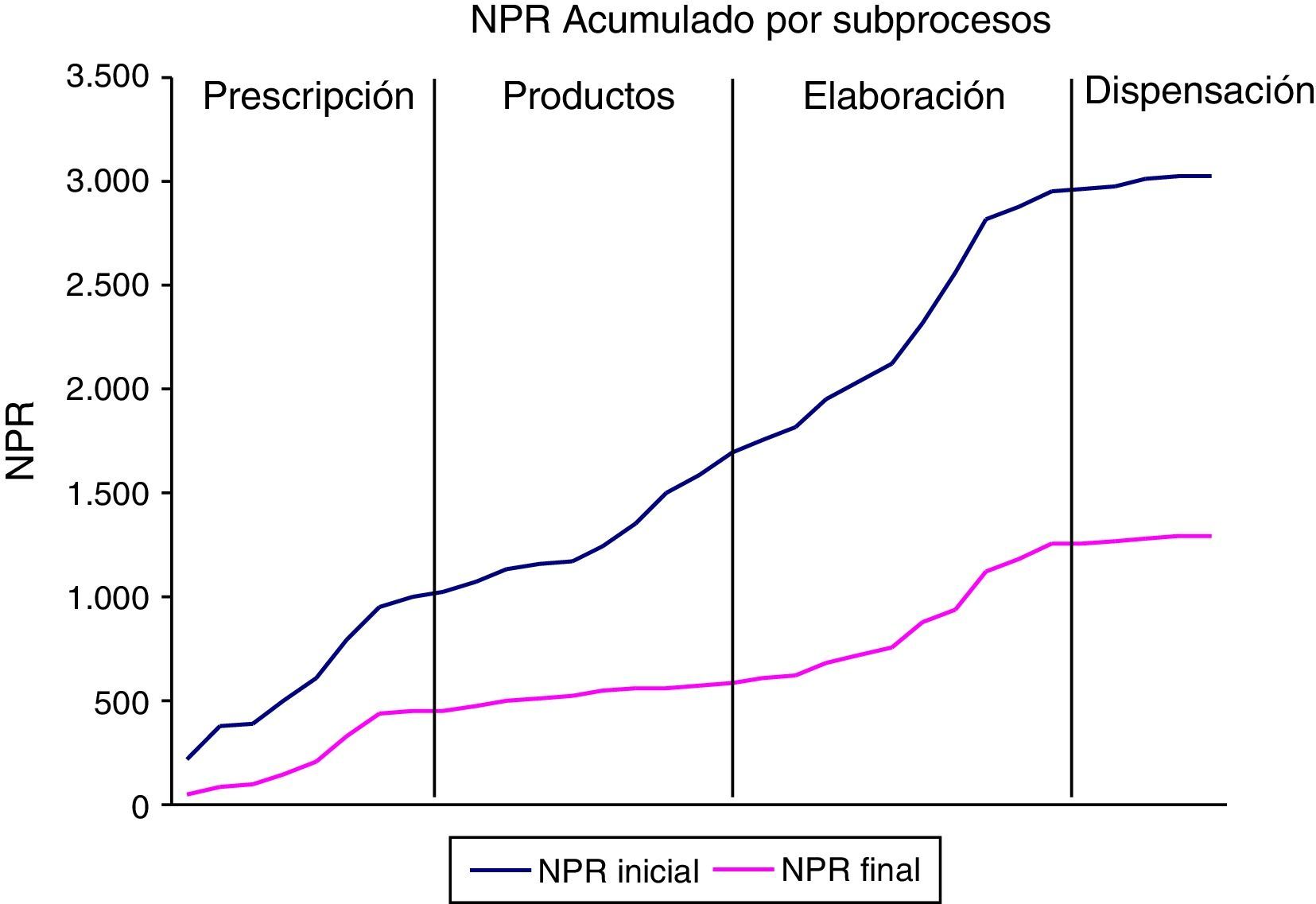
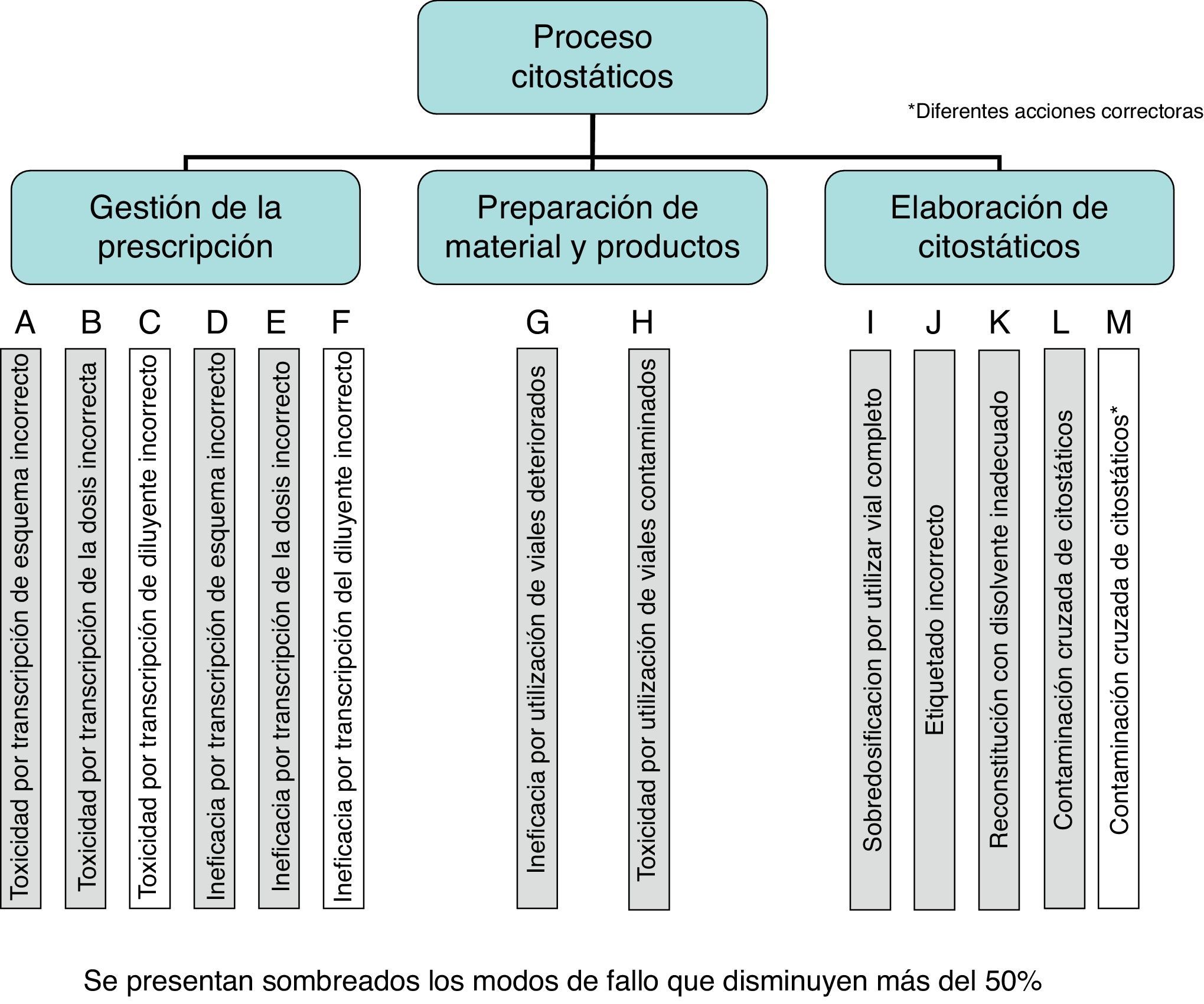
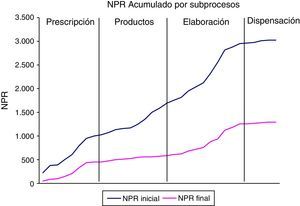
Se identificaron un total de 34 modos de fallo. Para cada uno de ellos se consensuó el efecto, la causa potencial, el NPR inicial, la acción recomendada y el NPR final (teórico). El NPR inicial acumulado fue de 3022 (rango: 3-252), y tras las acciones recomendadas el NPR final acumulado fue de 1292 (rango: 3-189). Se puede ver su variación a lo largo del proceso antes y después del AMFE en la figura 2; en el final del subproceso de preparación de materiales y productos, que representaba el punto medio del proceso, el riesgo acumulado fue de 1.692 frente a 590 tras el establecimiento de las medidas correctoras. Se obtuvieron puntuaciones de NPR por encima de 100 en 13 de los modos de fallo; solo el subproceso de dispensación estuvo exento de puntos críticos (NPR>100). Se consiguió una reducción del NPR final ≥50% en 9 modos de fallo (fig. 3).
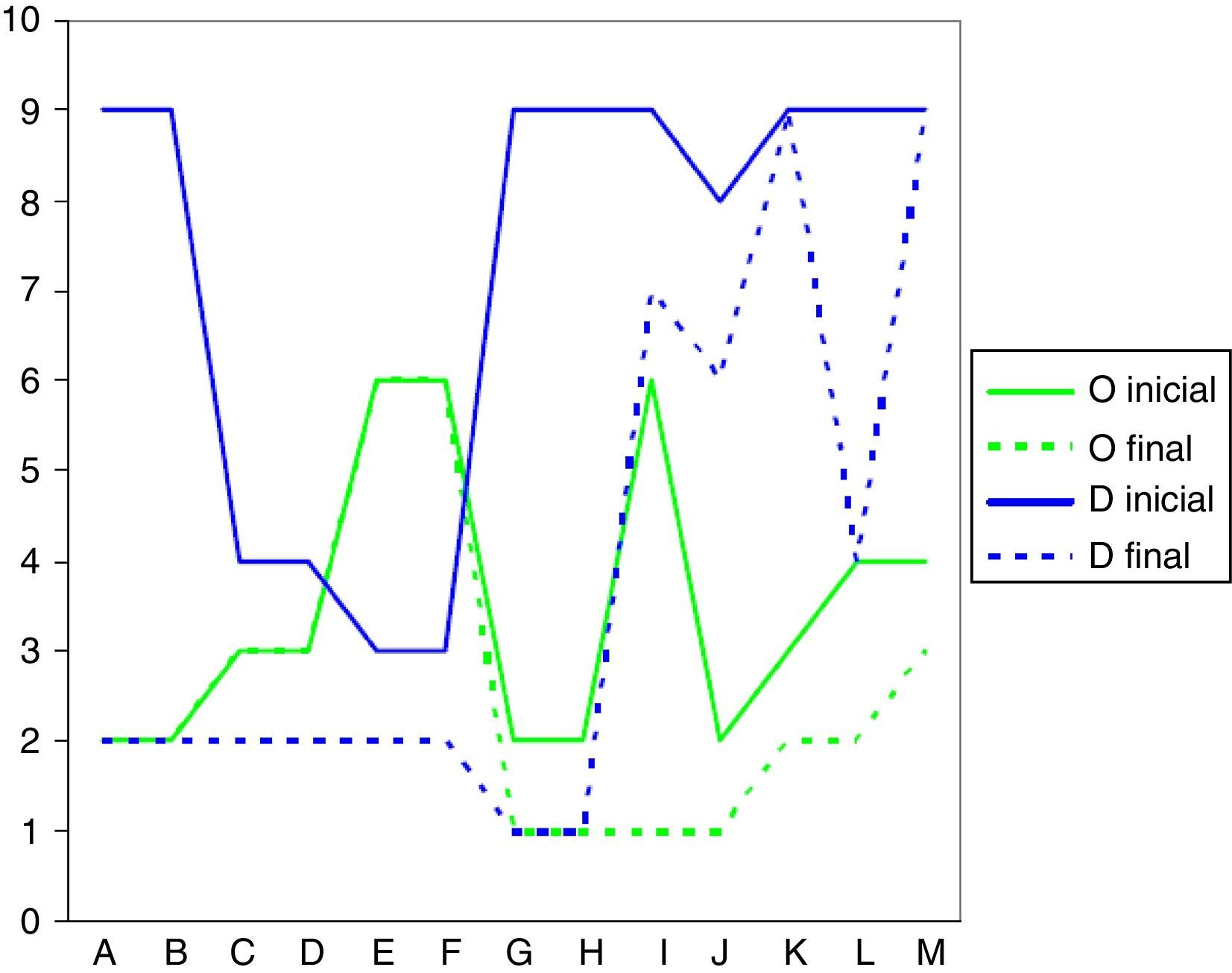
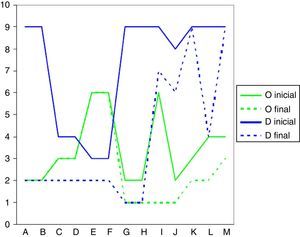
Dentro de los 10 modos de fallo con mayor riesgo, 5 correspondían a errores en la transcripción. El modo de fallo considerado de mayor riesgo (NPR=252) fue el de contaminación cruzada por utilización de jeringas de otro citostático, lo que podía producir incompatibilidad fisicoquímica. El cambio de jeringas en cada cambio de enfermera lo reducía hasta 189, mientras que el etiquetado de jeringas se estimó que reducía el riesgo hasta 56. El segundo modo de fallo por orden de NPR correspondía a la reconstitución de citostáticos con un diluyente inadecuado por error en la elaboración; en este caso la formación del personal se estimó que reduciría el riesgo desde 189 a 126. La gravedad de los modos de fallo críticos fue igual o superior a 7 excepto en 2 casos: la sobredosificación por utilización de viales completos y la reutilización de viales abiertos sin fecha de apertura. Las medidas de mejora propuestas no consiguieron disminuir la gravedad —y por tanto atenuar los posibles efectos de los errores— en ninguno de estos casos con NPR>100. En la figura 4 puede verse la variación de ocurrencia y detectabilidad de los modos de fallo crítico a lo largo del proceso, antes y después de realizar el AMFE.
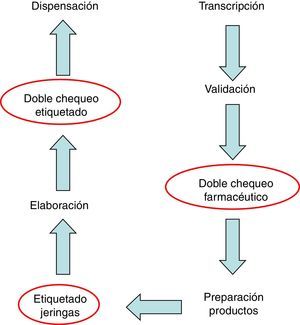
Las medidas de mejora propuestas incluyeron principalmente el doble chequeo farmacéutico de la prescripción (primer subproceso), la retirada de viales utilizados sin fecha de apertura (segundo subproceso), la lectura exhaustiva del Procedimiento Normalizado de Trabajo para el personal que se incorpora a la unidad de citostáticos, doble chequeo del etiquetado, formación del personal, y el etiquetado de jeringas en uso dentro de la campana (tercer subproceso). El rediseño del proceso dio lugar a la incorporación de tres nuevos pasos (fig. 5).
DiscusiónEl análisis realizado ha disminuido el riesgo de una manera considerable y ha permitido una mejoría significativa (superior al 50%) en la mayor parte de los puntos críticos del sistema. Se observa una reducción del NPR acumulado a la mitad del proceso, y esta tendencia se mantiene en los subprocesos finales. El subproceso de gestión de la prescripción y de elaboración propiamente dicha son los que acumulan la mayoría de puntos débiles del sistema y el objeto principal de las medidas de mejora. La escasa variación de la gravedad posterior a la realización del AMFE nos indica que las medidas recomendadas no reducirían la gravedad de los errores críticos si llegaran a producirse; sin embargo, se observa una mejora sustancial de la detectabilidad, que representa el principal componente del NPR en nuestro estudio, por la introducción de doble chequeo tanto en la validación farmacéutica como en el etiquetado. El modo de fallo que obtuvo un mayor NPR en nuestro análisis fue la contaminación cruzada por utilizar la misma jeringa; esto inicialmente puede resultar sorprendente si se compara con el elevado número de puntos críticos localizados en la validación farmacéutica considerados muy graves, pero en nuestro estudio este resultado elevado fue debido principalmente a la dificultad encontrada en su detectabilidad.
El número de modos de fallo incluidos es similar a otros estudios realizados en esta área, como el de Bonnabry et al.20, en el que se comparaban diferentes procesos para la elaboración de quimioterapia. Sin embargo, los valores de NPR obtenidos para los puntos débiles son notablemente inferiores en nuestro estudio.
La subjetividad de las escalas de valoración, la aplicación de estas por los miembros del equipo y, por consiguiente, el NPR calculado ponen a veces en evidencia la validez externa de esta metodología, y es uno de los aspectos más criticados de la metodología AMFE21-23. Por este motivo se utilizaron criterios explícitos para definir cada valor de la escala, y la subjetividad en su aplicación fue minimizada por la composición multidisciplinar del equipo24. En cualquier caso, debemos recordar que la principal misión del AMFE es priorizar y no establecer valores numéricos.
Otra limitación de esta metodología aplicada a procesos complejos, como la elaboración de citostáticos, es que no tiene en cuenta las interacciones entre los diferentes pasos del sistema y las consecuencias inesperadas de modificarlos individualmente. Existen análisis enfocados a pasos concretos del proceso, como el etiquetado, que intentan paliar este efecto25. También se ha propuesto una técnica de gestión de riesgos, denominada «modelaje de riesgos probabilístico», que permite estimar el efecto de combinaciones de fallos26. Otra de las potenciales desventajas de nuestros análisis es que incrementa el número de pasos del proceso, ya que una de las reglas básicas de seguridad nos indica que un mayor número de pasos conduce siempre a una mayor probabilidad de error; por lo que debe valorarse cuidadosamente el rediseño del proceso para evitar la incorporación de tareas onerosas. El tiempo invertido en este tipo de análisis supone un consumo de recursos alto; sin embargo, los resultados del AMFE representan un documento «vivo» que debe ser actualizado y, por tanto, pueden ser aprovechados en análisis posteriores.
La principal ventaja del método AMFE es su proactividad: la identificación de vulnerabilidades del sistema antes de que se produzca el error. Esto, en un entorno con un gran volumen de trabajo, cambios constantes y alto grado de automatización, como la elaboración de citostáticos, nos proporciona una herramienta muy valiosa, aunque el rendimiento a priori se considere bajo. Así, un estudio que utilizaba un análisis de riesgo prospectivo para seleccionar acciones de mejora consiguió una reducción del 23% en los errores de prescripción de quimioterapia27. Nuestro estudio representa uno de los trabajos publicados en nuestro país de aplicación de AMFE a la elaboración de medicamentos; aunque existen estudios similares a nivel internacional en el ámbito de la oncología, la aplicabilidad de estos AMFE es limitada, por la escasa validez externa y las diferentes metodologías existentes28.
Otro de los aspectos a considerar en la aplicación de la metodología AMFE es la llamada teoría de «homeostasis del riesgo», descrita por Wilde29, según la cual el sistema, al incrementar la seguridad de alguno de sus puntos, disminuye el nivel de alerta en otras tareas complejas y puede dar lugar a un incremento del nivel de riesgo global. Por ejemplo, en nuestro caso una mejora de la seguridad del proceso de elaboración de citostáticos no debería traducirse en ningún caso en una disminución del nivel de alerta de las enfermeras que llevan a cabo la administración de los mismos, o del propio paciente como último filtro de errores de medicación.
En nuestro trabajo, una herramienta para análisis de riesgo prospectivo, como la metodología AMFE, nos permite priorizar los puntos débiles del sistema para optimizar el empleo de recursos y conseguir una mejora considerable en la seguridad (disminución del NPR>50%) de un proceso de elaboración de citostáticos mediante la introducción de acciones correctoras como el doble chequeo (farmacéutico y de enfermería) y el etiquetado de productos intermedios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.