Las micobacterias de crecimiento rápido son una rara causa de endocarditis bacteriana. Durante las últimas décadas han aumentado las infecciones debido a este tipo de micobacterias, en especial las postraumáticas y las posquirúrgicas. Estas infecciones pueden ser localizadas o diseminadas, y también pueden producir brotes nosocomiales debido a la contaminación del equipamiento médico. Por lo general, las tinciones para bacterias ácido-alcohol resistentes no se emplean de rutina en el procesamiento de hemocultivos positivos. Sin embargo, el microbiólogo debe estar atento al ver un bacilo gram positivo, ya que podría tratarse de una micobacteria de crecimiento rápido. Describimos un caso de endocarditis por Mycobacterium mageritense en una paciente con parche pericárdico autógeno y un catéter para medir la presión en la aurícula izquierda. La bacteria fue identificada por espectrometría de masas (MALDI-TOF MS), score 2,3, y luego confirmada por secuenciación y análisis del gen ARNr 16s con las bases de datos del NCBI y EzTaxon, con una concordancia del 99,8 y el 100%, respectivamente.
Rapidly growing non-tuberculosis mycobacteria are a rare cause of bacterial endocarditis. During the last decades, there has been an increase in infections due to rapidly growing mycobacteria, mainly after trauma and post-surgical procedures, both localized and disseminated, as well as nosocomial outbreaks due to contamination of medical equipment. Routine acid-fast staining for blood culture bottles is not always performed; however, the microbiologist should be aware of potential RGM infections especially when gram positive bacilli are observed. We describe a case of endocarditis caused by Mycobacterium mageritense in a patient with an autologous pericardial patch and a pressure catheter in the left auricle. The bacterial species was identified as Mycobacterium mageritense by mass spectrometry (MALDI-TOF MS), score 2.3, and confirmed by 16S rRNA analysis with 99.8 and 100% agreement, respectively.
Mujer de 40 años oriunda de Paraguay, negativa para el VIH, con antecedente de corrección de comunicación interauricular, parche de pericardio autógeno y colocación de catéter medidor de presiones en la aurícula izquierda en 2008.
En 2010 presenta un absceso retromamario, que es drenado, y se remueve el fragmento subcutáneo del catéter. Se interna en julio de 2013 en Asunción (Paraguay) por sospecha de endocarditis infecciosa asociada a dispositivo electrónico cardiovascular. El laboratorio de referencia de Asunción informa en los hemocultivos complejo Mycobacterium smegmatis/goodii/mageritense, obtenido por el método molecular PRA (análisis de los fragmentos de restricción del amplicón de 440pb del gen hsp65, amplificado por PCR)10. La paciente recibe tratamiento antibiótico intravenoso con amicacina más vancomicina durante 26 días y egresa con doxiciclina.
Consulta en un hospital de la ciudad de Buenos Aires en octubre de 2013 por comenzar con fiebre intratratamiento antibiótico. Se realiza ecocardiograma transtorácico, que evidencia vegetación en la valva tricúspide de 1×1,5cm y de 0,5cm en la punta del catéter. Se toman hemocultivos seriados: Aerobic Plus/F, Anaerobic Plus/F y Myco/F Lytic (Becton Dickinson, EE. UU.). Inicia tratamiento empírico con meropenem (1g/8h) y ciprofloxacina (400mg/12h); evoluciona afebril.
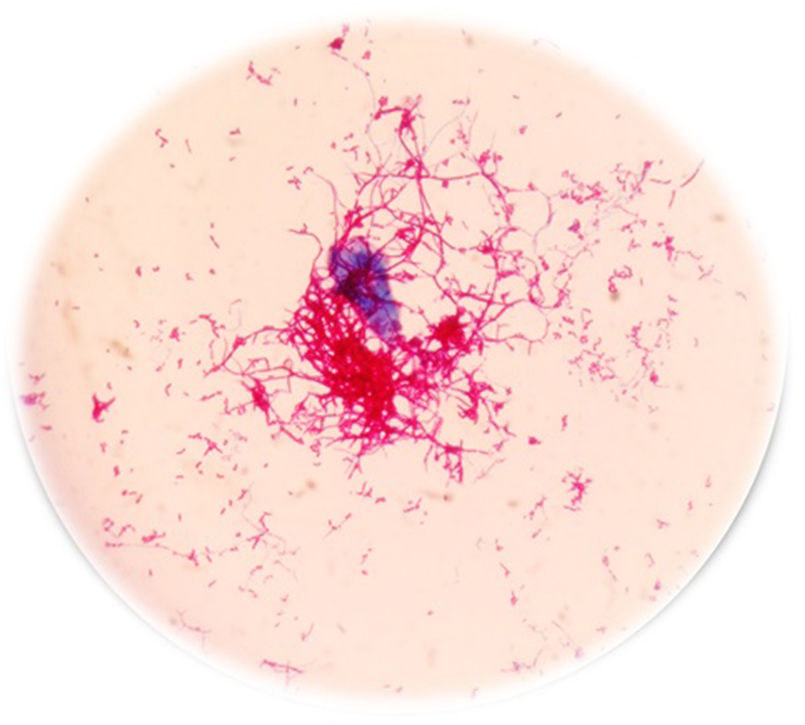
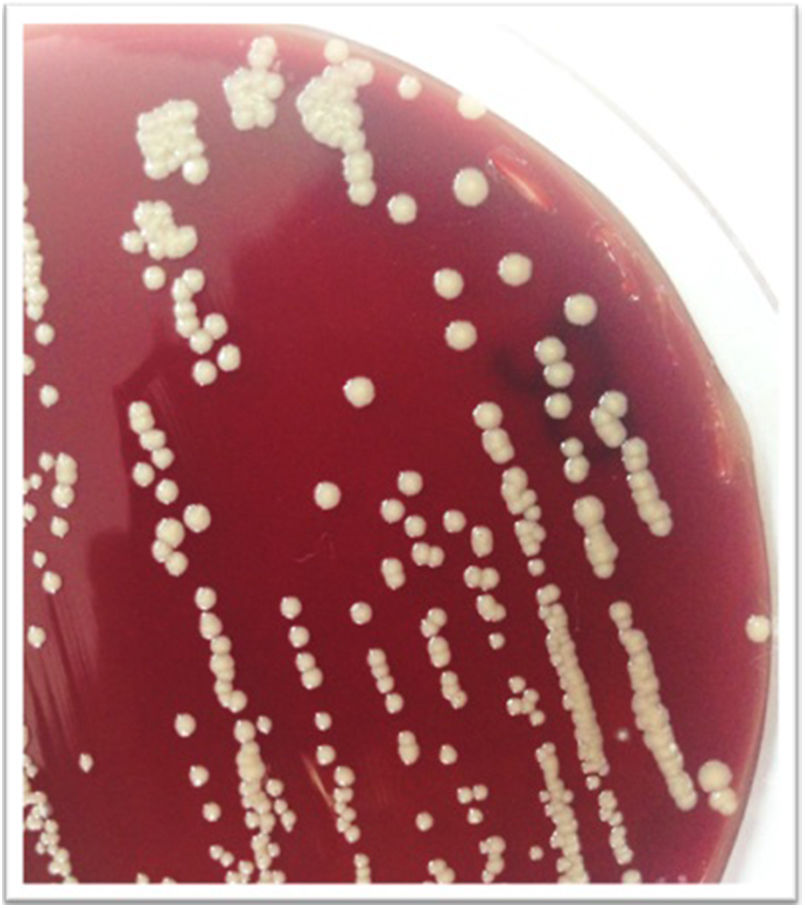
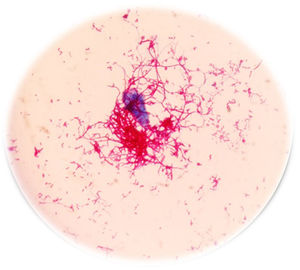
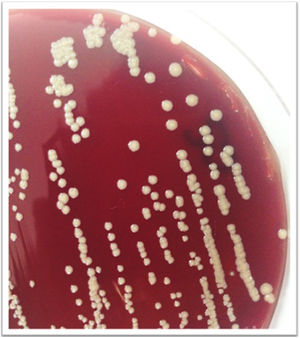
A las 48h los hemocultivos resultan positivos; en la coloración de Gram se ven bacilos gram positivos ramificados, se sospecha una micobacteria de crecimiento rápido (MCR) y se realiza la coloración de Kinyoun, variante en frío de la tinción de Ziehl-Neelsen para bacterias ácido-alcohol resistentes (fig. 1). Se procede con una extracción directa del frasco de hemocultivo, para analizar por espectrometría de masas MALDI TOF MS (Bruker, Bremen, Alemania), según el protocolo HF (procedimiento artesanal) recomendado por Cattani et al.2.El resultado es M. mageritense con un score de 2,3 (un score o puntaje de identificación≥2 confirma el género y la especie). Las micobacterias desarrollan a las 48h a partir de los hemocultivos en agar base Columbia con sangre ovina al 5% (bioMérieux, L’Étoile, Francia), como se aprecia en la figura 2.
Se envía la cepa al Laboratorio Nacional de Referencia de Tuberculosis INEI ANLIS Dr. Carlos G. Malbrán para la secuenciación del gen ARNr 16S, que confirma la identificación a nivel de especie con un 99,8% de identidad.
La identificación definitiva de los aislamientos de MCR es dificultosa. El análisis por MALDI-TOF MS, combinado con el análisis de la secuencia de ADN, constituye una técnica prometedora para la rápida identificación de las MCR, lo cual es muy importante para conocer la epidemiología de estos patógenos y su rol en las infecciones humanas. En un trabajo realizado en Argentina empleando la técnica de MALDI-TOF MS se identificó el 61% de las micobacterias no tuberculosas, de baja frecuencia en infecciones clínicas y que no se pudieron identificar a nivel de especie con otros métodos9.
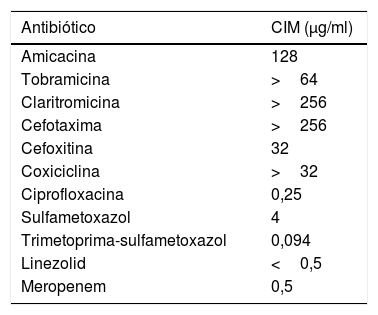
La paciente completa tratamiento intravenoso durante 10 semanas. Presenta como manifestación asociada a la endocarditis una esplenomegalia con hiperesplenismo e infarto esplénico, por lo que se realiza exéresis del bazo. Luego de la semana 10 del tratamiento, el ecocardiograma transesofágico muestra resolución de las vegetaciones y negativización de los hemocultivos. Por la buena evolución y teniendo en cuenta los resultados de las concentraciones inhibitorias mínimas para los distintos antimicrobianos ensayados (tabla 1), se rota el esquema a ciprofloxacina (500mg/12h) más trimetoprima-sulfametoxazol (160/800mg/12h), para continuar de manera ambulatoria a la espera de la resolución quirúrgica.
Sensibilidad de Mycobacterium mageritense
| Antibiótico | CIM (μg/ml) |
|---|---|
| Amicacina | 128 |
| Tobramicina | >64 |
| Claritromicina | >256 |
| Cefotaxima | >256 |
| Cefoxitina | 32 |
| Coxiciclina | >32 |
| Ciprofloxacina | 0,25 |
| Sulfametoxazol | 4 |
| Trimetoprima-sulfametoxazol | 0,094 |
| Linezolid | <0,5 |
| Meropenem | 0,5 |
CIM: concentraciones inhibitorias mínimas.
Las MCR tienen una amplia distribución en agua, suelo, aves y otros animales. Son capaces de formar biopelículas y sobrevivir en ausencia de nutrientes3. Se ha reportado un incremento de infecciones por MCR, en especial postraumáticas y posquirúrgicas asociadas a dispositivos, tanto localizadas como diseminadas. También las MCR producen brotes nosocomiales debido a la contaminación del equipamiento médico1,3,5,10. Hasta el momento se han descripto más de 170 especies, y más de la mitad se han relacionado con infecciones humanas6.
M. mageritense fue aislado por primera vez en España en 1987 y fue descripto como una nueva especie por Domenech et al.4, pero recién fue asociado a enfermedades en el 2002, en los EE. UU.13.
Entre las MCR más frecuentes en infecciones humanas están Mycobacterium chelonae, Mycobacterium abscessus y Mycobacterium fortuitum. M. mageritense pertenece a este último complejo, biovariedad 3, positivo a sorbitol11. M. mageritense se aísla con baja frecuencia de bacteriemia relacionada con dispositivo cardiovascular6,13. Se ha descripto un caso de endocarditis protésica en el que se aisló una cepa pigmentada8. La mayoría de las infecciones humanas documentadas están relacionas con infección posquirúrgica, catéteres y sinusitis13.
M. mageritense por lo general presenta resistencia a ciertos antibióticos, incluidos amicacina y claritromicina, fármacos con buena actividad frente a la mayoría de las MCR12,14. En nuestro caso, la paciente fue medicada en primer término en Paraguay, con antibióticos frente a los que el microorganismo resultó resistente, por lo que consideramos que es imprescindible identificar de forma correcta las MCR y determinar su sensibilidad14. Con la espectrometría de masas de los hemocultivos positivos se obtuvo un resultado certero en 20min.
El tratamiento contra este patógeno, que es de tiempo prolongado, incluye, además, la remoción de cualquier dispositivo (catéter, marcapasos, prótesis), ya que debido a su capacidad de formar biopelículas, las MCR pueden persistir, a pesar de instaurar el tratamiento adecuado7.
M. mageritense es una MCR con baja virulencia que por lo general no se asocia con enfermedad clínica. Nuestro caso, junto con otras infecciones clínicas reportadas6–8, muestra el potencial patogénico de este microorganismo.
Es importante sospechar la presencia de una MCR, ya que por la coloración de Gram estos gérmenes pueden confundirse con los géneros Corynebacterium, Actinomyces o Nocardia.
Creemos que es sustancial el aporte del laboratorio para determinar las diferentes MCR y su resistencia antibiótica. Hay que resaltar que el tratamiento antibiótico debe ser prolongado y debe incluir la remoción de catéteres/dispositivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.