La hemoptisis amenazante es una situación grave que precisa de un diagnóstico y tratamiento rápidos. Uno de los tratamientos de elección es la embolización. La evaluación inicial se dirige a localizar el origen y la causa del sangrado. El avance tecnológico de la TC multidetector (TCMD) ha supuesto un cambio en el manejo de estos pacientes. La angio-TCMD permite evaluar la causa rápida e incruentamente, y localizar los vasos implicados; es particularmente útil para detectar arterias bronquiales ectópicas, arterias sistémicas no bronquiales o seudoaneurismas pulmonares. Hacer sistemáticamente una angio-TCMD antes de la embolización permite planificar mejor el tratamiento. En este artículo revisamos la fisiopatología y las causas de la hemoptisis amenazante (incluyendo la hemoptisis criptogenética), la técnica del estudio de la angio-TCMD y describimos cómo evaluar sistemáticamente las imágenes (parénquima pulmonar, vía aérea y estructuras vasculares).
Life-threatening hemoptysis is a severe condition that requires rapid diagnosis and treatment. One of the treatments of choice is embolization. The initial assessment aims to locate the origin and cause of bleeding. The technological advance of the development of multidetector computed tomography (MDCT) has changed the management of patients with life-threatening hemoptysis. MDCT angiography makes it possible to evaluate the cause of bleeding and locate the vessels involved both rapidly and noninvasively; it is particularly useful for detecting ectopic bronchial arteries, nonbronchial systemic arteries, and pulmonary pseudoaneurysms. Performing MDCT angiography systematically before embolization enables better treatment planning. In this article, we review the pathophysiology and causes of life-threatening hemoptysis (including cryptogenic hemoptysis) and the MDCT angiography technique, and we review how to systematically evaluate the images (lung parenchyma, airways, and vascular structures).
La hemoptisis es la expectoración de sangre procedente del árbol traqueobronquial o del parénquima pulmonar1. En función de la cantidad expectorada, se clasifica en masiva o no masiva. Aunque no existe una definición unánime que las diferencie, suele catalogarse como masiva la hemorragia que supera los 400-600ml en 24-48h o cuando sobrepasa los 100-200ml en una hora2. Considerando que cuantificar el sangrado es difícil, clínicamente es más útil usar el término de hemoptisis amenazante para definir una situación en la que existe un riesgo inmediato para la vida del paciente3. El riesgo inmediato es el compromiso de la vía aérea, por lo que la significación clínica de un episodio de hemoptisis debería tener en cuenta no solo el volumen de sangre expectorado, sino también el efecto sobre las reservas respiratorias y cardiovasculares3,4. Aunque constituye solo una pequeña proporción de todos los casos de hemoptisis, la hemoptisis amenazante tratada inadecuadamente tiene una mortalidad superior al 50%5. La intervención quirúrgica urgente también tiene una morbimortalidad alta, y por ello, la embolización es actualmente el tratamiento de elección en la mayoría de los casos6,7.
La evaluación inicial de los pacientes con hemoptisis amenazante se dirige a localizar el origen y la causa subyacente del sangrado. Los protocolos de actuación varían en función del centro y deberían incluir la disponibilidad urgente de la TC, la fibrobroncoscopia, la embolización arterial y, eventualmente, el tratamiento quirúrgico8. En nuestro hospital la primera exploración realizada a un paciente con hemoptisis amenazante es una radiografía de tórax (que en muchas ocasiones localiza el área de sangrado) (fig. 1A), seguida de una angio-TC torácica (no hay posibilidad de fibrobroncoscopia urgente), que servirá de guía para el tratamiento, que en la mayoría de los casos será la embolización; la fibrobroncoscopia ha quedado relegada a los pocos casos en los que la TC no identifica la causa de sangrado.
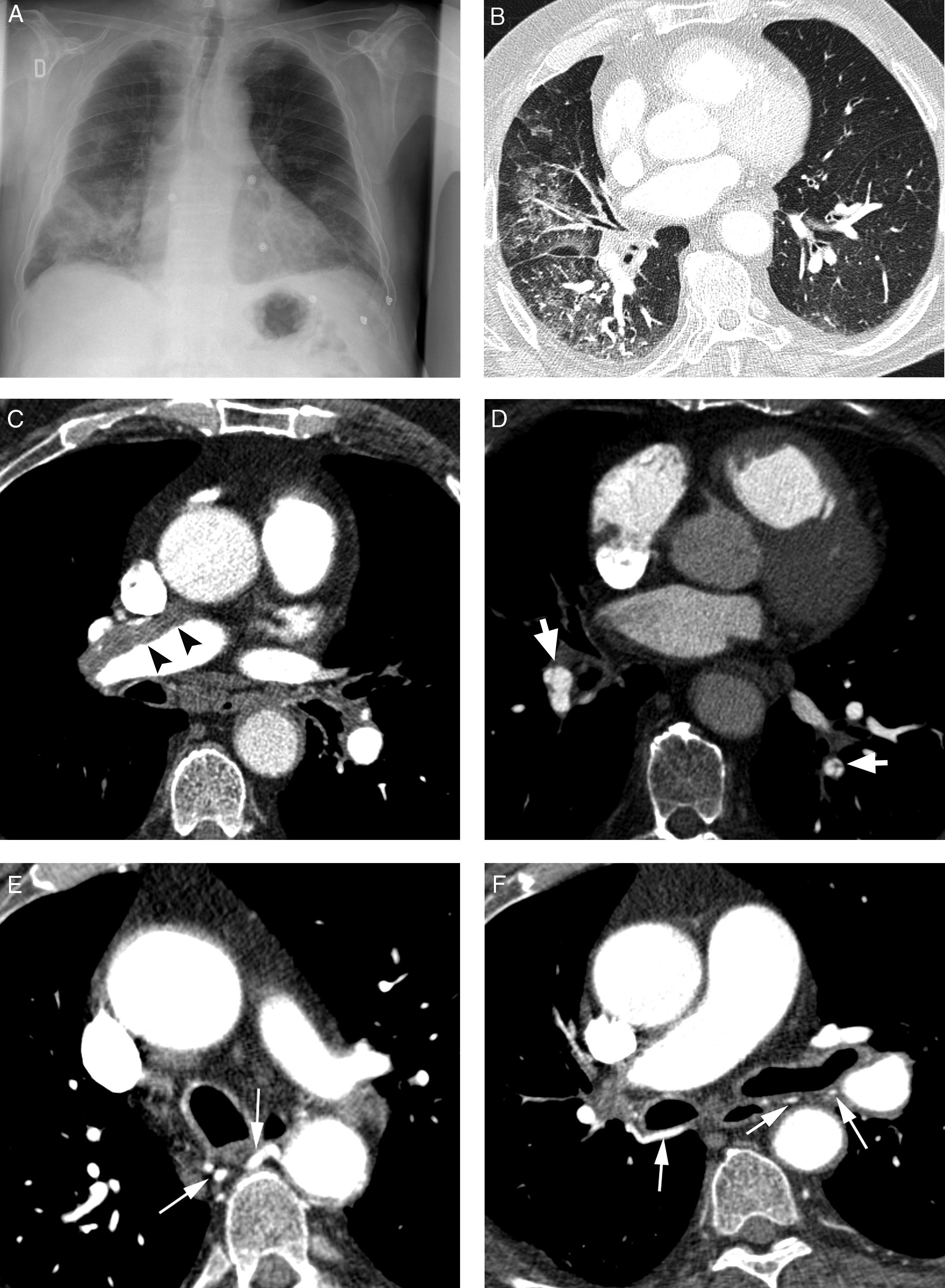
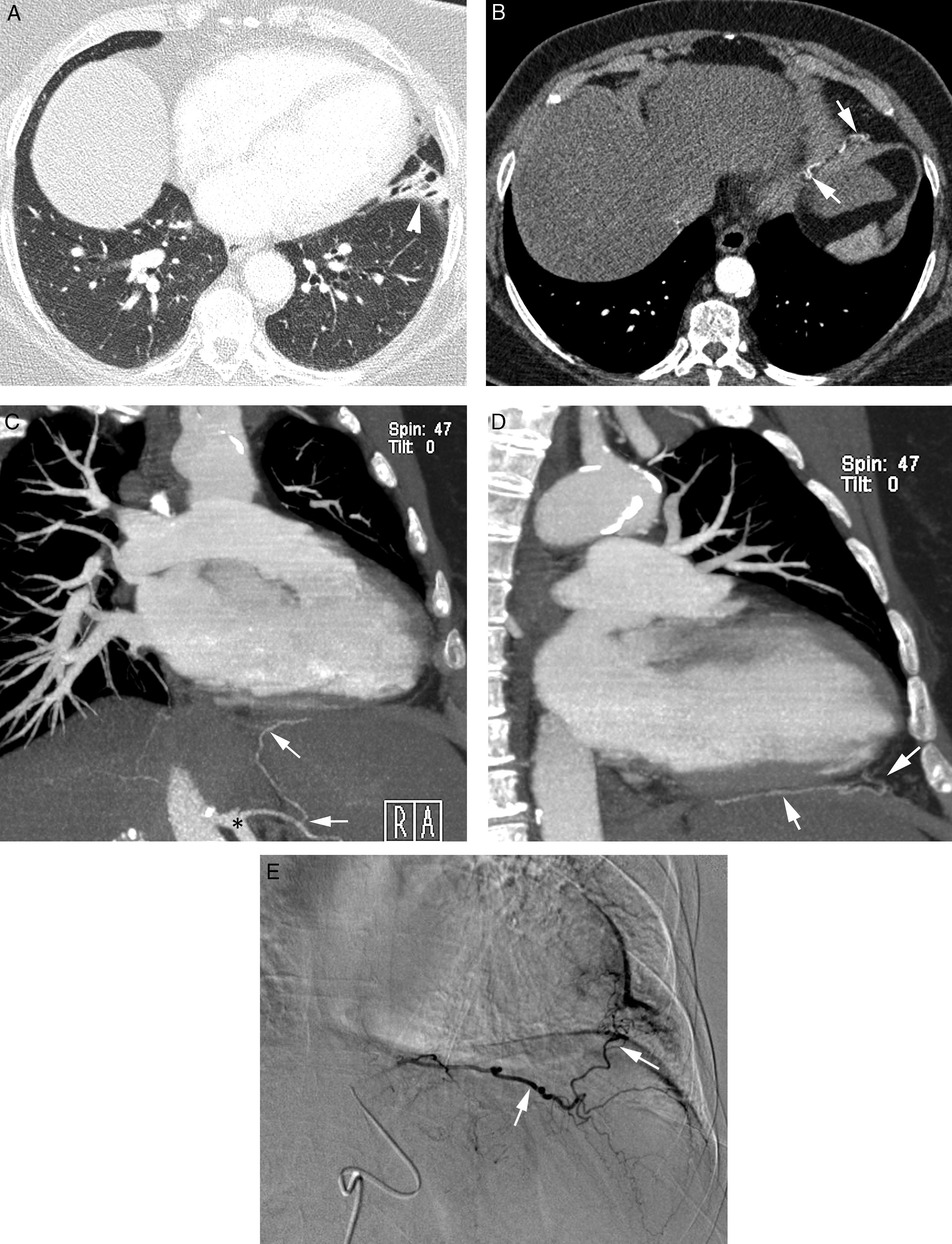
Paciente con tromboembolismo pulmonar crónico que acude por hemoptisis amenazante. A) Radiografía de tórax con consolidaciones en la base pulmonar derecha correspondientes al área de sangrado. B) La TC con ventana de pulmón muestra áreas en vidrio deslustrado en el lóbulo medio y lóbulo inferior derecho. C-H) Imágenes de angio-TCMD. Cortes axiales (C y D) que muestran signos de tromboembolismo pulmonar crónico con un gran trombo periférico en la arteria pulmonar principal derecha (cabezas de flecha), así como imágenes lineales en el interior de las ramas lobar y segmentaria en el lóbulo inferior derecho y lóbulo inferior izquierdo respectivamente, correspondientes a bandas residuales (flecha). Imágenes lineales y puntiformes (E y F) en el mediastino, con contraste similar al de la aorta (flechas), que se corresponden con arterias bronquiales hipertrofiadas. La reconstrucción MIP coronal (G) muestra un tronco intercostobronquial derecho (flechas blancas) y un tronco común bibronquial (flechas negras) hipertrofiados. Los hallazgos fueron confirmados en la arteriografía, que mostraba la hipertrofia del tronco intercostobronquial derecho (H: flechas, flechas finas en la rama intercostal) y la hipertrofia del tronco bibronquial (I: flechas). Obsérvese la analogía de las imágenes de la angio-TCMD y la arteriografía.
Los avances tecnológicos de la TC multidetector (TCMD) han supuesto un cambio en el manejo de los pacientes con hemoptisis amenazante. Permite determinar la localización y la causa del sangrado en un alto porcentaje de casos9,10, analizar detalladamente el mediastino y el parénquima pulmonar, y obtener estudios angiográficos torácicos (circulación sistémica y pulmonar) y del abdomen superior, que son útiles para planificar la embolización y, ocasionalmente, la intervención quirúrgica4,9,10.
En este artículo revisamos la fisiopatología y las causas de la hemoptisis amenazante (incluyendo la hemoptisis criptogenética), la técnica del estudio de la angio-TCMD y la evaluación sistemática de las imágenes (parénquima pulmonar, vía aérea y estructuras vasculares).
Irrigación del parénquima pulmonar y causas de hemoptisisLos pulmones tienen 2 sistemas vasculares independientes: las arterias pulmonares y las arterias sistémicas bronquiales. Las arterias pulmonares son el componente principal, proporcionan el 99% de la sangre arterial a los pulmones y participan en el intercambio gaseoso. Las arterias bronquiales representan un 1% del gasto cardíaco, cumplen la función de nutrición de múltiples estructuras (tráquea, bronquios, nervios, ganglios linfáticos, vasa vasorum de las estructuras vasculares, pleura, esófago), y no participan, en condiciones normales, en el intercambio gaseoso4. Los 2 sistemas crean un cortocircuito fisiológico derecha-izquierda por medio de las anastomosis entre los capilares pulmonares y bronquiales, que representa el 5% del gasto cardíaco4,11,12.
En circunstancias que disminuyen la circulación pulmonar de forma mantenida y producen isquemia (por ejemplo, en el tromboembolismo crónico), la circulación bronquial responde con una hipertrofia y proliferación vascular focal a través de las anastomosis para reemplazar a la circulación pulmonar; por otra parte, las neoplasias y la inflamación crónica (por ejemplo, las bronquiectasias e infecciones crónicas), por medio de factores de crecimiento angiogénico, producen neovascularización y un aumento de la circulación sistémica. Estos vasos sistémicos neoformados e hipertrofiados son generalmente muy frágiles y están expuestos a la presión sistémica, por lo que tienden a romperse en su porción más distal (capilar) hacia la luz bronquial o los alvéolos, provocando la hemoptisis13,14. En la mayoría de los casos de hemoptisis (90%) están implicadas las arterias bronquiales, pero también puede tener su origen en arterias sistémicas no bronquiales o, en raras ocasiones, en las arterias pulmonares15.
Las causas subyacentes de la hemoptisis varían en función de la localización geográfica de los estudios, de la prevalencia de tuberculosis y del uso de la TC16. En nuestro medio, las causas más frecuentes de hemoptisis amenazante son las bronquiectasias, la tuberculosis y sus secuelas, y el cáncer de pulmón17–19. En la tabla 1 se recogen las principales causas.
Causas de hemoptisis amenazante
| Adquiridas |
| Inflamación crónica del parénquima pulmonar |
| Bronquiectasias |
| Fibrosis quística |
| Bronquitis crónica |
| Aspergiloma |
| Necrosis del parénquima pulmonar |
| Tuberculosis |
| Neumonía bacteriana necrosante |
| Embolismos sépticos |
| Neoplasia pulmonar primaria o metastásica |
| Alteraciones vasculares |
| Oclusión crónica de la arteria pulmonar: trombembolismo pulmonar crónico, vasculitis |
| Aneurisma (enfermedad de Behçet y síndrome de Hughes-Stovin) y seudoaneurisma de la arteria pulmonar |
| Aneurisma de la arteria bronquial |
| Lesiones iatrogénicas o traumáticas penetrantes |
| Malposición del catéter de Swan-Ganz (seudoaneurisma de la arteria pulmonar) |
| Heridas penetrantes |
| Hemoptisis criptogenética |
| Congénitas |
| Secuestro |
| Irrigación sistémica a pulmón normal |
| Malformaciones arteriovenosas (enfermedad de Rendu-Osler) |
Disponemos de una TCMD de 16 filas de detectores (TCMD Sensation 16; Siemens, Erlagen, Alemania). Los parámetros utilizados son: 120kV, 70-120 mAs (valores variables según caredose®), tiempo de rotación de 0,42s, colimación 0,75mm y «pitch» de 0,85. El grosor de reconstrucción de las imágenes es de 1mm con un intervalo de 0,7mm.
La adquisición se realiza con el paciente en decúbito supino y en máxima inspiración, en dirección craneocaudal, abarcando desde la base del cuello al tercio medio de los riñones (nivel de las arterias renales) para incluir los troncos supraaórticos y las arterias infradiafragmáticas4.
Se administran 100ml de contraste yodado no iónico (Iopromide, Ultravist 300; Schering, Berlín, Alemania), a una velocidad de 4ml/s, y se instilan después 20ml de suero fisiológico. El estudio comienza automáticamente utilizando la técnica de bolus tracking. Para ello, se sitúa la región de interés en la aorta ascendente, establecemos un umbral de 120UH, y se inicia el estudio a los 10s de alcanzado el umbral.
Los cortes axiales serán útiles para detectar el origen de las arterias sistémicas. Las reconstrucciones en proyección de máxima intensidad (MIP) serán imprescindibles para estudiar el trayecto tortuoso de estas arterias. Las reconstrucciones en el plano coronal son las más adecuadas para estudiar las arterias intercostales y mamarias internas, y las axiales para las arterias frénicas inferiores y ramas del tronco celíaco. Las reconstrucciones en el plano sagital oblicuo son útiles también para estudiar los trayectos de las arterias mamarias y frénicas. El grado de oblicuidad y el grosor de las reconstrucciones se adaptan a cada caso4. Las reconstrucciones MIP de las arterias pulmonares en diferentes planos serán también necesarias cuando se sospeche que están afectadas. Las reconstrucciones multiplanares y en proyección de mínima intensidad son útiles para valorar la permeabilidad de la vía aérea.
Valoración de las imágenesLa angio-TCMD torácica nos ofrecerá un mapa guía para la embolización. Deberemos valorar sistemáticamente el parénquima pulmonar, vía aérea y mediastino (buscando el lugar y la causa del sangrado) (fig. 1B, C y D), y analizar los vasos posiblemente implicados: las arterias bronquiales, las arterias sistémicas no bronquiales y las arterias pulmonares.
Parénquima pulmonar y vía aéreaValorar el parénquima pulmonar puede identificar como causa del sangrado, entre otras, las bronquiectasias, neoplasia de pulmón e infección pulmonar aguda o crónica (particularmente las causantes de necrosis del parénquima)4.
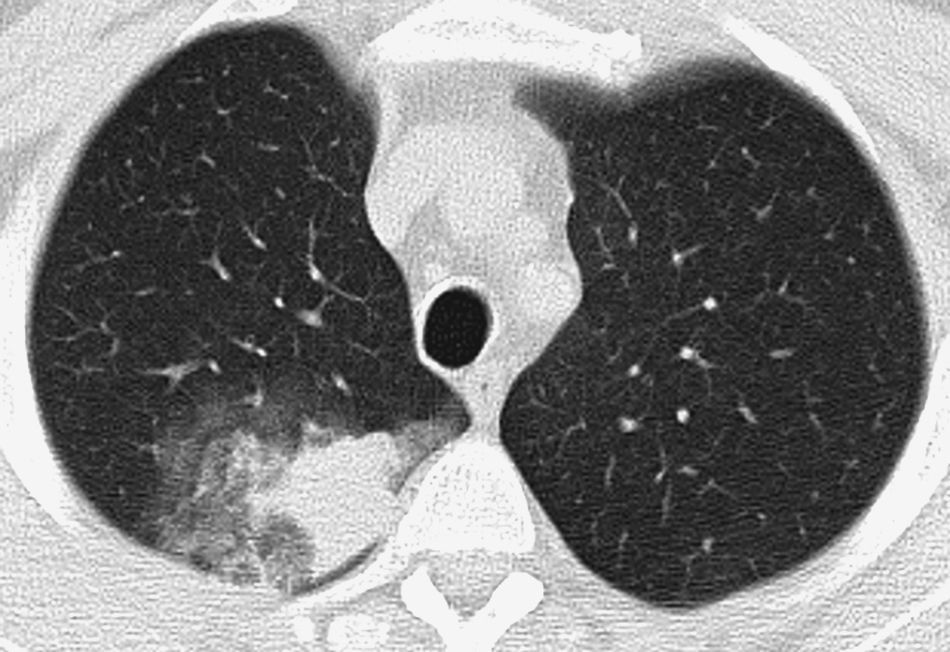
Los signos de sangrado más frecuentes en el parénquima pulmonar son los nódulos centrolobulillares, opacidades en vidrio deslustrado y/o condensaciones (figs. 1B y 2). Estos hallazgos nos ayudan a identificar el lugar del sangrado si son focales o unilaterales, y son de menor ayuda si la afectación es extensa y bilateral20; en estos casos las reconstrucciones multiplanares son útiles para valorar el predomino zonal del sangrado21. Cuando existen cavidades pueden rellenarse de sangre (fig. 3A y B) que puede ocultar lesiones intracavitarias como los micetomas; ocasionalmente se identifican áreas hiperdensas por los coágulos21. A veces los coágulos pueden simular nódulos o masas; por ello es aconsejable realizar una TC de control semanas después del episodio de hemoptisis para ver la evolución de imágenes sospechosas (fig. 4)4.
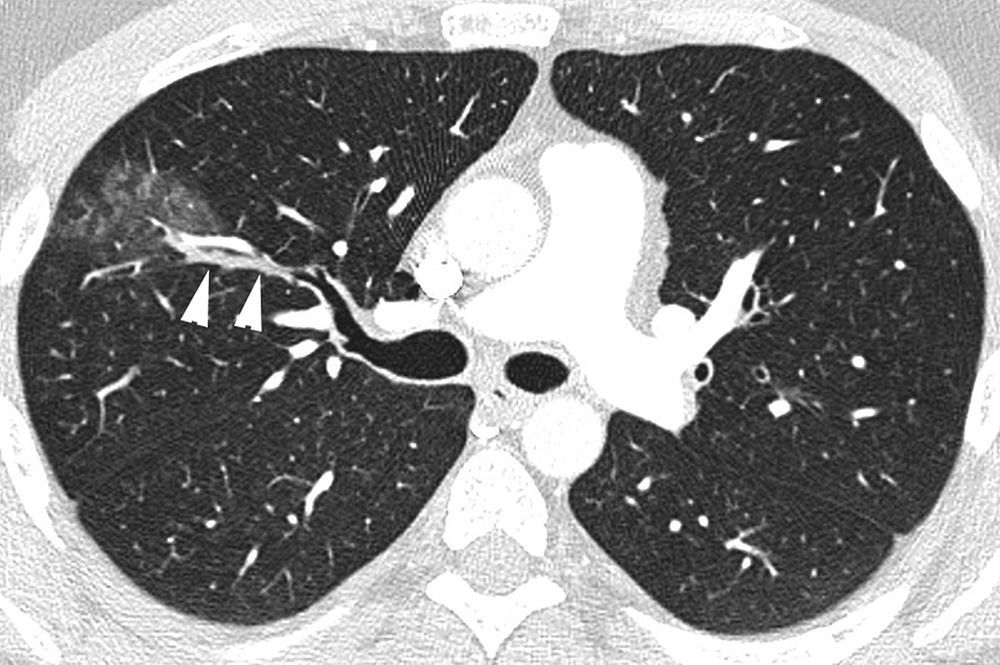
Paciente que acude por dolor pleurítico derecho y hemoptisis amenazante. TC con ventana de pulmón que muestra signos de sangrado en lóbulo superior derecho en forma de vidrio deslustrado y nódulos centrolobulillares, con ocupación de un bronquio subsegmentario (cabezas de flecha) que discurre paralelo a la arteria pulmonar.
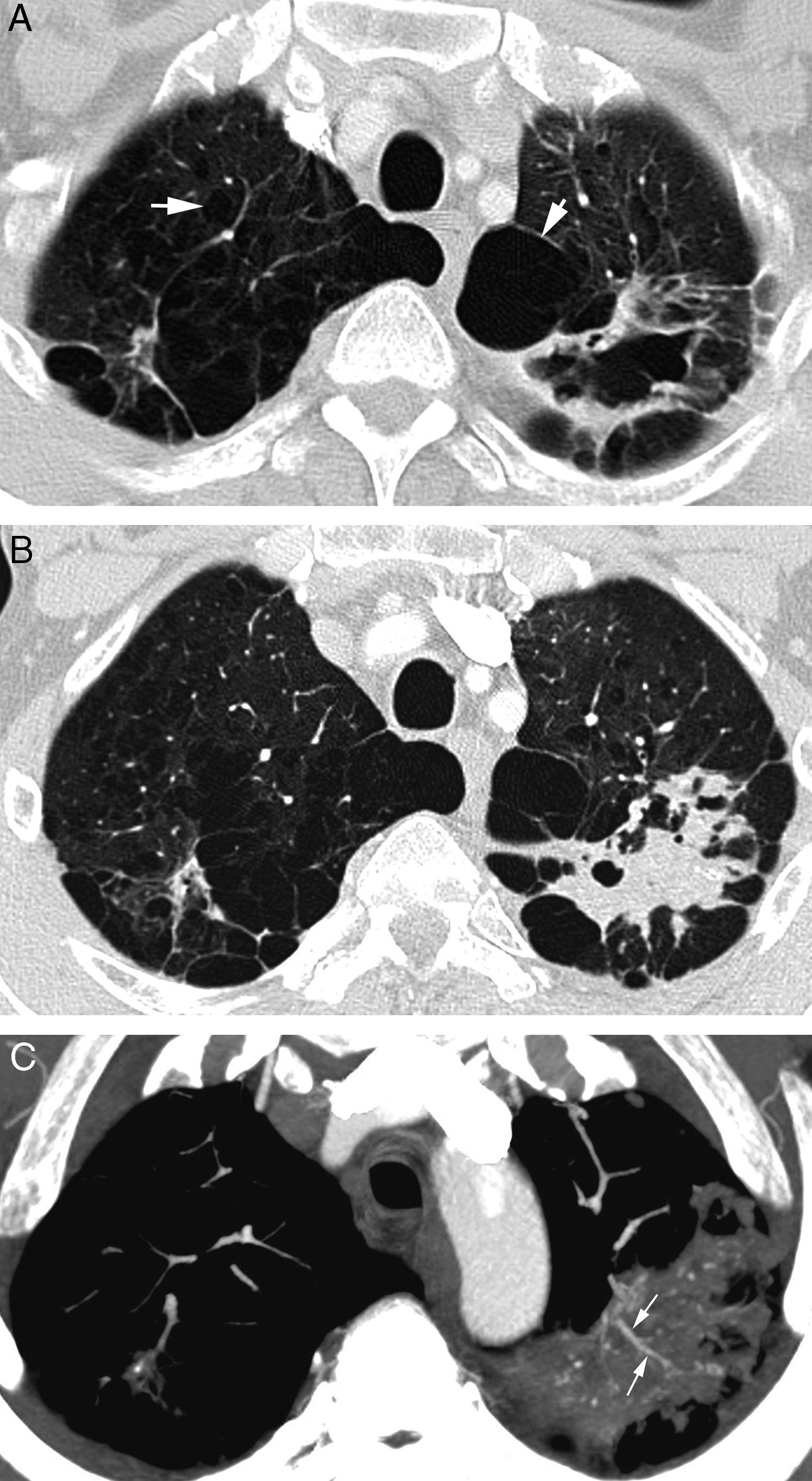
Paciente en tratamiento por infección por Micobacteria atípica que presenta hemoptisis amenazante. A) TC (ventana de pulmón) realizada 5 meses antes del episodio de hemoptisis que muestra una lesión cavitada de paredes irregulares en el lóbulo superior izquierdo. Se observa además una importante afectación por enfisema centrolobulillar y paraseptal (flechas). B) TC (ventana de pulmón) donde se observa la ocupación de la cavidad por el sangrado. C) Reconstrucción MIP axial, que muestra ramas de las arterias pulmonares (flechas) en la porción periférica inferior de la cavidad. Se observan además muchas imágenes focales pequeñas que se corresponden con granulomas calcificados.
Paciente con hemoptisis amenazante. TC con ventana de pulmón, donde se observa una consolidación en el segmento posterior del lóbulo superior derecho, secundaria al sangrado, con un área de vidrio deslustrado adyacente, hallazgos resueltos completamente en la TC de control realizada al cabo de un mes (no mostrada).
Es imprescindible analizar minuciosamente la permeabilidad de la vía aérea. Si la luz está ocupada, puede deberse a coágulos que secundariamente pueden producir atelectasias (fig. 2); la sangre puede ocultar pequeños tumores endobronquiales21. En raras ocasiones se puede observar extravasación de contraste a la luz bronquial20.
En definitiva, el sangrado en el parénquima y en la vía aérea puede ocultar el origen de la hemoptisis; por ello, en caso de no encontrarse la causa, es aconsejable realizar una TC de control a las pocas semanas del episodio4,21.
VasosArterias sistémicas bronquialesEn el 90% de los casos de hemoptisis, las arterias sistémicas bronquiales son el origen de la hemorragia4,9,20,22. Se consideran arterias bronquiales aquellas que se dirigen al pulmón a través del hilio pulmonar siguiendo el árbol bronquial12. Las arterias bronquiales ortotópicas son aquellas que tienen un origen en la aorta torácica descendente, al nivel de los cuerpos vertebrales T5-T6 (aproximadamente en la zona de la carina). Las arterias bronquiales que no nacen a ese nivel se denominan arterias bronquiales ectópicas4,23. Las arterias que no llegan al parénquima pulmonar a través del hilio pulmonar se denominan arterias sistémicas no bronquiales.
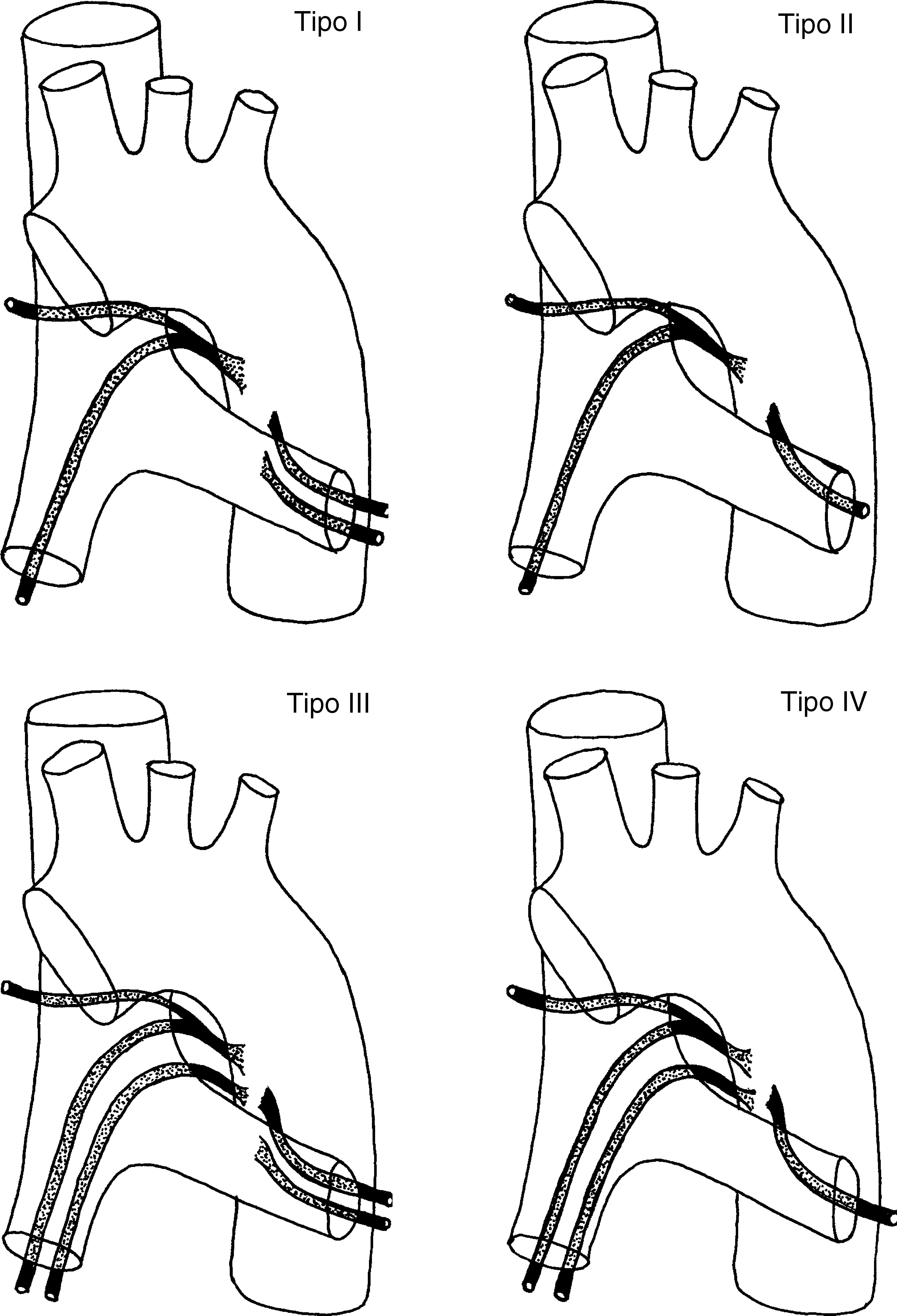
Las arterias bronquiales ortotópicas tienen un origen, ramificación y trayecto muy variables (fig. 5)24. La arteria intercostobronquial derecha es la que presenta una localización más constante. Está presente en casi un 90% de casos y es la más fácil de identificar en la angio-TCMD. Se origina de la cara posterolateral derecha de la aorta descendente para seguir primero un trayecto craneal, antes de ramificarse en la primera arteria intercostal derecha y la arteria bronquial derecha, y después un trayecto caudal para llegar al bronquio principal derecho (fig. 1G y H). Las arterias bronquiales izquierdas generalmente surgen de la cara anteromedial de la aorta. Suele haber 2, una superior y una inferior; su trayecto mediastínico es muy corto y su curso es más difícil de ver en la angio-TCMD; no es infrecuente tampoco que exista un tronco común derecho e izquierdo (fig. 1G y I)4,25,26.
Representación esquemática de los 4 patrones clásicos de ramificación de las arterias bronquiales: Tipo I: 2 arterias bronquiales en la izquierda y una en la derecha, originada de un tronco intercostal, conocida como tronco intercostobronquial derecho (40,6%); Tipo II: una arteria bronquial en la izquierda y un tronco intercostobronquial en la derecha (21%); Tipo III: 2 arterias bronquiales en la izquierda y 2 en la derecha (un tronco intercostobronquial y una arteria bronquial) (20%); Tipo IV: una arteria bronquial en la izquierda y 2 en la derecha (un tronco intercostobronquial y una arteria bronquial) (18%).
En los adultos, el diámetro normal de las arterias bronquiales es menor de 1,5mm en su origen y de 0,5mm en el punto de entrada en el segmento broncopulmonar4,22,25. Un diámetro mayor de 2mm se considera patológico e indica la arteria que hay que embolizar, aunque, desafortunadamente, no existe una buena correlación entre el tamaño de la arteria y el riesgo de sangrado4,23,26. Yoon et al.27, en un estudio retrospectivo comparando la angio-TCMD y la angiografía en 22 pacientes con hemoptisis, mostraron diferencias estadísticamente significativas entre las arterias que causaban hemoptisis y las que no; El trayecto de las causantes se veía mejor desde su origen hasta el hilio pulmonar que el de las arterias no responsables de la hemoptisis.
En la angio-TCMD veremos las arterias bronquiales como pequeñas imágenes nodulares o lineales en el mediastino (casi imperceptibles si no están hipertrofiadas), alrededor de los bronquios principales, esófago y en la ventana aortopulmonar (fig. 1E y F). Es imprescindible realizar reconstrucciones MIP y en diferentes planos para poder ver bien su origen y trayecto (fig. 1G)4.
Las arterias bronquiales ectópicas se ven en el 8,3 al 35% de los casos4,25. Los orígenes ectópicos más frecuentes son la concavidad del arco aórtico (74%), la arteria subclavia ipsi- o contralateral (10,5%) (fig. 6C), la aorta abdominal (8,5%), el tronco braquiocefálico ipsilateral (2%), la arteria mamaria interna ipsilateral (2,5%) y el tronco tirocervical ipsilateral (2,5%)28.
Paciente con aspergilomas bilaterales y hemoptisis amenazante. A) Radiografía de tórax mostrando importante pérdida de volumen de los lóbulos superiores con grandes cavidades en ambos. Se observan imágenes nodulares dentro de las cavidades (flechas) correspondientes a los aspergilomas. B) Reconstrucción MIP axial donde observamos la hipertrofia de las arterias bronquiales derecha (flechas blancas) e izquierda (flechas negras), así como el micetoma (*). C) Reconstrucción MIP coronal que muestra una arteria bronquial ectópica que se origina en arteria subclavia derecha y se dirige al pulmón por el hilio (flechas). D) Arteriografía que muestra la arteria bronquial ectópica originada de la subclavia derecha (flechas). E) Reconstrucción MIP coronal posterior que muestra además hipertrofia de las primeras arterias intercostales izquierdas (flechas) adyacentes al engrosamiento pleural que acompaña al aspergiloma del lóbulo superior izquierdo.
Para estudiar las arterias bronquiales en la TCMD habrá que9,26: a) localizar los ostia de las arterias bronquiales y ver si son ortotópicas o ectópicas; b) describir la salida en la pared aórtica (anterior, posterior, lateral derecha o izquierda); también es útil describir las placas de ateroma y el ángulo del vaso con la aorta, que si es muy agudo puede ser difícil de cateterizar; c) medir el diámetro de la arteria bronquial; y d) determinar el número total de arterias bronquiales patológicas por cada lado.
Los aneurismas de las arterias bronquiales son poco frecuentes, pueden localizarse en la porción intramediastínica de la arteria bronquial o en la porción intrapulmonar. La angio-TCMD puede demostrarlos (fig. 7)29. Los aneurismas bronquiales mediastínicos pueden causar síntomas por compresión de estructuras. La rotura de los aneurismas mediastínicos más proximales puede manifestarse con dolor torácico agudo que simula una disección aórtica. La rotura de los aneurismas intrapulmonares puede dar lugar a una hemoptisis masiva y, a menudo, catastrófica29,30. Embolizar los aneurismas mediastínicos puede ser difícil si están muy próximos al orificio de salida de la aorta29.
Paciente con fibrosis quística y hemoptisis amenazante. A) TC con ventana de pulmón en la que se observa una extensa afectación bilateral por bronquiectasias (predominantes en lóbulo medio y língula), impactos de moco y áreas de atrapamiento aéreo en ambos lóbulos inferiores. B) Reconstrucción MIP axial que muestra múltiples arterias bronquiales patológicas (flechas blancas). El tronco intercostobronquial derecho presenta un aneurisma (flecha negra). Se observan múltiples adenopatías mediastínicas reactivas a las infecciones de repetición (*).
Una de las complicaciones más temidas del procedimiento es embolizar inadvertidamente la arteria medular anterior, con el resultado de paraplejía. La porción anterior de la médula espinal la irriga la arteria espinal anterior. En la región torácica, la arteria espinal anterior procede de una arteria medular anterior larga y única (arteria de Adamkiewicz), que se origina entre T5 y L46. Aunque es poco frecuente (5%), la arteria de Adamkiewicz puede originarse de la porción costal del tronco intercostobronquial derecho, con una forma característica de horquilla en la arteriografía. Embolizar esta arteria produce una isquemia medular y debe evitarse31. Si durante la aortografía se ve la arteria de Adamkiewicz, la embolización deberá hacerse más allá de su salida, para no ocluirla32. Desafortunadamente, la arteria de Adamkiewicz es muy fina y rara vez se logra ver en la angio-TCMD de pacientes con hemoptisis4.
En definitiva, dada la gran variabilidad anatómica y prevalencia de arterias bronquiales ectópicas (que pueden ser difíciles de identificar durante la aortografía), demostrar estas variables con un método no invasivo antes del procedimiento intervencionista puede reducir las recidivas, relacionadas en muchas ocasiones con las arterias bronquiales ectópicas no ocluidas4,33–35.
Arterias sistémicas no bronquialesLas arterias sistémicas no bronquiales están implicadas en el 41-88% de los casos de hemoptisis según diversos artículos4,27. Pueden constituir la causa primaria de sangrado o ser una causa adicional al sangrado de las arterias bronquiales. A diferencia de las arterias bronquiales, no entran al pulmón a través del hilio y su curso no es paralelo a los bronquios. Estas arterias entran en el parénquima pulmonar a través de la pleura o por el ligamento pulmonar inferior26,36.
Las arterias sistémicas no bronquiales se pueden originar en las arterias intercostales (las más frecuentemente implicadas), ramas de los troncos supraaórticos (tronco innominado, arterias subclavia, troncos tirocervical y costocervical), arterias axilares, arterias mamarias internas y ramas aórticas infradiafragmáticas (arterias frénicas inferiores, arterias gástricas, tronco celíaco)26,36.
Ver en la TCMD arterias anormalmente dilatadas y tortuosas en la grasa extrapleural, con engrosamiento pleural (mayor de 3mm) y afectación del parénquima adyacente (bronquiectasias, secuelas tuberculosas) debe hacernos sospechar su implicación en la hemoptisis (figs. 6 y 8)27,35. Una vez localizado el sitio de sangrado en la TCMD, deben buscarse sistemáticamente las arterias no bronquiales que potencialmente pueden vascularizar esa zona: arteria frénica inferior (fig. 9) (lóbulos inferiores y segmento inferior de la língula), arterias intercostales (pleura posterior), arteria mamaria interna (segmento anterior de los lóbulos superiores, el lóbulo medio y língula) y ramas de las arterias subclavias y axilares (el ápex pulmonar)20,27. Cuando la arteria mamaria interna tiene un diámetro superior a 3mm o la arteria frénica superior a 2mm, debe sospecharse su implicación en el sangrado35. No reconocer estas arterias sistémicas puede ser motivo de una recurrencia temprana de la hemoptisis tras embolizar con éxito las arterias bronquiales4,9,34,35.
Paciente con secuelas tuberculosas y neumonía necrosante que afecta al lóbulo inferior derecho. TC con contraste que muestra una importante pérdida de volumen del hemitórax derecho, con colección pleural crónica calcificada en la base del hemitórax derecho (flechas). Se observa un aumento de la grasa subpleural, por donde discurre una arteria intercostal hipertrófica y tortuosa (cabezas de flecha).
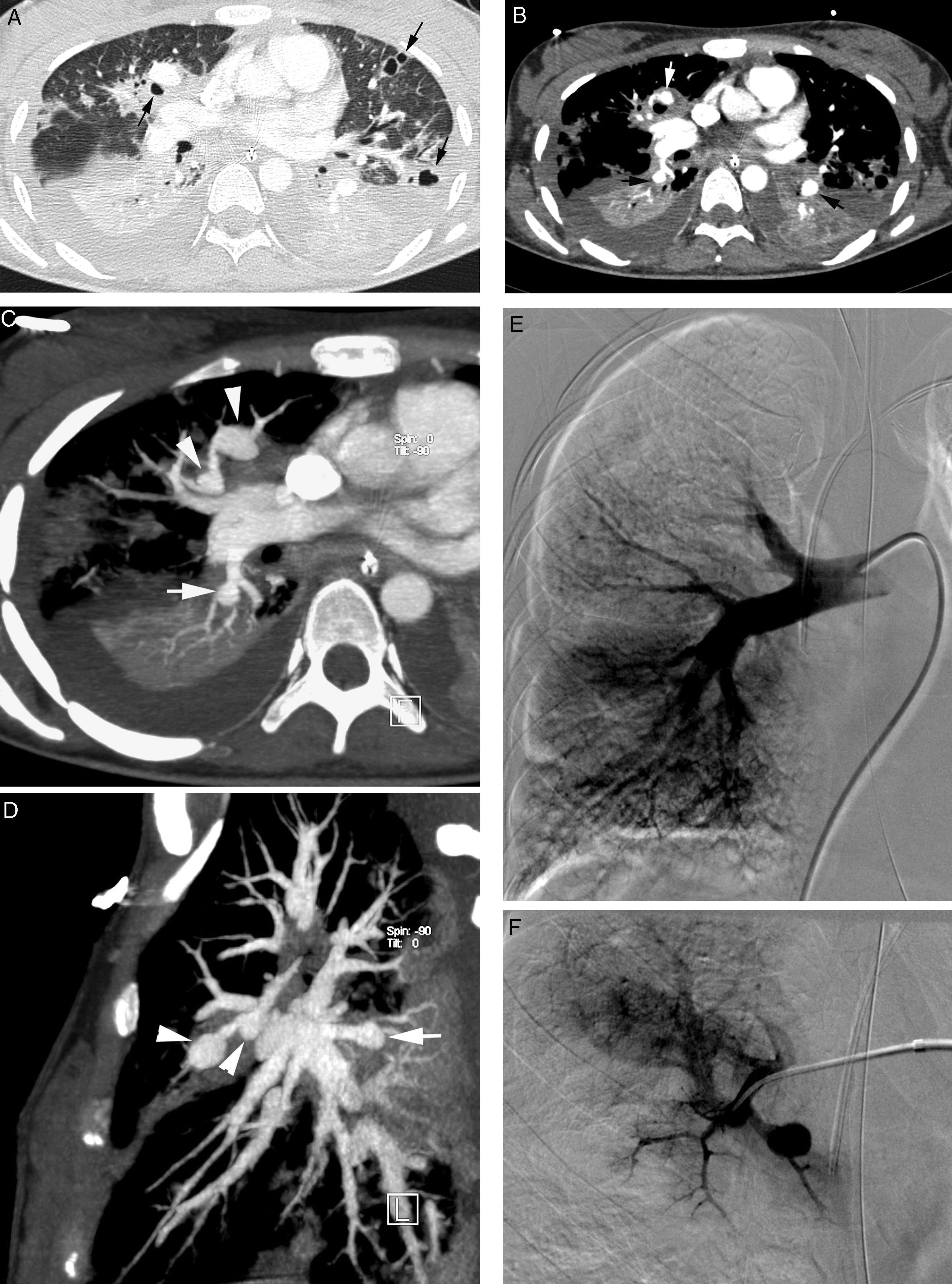
Paciente con bronquiectasias en la língula que presentó hace un año una hemoptisis amenazante por la que se embolizaron las arterias bronquiales. Ahora presenta un nuevo episodio de hemoptisis amenazante. A) TC con ventana de pulmón que muestra bronquiectasias en la língula (cabeza de flecha). B-D) Imágenes de angio-TCMD; B) Corte axial en la región subdiafragmática que muestra una arteria frénica izquierda tortuosa (flechas). Las reconstrucciones MIP coronales oblicuas C) y D) permiten ver el trayecto de la arteria no bronquial desde el tronco celíaco (*) a la língula (flechas). E) La arteriografía confirma los hallazgos de la TC; la arteria frénica se dirige a língula.
Aunque muy infrecuentes, pueden existir comunicaciones entre las arterias coronarias y las arterias bronquiales. Probablemente la comunicación es congénita, y en situaciones con disminución del flujo pulmonar o enfermedad pulmonar crónica (bronquiectasias) las anastomosis entre las arterias pulmonares y bronquiales pueden verse reforzadas por circulación colateral procedente de las arterias coronarias4. La mayoría de los pacientes están asintomáticos pero pueden causar angina, por el fenómeno de «robo coronario», fallo cardíaco, endocarditis y hemoptisis36. Estas fístulas suelen ser retrocardíacas, en áreas de recesos pericárdicos amplios. Pueden existir comunicaciones inversas, con flujo desde las arterias bronquiales hacia las coronarias en casos de estenosis coronarias arterioscleróticas36.
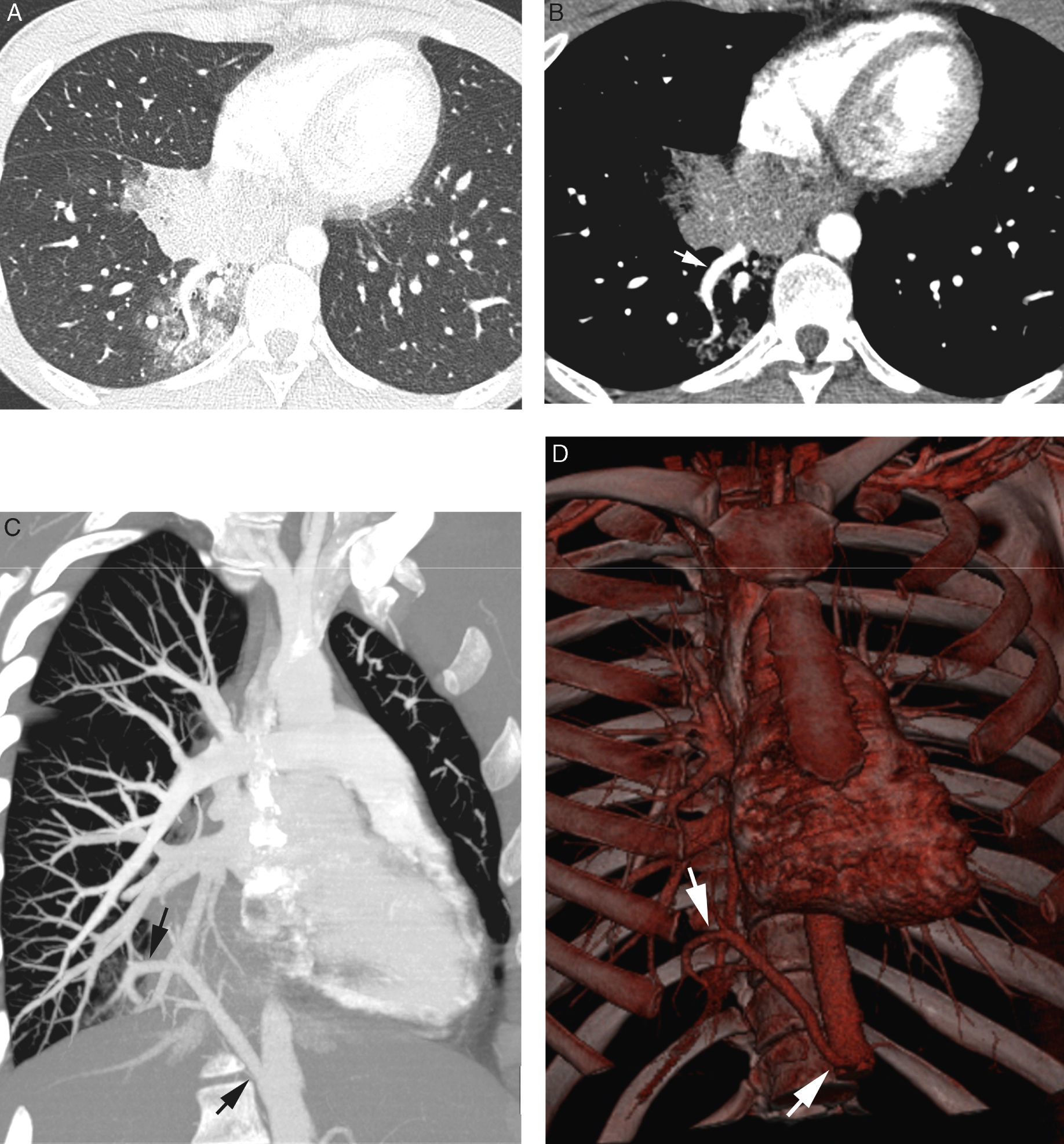
En este apartado consideraremos también las malformaciones pulmonares congénitas que presentan irrigación sistémica, como el secuestro broncopulmonar (masa de tejido pulmonar no funcionante, en general sin conexión con el árbol bronquial normal) (fig. 10) y la irrigación sistémica de pulmón normal, que aunque infrecuentes, pueden ser causa de hemoptisis amenazante37. La irrigación sistémica de pulmón normal, a diferencia del secuestro broncopulmonar, es una anomalía puramente vascular, en la que una arteria sistémica irriga una porción de pulmón normal38. En ambos casos la anomalía suele afectar los lóbulos inferiores, la arteria sistémica suele originarse de la aorta abdominal (entrando hacia el pulmón a través de la porción inferior del ligamento pulmonar) y el drenaje venoso se realiza a través de las venas pulmonares. En el caso de complicarse con una hemoptisis amenazante, esta puede ser eficazmente controlada embolizando la arteria sistémica aberrante4,39. Podemos sospechar la posibilidad de malformación congénita como causa de la hemoptisis amenazante especialmente en pacientes jóvenes, sin enfermedad pulmonar previa conocida (fig. 10).
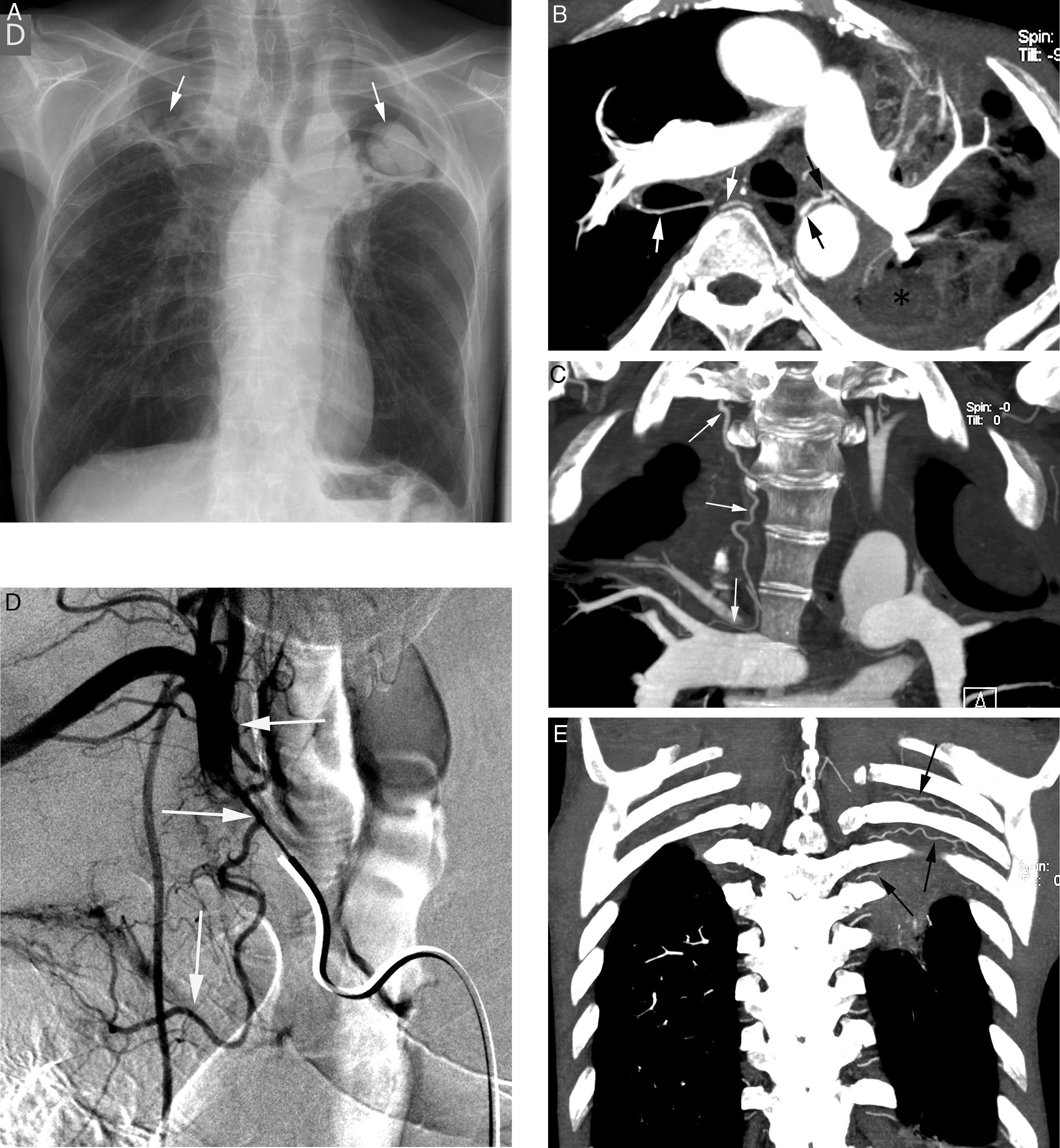
Paciente de 26 años sin antecedentes conocidos que presenta hemoptisis amenazante. A) TC con ventana de pulmón que muestra una consolidación en el lóbulo inferior derecho, con imágenes en vidrio deslustrado alrededor. B-D) Imágenes de angio-TCMD. Corte axial (B) que muestra una imagen vascular anómala (flecha) en el lóbulo inferior derecho adyacente a la consolidación. La reconstrucción MIP coronal oblicua (C) muestra un vaso anómalo que se origina en la aorta abdominal (flechas) y se dirige al lóbulo inferior derecho, confirmando que la afectación parenquimatosa se trata de un secuestro pulmonar. Reconstrucción de volumen (D) que muestra el vaso anómalo (flechas). Las reconstrucciones permiten observar el ángulo del vaso anómalo en su salida de la aorta.
La evaluación vascular torácica siempre debe incluir la circulación pulmonar. El sangrado con origen en las arterias pulmonares representa, según publicaciones recientes, aproximadamente un 10% de las causas de hemoptisis amenazante7,40,41.
El estudio de las arterias pulmonares se dirige principalmente a identificar aneurismas o, más frecuentemente, seudoaneurismas (dilatación de la arteria que no incluye todas las capas de la pared) de las arterias pulmonares7. Ambas lesiones se ven en la TC con contraste como dilataciones saculares o fusiformes de las arterias pulmonares que se rellenan de contraste, de manera simultánea al resto de las arterias pulmonares (fig. 11A, B, C y D)42. Ver ramas de las arterias pulmonares en la porción interna de las paredes de las cavidades necróticas también es un signo que sugiere su implicación en el sangrado (fig. 3C)20.
La angio-TCMD, con las reconstrucciones MIP y multiplanares, localiza con exactitud el seudoaneurisma y su arteria nutricia. En ocasiones, los seudoaneurismas distales no son visibles en la arteriografía pulmonar global o lobar y solo se ven en una angiografía supraselectiva de las arterias pulmonares. La información que proporciona la angio-TCMD es vital, pues indica con precisión cuál es el vaso afectado para poder realizar una embolización supraselectiva7 (fig. 11E y F).
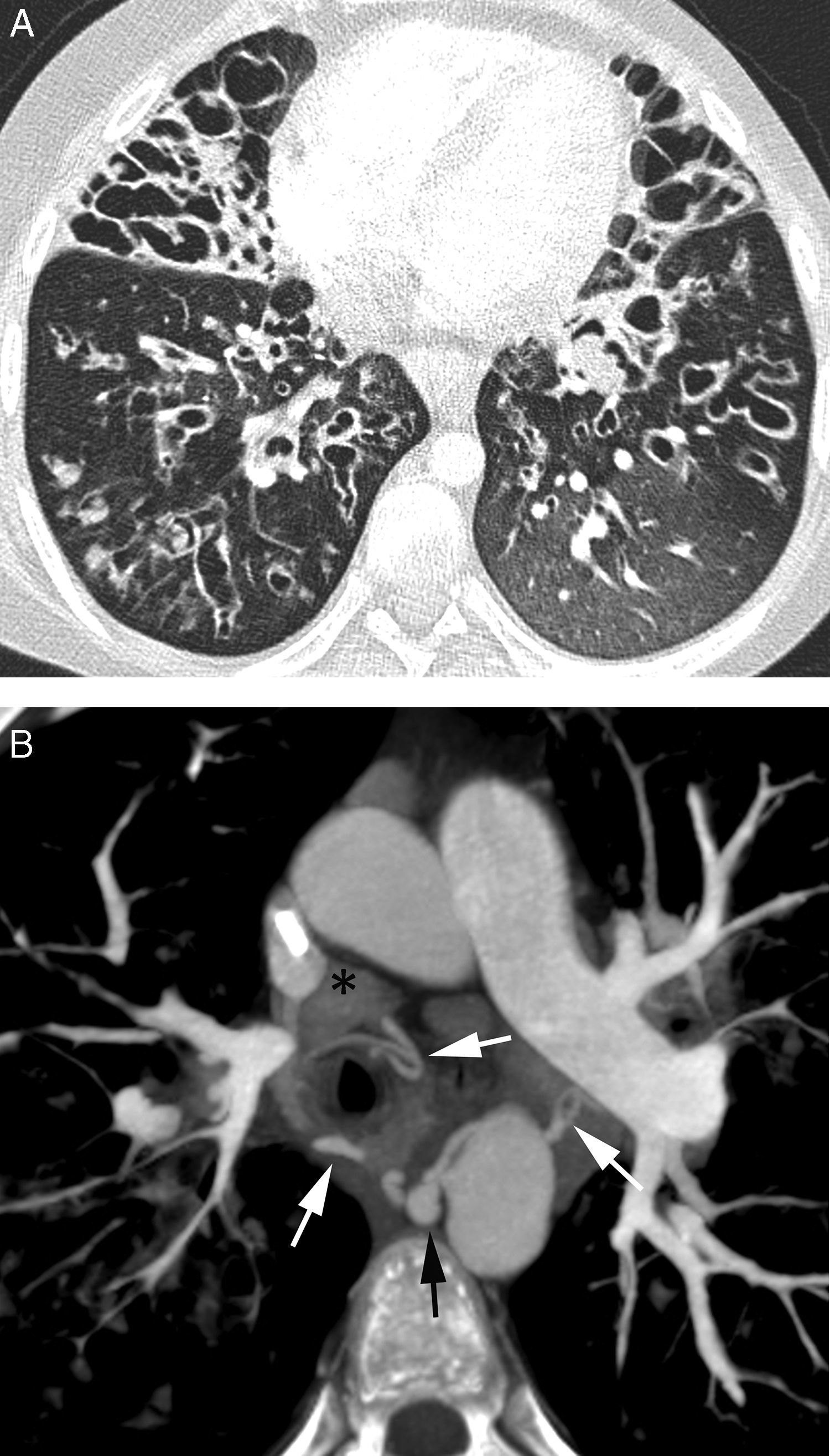
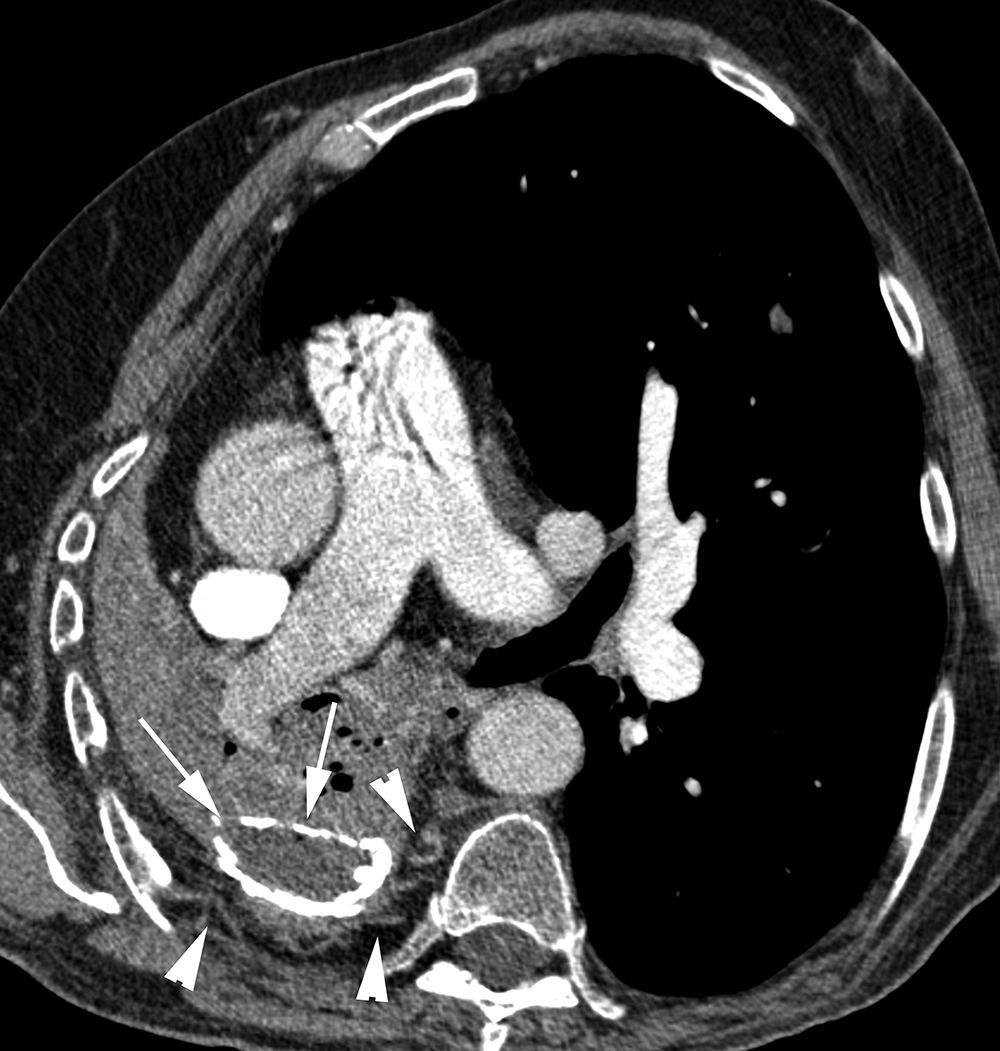
Paciente con embolismos sépticos y hemoptisis amenazante. A) TC con ventana de pulmón en la que se observan múltiples lesiones cavitadas bilaterales, algunas con paredes finas, otras con paredes gruesas, que se corresponden con embolismos sépticos (flechas). B-E) imágenes de angio-TCMD. Se observan (B) múltiples dilataciones de las arterias pulmonares (flechas), algunas de ellas adyacentes a una cavidad (flecha blanca), que se corresponden con seudoaneurismas micóticos múltiples. Reconstrucción MIP axial (C) que muestra 2 aneurismas en ramas segmentarias anteriores del lóbulo superior derecho (cabezas de flechas) y otro aneurisma en una rama segmentaria del lóbulo inferior derecho (flecha). Reconstrucción MIP sagital (D) que muestra los 3 aneurismas derechos, 2 en el lóbulo superior derecho (cabezas de flecha) y uno en el lóbulo inferior derecho (flecha); Arteriografía pulmonar global (E) en la que los seudoaneurismas no se ven. F) Arteriografía supraselectiva donde se observa uno de los aneurismas del lóbulo superior derecho.
Las causas potenciales de sangrado con origen en las arterias pulmonares son numerosas e incluyen: enfermedades con necrosis del parénquima pulmonar (fig. 11A y B) (tuberculosis activa o crónica, absceso pulmonar, neumonía necrosante, aspergilosis, neoplasias), vasculitis (enfermedad de Behçet, síndrome Hughes-Stovin), iatrogenia/traumatismos (catéteres, heridas penetrantes) y malformaciones arteriovenosas (MAV)7. En los pacientes con necrosis del parénquima pulmonar (secundaria a infección o neoplasia), la hemoptisis con origen en las arterias pulmonares se produce por erosión de las arterias que forma un seudoaneurisma43. Se denominan aneurismas de Rasmussen los seudoaneurismas de las arterias pulmonares originados en áreas de inflamación tuberculosa; en la TC se manifiestan como imágenes redondeadas en la pared de las cavidades tuberculosas que captan mucho contraste. En los casos de malposición de un catéter de Swan-Ganz, el extremo distal del catéter erosiona la pared de la arteria, produciendo un seudoaneurisma que queda contenido por la adventicia y en ocasiones por la trombosis43. Las vasculitis producen una inflamación de los vasa vasorum de la capa media, destrucción de las fibras elásticas y dilatación de la luz vascular.
La hemoptisis amenazante puede ocurrir, aunque es raro, por rotura de MAV pulmonares. Se trata de comunicaciones anómalas entre la circulación pulmonar arterial y venosa que resultan en un cortocircuito derecha-izquierda. La mayoría son congénitas y asociadas a la enfermedad de Rendu-Osler. Se suele recomendar de manera electiva la embolización de las MAV cuyo vaso aferente sea mayor de 3mm4.
Antes de la introducción de la TCMD, la hemoptisis con origen en las arterias pulmonares se sospechaba cuando la embolización de las arterias sistémicas no controlaba el sangrado44. Khalil et al.15 compararon 2 grupos consecutivos de pacientes con hemoptisis; a uno de ellos se le realizó angio-TCMD antes del tratamiento endovascular y al otro no. La angio-TCMD aumentó el diagnóstico de hemoptisis de origen pulmonar y disminuyó las resecciones quirúrgicas urgentes y las arteriografías pulmonares sin embolización. En el grupo sin angio-TCMD las embolizaciones pulmonares se realizaron ante la recurrencia de la hemoptisis.
Hemoptisis criptogenéticaEs la hemoptisis de la que no se encuentra una causa subyacente, a pesar de hacer un estudio completo, incluyendo TC torácica y fibrobroncoscopia; se trata de un diagnóstico de exclusión. Representa aproximadamente un 15% de las hemoptisis45 y, en un tercio de los casos, puede ser amenazante4. Se presenta con mayor frecuencia en pacientes fumadores4,45,46. Menchini et al.46, estudiando los hallazgos angiográficos de la hemoptisis criptogenética en paciente fumadores, destacaron que en un 80% de pacientes existe una marcada hipertrofia de arterias bronquiales. En estos casos, embolizar las arterias bronquiales resuelve la hemoptisis.
En el estudio de Herth et al.47 el 6% de los pacientes con hemoptisis criptogenética desarrollaron un cáncer durante el periodo de seguimiento de 3 años. Este hecho resalta la importancia de estudiar detalladamente el parénquima pulmonar y los bronquios para excluir un carcinoma de pulmón pequeño, y la importancia de realizar un seguimiento por TC meses después, para poder detectar un cáncer de intervalo. Sin embargo, en un estudio posterior que siguió evolutivamente a 81 pacientes con hemoptisis criptogenética, Savale et al.45 no mostraron una incidencia mayor de neoplasia de pulmón. En su muestra, 13 de los pacientes con hemoptisis criptogenética fueron intervenidos quirúrgicamente por persistencia del sangrado y más de la mitad presentaban en la submucosa hallazgos compatibles con la enfermedad de Dieulafoy. Esta enfermedad se caracteriza por la dilatación anómala de vasos en la submucosa con tendencia al sangrado. Se describió originalmente en el tracto gastrointestinal (la localización típica es el estómago seguido del duodeno)48 y, más recientemente, en los bronquios. Generalmente coexiste con procesos inflamatorios crónicos, como la bronquitis crónica48, y la mayoría de los pacientes en los que se diagnostica son fumadores importantes. En ninguno de estos pacientes se encontraron hallazgos ni en la fibrobroncoscopia ni en la TC que hicieran sospechar la entidad, por lo que se piensa que la enfermedad de Dieulafoy pueda estar implicada en algunos casos de hemoptisis criptogenética amenazante en pacientes fumadores45,49.
Causas de resangradoTras la embolización se consigue un control inmediato de la hemoptisis en un 73-99% de los pacientes50–53. Sin embargo, no es infrecuente que la hemoptisis recurra, lo que ocurre en el 10-53% de casos53–56. La recurrencia precoz, en las primeras semanas, se relaciona con una oclusión incompleta de los vasos involucrados, porque exista una causa subyacente con afectación muy extensa, o por no haber examinado exhaustivamente todos los vasos participantes53–55. La recurrencia tardía se debe a la recanalización de los vasos previamente embolizados, no haber embolizado otros vasos implicados, o por revascularización por circulación colateral causada por la persistencia o progresión de la patología subyacente. De las causas de hemoptisis amenazante, el aspergiloma y las neoplasias pulmonares son las que presentan un peor control inmediato y tardío de la hemoptisis53,54; en un artículo de nuestro medio, la recidiva tardía más frecuente se produjo en los pacientes con bronquiectasias18.
Por todo lo expuesto, es importante identificar y embolizar todos los vasos que puedan contribuir a la irrigación anómala, incluyendo cualquier arteria sistémica no bronquial o pulmonar. Por otra parte, la información sobre la aterosclerosis y estenosis de los ostia de las arterias bronquiales que aporta la angio-TCMD al radiólogo intervencionista puede prevenir el fallo en la cateterización15.
Recomendaciones prácticas para valorar la angiotomografía computarizada multidetector en la hemoptisis amenazanteEl estudio debe incluir los troncos supraaórticos y la parte superior del abdomen, porque puede haber vasos sistémicos implicados en el sangrado que se originan en ramas supraaórticas y/o infradiafragmáticas.
Es aconsejable iniciar la evaluación de las imágenes con la ventana de pulmón, que, la mayoría de las veces, orienta sobre la causa de sangrado y su localización.
Debe revisarse de forma sistemática la vía aérea en los cortes axiales o mediante reconstrucciones multiplanares o en proyección de mínima intensidad.
Las imágenes axiales con ventana de mediastino permiten estudiar inicialmente los vasos implicados y son útiles para ver el ostium de las arterias sistémicas de la aorta o sus ramas, pero las reconstrucciones MIP y multiplanares (con grosor y planos ajustados en cada caso) son imprescindibles para demostrar el trayecto tortuoso de los vasos sistémicos o las alteraciones de las arterias pulmonares.
Si se observan signos de sangrado en los lóbulos superiores deben revisarse las arterias subclavias y las arterias mamarias internas.
Si los signos de sangrado se localizan en los lóbulos inferiores, língula y lóbulo medio, deben revisarse las arterias frénicas.
En caso de infecciones agudas o crónicas, o si hay lesiones cavitadas pulmonares, deben revisarse las arterias pulmonares para detectar seudoaneurismas.
Cuando hay enfermedad pleural, tiene que valorarse la posible implicación de las arterias intercostales.
En pacientes mayores con aterosclerosis debemos mencionar las placas de ateroma en los ostia de las arterias bronquiales, que pueden dificultar su cateterización en la angiografía.
Para facilitar el cateterismo, la angio-TCMD puede indicar la angulación de los vasos en el origen de la aorta.
En un paciente joven sin enfermedad pulmonar previa conocida hay que pensar en lesiones congénitas y valorar si hay vasos sistémicos procedentes de la aorta abdominal, que se dirijan a los lóbulos inferiores.
ConclusiónLa hemoptisis amenazante es una situación clínica grave que precisa ser diagnosticada y tratada urgentemente. El tratamiento de elección es la embolización. La circulación bronquial es la causa más frecuente de hemoptisis amenazante, pero las arterias sistémicas no bronquiales o las arterias pulmonares pueden también ser causa del sangrado dependiendo de la enfermedad subyacente.
Con la angio-TCMD se estudia la causa, la localización y los posibles vasos implicados en la hemoptisis de forma no invasiva, rápida y precisa, y es particularmente útil para detectar arterias bronquiales ectópicas, arterias sistémicas no bronquiales o seudoaneurismas pulmonares. Hacer sistemáticamente una angio-TCMD antes de embolizar permite planificar mejor el tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Autorías- 1.
Responsable de la integridad del estudio: CS, EC.
- 2.
Concepción del estudio: CS, EC.
- 3.
Diseño del estudio: CS, EC.
- 4.
Obtención de los datos: CS, EC, XG, MA, AA.
- 5.
Análisis e interpretación de los datos: CS, EC, XG, MA, AA.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: CS, EC.
- 8.
Redacción del trabajo: CS, EC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: XG, MA, AA.
- 10.
Aprobación de la versión final: CS, EC, XG, MA, AA.
Los autores declaran no tener ningún conflicto de intereses.