Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosLa enfermedad vascular torácica urgente representa un grupo de entidades con elevada mortalidad. Vamos a centrar nuestra atención en la enfermedad aórtica aguda, el tromboembolismo pulmonar y la hemoptisis. En ellas, la radiología desempeña un papel fundamental en su diagnóstico, permitiendo la toma de las decisiones terapéuticas urgentes. La angiotomografía computarizada multidetector es la técnica de elección. Proponemos un modelo de informe estructurado como herramienta para organizar la información, facilitar la síntesis de hallazgos y promover una comunicación clara con el resto de especialistas.
Urgent thoracic vascular conditions comprise a group of entities with high mortality. This paper will focus on acute aortic disease, pulmonary embolisms, and hemoptysis, conditions in which radiology plays a fundamental role in the diagnosis and in urgent decision making about treatment. Multidetector CT angiography is the imaging technique of choice. We propose a model for structured radiology reports to organize the information included, facilitate the synthesis of the findings, and foster clear communication with professionals of other specialties.
Se propone un modelo de informe estructurado de 3de las 4patologías urgentes vasculares torácicas, donde quedan expuestos los datos más relevantes de cara al tratamiento.
Patología aguda de la aorta torácicaEn la última década, hemos asistido a importantes avances en el tratamiento de la enfermedad de la aorta torácica con el desarrollo de nuevos procedimientos que combinan cirugía abierta y reparación intravascular1.
La angiotomografía computarizada multidetector (angio-TCMD) es la modalidad de imagen de elección para su valoración preoperatoria. El radiólogo tiene un papel esencial en el abordaje sistematizado y protocolizado llevado a cabo en los comités de aorta multidisciplinarios. Sin embargo, con frecuencia nuestros informes no aportan los datos necesarios para una planificación preoperatoria acorde con los últimos avances. Tampoco empleamos terminología ni técnicas de medición uniformes1–5.
Nuestro objetivo es hacer una propuesta de informe tipo, basado en las más recientes guías y documentos de consenso nacionales e internacionales, que permita evitar fallos e inexactitudes en la valoración de la enfermedad aórtica (tabla 1).
Propuesta de informe estructurado para enfermedad aguda de la aorta torácica
| Técnica | Rango exploración y fases estudioUso de contraste intravenoso: sí/no (nombre comercial, concentración y volumen)Sincronización cardíaca: sí/no (preferiblemente fase sistólica) |
| Hallazgos | |
| Signos de rotura aórtica | Hemopericardio: sí/noHemotórax: sí/noHemomediastino: sí/noExtravasación de contraste: sí/no |
| Clasificación de la disección | Stanford tipo AStanford tipo BDisección no A no B |
| Descripción de la disección | Puerta de entrada principal: localización y tamañoOtras comunicaciones entre lucesTrayecto de la disecciónDiferenciación entre luz verdadera y falsaDiámetro y trombosis de la luz falsaCompresión de la luz verdadera por la falsa |
| Diámetros de la aorta | Anillo aórticoSenos de Valsalva (método: seno-seno/ seno-comisura)Unión sinotubularAorta tubular ascendenteArco aórtico (tercio proximal, medio y distal)Aorta torácica descendenteAorta abdominal supra e infrarrenal |
| Troncos supraaórticos (tronco braquiocefálico, carótida común izquierda y subclavia izquierda) | Extensión de la disección y diámetrosConfiguración del arco aórtico: tipo i/ii/iiiVariantes anatómicas |
| Accesos vasculares (arterias femorales comunes, carótidas comunes, subclavias y axilares) | Extensión de la disección y diámetrosAteromatosis: calcificada/no calcificada; grado |
| Arterias coronarias | Origen normal/anómalo/no visualizadas |
| Malperfusión visceral | Hepática: sí/ noEsplénica: sí/noRenal: sí/noIntestinal: sí/no |
| Conclusión | Hemopericardio: sí/noTipo disección: tipo A/tipo B/no A no BLocalización puerta de entradaSignos de malperfusión visceral: sí/no |
La adquisición debe realizarse desde los troncos supraaórticos hasta la bifurcación de las arterias femorales. Idealmente, incluirá también el polígono de Willis, ya que determinar su permeabilidad y morfología está recomendado cuando el tratamiento puede implicar al arco aórtico (zonas de anclaje o landing zones Z0 a Z2 de Ishimaru)1,2.
Respecto a las fases, es importante iniciar el protocolo con un estudio sin contraste que ayude a identificar los hematomas intramurales, las calcificaciones vasculares y el material quirúrgico postoperatorio. La fase arterial se suele realizar con técnica de seguimiento del bolo (“bolus tracking”) con contraste de alta concentración (≥ 350mg I/ml) e infundido a alta velocidad (5-6ml/s) para asegurar un realce óptimo de la aorta torácica. Una tercera adquisición en fase venosa, 60-90 segundos después de la inyección del contraste, permite valorar malperfusión visceral, relleno tardío de la luz falsa, extravasación de contraste en la rotura aórtica o realce de tejido inflamatorio en vasculitis e infecciones. También realizar diagnósticos abdominales alternativos en ausencia de enfermedad aórtica aguda2,5.
La sincronización cardíaca no es necesaria en estudios rutinarios, aunque resulta muy útil para realizar mediciones precisas de la raíz aórtica y aorta ascendente al minimizar los artefactos de movimiento y las variaciones sístole/diástole. También permite la evaluación de las arterias coronarias proximales3.
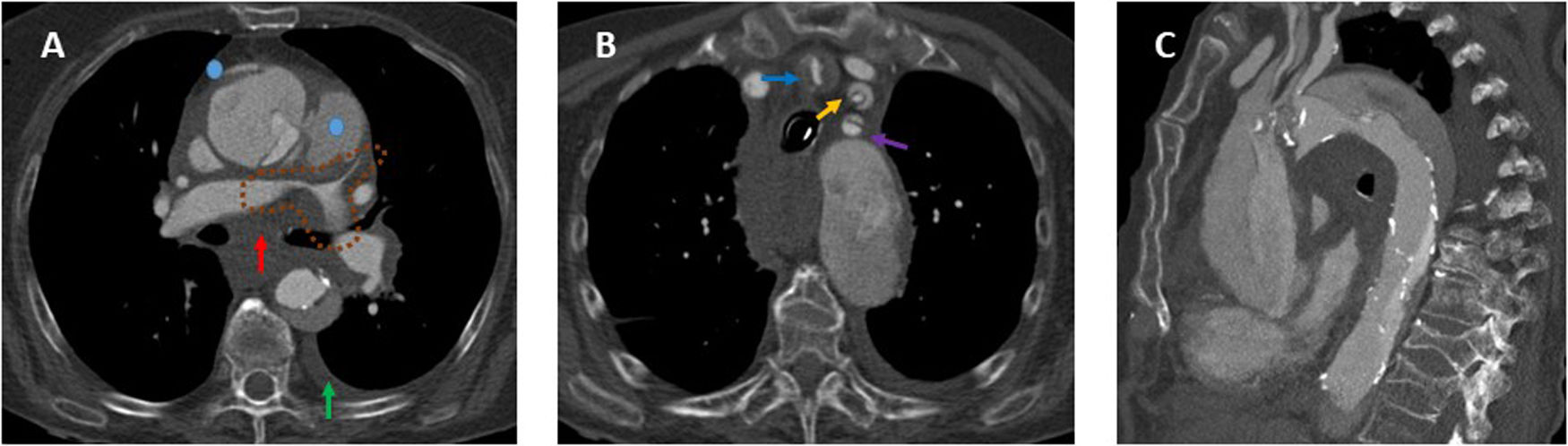
HallazgosSignos de rotura aórticaSon factores de mal pronóstico que sugieren rotura de la luz falsa (fig. 1).
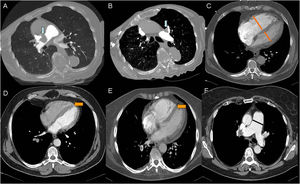
Disección aguda de aorta torácica tipo A de Stanford con signos de rotura aórtica. A) Imagen axial poscontraste en fase arterial donde observamos infiltración hemática del mediastino (flecha roja), pequeño hemotórax izquierdo (flecha verde) e irregularidad de la pared de la aorta ascendente con 2focos de extravasado de contraste procedentes de la luz falsa (puntos azules) como signos de rotura aórtica. También había pequeño hemopericardio no mostrado. Asimismo, hay una disminución de calibre de las arterias pulmonares proximales (línea discontinua marrón) provocada por la extensión subadventicial del sangrado o la compresión ejercida por el hematoma mediastínico. B) Imagen axial poscontraste en fase arterial en la que se muestra la extensión de la disección al tronco arterial braquiocefálico derecho (flecha azul), a la arteria carótida izquierda (flecha naranja) y a la arteria subclavia izquierda (flecha morada). C) Reconstrucción MPR en el plano sagital donde apreciamos mejor la extensión de la disección a la largo de la aorta torácica (ascendente, cayado y descendente) y a troncos supraaórticos.
La disección tipo A de Stanford afecta a la aorta torácica ascendente y el tipo B solo a la aorta torácica descendente. La disección no A no B es aquella en la que el arco aórtico está implicado, ya sea porque la puerta de entrada principal se sitúa en el arco aórtico o por extensión retrógrada de una disección tipo B1,2. La afectación del arco aórtico en el proceso de disección es determinante en la evolución clínica, el tratamiento y el pronóstico, por lo que resulta razonable no categorizar a estos enfermos como tipo B1.
Descripción de la disecciónPara ayudar a entender mejor la fisiopatología de la disección y homogeneizar el lenguaje, se recomienda utilizar los términos «puerta de entrada principal» y «comunicaciones entre luces». El término «múltiples entradas y reentradas» debe ser evitado por confuso2.
La puerta de entrada principal es la de mayor tamaño. En caso de no encontrarla, señalaremos dónde sospechamos que se encuentra. La zona de mayor colapso de la luz verdadera puede orientarnos.
En las disecciones tipo B, es útil informar de la proximidad de la disección a la arteria subclavia izquierda, porque esto determina la viabilidad de la zona de anclaje proximal de la endoprótesis. Una longitud de menos de 2-3cm no se considera adecuada. En estos casos, el cirujano realizará un bypass carótido-subclavio previo. Si con esto no consigue una zona de anclaje suficiente, está indicada la cirugía con técnica de «trompa de elefante congelada»5.
Diámetros de la aortaLas guías sugieren que se deben reportar los diámetros aórticos máximos en 8localizaciones. Estas mediciones incluirán la pared aórtica y se realizarán en un plano doble oblicuo, con el objetivo de obtener planos totalmente perpendiculares el flujo aórtico. Así, obtendremos una verdadera imagen axial corregida de la aorta, circular y no elipsoide. En casos de morfología aórtica no circular, se deben indicar ambos diámetros, mayor y menor1–5.
La raíz aórtica es geométricamente la porción más compleja de la aorta, por su morfología asimétrica en hoja de trébol que, al no tener forma circular, no tiene verdadero diámetro. Los senos de Valsalva se pueden medir con el método seno-comisura (línea desde la porción más profunda de un seno a la comisura opuesta a través del centro) o seno-seno (línea del centro de un seno al centro del seno adyacente). Idealmente, se deben notificar las 3líneas obtenidas, o en su defecto, la más larga. La técnica utilizada para medir los senos de Valsalva debe ser especificada en el informe3.
Troncos supraaórticosDistinguimos 3tipos de configuración de arco aórtico según la posición de la arteria innominada. En el tipo i, los 3troncos supraaórticos se originan en el mismo plano horizontal a la altura de la curvatura externa del arco. En el tipo ii, la arteria innominada nace entre los planos horizontales de la curvatura externa e interna del arco y en el tipo III sale por debajo del plano horizontal de la curvatura interna del arco. Otros términos para describir la morfología del arco se consideran subjetivos y no se deben usar1,4.
Las variantes anatómicas más frecuentes a tener en consideración son:
- –
Origen común del tronco braquiocefálico y la arteria carótida común izquierda o arco bovino (este último término debe ser evitado a favor del primero más descriptivo).
- –
Nacimiento independiente de la arteria vertebral izquierda (típicamente entre arteria carótida común izquierda y arteria subclavia izquierda).
- –
Arteria subclavia derecha aberrante (importante reflejar su ausencia en el informe).
- –
Hipoplasia de las arterias vertebrales y la hipoplasia del segmento V4 distal al origen de la arteria cerebelosa posterior inferior (relevante para perfundir la arteria vertebral izquierda durante el tiempo de perfusión cerebral)6.
Se deben valorar arterias femorales comunes, axilares, subclavias y ejes carotídeos. Se requiere un diámetro mínimo de 6mm en arterias femorales comunes e ilíacas externas para la colocación de la endoprótesis1.
Arterias coronariasLas variaciones anatómicas de las arterias coronarias tienen gran importancia en los procedimientos quirúrgicos. Es importante comprobar su nacimiento de los senos aórticos correspondientes y señalar cualquier anomalía o variante anatómica observada, especialmente, el origen de las arterias coronarias en sus senos opuestos con recorrido intramural.
Signos de malperfusión visceralLa disección puede extenderse a ramas viscerales provocando un síndrome de malperfusión, con signos de isquemia hepática, esplénica, renal o mesentérica. Se produce por 2mecanismos: estático, en el que el flap se introduce en la rama vascular, y dinámico, en el que el flap cubre el origen del vaso como una cortina. La malperfusión es uno de los factores pronósticos más importantes en la disección y su notificación en el informe es obligada4.
ConclusiónEn este apartado, recalcaremos los signos de rotura aórtica si los hubiera (hemopericardio), el tipo de disección, la localización de la puerta de entrada y los signos de malperfusión2.
Tromboembolismo pulmonarLa enfermedad tromboembólica venosa que se presenta como trombosis venosa profunda o tromboembolismo pulmonar (TEP) es la tercera urgencia cardiovascular en frecuencia, después del infarto de miocardio y el ictus. Causa al menos 300.000 muertes al año en Estados Unidos y genera considerables gastos hospitalarios. La tasa de incidencia anual de la embolia pulmonar es de 39-115 cada 100.000 habitantes, con un aumento de las tasas de incidencia anual en las poblaciones envejecidas de Europa y otras partes del mundo7.
La Sociedad Europea de Cardiología (ESC) incluyó en la guía clínica de 2014 la angio-TCMD de tórax como modalidad de imagen de referencia en pacientes con sospecha de TEP, tras la evaluación clínica inicial8. Permite la adecuada visualización de las arterias pulmonares hasta el nivel subsegmentario, con una sensibilidad del 83% y una especificidad del 96%7. El incremento de las peticiones de angio-TC pulmonar en la práctica clínica diaria justifica el objetivo de realizar un informe estructurado que facilite la labor del radiólogo (tabla 2).
Propuesta de informe estructurado para TEP
| Encabezado | Datos clínicos aportadosTécnica y el contraste utilizadoExistencia de estudios previos comparativos |
| Hallazgos | |
| Defectos de repleción | Arterias pulmonares centrales (D/I), lobares o segmentarias (LSD, LM, LID, LSI, LII) |
| Parénquima pulmonar | Localización por lóbulos de:Infarto pulmonarOpacidad en vidrio deslustradoAtelectasia subsegmentaria |
| Derrame pleural | Sí/no |
| Valoración de la carga de trombo en ambos pulmones | Índice Ghanima derecho e izquierdo (1/2/3/4) |
| Signos de sobrecarga de ventrículo derecho | Diámetro de los vasos arteriales pulmonares: tronco de la arteria pulmonar (mm), arteria pulmonar derecha (mm) e izquierda (mm)Cociente VD/VI (menor a 1, igual o mayor a 1)Reflujo a VCI y venas suprahepáticas (sí/no)Morfología del septo interventricular (normal, rectificado, invertido) |
| Otros hallazgos | MediastinoAbdomen superiorPlanos musculares y partes blandas. Estructuras óseas |
| Conclusión | Sin hallazgos de TEP agudoTEP agudo central/lobar/segmentario, sin/con signos de sobrecarga derecha (índice Ghanima D/I) |
D: derecha; I: izquierda; LSD: lóbulo superior derecho; LM: lóbulo medio; LID: lóbulo inferior derecho; LSI: lóbulo superior izquierdo; LII: lóbulo inferior izquierdo; VD: ventrículo derecho; VI: ventrículo izquierdo; VCI: vena cava inferior; TEP: tromboembolismo pulmonar.
La adquisición debe incluir desde vértices pulmonares a senos costofrénicos, técnica de seguimiento del bolo en la arteria pulmonar principal, con contraste de alta concentración (≥ 350mg I/ml) e infundido a alta velocidad (4ml/s) para asegurar un realce óptimo de los vasos pulmonares arteriales.
Diagnóstico de embolia pulmonarSe basa principalmente en la identificación de defectos de repleción que ocupan la luz arterial de forma parcial o completa, que pueden asociar o no hallazgos parenquimatosos o pleurales.
- –
Signos directos o vasculares: los trombos aparecen como estructuras de baja atenuación en la luz vascular.
- a.
Defecto de llenado completo del vaso con aumento de su diámetro, si comparamos con arterias contralaterales, debido al trombo impactado.
- b.
Defecto de llenado parcial con contraste intravenoso rodeando al trombo (signo del anillo y signo del tranvía, si vemos el vaso en su eje transversal o en su eje longitudinal, respectivamente).
- c.
Defecto de llenado periférico formando ángulo agudo con la pared del vaso.
- –
Signos parenquimatosos:
- a.
Infartos: consolidaciones periféricas triangulares o en forma de cuña, con base pleural por trombos en arterias periféricas. Presentan un centro de menor densidad y no captan contraste. La presencia del signo vascular (vaso trombosado dilatado que se dirige al vértice de la consolidación) aumenta la especificidad para el diagnóstico de infarto.
- b.
Opacidades en vidrio deslustrado: corresponden a hemorragia por la isquemia transitoria y posterior reperfusión por circulación bronquial.
- c.
Atelectasias subsegmentarias secundarias a alteraciones del surfactante.
- –
Derrame pleural: el TEP es la cuarta causa más frecuente de derrame pleural, tras la insuficiencia cardíaca congestiva, las neumonías y las neoplasias. Su aparición se debe a un aumento de la permeabilidad vascular, tanto por la isquemia distal a la zona embolizada, como por la liberación de citocinas inflamatorias.
Mediante la angio-TCMD, se definen 2tipos de criterios morfológicos para estimar la gravedad del TEP agudo (fig. 2):
- –
Cuantificación del grado de obstrucción del lecho arterial pulmonar mediante diferentes escalas, de modo que un índice de obstrucción estimado mayor del 60% se asocia a aumento de mortalidad. Se han publicado diferentes sistemas propuestos por Miller (1971), Walsh (1973), Qanadli (2001) y Mastora (2003) de difícil aplicación en la práctica clínica9, por lo que rutinariamente no se establece el índice de obstrucción. Se propone incluir el índice de Ghanima como medida del grado de obstrucción vascular. Se basa en la extensión proximal del trombo con relación al árbol arterial pulmonar que se subdivide en 4componentes. La puntuación establece 4niveles de gravedad (1 a 4) y se calcula según el vaso afectado de mayor calibre en cada pulmón: arterias mediastínicas (4 puntos), arterias lobares (3 puntos), arterias segmentarias (2 puntos) y subsegmentarias (1 punto)8,9.
- –
La presencia de signos de sobrecarga ventricular derecha, que incluyen:
- a.
Cociente ventrículo derecho (VD)/ventrículo izquierdo (VI). Se produce crecimiento del diámetro del eje corto de VD, disminución del eje corto del VI, que se traduce en un cociente ventricular VD/VI ≥ 1. Las medidas se obtienen en el plano axial, desde el margen endocárdico de la pared libre al tabique interventricular. Es la única variable aceptada para estratificar el riesgo de la TEP en las guías de la ESC10.
- b.
Rectificación o desplazamiento del tabique interventricular. Tanto el aplanamiento como la inversión (desplazamiento hacia la izquierda) del septo interventricular se consideran signos de disfunción del ventrículo derecho. Se considera un indicador de TEP grave, sobre todo si se asocia con grosor de pared del VD ≤ 4mm. Un engrosamiento de la pared del VD > 6mm se asocia a hipertensión pulmonar crónica.
- c.
Aumento de tamaño del tronco de la arteria pulmonar. Un diámetro de la arteria pulmonar principal ≥ 29mm es indicador moderadamente específico de hipertensión pulmonar, aunque con una sensibilidad limitada. Una dilatación asimétrica de las arterias principales sugiere hipertensión pulmonar tromboembólica crónica.
- d.
Reflujo de contraste a vena cava inferior y venas suprahepáticas. Es un signo indirecto de insuficiencia valvular tricuspídea y elevación de la presión de aurícula derecha, con sensibilidad del 90% y especificidad del 100%. Se trata de otra de las manifestaciones de fallo del corazón derecho, que ha sido descrito como predictor de mortalidad en pacientes con embolia pulmonar grave11.
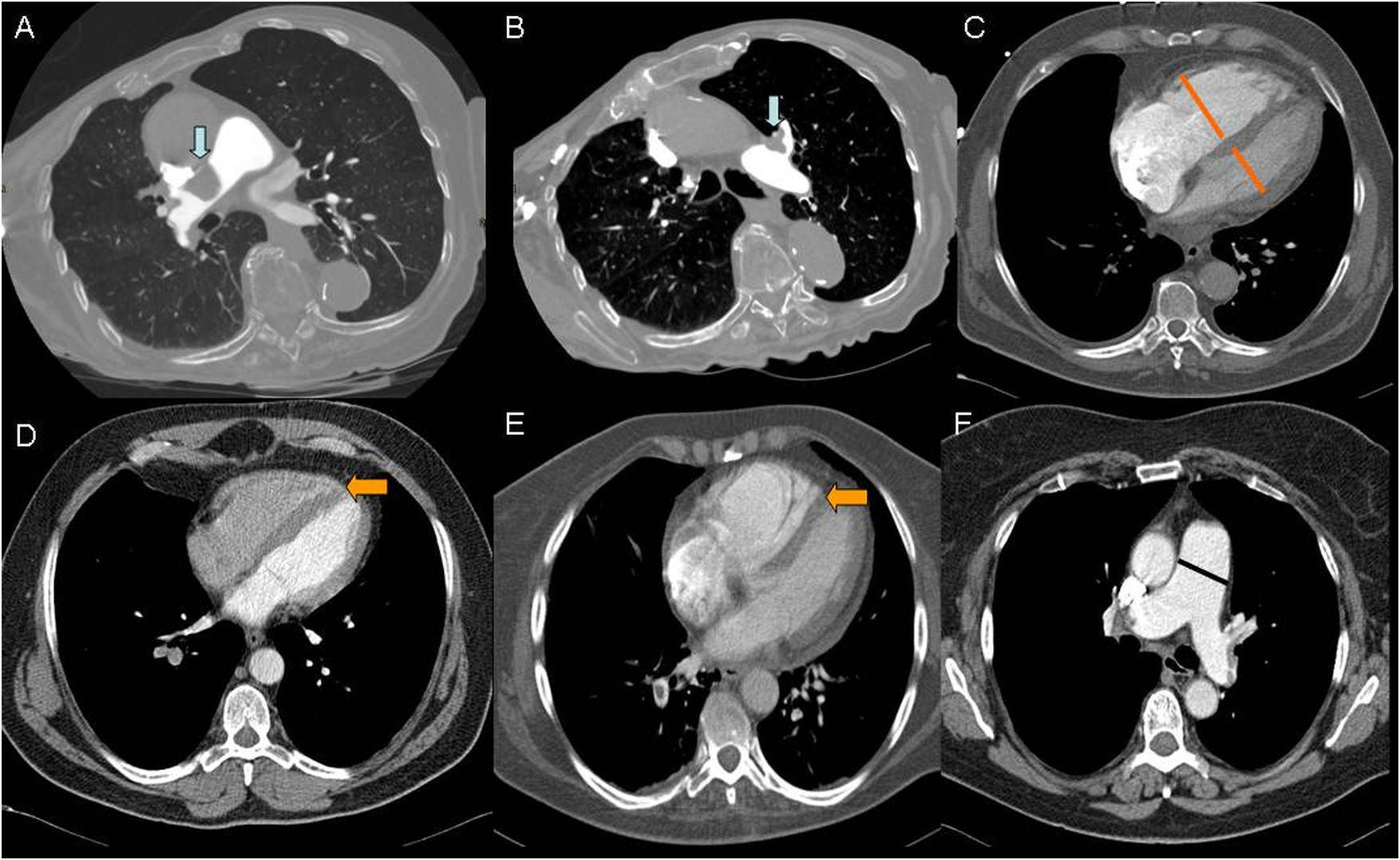
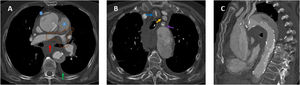
Cortes axiales de angiotomografía multidetector. Índice 4 de Ghanima con trombo central derecho (flecha azul en imagen A). Índice de Ghanima 3 con trombo en arteria lobar de lóbulo superior izquierdo (flecha azul en imagen B). Medidas de ventrículo derecho e izquierdo para cálculo del cociente VD/VI (líneas naranjas en C). Septo interventricular rectificado (flecha naranja en imagen D). Septo interventricular invertido (flecha naranja en imagen E). Medida de la arteria pulmonar principal (línea negra en imagen F).
El objetivo es responder a la pregunta clínica con la máxima claridad y comprensión, con frases cortas y bien estructuradas12.
- –
Estudio negativo para TEP agudo.
- –
TEP agudo central/lobar/segmentario, sin/con signos de sobrecarga derecha.
La hemoptisis se define como la expectoración de sangre procedente del árbol tráqueo-bronquial y los alvéolos. La mayoría de las hemoptisis son autolimitadas, pero aproximadamente un 5% constituirá una amenaza para la vida del paciente.
Actualmente se considera más correcto clasificar la gravedad de la hemoptisis en función de su repercusión clínica en amenazante y no amenazante. Consideramos amenazante cualquier volumen de sangre expectorada capaz de poner en riesgo la vida del enfermo de forma inmediata, siendo la asfixia la causa del fallecimiento, más que la pérdida de sangre13. La hemoptisis amenazante se subdivide en inestable o estable.
La angio-TCMD es la modalidad de imagen de elección para la valoración de la hemoptisis amenazante no inestable, siendo la técnica más eficiente en identificar la causa de la hemoptisis y ayuda en la planificación del tratamiento intravascular13 (tabla 3).
Propuesta de informe estructurado para la hemoptisis
| Encabezado | Datos clínicosTécnica y el contraste utilizadoEstudios previos comparativos | |
| Hallazgos | ||
| 1. Signos de hemorragia alveolar | Sí/noOpacidad en vidrio deslustradoConsolidaciónEngrosamientos septales | Distribución:Unilateral/bilateralDifusa/parcheadaCentral/periféricaLocalización:Lóbulos afectos (LSD, LM, LID, LSI y LII) |
| 2. Signos de hemorragia de la vía aérea | Sí/noDefectos de repleción árbol bronquial centralAtelectasiasNódulos centrolobulillares (árbol en brote) | Localización:Tráquea, árbol bronquial central o periféricoLóbulos afectos |
| 3. Signos vasculares | Sí/no. ¿Cuál? | |
| Hipertrofia vascular | Arterias patológicas:Arterias bronquiales ortotópicasArterias bronquiales ectópicasArterias sistémicas no bronquiales | NúmeroOrigen y recorridoDiámetro máximo |
| Seudoaneurisma | Arterias pulmonaresArterias bronquiales | LocalizaciónDiámetroRelación con el árbol bronquial |
| Malformación y fístula arterio-venosas | LocalizaciónAporte arterial, describir arteria nutricia y su tamañoVena de drenaje, recorrido y tamaño.Nido | |
| 4. Lesión culpable | InfecciónTumorBronquiectasiasFibrosis quísticaBronquiolitoIatrogenia, traumatismo | |
| Otros hallazgos | MediastinoAbdomen superiorPlanos musculares y partes blandasEstructuras óseas | |
| Conclusión | Signos de hemorragia alveolar o en la vía aéreaSignos vasculares primarios subsidiarios de tratamientoLesión culpable |
LSD: lóbulo superior derecho; LM: lóbulo medio; LID: lóbulo inferior derecho; LSI: lóbulo superior izquierdo; LII: lóbulo inferior izquierdo.
Las causas más frecuentes de la hemoptisis en Occidente son el carcinoma broncogénico, las bronquiectasias y la aspergilosis, mientras que en los países no occidentales es la tuberculosis.
TécnicaSe recomienda la realización de angio-TCMD en fase arterial sistémica colocando el ROI (region of interest) en el tercio medio de la aorta torácica descendente, lo que asegura una correcta opacificación de las arterias bronquiales, responsables del sangrado en el 90% de los casos de hemoptisis que requieren embolización13. Las arterias pulmonares, responsables del 10% de los sangrados, también se rellenarán correctamente en esta adquisición. Se recomienda no administrar un bolo de suero salino después de la inyección del contraste para evitar la dilución del contraste y usar mayor cantidad de contraste (110-125ml), para lograr una mejor opacificación de las arterias pulmonares14.
Debe incluir la base del cuello hasta la altura de las arterias renales (L2), porque las arterias responsables de la hemoptisis pueden tener su origen en los troncos supraaórticos o en las arterias del abdomen superior, como la arteria frénica inferior o ramas del tronco celíaco.
Valoraremos las imágenes adquiridas con reconstrucciones multiparamétricas, maximum intensity projection (MIP) y 3D. En algunos pacientes, se puede completar el estudio con fase venosa para mejor valoración de tumores o infecciones, pero no está indicada de rutina.
HallazgosIdentificar sangre en los alvéolos y vía aéreaLa sangre en los alvéolos se manifiesta como una opacidad en vidrio deslustrado o consolidación. Cuando la hemorragia es subaguda, también podemos ver engrosamientos septales (patrón en empedrado).
La sangre en el árbol bronquial central se observa como defectos de repleción, en algunos casos de atenuación elevada superior a las 40 UH, lo que permite diferenciarlo del moco. Esta obstrucción de la vía aérea puede dar lugar a atelectasias. La sangre en la vía aérea distal aparece como nódulos centrolobulillares, que pueden adquirir apariencia de árbol en brote.
Identificar el mecanismo de la hemoptisisPuede deberse a causas vasculares primarias o secundarias.
Causas primariasHipertrofia vascular crónicaLos pulmones reciben una doble vascularización arterial, un 99% de arterias pulmonares y el restante por arterias bronquiales. En la mayoría de los casos de hemoptisis (90%) están implicadas las arterias bronquiales, pero también puede tener su origen en arterias sistémicas no bronquiales o, en raras ocasiones, en las arterias pulmonares.
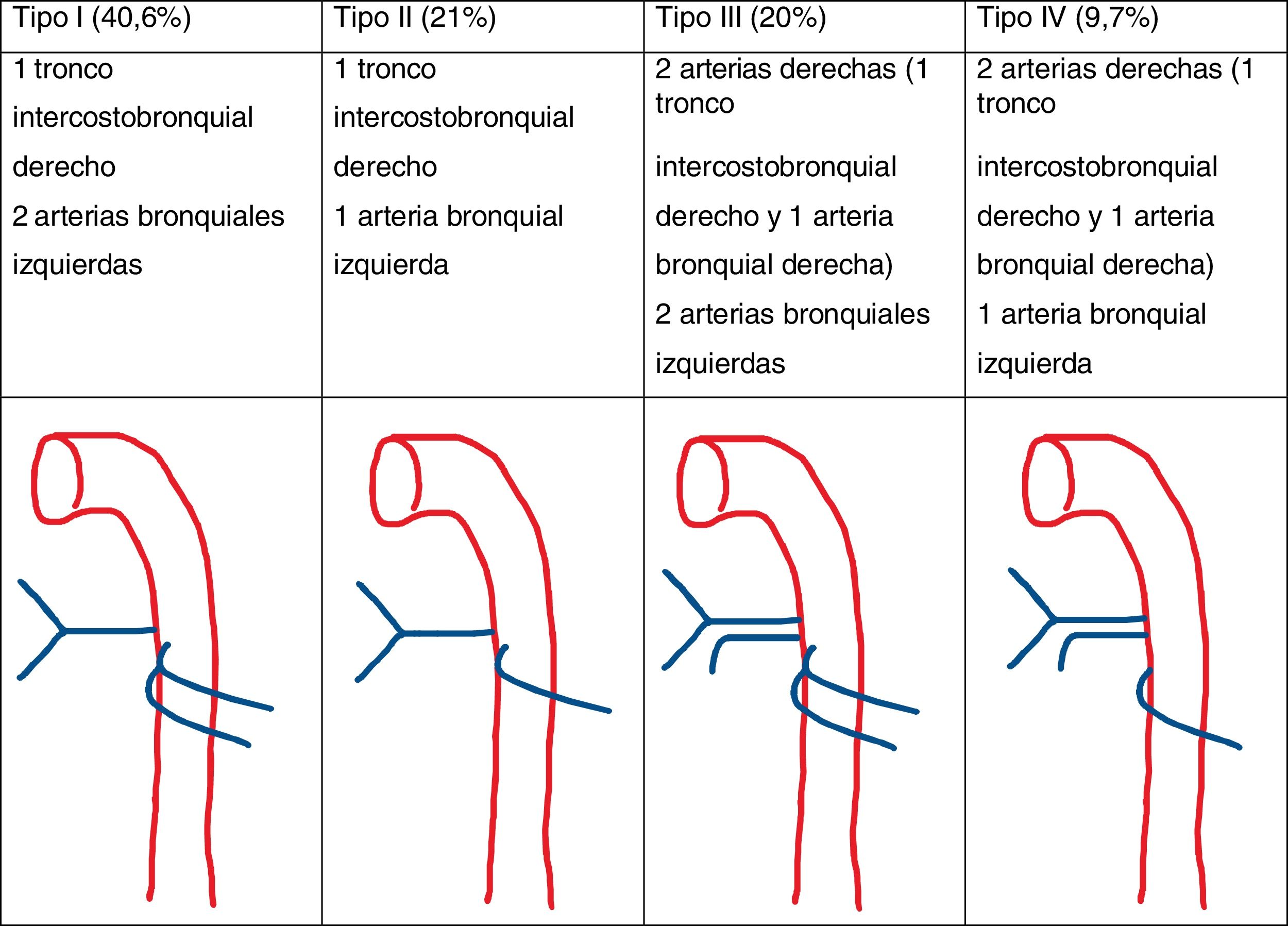
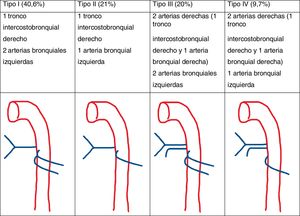
Las arterias bronquiales ortotópicas nacen de la aorta torácica descendente a la altura de la carina traqueal (T5-T6). Su disposición es variable, pero lo más común, es que haya una bronquial derecha y 2izquierdas (fig. 3)15.
Las arterias bronquiales ectópicas son las que nacen fuera del segmento de la aorta torácica descendente situado a la altura de la carina traqueal. La mayoría nacen de la cara inferior del cayado aórtico, pero otros sitios potenciales son el tronco braquiocefálico, arteria subclavia, tronco tirocervical, mamaria interna, intercostales o incluso las coronarias. Estas también siguen el curso de los bronquios y penetran en los pulmones a través de los hilios16.
Las arterias sistémicas no bronquiales, al igual que las arterias bronquiales ectópicas, se pueden originar de cualquier vaso próximo al tórax, en arterias infradiafragmáticas, troncos supraaórticos o en sus ramas, pero a diferencia de las arterias bronquiales, no penetran en el parénquima pulmonar a través del hilio siguiendo los bronquios, sino que lo hacen a través de adherencias pleurales o del ligamento pulmonar inferior17.
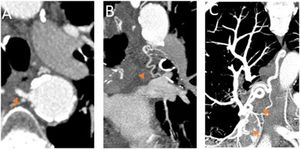
Las arterias bronquiales normales miden menos de 2mm proximalmente y menos de 0,5mm distalmente, cuando se introducen en el hilio siguiendo el árbol bronquial. Se consideran patológicas si superan estos límites, son tortuosas y se logra visualizar el vaso en todo su trayecto14–18 (fig. 4).
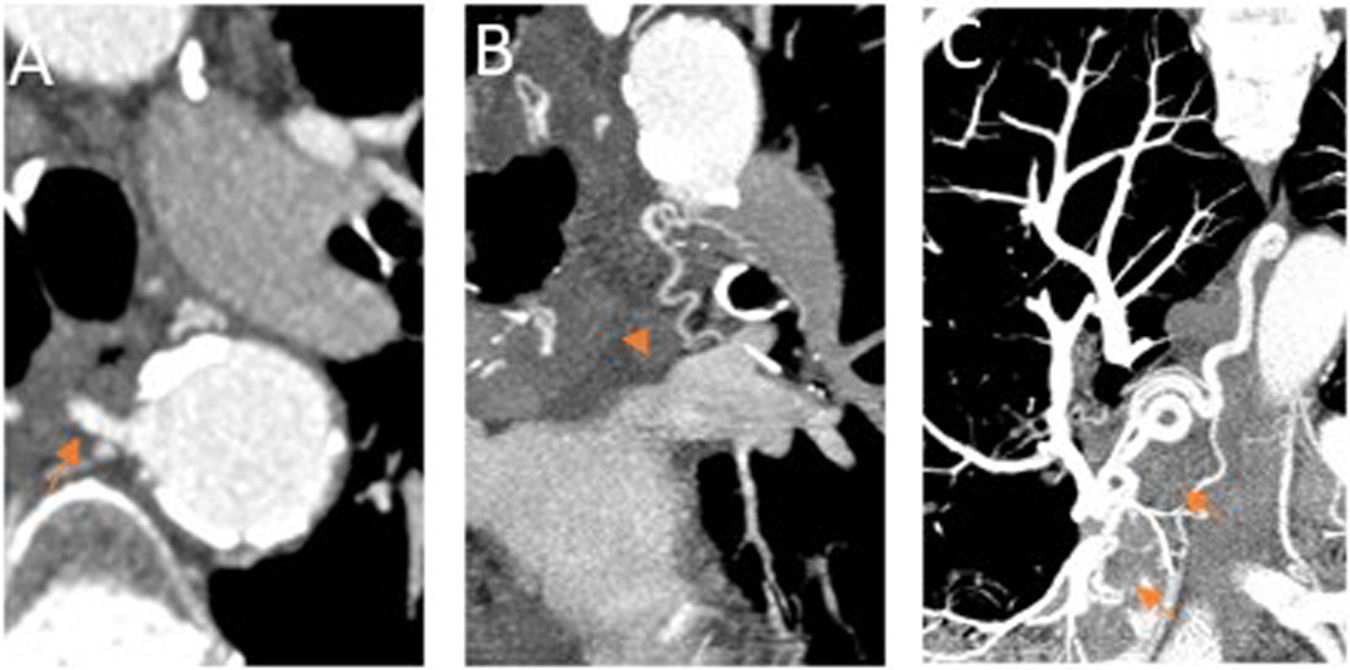
Arterias bronquiales patológicas. angio-TCMD en fase arterial sistémica.
A) Corte axial en el que se identifica una dilatación de la arteria bronquial derecha en su origen, mayor de 2mm (flecha naranja). B y C) Corte coronal y MIP (proyección de máxima intensidad). B) Se observa la arteria bronquial izquierda dilatada y tortuosa en el hilio pulmonar (punta de flecha). C) se visualiza la arteria bronquial derecha ortotópica dilatada y tortuosa, visible en todo su trayecto (flechas cortas).
Para las arterias sistémicas no bronquiales no existe un umbral en su tamaño para considerarlas patológicas. Su identificación en la tomografía computarizada implica reclutamiento de vasos sistémicos colaterales no anatómicos.
La hipertrofia vascular puede estar causada por hipoxia crónica, inflamación o tumores.
Lesión vascularSeudoaneurisma de las arterias pulmonares y, más raro, de arterias bronquiales19. Las causas son las infecciones (más común), tumores, vasculitis, iatrogénico o traumático.
Secuestro pulmonarSangrado de arterias sistémicas que vascularizan el secuestro20.
Malformación y fístula arteriovenosasRotura de vasos implicados21.
Hemorragia alveolar difusaPor sangrado capilar. Puede tener causas inmunes (vasculitis) y no inmunes, como la anticoagulación o la estenosis mitral.
Causas secundariasDestrucción del parénquimaCausada por infección o necrosis tumoral.
Invasión de la vía aéreaCausada por tumores, bronquiolitos o cuerpo extraño.
Identificar el mecanismo de la hemoptisis es importante por sus implicaciones terapéuticas, ayudando a definir qué pacientes son subsidiarios de tratamiento endovascular o quirúrgico, como en la hipertrofia vascular, seudoaneurismas, malformaciones y fístulas AV.
Algunas causas como la neumonía o los tumores, pueden implicar varios mecanismos14.
ConclusiónSe hará énfasis en la presencia de:
- –
Causas vasculares primarias subsidiarias vasculares primarios subsidiario de tratamiento intravascular o quirúrgico.
- –
Lesión culpable (infecciones, tumor, etc.).
- –
Signos de hemorragia alveolar o en la vía aérea.
- 1.
Responsable de la integridad del estudio: SOV, ADT y MLPG.
- 2.
Concepción del estudio: SOV, ADT y MLPG.
- 3.
Diseño del estudio: SOV, ADT y MLPG.
- 4.
Obtención de los datos: SOV, ADT y, MLPG.
- 5.
Análisis e interpretación de los datos: SOV, ADT y MLPG.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: SOV, ADT y MLPG.
- 8.
Redacción del trabajo: SOV, ADT y MLPG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SOV, ADT y MLPG.
- 10.
Aprobación de la versión final: SOV, ADT y MLPG.
Los autores declaran no tener ningún conflicto de intereses.