La eritromicina es el primer representante de los antibióticos del grupo de los macrólidos. Su descubrimiento fue anunciado en 1952 por Mc Guire et al, los cuales mostraron sus propiedades físicas, químicas, así como su actividad antibacteriana.
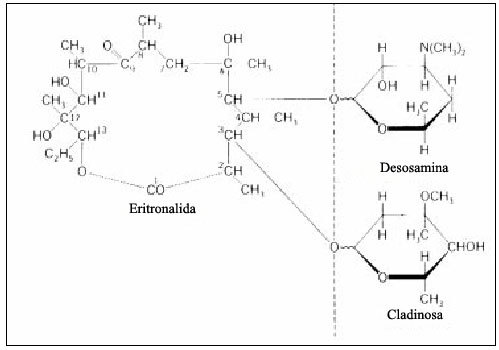
Fig. 1. Estructura química de la eritromicina.
La eritromicina, según Tidwell y Lewis, puede utilizarse como sustituto de la penicilina como un antibiótico profiláctico en la supresión de la infección de estreptococo B hemolítico
Cuando se extrae con reactivos adecuados del filtrado, el antibiótico se obtiene en forma cristalina como un compuesto básico de color blanco o amarillo suave, soluble en agua hasta 2 mg por ml, aunque es muy soluble en alcohol y otros solventes orgánicos como acetona, cloroformo, acetonitrilo y acetato de etilo.
La eritromicina es una polihidroxicetolactona cuya fórmula molecular es C37H67NO13 y su peso molecular es 733. En su molécula hay un aminoazúcar, desosamina y un azúcar sin nitrógeno, que es la cladinosa, unidos ambos a un anillo lactónico macrocíclico. En solución saturada acuosa posee un pH de 9. La absorción máxima de la eritromicina A al UV es a 278 nm.
Usos
La eritromicina se emplea tanto en forma de base como en forma de ésteres. Es un antibiótico que ha sido utilizado con éxito en el tratamiento de varias infecciones bacterianas. Se han realizado estudios por Batterman y Mouratiff en una gran variedad de infecciones comunes en las vías respiratorias. Su espectro abarca fundamentalmente bacterias grampositivas y algunas gramnegativas e incluye actinomicetos, treponemas, micoplasmas, clamidias y rickettsias. A pesar de su menor actividad como regla general sobre los gramnegativos, se muestra eficaz frente a algunas especies, constituyendo incluso el tratamiento de elección de las infecciones producidas por Legionella, Bordetella, Campylobacter y Helicobacter. Sus principales limitaciones derivan de alguna de sus propiedades farmacocinéticas (inactivación del antibiótico a pH ácido, vida media de eliminación corta, interacciones medicamentosas con teofilina, ciclosporina, digoxina, warfarina, etc.), el rápido desarrollo de resistencias y su limitada actividad frente a Haemophilus influenzae.
Se puede utilizar con éxito en infecciones tales como faringitis, fiebre escarlatina, neumonía, septicemia, otitis media y sinusitis. Se emplea igualmente para el tratamiento de la amebiasis intestinal, ya que raramente altera la flora intestinal. También se aconseja su empleo en el tratamiento de la pulmonía, pneumopleuresía, escarlatina, erisipela, sepsis, otitis supurativa, anginas, tonsilitis, laringitis, carbúnculo, infecciones traumáticas y otras.
Mouratiff y Bell encuentran que la eritromicina es útil en el tratamiento de la pielonefritis, cistitis u otros tipos de infecciones en el aparato genitourinario.
La eritromicina resulta útil mediante un tratamiento temporal en los casos de erupciones misceláneas en la piel, según observan Johnson y Schuster. Las erupciones pueden ser acné vulgar u otras infecciones bacterianas. Las reacciones adversas son menores que con el uso de otros antibióticos y las reacciones que pudieran resultar colaterales, desaparecen con el cese de la administración del fármaco y en muchos casos al volver a administrar el antibiótico, los síntomas adversos no aparecen.
La eritromicina, según Tidwell y Lewis, puede utilizarse como sustituto de la penicilina como un antibiótico profiláctico en la supresión de la infección de estreptococo B hemolítico. Esta observación también la hace Semich, el cual recomienda el uso de la eritromicina en las infecciones causadas por estafilococos resistentes a la penicilina.
La eritromicina forma sales con los ácidos,pero ensayos preliminares indican que se inactiva
en gran medida a pH bajos
Microbiología
En sus estudios microbiológicos, Haight y Maxwell observan que el resultado de los testigos in vitro mostraban que los organismos grampositivos incluyendo cepas de Micrococus pyogenes var aureus, que son resistentes a otros antibióticos, resultan altamente sensibles a la eritromicina, siendo inhibidas por concentraciones de menos de 1 µg/cm3.
Kuschinsky y Lüllmann plantean que su espectro antimicrobiano se debe colocar entre el de la penicilina y el de la tetraciclina.
Según Powell y Bonience, la eritromicina demuestra actividad contra los virus como la meningoneumonitis, lymphogranuloma venereum y tifus epidémico.
Cepas de algunos microorganismos gramnegativos como la Neisseria, Hemophilus y Brucella y ciertas micobacterias eran también sensibles y fueron inhibidas por concentraciones de 6 µg o menos por cm3.
Matthew y Howard comprueban que la eritromicina resulta muy activa contra estreptococos, actinomicetos, corynabacteria, clostridia y estafilococus aureus, sean o no sensibles o resistentes a otros antibióticos.
La eritromicina es más potente contra los cultivos de Bacillus cereus, Bacillus subtilis, Clostridium tetanii, Escherichia coli, Klebsiella pneumoniae, M. pyogenes var. Aureus, Mycobacterium smegmatis, Nocardia asteroides y Serratia marcescens.
Tinker y Husa encuentran que la actividad antibacteriana de la eritromicina cuando se utiliza en ungüento del tipo de petrolato se mejora por la incorporación de ácidos benzoico y salicílico, calamina, cloruro mercurioso, fenol y óxido de cinc aunque con estos dos últimos compuestos la actividad de la eritromicina decae en el transcurso de una semana.
Según Haight y Maxwell, la eritromicina es más activa en un medio moderadamente alcalino pues la sensibilidad de una cepa se aumenta progresivamente cuando se incrementa el nivel de pH de 5,5 a 8,5. Se estudia la efectividad con otros antimicrobianos orales recientes, mostrándose una menor actividad que la azitromicina y claritromicina frente a la Eikenella corrodens. Sin embargo la eritromicina muestra buena eficacia en comparación con la azitromicina respecto a infecciones de neumonía adquirida aunque la azitromicina posee la gran ventaja de un corto tratamiento para obtener iguales resultados.
Farmacología. Modo de acción
En sus diversos trabajos Dipalma encontró que la eritromicina inhibe la formación de la unión del péptido entre el aminoácido en el RNAt y la cadena de péptidos que crecen, al igual que el cloranfenicol y lincomicina. Estas tres drogas, aunque químicamente diferentes, tienen una acción similar en la inhibición de la síntesis de proteínas. El mecanismo de acción de la eritromicina frente a las bacterias gramnegativas se ve disminuido debido a la incapacidad del antibiótico a penetrar a través de la pared celular. A bajas concentraciones es bacteriostático, y a altas concentraciones es bactericida.
McGuire, Bunch y Anderson encontraron que el LD50 de la eritromicina, administrándose por vía subcutánea, es de 1 800 mg/kg.
No tiene efecto significativo en el sistema cardiovascular ni en la composición de la sangre; no cambia la función hepática y durante una administración prolongada no hay efecto vascular; sin embargo, administrándose i.m., se observa una moderada acción irritante local.
Farmacología. Absorción
Durante su trabajo, Sylvester y Josselyn necesitaron proteger eritromicina contra la secresión gástrica. Cuando no se hacía esta protección, la droga era destruida debido al medio ácido o su acción bloqueada si ésta era administrada con o después de las comidas. Ricci y Cervini observan que en medio alcalino se absorbe con facilidad y se difunde rápidamente en sangre.
Una vez absorbida, se excreta rápidamente con la bilis aunque también se encuentra en orina. Se difunde fácilmente en el líquido pleural y ascítico, atraviesa la placenta y también el líquido cerebro espinal en dependencia del ritmo de administración.
Toxicidad
En sus investigaciones, Anderson y Harris encuentran la eritromicina en sangre, orina, heces y fluidos cerebroespinales de perros, ratas, etc., que reciben la droga oral.
Estos investigadores observan que los primeros síntomas tóxicos son pocos y benignos (diarrea en pequeño número de pacientes). Cuando se administra durante dos años sólo se observa una resistencia ácida a las tabletas revestidas. No se determina la dosis media letal en ratas debido al gran volumen requerido.
Por vía intravenosa, la eritromicina es más tóxica que por vía subcutánea. La inyección i.v. de la dosis letal produce convulsiones, postración y depresión respiratoria.
Ricci y Cervini hicieron observaciones toxicológicas suministrando dosis 0,40,5 g en vía oral. Observaron que dosis más altas pueden provocar problemas gastrointestinales como náuseas, vómitos y excepcionalmente diarreas.
Derivados
Como se ha visto, la eritromicina resulta útil administrada en el tratamiento de diversas afecciones. Como base libre, es relativamente insoluble en agua, pero las suspensiones acuosas tienen un sabor marcadamente amargo y, por tanto, no resultan adecuadas para la administración oral, se inactivan fácilmente en medio ácido y las sales de eritromicina causan dolor en inyecciones i.m. a pesar de que se inyecte con un anestésico local.
Clark y Varner hicieron estudios acerca de este problema y encuentran que el estearato brinda un producto insoluble que elimina el sabor amargo.
Griffith estudia el propionato de eritromicina observando que in vitro es igualmente activo que la base, sus espectros son prácticamente idénticos al igual que sus potencias antibacterianas. Este autor también estudia el éster propionílico de la eritromicina viendo que tanto su efectividad así como su toxicidad eran las mismas. Con el fin de obviar las deficiencias que muestra la eritromicina, se han sintetizado una serie de nuevos macrólidos, muchos de ellos ya disponibles en España desde principios de los años noventa. Los nuevos macrólidos se obtienen, en su mayoría a partir de modificaciones del anillo lactónico de la eritromicina, dando lugar a derivados de 14, 15 y 16 átomos. Dentro de los de 14 átomos, la oleandomicina es un compuesto natural, mientras que la roxitromicina, la diritromicina y la claritromicina son derivados semisintéticos de la eritromicina. Entre los macrólidos de 15 átomos, también denominados azálidos por poseer un nitrógeno intramolecular, el único representante es la azitromicina. Dentro del grupo de los de 16 átomos se han descrito la josamicina, la espiramicina y la diacetilmidecamicina como derivados naturales y la rokitamicina y la miokamicina como derivados sintéticos.
La cromatografía en capa fina para los antibióticos recibe mayor atención que la de papel puesto que
es mucho más rápida y posee un poder de resolución mayor
Formas farmacéuticas
La eritromicina se dispensa en diversos preparados farmacéuticos, tanto en forma de base como sus ésteres. Así, tenemos tabletas de eritromicina base, que se preparan con una película, o cubierta azucarada debido a su sabor amargo. También se preparan tabletas de estearato y estolato de eritromicina y cápsulas de estolato de eritromicina y propionato laurilsulfato del antibiótico, aunque se puede fabricar en forma de gránulos, viales e inyecciones liofilizadas.
Entre las formas farmacéuticas en las que se utiliza la eritromicina están los supositorios, en los cuales, según Blissitt y Tinker, la efectividad y estabilidad del antibiótico está en dependencia de la base a escoger como soporte o vehículo. También se utilizan suspensiones orales como etilcarbonato, glucoheptonato, lactobionato, estearato, estolato, etc. Generalmente se fabrican como polvo para suspensión.
En la farmacopea de Estados Unidos, la eritromicina aparece reportada en forma de ungüento al 1% como uso antibacteriano tópico; también se utiliza como ungüento oftálmico al 0,5%. En forma de ésteres aparece como etilsuccinato para suspensión oral y tabletas, glucoheptonato de eritromicina para inyección i.v., lactobionato de eritromicina también por vía i.v. y tabletas de estearato de eritromicina.
Estabilidad
La estabilidad de la eritromicina es estudiada por Sheinaus y Lee, quienes señalan que su inestabilidad parece depender del efecto estabilizador del buffer en distintos niveles de pH. La eritromicina forma sales con los ácidos, pero ensayos preliminares indican que se inactiva en gran medida a pH bajos.
Identificación cualitativa
Fischbach y Levine disuelven la eritromicina en acetona y adicionan HClc, desarrollándose rápidamente un color que comienza por naranja, cambiando a rojo y finalmente se obtiene un púrpura subido. Si se agita con cloroformo, éste toma color púrpura también.
En la Farmacopea de Estados Unidos se identifica al antibiótico por una reacción en la cual mediante la adición de H2SO4 se desarrolla un color pardo rojizo producto de la hidrólisis con dicho ácido.
Como medio de identificación planteado por la Farmacopea británica está su punto de fusión, el cual aparece reportado como de 190-193 ºC.
Como la eritromicina presenta carbonos asimétricos producto de los azúcares que contiene en su estructura, se le puede determinar la rotación específica (25D) que se obtiene disolviendo la eritromicina en etanol al 2% p/v. El valor obtenido es de 78. También es posible identificarla en cuanto a su absorbancia al UV según plantea Horodecka y Wieclawek, los cuales determinan el antibiótico en el fermento a 236 nm.
Igualmente, se puede identificar mediante su medida de absorción en el I.R. a 10,310,7 µ, según plantea Washburn, siendo un método bastante reproducible.
Determinación cuantitativa
Basándose en el desarrollo de color que la eritromicina puede dar en presencia de diversos reactivos, Perlman utilizó el reactivo de arsenomolibdato para producir un complejo de color azul que se lee a 660 nm. En dicho método se utiliza H2SO4 para obtener la máxima sensibilidad en la determinación. Se plantea que, además del arsenomolibdato, se puede usar el reactivo de Fehling, ya que la reacción que se produce es una medida de la presencia de sustancias reductoras después del tratamiento ácido, por lo que el método no resulta bueno ya que lo que se determina es precisamente los productos de alteración de la hidrólisis ácida y no el antibiótico como tal.
La eritromicina también puede ser valorada en solución no acuosa, así como en un sistema de agua-dimetilformamida, pero estas valoraciones sólo miden la basicidad de la muestra y en la práctica no se detecta exactitud en todos los casos.
Kuzel y Woodside plantean un método de absorbancia a 236 nm mediante una hidrólisis suave previa, ácida o básica, las cuales muestran fuerte absorción en ciertas regiones del espectro. Si las soluciones de eritromicina se exponen a condiciones ácidas suaves y luego se someten a hidrólisis alcalina, no tienen el característico aumento de la absorbancia a 236 nm. Las curvas obtenidas cumplen con la Ley de Lambert-Beer en una concentración de 10 a 75 µg.
Método cromatográfico
La aplicación de diversos métodos cromatográficos permite la determinación cualitativa de forma fácil y rápida pero a veces dicha determinación no resulta satisfactoria ya que se requiere no sólo la determinación cualitativa sino también cuantitativa.
Según la Farmacopea británica, se puede identificar el estolato de eritromicina utilizando papel con técnica ascendente y como solvente metil isobutilcetona previamente lavada con solución de Na2CO3 y luego con agua destilada, revelando con Bacillus pumilus. También encontramos un trabajo de Sokolski y Ullmann en el que utilizan el papel con técnica descendente a temperatura ambiente y utilizando 10 sistemas de solventes, revelando microbiológicamente con Bacillus subtilis NRRL B971.
Vladimir Betina plantea un método para lactobionato de eritromicina donde también utiliza papel en diversos solventes con técnica ascendente, revelando con Bacillus subtilis. Se hace un estudio general con 62 antibióticos realizando una división en cuanto a los Rf encontrados con los sistemas planteados.
La cromatografía en capa fina para los antibióticos recibe mayor atención que la de papel puesto que es mucho más rápida y posee un poder de resolución mayor.
Anderson plantea un método rápido, sensible y menos sujeto a variación de temperatura. Su estudio está dirigido a los residuos azucarados que ella posee que son semejantes a los azúcares de los glicósidos y aplica la cromatografía de glicósidos descrita por Stahl utilizando cloruro de metileno-metanol-formamida (80:19:1) obteniéndose buenos resultados cuando se incluye en el solvente benceno y cantidades variables de formamida de acuerdo a la humedad ambiental. Utilizó como revelador ácido fosfomolíbdico al 10% en etanol y H2SO4 al 50% en solución acuosa.
Se han encontrado trabajos como los de Banaszek y Krowick, los cuales utilizan como soporte una mezcla de Silica Gel G y Kieselguhr G (1:1), desecando por una hora a 110 ºC, revelando con sulfato cérico 1% y ácido molíbdico 2,5% en 10% de H2SO4, llevándose a 110 ºC por unos minutos.
En los diversos trabajos cromatográficos encontrados, sólo se halló uno que determinara cuantitativamente a la eritromicina utilizando un método densitométrico para su determinación. Éste es el método presentado por Radecka y Wilson, quienes identificaron de forma específica y simultánea el estolato de eritromicina y la eritromicina base. Dichos investigadores utilizaron capa fina de Sílica Gel G buffereados con acetato de sodio 0,02N; el solvente elegido es metanol-acetato de sodio 0,02N (130:20), y su revelador es glucosa en una mezcla de ácido fosfórico (85%), agua, etanol y n-butanol (10:40:30:30), calentados durante 5 minutos a 150 ºC. Luego de reveladas las manchas, se pasan a leer en el densitómetro y se determina su concentración por referencia a una curva estándar previamente confeccionada.
Es necesario señalar que todos estos métodos cromatográficos son desarrollados para separar la eritromicina de sus ésteres, pero no aparece ningún método que reporte la separación de la eritromicina de sus productos de alteración en medio ácido, básico o neutro.
Los autores del presente trabajo procedieron a desarrollar un método cromatográfico capaz de cuantificar tanto la eritromicina como sus ésteres y posibles productos de alteración, tanto en materia prima como en producto terminado. Dicho trabajo será objeto de otra publicación futura. *
Bibliografía general
Anderson TT. Thin-Layer Chronmatography of Erythromycins. Journal of Chromatography 1964;14(1):127.
Bahal N, Nahata MC. The new macrolide antibiotics: azithromycin, clarithromycin, dirithromycin and roxithromycin. Ann Phramacother 1992;26: 46-55.
Banaszek A. Thin Layer and Column Chromatography of Erythromycins and some degradation products. Journal of Chromatography 1968;32(3):581.
Batterman RC. Responsiveness of commonly encountered respiratory infections to oral administration of Erythromycin. Antibiotics Ann 19561957;144.
Clark RC. New esters of Erythromycin. Antibiotics & Chemotherapy 1957;7(9):487.
Johson SAM. Clinical observations on the use of erythromycin in Acne vulgaris and some pyogenic skin eruptions. Antibiotics Ann 19561957; 164.
Kuzel NR. Spectrophotometric determination of Erythromycin in pharmaceutical products. Antibiotics & Chemotherapy 1954;4(2):1234.
Martindale. The Extra Pharmacopoeia 1958;1413.
Mc Guire JM. Ilotycin. A new antibiotic. Antibiotics & Chemotherapy 1952; 2:281.
Piscitelli SC, Danziger LH, Rodvold KA. Clarithromycin and azithromycin. New macrolide antibiotics. Clin Pharm 1992;11:137-52.
Radecka C. Determination of erythromycin in pharmaceutical preparations by direct densitometry after TLC. J Pharm Sci 1973;61(3):430.
Reyes JM. Revisiones de conjunto. Antibióticos 1973;1(2):68.
Satischandra PP. Oral absorption efficiency of acid-labile antibiotics from lipid-drug delivery systems. J Pharm Sci 1975;64(5):869.
Spencer RC, Wheat PF, Magee JT, Brown EH. Erithromycin resistance in streptococci. Lancet 1989;168.
Stahl E. Thin-Layer Chromatography. Academic Press 1969;862.
Teixeira N, Gomez L. Azitromicina contra eritromicina en el tratamiento de infecciones del tracto respiratorio bajo en niños. Acta Pediátrica Portuguesa 1999;31(5).
The Brittish Pharmacopeia 1973;187.
The State Pharmacopeia of the URSS;X:244.
The United States Pharmacopeia XIX;175.
Van Asselt GJ, Sloos JH, Mouton RP, Van Boven CPA, Van de Klundext JAM. Susceptibility of Streptococcus pyogenes to azithromycin, clarithromycin, erithromycin and roxithromycin in vitro. J Med Microbiol 1995;43:386-91.
Washburn W. The infrared determination of Erythromycin. J Am Pharm Assoc 1954;43(48).
Wiley, Paul F. Erythromycin, structure of. J Am Chem Soc 1957;79(22):6062.
Wolfe, Alan D. Erythromycin: mode of action. Science 1964; 143(3613):1445.