La fibromialgia (FM) es una patología crónica caracterizada por la presencia de dolor musculoesquelético generalizado que se asocia a trastornos psicológicos que afectan a la calidad de vida. En los últimos años, la estimulación transcraneal con corriente directa (tDCS) y la estimulación magnética transcraneal (TMS) se han estudiado para el abordaje del dolor crónico. El objetivo de esta revisión es determinar los efectos de la tDCS y la TMS en los síntomas característicos de los pacientes con FM.
DesarrolloSe realizó una revisión sistemática acorde a los criterios PRISMA. Se realizaron búsquedas en las bases de datos Medline, Scopus, PEDro y Cochrane Library. Se seleccionaron ensayos clínicos aleatorizados que analizaran los efectos de estas intervenciones en el dolor, el umbral de dolor a la presión, la fatiga, la ansiedad y depresión, el catastrofismo y la calidad de vida en pacientes con FM. Se incluyeron 14 estudios.
ConclusionesLa aplicación de tDCS en el córtex motor es la única intervención que ha mostrado disminuir el dolor a corto y medio plazo en pacientes con FM. La aplicación de ambas intervenciones ha mostrado mejoras en el umbral de dolor a la presión, el catastrofismo y la calidad de vida cuando se aplica en el córtex motor, y de la fatiga cuando se aplica en la corteza dorsolateral prefrontal. Los efectos de estas intervenciones en la ansiedad y depresión no son concluyentes.
Fibromyalgia syndrome (FM) is a chronic pathology characterized by widespread pain commonly associated with psychological distress affecting quality of life. In recent years, transcranial direct current stimulation (tDCS) and transcranial magnetic stimulation (TMS) have been investigated to treat chronic pain. The aim of the current review is to determine the effects of tDCS and TMS on the main symptoms of patients with FM.
DevelopmentA systematic review based on PRISMA guidelines was carried out. The search strategy was performed in Medline, Scopus, PEDro and Cochrane Library. Randomized controlled trials based on the effects of tDCS and TMS on pain, pressure pain threshold, fatigue, anxiety and depression, catastrophizing and quality of life in patients with FM were analysed. Fourteen studies were included.
ConclusionsThe application of tDCS to the motor cortex is the only intervention shown to decrease pain in the short and medium-term in patients with FM. The application of both interventions showed improvements in pressure pain threshold, catastrophizing and quality of life when applied to the motor cortex, and in fatigue when applied to the dorsolateral prefrontal cortex. The effects of these interventions on anxiety and depression are unclear.
La fibromialgia (FM) es una patología reumática crónica caracterizada por dolor musculoesquelético generalizado y disminución de los umbrales de dolor a la presión (UDP)1–3. El dolor es el síntoma principal de la FM, asociado frecuentemente con otras manifestaciones clínicas como la fatiga, ansiedad, depresión y pensamientos catastrofistas que condicionan una disminución de la calidad de vida4. A nivel global, se ha establecido una prevalencia del 2,1%5 y en España, de un 2,4% siendo más frecuente en mujeres que en hombres6. Respecto a la detección y diagnóstico de estos pacientes, no hay un método objetivo claro, siendo los criterios clínicos descritos por el American College of Rheumatology (ACR) los empleados en la actualidad7,8.
La patofisiología de la FM todavía no se conoce con exactitud, pero se asume como mecanismo clave la sensibilización del sistema nervioso central y la alteración del control de las vías del dolor9–11. La consideración de esta hipótesis ha conducido al desarrollo de múltiples métodos de tratamiento.
Los tratamientos recopilados por la guía clínica más actual para el abordaje de la FM realizada por la European League Against Rheumatism12 incluyen el uso de terapias conservadoras no farmacológicas como primera línea de actuación. Dentro de estas se incluyen el ejercicio terapéutico, la educación terapéutica y la terapia cognitivo-conductual, entre otras13,14. En los últimos años, gracias a los avances en neurorrehabilitación, se ha comenzado a desarrollar otro tipo de abordajes conservadores no farmacológicos como son la estimulación transcraneal con corriente directa (tDCS) y la estimulación magnética transcraneal (TMS)15.
Ambas técnicas neurofisiológicas son de carácter no invasivo y tienen como objetivo la modulación de la actividad cerebral y la normalización de alteraciones16. La tDCS lo realiza a través de la generación de una corriente eléctrica continua de baja intensidad (0,5-2,0mA) que pasa a través de electrodos colocados sobre el cuero cabelludo a un área específica del cerebro17, mientras que la TMS lo realiza a través de la generación de un campo magnético que pasa a través del cuero cabelludo y que induce una corriente a nivel cerebral, por lo que se considera una estimulación eléctrica por inducción electromagnética18.
En los últimos años se ha incrementado el número de estudios en los que se aplican estas técnicas de tratamiento, mostrando efectos analgésicos en patologías crónicas15. Sin embargo, sus efectos en pacientes con diagnóstico de FM no se han establecido con claridad.
El objetivo de este estudio fue realizar una revisión sistemática acerca de los efectos de la terapia conservadora no farmacológica basada en tDCS y TMS en pacientes con diagnóstico de FM en el dolor, el UDP, la fatiga, la ansiedad, la depresión, el catastrofismo y la calidad de vida.
Material y métodosEstrategia de búsquedaSe llevó a cabo una revisión sistemática siguiendo los criterios establecidos por la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)19.
Se realizaron búsquedas bibliográficas desde octubre de 2019 hasta febrero de 2020 en las bases de datos Medline (Pubmed), Physiotherapy Evidence Database (PEDro), Scopus y Cochrane Library. Las búsquedas se realizaron usando la combinación de los siguientes Medical Subjects Heading (MeSH): «fibromyalgia», «transcranial direct current stimulation», «transcranial magnetic stimulation» unidos con los operadores booleanos AND y OR y sin límite de fecha de publicación. La estrategia de búsqueda se muestra con detalle en el apéndice A.
Selección de los artículosPara que los estudios fueran incluidos, debían cumplir los siguientes criterios de inclusión basados en el método PICOS:
- •
Población: pacientes con diagnóstico de FM realizado por reumatólogos y basado en los criterios clínicos del ACR.
- •
Intervención: la intervención fue el tratamiento mediante tDCS o TMS.
- •
Comparación: otro tratamiento conservador, con técnicas placebo o no intervención.
- •
Resultados: la intensidad de dolor, el UDP, la fatiga, la ansiedad, la depresión, el catastrofismo y la calidad de vida.
- •
Diseño del estudio: ensayos clínicos aleatorizados (ECA).
- •
Lenguaje: inglés o español.
Se excluyeron los estudios si: los pacientes seleccionados presentaban patologías concomitantes como artritis reumatoide, enfermedades autoinmunes, patologías neurológicas u oncológicas, u otras enfermedades sistémicas; no se explicó el control del tratamiento farmacológico en el caso de que lo hubiera; se realizó un tratamiento multimodal; se comparó la intervención con terapias farmacológicas o quirúrgicas; no presentaban un diseño de ECA; la calidad metodológica fue menor de 5 en la escala PEDro.
Dos autores de forma independiente revisaron el título y el resumen de los artículos recuperados desde las bases de datos y aplicaron los criterios de inclusión para seleccionar los estudios potencialmente relevantes. La extracción de datos de cada uno de los estudios fue realizada por los mismos revisores de forma individual. Un tercer revisor fue el encargado de decidir en el caso de desacuerdo. Para evitar la pérdida de estudios potencialmente incluibles, se realizaron revisiones manuales de las listas bibliográficas de los estudios incluidos.
Análisis y síntesis de los datosLa lista de verificación PRISMA fue utilizada para documentar los estudios e incluir información sobre diseños de los estudios, tamaño de la muestra, características de los sujetos, protocolo de tratamiento, variables dependientes, herramientas de medición y resultados obtenidos.
Para valorar la calidad metodológica de los estudios se utilizó la escala PEDro que está basada en la lista Delphi desarrollada por Verhagen et al., del Departamento de Epidemiología de la Universidad de Maastricht. La lista Delphi contiene criterios para la calificación de la calidad de ensayos clínicos para la realización de revisiones sistemáticas según el consenso Delphi20. La escala PEDro tiene 11 ítems y el valor total es sobre 10 refiriéndose al número de criterios que se cumplen. Una mayor puntuación indica una mejor calidad metodológica. Un resultado igual o superior a 7 es considerado como calidad «alta», 5-6 es considerado como calidad «aceptable» y una calificación de 4 o inferior se considera como calidad «pobre». La escala PEDro ha mostrado ser una medida válida de calidad metodológica de ensayos clínicos y tener una alta consistencia interna (0,53), confiabilidad entre evaluadores (0,4-0,75) y fiabilidad test-retest (r=0,99)21.
Así mismo, se aplicó la escala Oxford Centre of Evidence-Based Medicine con el objetivo de determinar el nivel de evidencia de cada estudio incluido. Dicha escala se caracteriza por realizar una valoración de la evidencia basada en el área temática y el tipo de estudio. Presenta la ventaja de graduar la evidencia de acuerdo al mejor diseño para cada escenario clínico22. La extracción de datos y la calidad del estudio fueron revisados de manera independiente por los 2 mismos autores.
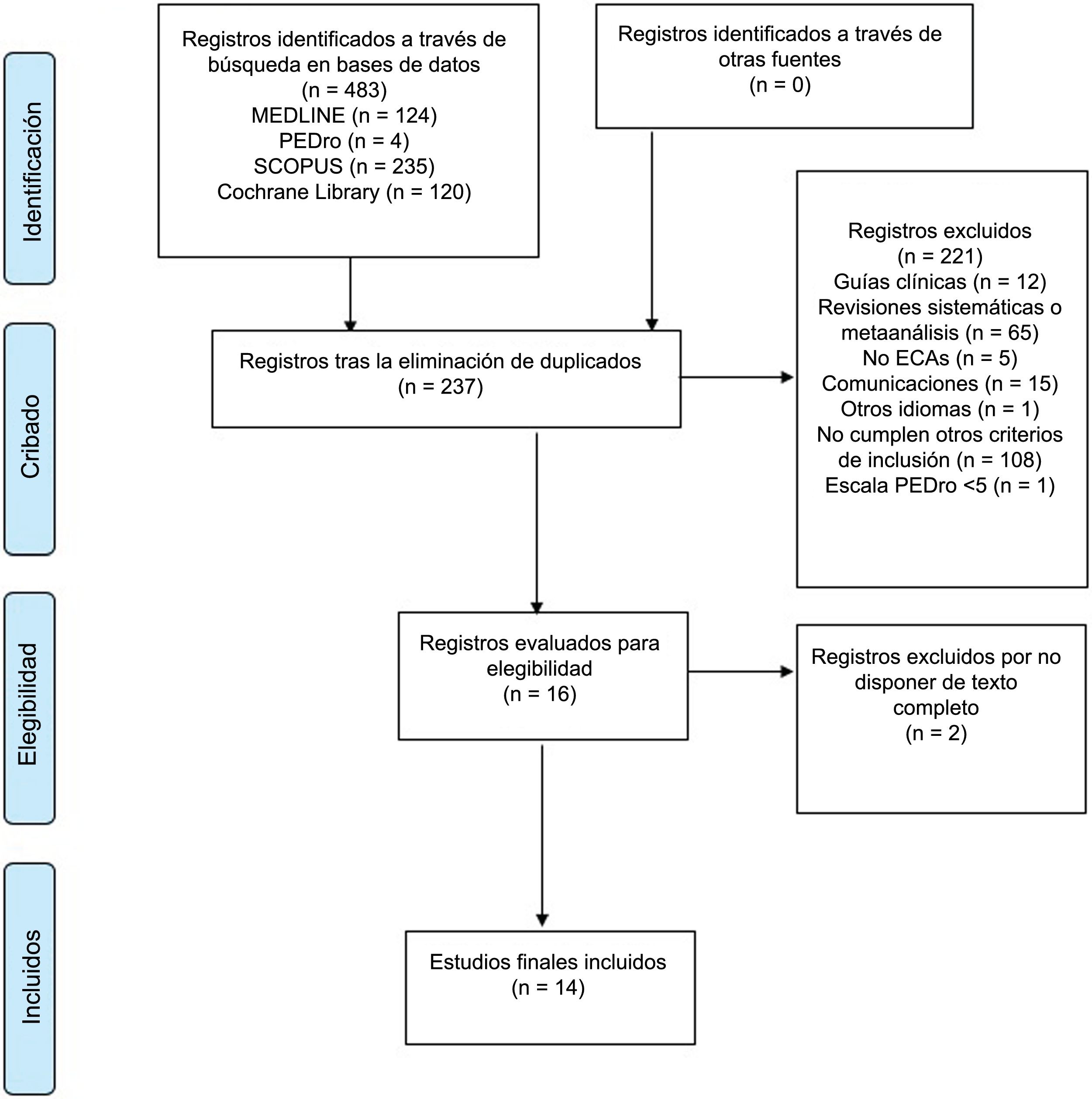
ResultadosSe obtuvieron un total de 483 estudios entre las diferentes bases de datos analizadas (124 en Medline, 4 en PEDro, 235 en Scopus y 120 en Cochrane Library). Después de eliminar los duplicados, se revisó el título y resumen de cada uno de ellos y se obtuvieron un total de 16 estudios relevantes para su revisión a texto completo. Finalmente, un total de 14 estudios que cumplieron con los criterios de inclusión fueron incluidos. El proceso de selección de los artículos se muestra en la figura 1.
Características de los estudiosUn total de 565 participantes se examinaron en los estudios incluidos en esta revisión. Se observó una gran variabilidad en el tamaño de las muestras. La mayoría de los estudios incluyeron muestras de entre 30 y 50 participantes16,23–30; únicamente 3 estudios incluyeron más de 50 participantes31–33 y solo 2 menos de 3034,35. El cálculo del tamaño muestral en la mitad de los estudios se basó en la obtención de la mínima diferencia clínicamente relevante para al menos una de las variables principales16,23–26,31,35. Los estudios fueron realizados en Europa16,23–26,31,32, América29,30, Asia27,33,35, África28 y Oceanía34. El reclutamiento de los pacientes se realizó principalmente accediendo a bases de datos de Hospitales16,23,28–31, a Servicios de Medicina Física y Rehabilitación24,27,33, a Unidades de Dolor y Servicios de Medicina Nuclear25, a Centros de Investigación34, a asociaciones de FM23,32 y mediante la publicación de anuncios en prensa23.
Entre los estudios incluidos, 6 utilizaron tDCS como intervención y 8 TMS.
La frecuencia y el número de sesiones fueron dispares. La mayoría de ellos realizaron entre 10 y 15 sesiones distribuidas en 2 o 3 semanas16,25–29,33,35: 3 estudios realizaron 8 sesiones distribuidas en 4 semanas24,31 o en 8 semanas32, 2 estudios realizaron 5 sesiones durante 5 días consecutivos23,30 y un estudio realizó 20 sesiones durante 4 semanas34. Con respecto a la duración de las sesiones, todos los estudios que usaron tDCS realizaron sesiones de 20min23,24,28–31, mientras que los estudios que usaron TMS mostraron duraciones de entre 8,533 y 30min27,32,34. En cuanto a la localización del área estimulada, 12 de los estudios incluidos emplearon el Sistema Internacional 10-20 (International 10-20 EEG system)16,23,24,26–34.
En relación con las variables dependientes y sus instrumentos de medida, 13 estudios evaluaron la intendisdad de dolor, mediante la escala númerica del dolor (NPRS)16,23–26,31,34, la escala visual anaógica (VAS)27,33,35, el cuestionario de dolor de McGill (SF-MPQ)16,26,34, el índice de dolor generalizado (WPI) y la escala de severidad de los síntomas (SS)28, y el cuestionario breve del dolor (BPI)16,26,34. Cuatro estudios valoraron el UDP mediante algometría16,25,32 y monofilamentos de Von Frey28. En 3 estudios se valoró la fatiga mediante el cuestionario multidimensional de fatiga (MFIS)24,34 y la escala de severidad de la fatiga (FSS)27. Doce estudios valoraron la ansiedad y/o depresión mediante la escala de ansiedad y depresión hospitalaria (HADS)16,23,25,26, el cuestionario de depresión de Beck (BDI)16,25–27,29–31,34,35, el cuestionario de ansiedad de Beck (BAI)34, la escala Hamilton de depresión (HAM-D)28, la escala Hamilton de ansiedad (HAM-A)28, la escala de depresión en personas mayores (GDS)29, la escala de depresión de Montgomery-Åsberg (MADRS)33, y el cuestionario de ansiedad estado-rasgo (STAI)29. Tres estudios valoraron la catastrofización a través de la escala de catastrofismo ante el dolor (PCS)24,26,34. Doce estudios valoraron la calidad de vida mediante el cuestionario de impacto de la fibromialgia (FIQ)16,23,25–27,29–32,34,35, el cuestionario de salud de 36 ítems (SF-36)23,25,27,30,34 y el cuestionario de la calidad de vida según la Organización Mundial de la Salud (WHOQOL-BREF)33.
Efectos terapéuticosDolorSeis estudios mostraron que la aplicación de tDCS en el córtex motor (M1) mejoró la intensidad de dolor a corto plazo23,24,28–31 y a medio plazo28–30 en comparación con un grupo placebo. La aplicación de tDCS en el córtex prefrontal dorsolateral (DLPFC) mostró controversia, ya que 2 estudios mostraron mejorar la intensidad de dolor a corto plazo en comparación con un grupo placebo24,29, y otros 2 no30,31.
Los resultados de la aplicación de TMS en M1 fueron controvertidos. Cinco estudios mostraron que la aplicación de TMS en M1 mejoró la intensidad de dolor a corto plazo16,26,27,32,33 y a medio plazo16,26 en comparación con un grupo placebo, mientras que 2 estudios no mostraron mejoras25,35. Por otro lado, la aplicación de TMS en DLPFC no produjo mejoras en la intensidad de dolor27,34.
Umbral de dolor a la presiónUn estudio mostró que la aplicación de tDCS en M1 mejoraba los UDP en comparación con un grupo placebo28.
Tres estudios evaluaron los efectos de la TMS en el UDP. Dos estudios mostraron que la TMS en M1 aumentó el UDP a corto plazo pero no a medio plazo en comparación con un grupo placebo16,32. Un estudio no mostró mejoras en el UDP25.
FatigaUn estudio mostró que la tDCS aplicada en DLPFC mejoró la fatiga a corto plazo en comparación con tDCS aplicada en la zona occipital y con un grupo placebo24.
Un estudio mostró que la TMS en DLPFC mejoró la fatiga a corto y a medio plazo en comparación con un grupo placebo34.
Ansiedad y depresiónSe ha mostrado controversia acerca de los efectos de la tDCS en la ansiedad y depresión. Dos estudios mostraron que la aplicación de tDCS, en M1 y DLPFC, mejoró la ansiedad y/o depresión en comparación con un grupo placebo28,31. Por otro lado, 3 estudios no mostraron mejoras con la aplicación de tDCS23,29,30.
Cinco estudios no mostraron mejoras en la ansiedad y depresión tras la aplicación de la TMS, en M1 y DLPFC, en comparación con un grupo placebo ni a corto ni a medio plazo16,25,26,33,34. Dos estudios mostraron que la TMS mejoró la depresión a corto plazo27,35 pero no a medio plazo35.
CatastrofismoUn estudio mostró que la aplicación de tDCS, en M1 o en DLPFC, mejoraba el catastrofismo a corto plazo en comparación con un grupo placebo24.
Un estudio mostró que la aplicación de TMS en M1 mejoraba el catastrofismo a corto y a medio plazo en comparación con un grupo placebo26, y otro estudio mostró que la aplicación de TMS en DLPFC no mejoraba el catastrofismo34.
Calidad de vidaCuatro estudios mostraron que la tDCS, aplicada en M1 o en DLPFC, mejoró la calidad de vida a corto plazo23,29–31 y a medio plazo cuando se aplicó en M129,30.
Siete estudios mostraron que la aplicación de TMS en M1 mejoró algunos de los subdominios de las escalas de valoración de la calidad de vida a corto plazo en comparación con un grupo placebo16,25–27,32,33,35. Un estudio mostró que la aplicación de TMS en DLPFC mejoró en algunos de los subdominios de las escalas de calidad de vida a corto plazo en comparación con un grupo placebo27 y otro no34. Los resultados de los estudios seleccionados se muestran en la tabla 1.
Resultado de los artículos incluidos
| Autor | Muestra (n) | Intervención | Intensidad | Número de sesiones / frecuencia / duración de la sesión | Variables | Resultados | Seguimiento del estudio |
|---|---|---|---|---|---|---|---|
| tDCS | |||||||
| Fagerlund et al.23 | G1: 49,04±8,63años(n=24)G2:48,17±10,56años(n=24) | G1: tDCS en M1G2: tDCS placebo | G1: intensidad de 2mAG2: intensidad de 2mA | G1: 5 sesiones en 5 días consecutivos de 20min cada unaG2: mismo procedimiento, pero estuvo activo 30s | NPRSFIQHADSSF-36 | G1 mejoró en NPRS y en FIQ con respecto al G2 (p<0,05). No se encontraron diferencias estadísticamente significativas en el resto de variables (p>0,05) | Sin datos |
| Fregni et al.30 | G1: 54,2±7,4años(n=11)G2: 54,8±9,3años (n=11)G3: 50,8±10,2años(n=10) | G1: tDCS en DLPFCG2: tDCS en M1G3: tDCS placebo | G1: intensidad de 2mAG2: intensidad de 2mAG3: intensidad de 2mA | G1 y G2: 5 sesiones en días consecutivos de 20min cada unaG3: mismo procedimiento, pero estuvo activo 30s | VASFIQSF-36BDIVAS-Ansiedad | G2 mejoró más que G1 y G3 en FIQ y los subdominios de función física y dolor corporal de SF-36 (p<0,05). G2 mostró más mejoras en la VAS en comparación con el G3 (p<0,05). No hubo diferencias entre G1 y G3 (p>0,05). No se encontraron diferencias entre los 3 grupos en el resto de variables (p>0,05) | Se mantuvieron las mejoras mostradas a 3 semanas de seguimiento |
| Yoo et al.31 | G1: 47,81±8,23años (n=21)G2: 45,76±10,80años (n=21)G3: 47,19±8,14años (n=16) | G1: tDCS en nervio occipitalG2: tDCS en DLPFC previo a nervio occipitalG3: tDCS placebo | G1: intensidad de 1,5mAG2: intensidad de 2mAG3: intensidad de 1,5mA | G1 y G2: 2 sesiones por semana con 3 días de separación durante 4 semanas. 8 sesiones en totalLa duración para G1 fue de 20min y de 40min para G2G3: mismo procedimiento, pero estuvo activo 30s | FIQBDINPRS | Hubo una mejora en NPRS y FIQ en el G1 en comparación con el G3 (p<0,05). Sin diferencias entre G2 y G3Hubo una mejora en BDI tanto en el G1 como en el G2 en comparación con el G3 (p<0,05) | Sin datos |
| Khedr et al.28 | G1: 31,3±10,9años(n=18)G2: 33,9±11,2años(n=18) | G1: tDCS en M1G2: tDCS placebo | G1: intensidad de 2mAG2: intensidad de 2mA | G1: 5 sesiones consecutivas durante 2 semanas. 10 sesiones en total de 20min cada unaG2: mismo procedimiento, pero estuvo activo 30s | WPISSVASUDPHAM-DHAM-A | G1 mejoró en WPI, en VAS, en UDP, en HAM-D y en HAM-A en comparación con el G2 al finalizar el tratamiento (p<0,05) | A 2 y 4 semanas de seguimiento, G1 mantuvo la mejoría en todas las variables en comparación con G2 (p<0,05) |
| Valle et al.29 | G1: 54,8±9,6años(n=14)G2: 54,8±9,6años(n=13)G3: 54,8±9,6años(n=14) | G1: tDCS en M1G2: tDCS en DLPFCG3: tDCS placebo | G1: intensidad de 2mAG2: intensidad de 2mAG3: intensidad de 2mA | G1 y G2: 5 sesiones consecutivas durante 2 semanas. 10 sesiones en total de 20min cada unaG3: mismo procedimiento, pero estuvo activo 30s | VASFIQBDIGDSSTAI | Se mostraron diferencias entre los 3 grupos en VAS y FIQ (p<0,05). G1 y G2 mostraron mejoras estadísticamente significativas (p<0,05). No se encontraron diferencias entre los 3 grupos en el resto de variables (p>0,05) | A uno y 2 meses de seguimiento únicamente G1 mantuvo las mejoras en la VAS (p<0,05) |
| To et al.24 | G1: 47,13±10,01años (n=15)G2: 47,81±10,17años (n=11)G3: 46,19±10,49años(n=16) | G1: tDCS en occipitalG2: tDCS en DLPFCG3: tDCS placebo | G1: intensidad de 1,5mAG2: intensidad de 1,5mAG3: intensidad de 1,5mA | G1 y G2: 2 sesiones por semana durante 4 semanas. 8 sesiones en total de 20min cada unaG3: mismo procedimiento, pero estuvo activo 10s | NPRSPCSMFIS | Se mostraron diferencias estadísticamente significativas entre los 3 grupos. G1 y G2 mostraron mejoras en NPRS y PCS en comparación con G3 (p<0,05), sin diferencias entre ambos grupos (p>0,05). G2 mostró mejoras en MFIS en comparación con G1 y G3 (p<0,05) | Sin datos |
| TMS | |||||||
| Passard et al.16 | G1: 52,6±7,9años(n=15)G2: 55,3±8,9años(n=15) | G1: TMS en M1G2: TMS placebo (bobina que replicaba el sonido de la bobina real) | G1: 25 series de 10Hz; 2.000 pulsos | 5 sesiones consecutivas durante 2 semanas. 10 sesiones en total. Duración de la sesión sin especificar | NPRSUDPSF-MPQFIQBPIHADSBDIHAM-D | G1 mejoró NPRS, UDP (epicóndilo y trocánter), SF-MPQ, FIQ y BPI (caminar, dormir y actividad general) en comparación con G2 (p<0,05). No hubo diferencias en el resto de variables (p>0,05) | A 2 semanas de seguimiento se mantuvieron las mejoras en NPRS y BPI (p<0,05), y a 5 semanas únicamente en NPRS (p<0,05) |
| Boyer et al.25 | G1: 49,1±10,6años(n=19)G2: 47,7±10,4años(n=19) | G1: TMS en M1G2: TMS placebo (bobina que replicaba el sonido de la bobina real) | G1: 20 series de 10 Hz; 2.000 pulsos | 5 sesiones consecutivas durante 2 semanas y una sesión cada 2 semanas. 14 sesiones en total. Duración de la sesión sin especificar | FIQSF-36NPRSUDPHADSBDI | No se encontraron diferencias entre grupos tras el tratamiento (p>0,05) | A 11 semanas de seguimiento mejoró G1 en FIQ y SF-36 (salud mental) en comparación con G2 (p<0,05) |
| Tekin et al.33 | G1: 42,4±7,63años (n=27)G2: 46,5±8,36años(n=25) | G1: TMS en M1G2: TMS placebo (bobina que replicaba el sonido de la bobina real) | G1: 30 series de 10Hz; 1.500pulsos | 10 sesiones consecutivas de 8,5min de duración | VASMADRSWHOQOL-BREF | G1 mejoró VAS y la subescala de dominio físico de WHOQOL-BREF en comparación con G2 (p<0,05). No hubo diferencias en el resto de variables (p>0,05) | Sin datos |
| Maestú et al.32 | G1: 40,7±6,7 (n=34)G2: 40,7±6,7(n=33) | G1: low-intensity TMS en toda la cortezaG2: TMS placebo (bobina apagada) | G1: Sin especificar número de series ni pulsos totales. Frecuencia de 8Hz | Una sesión por semana durante 8 semanas consecutivas. 8 sesiones en total de 20min de duración cada una | UDPFIQ (VAS adaptadas) | G1 mejoró el UDP y las VAS de actividad diaria, calidad de sueño y dolor adaptadas del FIQ en comparación con G2 (p<0,05). No hubo diferencias en el resto de dominios (p>0,05) | Sin datos |
| Yağci et al.35 | G1: 45,25±9,33años (n=12)G2: 43±7,63años (n=13) | G1: TMS en M1G2: TMS placebo (bobina a 90° de M1) | G1: sin especificar número de series. Frecuencia de 1Hz; 1.200 pulsos | 5 sesiones por semana durante 2 semanas. 10 sesiones en total. Duración de la sesión sin especificar | VASFIQBDI | G1 mejoró FIQ y BDI en comparación con G2 (p<0,05). No se mostraron diferencias en el resto de variables (p>0,05) | A 4 y 12 semanas de seguimiento no hubo mejoras entre grupos en ninguna variable (p<0,05) |
| Mhalla et al.26 | G1: 51,8±11,6años(n=20)G2: 49,6±10,0años(n=20) | G1: TMS en M1G2: TMS placebo (bobina que replicaba el sonido de la bobina real) | G1: 15 series de 10Hz; 1.500 pulsos | 5 sesiones consecutivas, seguidas de una sesión por semana durante 3 semanas, seguido de una sesión cada 2 semanas durante 6 semanas y seguido de una sesión al mes durante 3 meses. 14 sesiones en total. Duración de la sesión sin especificar | NPRSSF-MPQBPIFIQHADSBDIPCS | G1 mejoró NPRS, SF-MPQ (componente afectivo), BPI (caminar, relaciones, disfrute, sueño y actividad general), FIQ (fatiga, rigidez y cansancio) y PCS en comparación con G2 (p<0,05). No hubo diferencias en el resto de subescalas ni en HADS y BDI (p>0,05) | A 4 semanas de seguimiento se mantuvieron las mejoras mostradas por G1 en comparación con G2 (p<0,05) |
| Fitzgibbon et al.34 | G1: 45,07±11,02años(n=14)G2: 46,25±15,04años(n=12) | G1: TMS en DLPFCG2: TMS placebo (bobina que replicaba el sonido de la bobina real) | G1: 75 series de 10Hz; 3.000 pulsos | G1: 5 sesiones, de 30min de duración, por semana durante 4 semanas. 20 sesiones en total | SF-MPQBPINPRSFIQSF-36MFI-20PCSBDIBAI | G1 mostró mejoras en MFI-20 en comparación con G2 (p<0,05). No se encontraron diferencias entre grupos en el resto de variables (p>0,05) | A 4 semanas de seguimiento se mantuvo la mejora de G1 en comparación con G2 (p<0,05) |
| Altas et al.27 | G1: 46,3±9,01 (n=10)G2: 47,9±7,89 (n=10)G3: 48,2±9,38 (n=10) | G1: TMS en M1G2: TMS en DLPFCG3: rTMS placebo (bobina colocada de forma inversa) | G1: 60 series de 10Hz; 1.200 pulsosG2: 60 series de 10Hz; 1.200 pulsosG3: 60 series de 0,1Hz; 1.200 pulsos | 5 sesiones consecutivas, de 30min de duración, durante 3 semanas. 15 sesiones en total | VASFIQFSSSF-36BDI | Se encontraron diferencias entre grupos en VAS, SF-36 y BDI. G1 mostró mejoras en VAS en comparación con G3 y en el dominio de función emocional en comparación con G2 y G3 (p<0,05). G1 y G2 mostraron mejoras en BDI y en los dominios de función física rol de la función física y percepción de salud general de SF-36. No se encontraron diferencias entre grupos en FIQ ni FSS (p>0,05) | Sin datos |
BAI: cuestionario de ansiedad de Beck; BDI: inventario de depresión de Beck; BPI: cuestionario breve del dolor; DLPFC: corteza prefrontal dorsolateral; FIQ: cuestionario de impacto de la fibromialgia; FSS: escala de gravedad de la fatiga; G: grupo; GDS: escala de la depresión en personas mayores; HADS: escala de ansiedad y depresión hospitalaria; HAM-A: escala de Hamilton para evaluar la ansiedad; HAM-D: escala de Hamilton para evaluar la depresión; MADRS: escala de clasificación de la depresión de Montgomery-Åsberg; M1: corteza motora primaria; MFI-20: cuestionario multidimensional de fatiga de 20 ítems; MFIS: escala de impacto de la fatiga modificada; n: tamaño de la muestra; NPRS: escala numérica del dolor; PCS: escala de catastrofismo del dolor; SF-36: cuestionario de salud de 36 ítems; SF-MPQ: cuestionario de dolor de McGill; SS: severidad de los síntomas; STAI: cuestionario de ansiedad estado-rasgo; tDCS: estimulación transcraneal con corriente directa; TMS: estimulación magnética transcraneal; UDP: umbral de dolor a la presión; VAS: escala visual analógica; WHOQOL-BREF: cuestionario de la calidad de vida según la Organización Mundial de la Salud; WPI: índice de dolor generalizado;
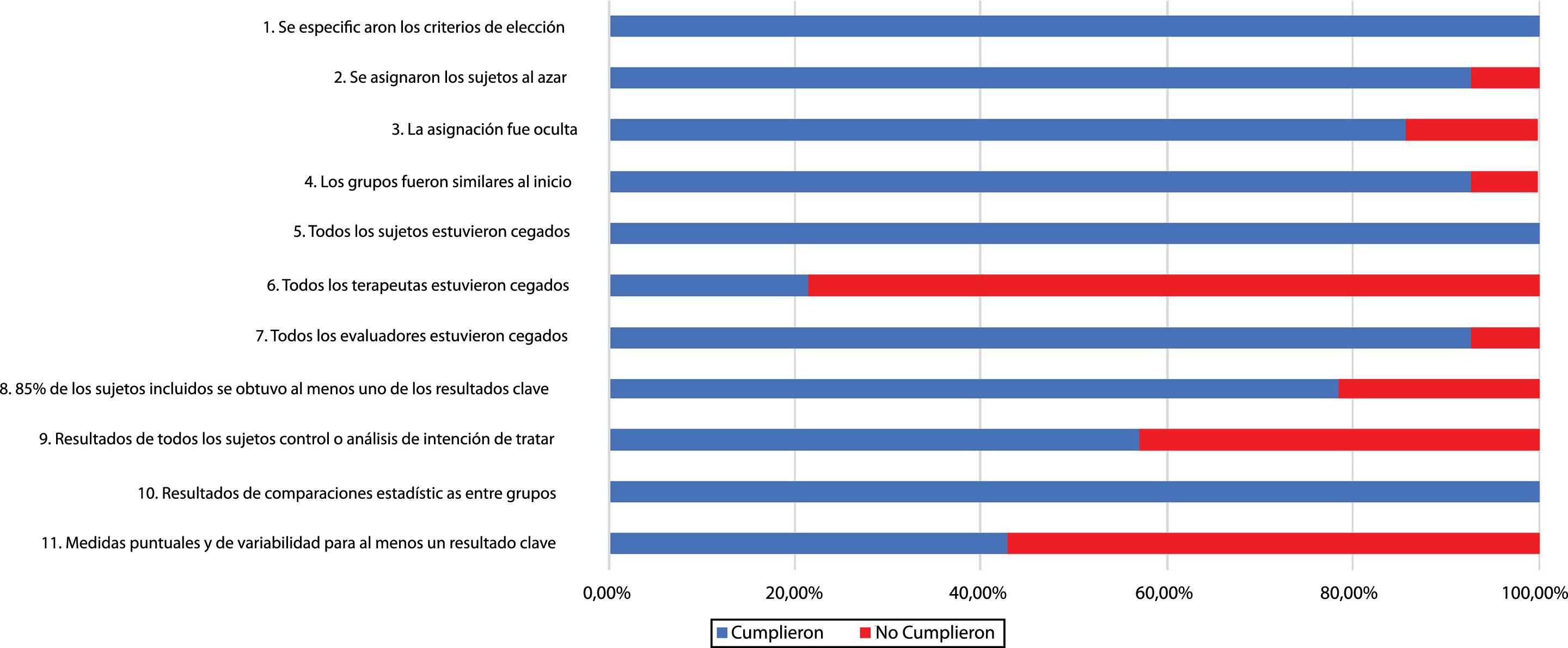
De acuerdo con la valoración de la escala PEDro, 5 estudios que utilizaron tDCS mostraron una calidad metodológica alta con una puntuación de 7 o superior23,28–31 y un único estudio mostró una puntuación de 624. Todos los estudios que utilizaron TMS presentaron una calidad metodológica alta con una puntuación de 7 o superior16,25–27,32–35. La calidad metodológica de cada uno de los estudios incluidos se muestra en la tabla 2. Todos los estudios mostraron un cegamiento adecuado de los sujetos, y también los resultados de las comparaciones estadísticas entre grupos para al menos un resultado clave. Por otro lado, en la mayoría de los estudios los terapeutas no fueron cegados. La figura 2 muestra el riesgo de sesgo de cada uno de los estudios.
Puntuación de la escala PEDro de los estudios incluidos
| Referencia | Ítems | Total | Calidad del estudio | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |||
| Khedr et al.28 | S | S | S | S | S | N | S | S | N | S | N | 7/10 | Alta |
| To et al.24 | S | S | S | S | S | N | N | N | N | S | S | 6/10 | Aceptable |
| Fagerlund et al.23 | S | S | S | S | S | S | S | S | N | S | S | 9/10 | Alta |
| Boyer et al.25 | S | S | S | S | S | N | S | N | S | S | N | 7/10 | Alta |
| Mhalla et al.26 | S | S | S | S | S | N | S | S | S | S | S | 9/10 | Alta |
| Passard et al.16 | S | S | N | S | S | N | S | S | S | S | N | 7/10 | Alta |
| Fregni et al.30 | S | S | N | S | S | N | S | S | S | S | N | 7/10 | Alta |
| Maestú et al.32 | S | S | S | S | S | S | S | N | N | S | N | 7/10 | Alta |
| Altas et al.27 | S | S | S | S | S | N | S | S | S | S | N | 8/10 | Alta |
| Tekin et al.33 | S | S | S | S | S | N | S | S | N | S | S | 8/10 | Alta |
| Valle et al.29 | S | N | S | S | S | N | S | S | S | S | N | 7/10 | Alta |
| Yoo et al.31 | S | S | S | N | S | N | S | S | S | S | S | 8/10 | Alta |
| Yağci et al.35 | S | S | S | S | S | N | S | S | N | S | S | 8/10 | Alta |
| Fitzgibbon et al.34 | S | S | S | S | S | S | S | S | S | S | N | 9/10 | Alta |
1. Los criterios de elección están especificados.
No se evalúa en la puntuación final.
Sobre 10: S - Sí cumple el criterio; N - No cumple el criterio.
2. Los sujetos fueron asignados al azar a los grupos.
3. La asignación fue oculta.
4. Los grupos fueron similares al inicio en relación con los indicadores de pronóstico más importantes.
5. Todos los sujetos fueron cegados.
6. Todos los terapeutas que administraron la terapia fueron cegados.
7. Todos los evaluadores que midieron al menos un resultado clave fueron cegados.
8. Las medidas de al menos uno de los resultados clave fueron obtenidas de más del 85% de los sujetos inicialmente asignados a los grupos.
9. Se presentaron resultados de todos los sujetos que recibieron tratamiento o fueron asignados al grupo control, o cuando esto no pudo ser, los datos para al menos un resultado clave fueron analizados por «intención de tratar».
10. Los resultados de comparaciones estadísticas entre grupos fueron informados para al menos un resultado clave.
11. El estudio proporciona medidas puntuales y de variabilidad para al menos un resultado clave.
Además, todos los estudios incluidos en esta revisión presentaron un nivel de evidencia 1b, lo que se corresponde con un grado de recomendación aconsejable y un grado de evidencia moderada. Esto significa que la medida es efectiva y los beneficios son superiores a los perjuicios22.
DiscusiónEl objetivo de la presente revisión sistemática fue valorar los efectos de la intervención basada en tDCS o TMS en pacientes con diagnóstico de FM en el dolor, el UDP, la fatiga, la ansiedad, la depresión, el catastrofismo y la calidad de vida.
Los resultados de este estudio parecen indicar que la aplicación de tDCS mejora la intensidad del dolor a corto23,24,28–31 y a medio plazo28–30 y el UDP a corto plazo cuando se aplica en M128. Los efectos analgésicos con la aplicación de tDCS en DLPFC y con TMS fueron controvertidos.
Los autores de estos estudios han propuesto que la sensibilización central característica de los pacientes con dolor crónico podría implicar una disfunción del procesamiento sensorial con cambios neuroplásticos maladaptativos de la actividad cortical36. El uso de estas técnicas neurofisiológicas basadas en la aplicación de corriente a la corteza cerebral parece producir un incremento de la excitabilidad cortical favoreciendo cambios en las áreas moduladoras del dolor30.
Se ha propuesto que los efectos analgésicos podrían venir inducidos por la activación de los sistemas moduladores del dolor18,37. En concreto, estudios recientes han demostrado la activación del sistema opioide endógeno y un aumento de la liberación de β-endorfinas tras la aplicación de estas técnicas38. Además, la aplicación en M1 podría producir una inhibición directa del tálamo, a través de las fibras tálamo-corticales, lo que podría resultar en una modulación de los núcleos del tálamo39,40. Por otro lado, los posibles efectos analgésicos atribuidos a la aplicación en DLPFC, que como muestra la presente revisión fueron controvertidos, podrían explicarse por la modulación del sistema límbico y la corteza cingular anterior26,28,31, las cuales se encuentran relacionadas con las emociones, los estados afectivos30 y las dimensiones emocionales del dolor41,42.
Como reflejan los resultados de los estudios incluidos, tanto la técnica de tDCS como la TMS aplicadas ambas en DLPFC parecen disminuir la fatiga, teniendo un efecto más prolongado con la aplicación de TMS24,34.
La definición y evaluación de la fatiga es un aspecto complejo, ya que envuelve componentes multidimensionales asociados a cambios funcionales y estructurales en el córtex prefrontal43. Cabe destacar que los beneficios en la fatiga se han evidenciado únicamente con la aplicación en DLPFC. Los resultados de este estudio podrían venir determinados porque la estimulación de esta zona podría producir una modulación del sistema límbico y otras redes relacionadas con el sistema sensorial, afectivo y cognitivo que podrían afectar a la percepción de la fatiga43.
Los resultados registrados por los estudios incluidos en esta revisión ponen de manifiesto la gran controversia que existe en cuanto a los efectos psicosociales de ansiedad y depresión atribuidos a estas técnicas. Cuatro estudios mostraron resultados favorables27,28,31,35, mientras que 8 estudios no encontraron mejoras tras la aplicación de tDCS o TMS16,23,25,26,29,30,33,34. Con respecto a la variable catastrofismo, mostró mejoras con la aplicación de tDCS a corto plazo y TMS en DLPFC a corto y medio plazo24,26.
Las mejoras alcanzadas podrían venir por la activación del sistema opioide endógeno y la liberación de β-endorfinas que han mostrado efectos analgésicos38. En este sentido, los síntomas de ansiedad y depresión se han mostrado estrechamente relacionados con la intensidad del dolor en pacientes con dolor crónico musculoesquelético44; el catastrofismo considera los pensamientos y sensaciones ante situaciones dolorosas26, por lo que la disminución de la intensidad del dolor podría explicar las mejoras en estas variables. Por otro lado, los estudios que no mostraron beneficios en la ansiedad y/o depresión con estas intervenciones lo achacaron a las características de los pacientes incluidos. Estas técnicas, principalmente la TMS, han sido descritas para el tratamiento de trastornos psiquiátricos y síntomas depresivos severos45, por lo que los autores discutieron que la falta de mejoras en estas variables podía venir determinado porque los pacientes incluidos presentaban síntomas depresivos de carácter leve y moderado30.
Respecto a la calidad de vida, los resultados de los estudios incluidos mostraron que ambas aplicaciones producen mejoras en diferentes aspectos relacionados con esta, como la función física, la calidad del sueño o actividades de la vida diaria, tanto a corto como a medio plazo16,24–27,29–34. Si bien la presencia de síntomas como el dolor, la fatiga y el catastrofismo se han relacionado con una disminución de la calidad de vida en estos pacientes, las mejoras alcanzadas en estos síntomas característicos de la FM podrían traducirse en una mejora de la calidad de vida26.
En relación con los protocolos de tDCS, los autores parecen coincidir en que deben ser de carácter anódico, con sesiones de 20min a una intensidad de entre 1,5 y 2mA23,24,28–31 y durante al menos 5 sesiones23,30, destacando que el aumento de sesiones parece mantener los efectos a medio plazo28,29. La colocación del electrodo anódico implica un incremento de la excitabilidad46. Por el contrario, los protocolos de TMS han mostrado una mayor variabilidad. Gran parte de los estudios aplicaron el tratamiento en sesiones de 8,5 a 30min, con una frecuencia de 10Hz y principalmente durante 5 sesiones consecutivas a la semana durante 216,25,33,35, 327 o 4 semanas34. Los protocolos de estimulación de alta frecuencia producen una excitabilidad cortical elevada18. Ambos protocolos de tratamiento son similares a los descritos por otros autores para el abordaje de otras patologías crónicas15.
Esta revisión presenta varias limitaciones. En primer lugar, la heterogeneidad de los instrumentos de medición utilizados para el registro de las diferentes variables dificulta la comparación de resultados entre estudios. En segundo lugar, el hecho de que los estudios incluidos fueran en inglés o castellano, pudiendo excluir estudios potencialmente relevantes en otros idiomas. Finalmente, solo se incluyeron estudios con pacientes afectados por FM, lo cual evita la generalización de los resultados a otras patologías caracterizadas con dolor crónico.
Futuros estudios deberían valorar los efectos a largo plazo de estas intervenciones, el tiempo de intervención más beneficioso y la duración de la sesión óptima, así como la combinación de estas intervenciones con otros tratamientos.
ConclusiónLos resultados de esta revisión muestran que la aplicación de tDCS en M1 disminuye el dolor a corto y medio plazo en pacientes con FM. La aplicación de tDCS o TMS produce mejoras en el UDP, el catastrofismo y la calidad de vida cuando se aplica en M1, y en la fatiga cuando se aplica en DLPFC. Sin embargo, los efectos de estas intervenciones en la ansiedad y depresión no son concluyentes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Medline (Pubmed): (“fibromyalgia”[MeSH Terms] OR “fibromyalgia”[All Fields]) AND ((“transcranial direct current stimulation”[MeSH Terms] OR (“transcranial”[All Fields] AND “direct”[All Fields] AND “current”[All Fields] AND “stimulation”[All Fields]) OR “transcranial direct current stimulation”[All Fields]) OR (“transcranial magnetic stimulation”[MeSH Terms] OR (“transcranial”[All Fields] AND “magnetic”[All Fields] AND “stimulation”[All Fields]) OR “transcranial magnetic stimulation”[All Fields])).
PEDro: fibromyalgia AND transcranial direct current stimulation; fibromyalgia AND transcranial magnetic stimulation.
Scopus: fibromyalgia AND (transcranial AND direct AND current AND stimulation OR transcranial AND magnetic AND stimulation).
Cochrane Library: fibromyalgia AND (transcranial direct current stimulation OR transcranial magnetic stimulation).