La hiposmia y la hiperecogenicidad de la sustancia negra (SN+) son marcadores característicos de la enfermedad de Parkinson (EP), aunque su valor diagnóstico de forma aislada puede ser limitado. Se evalúa la prevalencia combinada de ambos marcadores en pacientes diagnosticados de enfermedad de Parkinson (EP) y su rentabilidad diagnóstica frente a una muestra con temblor esencial (TE) y otra de sujetos sanos.
MétodosSe incluyó a pacientes con diagnóstico de EP y TE procedentes de nuestra consulta externa. La olfación se evaluó con el test de identificación de olores Sniffin Sticks test (SS-12) y la evaluación de la sustancia negra mediante dúplex transcraneal.
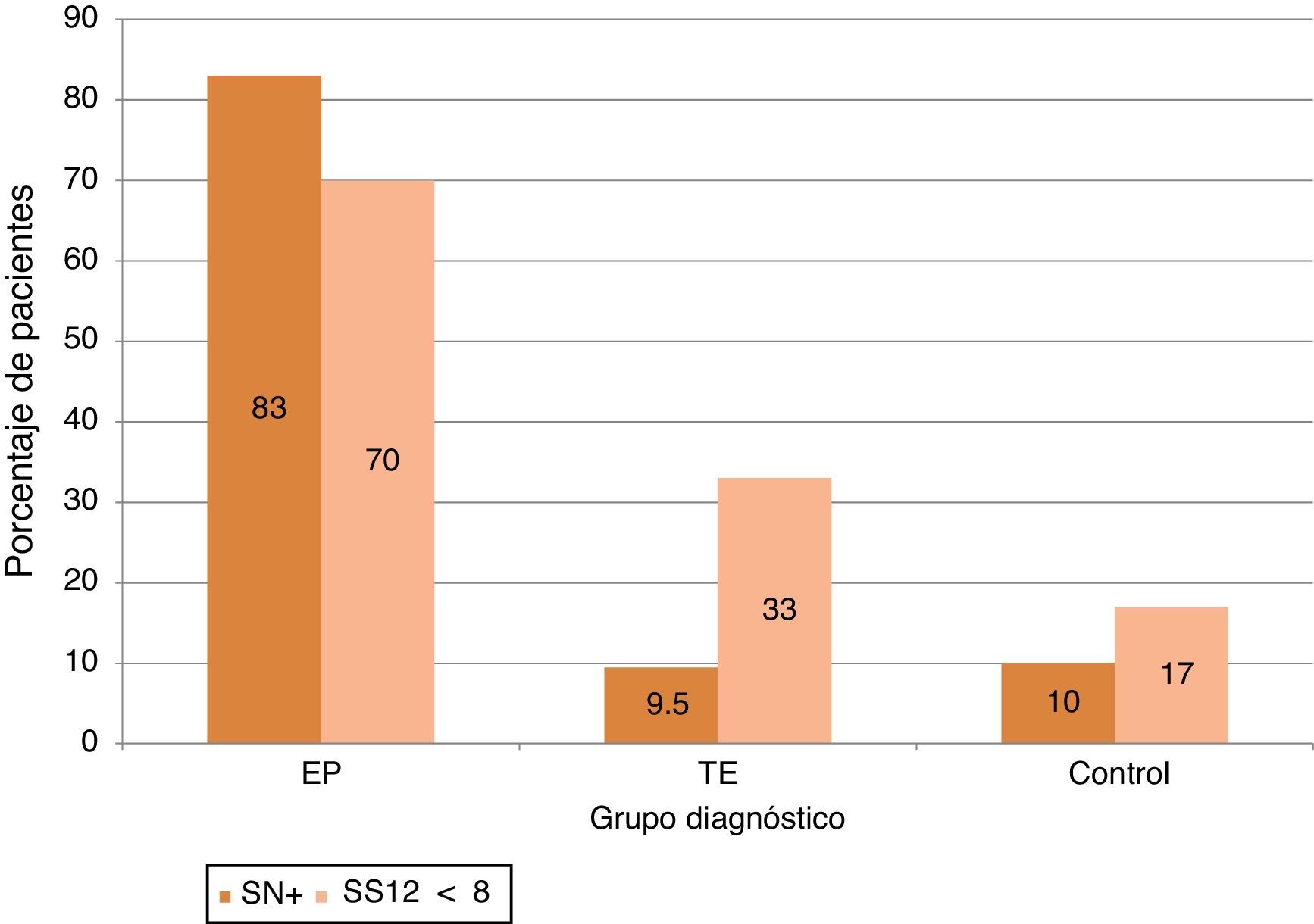
ResultadosSe evaluó a 98 individuos, 30 con diagnóstico de EP, 21 con TE y 47 controles. Las prevalencias de hiposmia (SS-12 < 8) e hiperecogenicidad de SN (área > 0,24cm2) fueron del 70 y el 83,3% en EP, el 33,3 y el 9,5% en TE y el 17 y el 10,6% en los controles, respectivamente. La combinación de ambos marcadores estaba presente en el 63% de los pacientes con EP y en ninguno de los pacientes con TE y solo en 2 de los controles.
ConclusionesLa evaluación combinada de la evaluación olfativa mediante el SS-12 y de la sustancia negra mediante ecografía, 2 test rápidos, inocuos y accesibles, mejora la especificidad aislada que cada marcador tiene en el diagnóstico de la EP frente a pacientes con TE o controles. Dado que ambos marcadores se han descrito en fases muy precoces de la EP, su aplicación podría ayudarnos en su diagnóstico precoz.
Hyposmia and substantia nigra hyperechogenicity (SN+) are characteristic markers of Parkinson's disease (PD), although their diagnostic value in isolation may be limited. We evaluated the combined prevalence of both disorders in patients diagnosed with PD and assessed their diagnostic yield compared to a sample with essential tremor (ET) and another group of healthy subjects.
MethodsPatients diagnosed with PD and ET and treated in our outpatient clinic were enrolled. Olfaction was assessed using the “Sniffin’ Sticks” odour identification test (SS-12) and hyperechogenicity of the substantia nigra (SN+) was assessed by transcranial duplex ultrasound.
ResultsA total of 98 subjects were analysed, comprising 30 with PD, 21 with ET, and 47 controls. The respective prevalence rates of hyposmia (SS-12 < 8) and SN+ (area > .24cm2) were 70% and 83.3% in PD, 33.3% and 9.5% in ET, and 17% and 10.6% in controls. Both markers were present in 63% of patients with PD, none of the patients with ET, and only 2 of the controls.
ConclusionsCombined use of substantia nigra sonography and olfactory testing with SS-12, two rapid, safe, and accessible tests, was more specific than each isolated marker for distinguishing patients with PD from patients with ET and control subjects. Since both markers have been described in very early phases of PD, combined use may be helpful in providing early diagnosis of PD.
La enfermedad de Parkinson (EP) es una de las enfermedades neurodegenerativas más comunes, afectando aproximadamente al 2% de la población mayor de 60 años1.
Pese a los importantes avances de las últimas décadas en el diagnóstico de la EP, en la actualidad, y fuera de los ámbitos de la investigación, el diagnóstico de esta enfermedad sigue basándose en criterios clínicos. Especialmente en las fases precoces, su diferenciación de otros procesos, como el temblor esencial (TE), la atrofia multisistema, la parálisis supranuclear progresiva y el parkinsonismo vascular o medicamentoso, puede ser de especial dificultad2.
Además, herramientas diagnósticas como el test de apomorfina, estudios de radiotrazadores y otras técnicas de neuroimagen no siempre son concluyentes, incluso pueden ser normales hasta fases más evolucionadas3,4.
Existe, por tanto, un creciente interés en el desarrollo de marcadores biológicos que mejoren el diagnóstico de la EP y la disfunción olfativa y la hiperecogenicidad de la sustancia negra en la ecografía transcraneal (SN+) son marcadores frecuentemente asociados a la EP, que además de estar presentes en fases precoces de la enfermedad, se mantienen constantes a lo largo de ella5-9 y pueden ser evaluados de forma sencilla, inocua y con bajo coste económico por el mismo neurólogo.
Sin embargo, conviene recordar que estas alteraciones no son específicas de la EP y su valor diagnóstico cuando son aplicadas de forma aislada puede ser limitado. Es posible que el análisis combinado de ambos marcadores aumente la especificidad diagnóstica.
Para ello, nuestro objetivo es valorar la sensibilidad, la especificidad y el valor predictivo positivo de la presencia de SN+ evaluada mediante dúplex transcraneal y de alteración olfativa evaluada mediante el Sniffin Sticks test (SS-12) en una muestra de pacientes con EP comparándola con una muestra de pacientes con TE y otra de controles sanos.
Pacientes y métodosSe trata de un estudio observacional realizado en el servicio de Neurología del hospital IMED Levante (Alicante, España). Se incluyó a los pacientes con diagnóstico clínico de EP y de TE sobre la base de los criterios diagnósticos aceptados10,11, teniendo que estar al menos un año con este diagnóstico.
Los controles sanos se reclutaban de acompañantes y de otros pacientes atendidos en la consulta de Neurología, sin historia clínica ni antecedentes personales ni familiares de trastornos del movimiento.
Se excluía del análisis a los sujetos sin ventana acústica y a aquellos con anomalías olfativas previas (rinitis, intervenciones nasales) que impidieran un análisis fiable de la olfación.
El período del estudio fue desde mayo del 2011 hasta mayo del 2012 y, tras consentimiento informado, se realizaba a cada individuo el análisis de olfación y la ecografía transcraneal por el mismo investigador.
Estudio de olfaciónLa evaluación de la olfación se realizó mediante el SS-12 (Burghart Messtechnik, Wedel, Alemania). Elegimos este test de identificación de 12 olores porque puede ser aplicado en pocos minutos en la consulta y porque ya ha sido empleado en poblaciones de pacientes con EP. Según las recomendaciones del fabricante, el test se realizaba en una habitación bien ventilada, siempre por el mismo investigador. Cada uno de los lápices se presentaba por el investigador durante no más de 3-4 s, tras retirarle la capucha, frente a las fosas nasales del paciente, sin que toque la piel. Se trata de un test de elección múltiple forzada, en el que antes de pasar al siguiente lápiz, el paciente tiene que elegir una entre 4 opciones presentadas, obteniéndose un punto por cada acierto. El intervalo entre cada lápiz era de aproximadamente 20 s. El resultado absoluto es un valor numérico entre 0 y 12 aciertos.
Se han empleado curvas Receiver Operating Characteristic (ROC) para establecer el mejor punto de corte. Se evalúa también la frecuencia de alteración olfativa según el normograma procedente de estudios germanos12, considerando patológico si la puntuación era menor que el percentil 10 para su grupo de edad y sexo. Para el análisis combinado se emplea solo el criterio absoluto.
Estudio ecográfico transcranealEl estudio ecográfico fue realizado a través de la ventana temporal con una sonda 1-4MHz (Acuson Antares, Siemens, Erlangen, Alemania) con la siguiente configuración: profundidad campo 14-16cm, rango dinámico 45-50dB y postprocesamiento en modo G.
Cada SN era insonada ipsolateralmente. Una vez localizado el plano axial mesencefálico con el área hiperecogénica correspondiente a la SN, la imagen era congelada, aumentada 3-4 veces y grabada (imágenes y vídeos) para posterior medición planimétrica circunferenciando manualmente el área hiperecogénica, obteniéndose el valor del área automáticamente. Todos los estudios fueron realizados por el mismo investigador (NL), que no era ciego al grupo diagnóstico del sujeto en el momento del estudio, aunque la medición planimétrica era realizada de forma diferida y con ocultación de los datos del paciente.
Como se recomienda en las guías internacionales13, calculamos nuestro propio valor de referencia para considerar como patológico (SN+) a todo individuo con al menos una SN cuya hiperecogenicidad sea superior al percentil 90 de los valores obtenidos en los controles por nuestro laboratorio.
Análisis estadísticoSe presenta el análisis descriptivo de cada grupo diagnóstico, con las frecuencias y las medias ± desviaciones estándar del sexo y la edad.
Se ha calculado para cada prueba diagnóstica su sensibilidad, especificidad y valor predictivo positivo.
Para establecer las relaciones de dependencia entre la variable cualitativa diagnóstico (EP/no EP) y los resultados (positivo/negativo) de cada marcador, se ha usado el test de la chi al cuadrado (χ2). Para los estudios de comparación de medias, se ha comprobado la distribución normal de los datos mediante las pruebas de Kolmogorov-Smirnov y de Shapiro-Wilk, y se han utilizado las pruebas de la t de Student y ANOVA. Hemos considerado significativo un p-valor < 0,05.
Para todo ello, se ha usado el programa estadístico SPSS 15 para Windows (IBM).
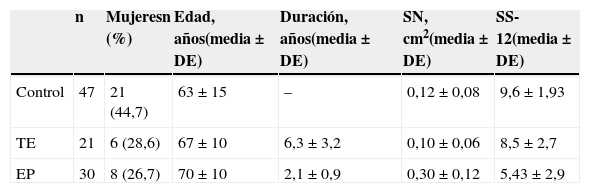
ResultadosDe una muestra inicial de 107 individuos, se excluyó por insuficiente ventana acústica a un total de 9. De estos sujetos excluidos, había un total de 8 mujeres (88,9%) con edad media ± desviación estándar de 72,8 ± 6,4 años. Se incluyó en el estudio a 98 individuos, con total de 35 mujeres (35,7%) con edad de 66 años ± 13,2 años, de los que 30 eran pacientes con EP, 21 con TE y 47 controles. Las características de la muestra se detallan en la tabla 1.
Características demográficas de la población y resultados de los estudios ecográficos y de olfación según grupo diagnóstico
| n | Mujeresn (%) | Edad, años(media ± DE) | Duración, años(media ± DE) | SN, cm2(media ± DE) | SS-12(media ± DE) | |
|---|---|---|---|---|---|---|
| Control | 47 | 21 (44,7) | 63 ± 15 | – | 0,12 ± 0,08 | 9,6 ± 1,93 |
| TE | 21 | 6 (28,6) | 67 ± 10 | 6,3 ± 3,2 | 0,10 ± 0,06 | 8,5 ± 2,7 |
| EP | 30 | 8 (26,7) | 70 ± 10 | 2,1 ± 0,9 | 0,30 ± 0,12 | 5,43 ± 2,9 |
DE: desviación estándar; SN: sustancia negra; SS-12: Sniffin Sticks test.
Las puntuaciones medias en SS-12 de los diferentes grupos se muestran en la tabla 1.
Según las curvas ROC, el área bajo la curva es de 0,70 y el valor de corte en menos de 8 aciertos es el que mejor diferencia a los pacientes con EP del resto.
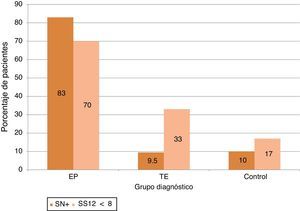
La alteración olfativa fue más frecuente al definirse con criterios absolutos (puntuación < 8) que si se empleaban los valores normativos para edad y sexo: (70% en EP [frente al 56,7%], 33,3% en TE [frente a 19%] y 17% en controles [frente a 8,5%)) (véase la figura 1).
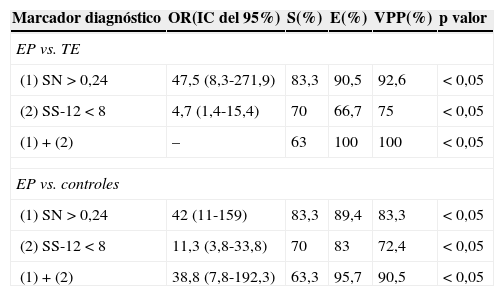
Considerando como hipósmico a todo individuo con una puntuación SS-12 < 8, su rentabilidad diagnóstica para diferenciar a los pacientes con EP de aquellos con TE (y de los controles) tenía una sensibilidad, una especificidad y un valor predictivo positivo del 70% (70%), el 66,7% (83%) y el 75% (72,4%), respectivamente (tabla 2).
Marcadores diagnósticos en la diferenciación de los pacientes con EP respecto a TE y controles
| Marcador diagnóstico | OR(IC del 95%) | S(%) | E(%) | VPP(%) | p valor |
|---|---|---|---|---|---|
| EP vs. TE | |||||
| (1) SN > 0,24 | 47,5 (8,3-271,9) | 83,3 | 90,5 | 92,6 | < 0,05 |
| (2) SS-12 < 8 | 4,7 (1,4-15,4) | 70 | 66,7 | 75 | < 0,05 |
| (1) + (2) | – | 63 | 100 | 100 | < 0,05 |
| EP vs. controles | |||||
| (1) SN > 0,24 | 42 (11-159) | 83,3 | 89,4 | 83,3 | < 0,05 |
| (2) SS-12 < 8 | 11,3 (3,8-33,8) | 70 | 83 | 72,4 | < 0,05 |
| (1) + (2) | 38,8 (7,8-192,3) | 63,3 | 95,7 | 90,5 | < 0,05 |
E: especificidad; EP: enfermedad de Parkinson; IC: intervalo de confianza; OR: odds ratio; S: sensibilidad; TE: temblor esencial; VPP: valor predictivo positivo.
Los valores obtenidos de hiperecogenicidad de SN en cada grupo diagnóstico pueden verse en la tabla 1. En el grupo de EP, esta área fue significativamente mayor (0,30 ± 0,13cm2) que en los grupos TE (0,10 ± 0,07 cm2) y control (0,12 ± 0,08 cm2).
De los valores obtenidos en el grupo control, se calculó el percentil 90 para definir a aquellos individuos con SN+ agrandada, obteniéndose el punto de corte en 0,24cm2. Con este criterio, evidentemente un 10% de los sujetos control presentaban SN+, similar al 9,5% de los pacientes con TE, que aumentaba a un 93% de los pacientes con EP. (véase la figura 1).
La presencia de este marcador permitía diferenciar a los pacientes de EP de aquellos con TE (y controles) con una sensibilidad, una especificidad y un valor predictivo positivo del 83,3% (83,3%), el 90,5% (89,4%) y el 92,6% (83,3%), respectivamente.
Análisis combinadoEvaluada de forma aislada, la hiperecogenicidad de la SN es un marcador diagnóstico más sensible y específico que la evaluación de la olfación (véase la tabla 2).
Sin embargo, cuando analizamos ambos marcadores de forma conjunta, la precisión de nuestro diagnóstico mejoraba de forma significativa, aumentando la especificidad de diagnóstico de EP frente a controles al 95,7% (OR = 38,8) y frente a pacientes con TE al 100% (OR no calculable).
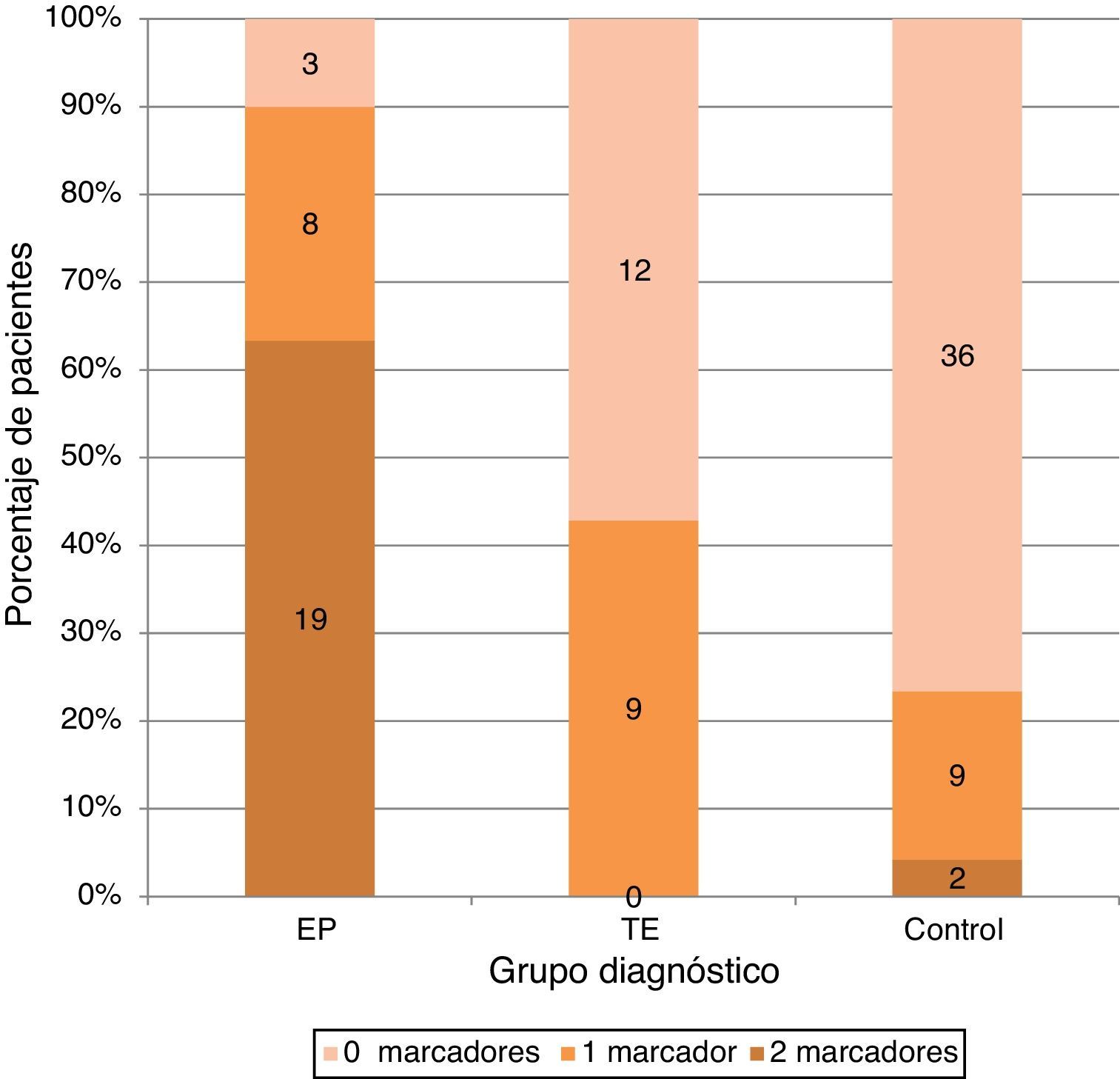
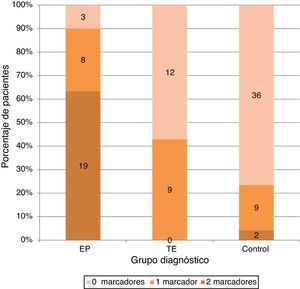
La presencia de uno cualquiera de los 2 marcadores aparecía en un 26,6% (n = 8) en el grupo de EP frente a un 42,9% (n = 9) en el grupo TE y 19,1% (n = 9) en grupo control, mientras que los 2 marcadores de forma combinada estaban presentes en el 63,3% (n = 19) de los pacientes con EP y solo en 4,3% (n = 2) de los controles y en ninguno de los del grupo TE (fig. 2).
DiscusiónNuestros resultados muestran cómo la presencia combinada de hiperecogenicidad de la SN e hiposmia discrimina a los pacientes con EP de los controles sanos y de pacientes con TE con elevada especificidad.
Ningún individuo diagnosticado de TE y solo 2 casos (4,3%) de los controles presentaban esta combinación de marcadores. Este hecho, unido a la facilidad con que ambos marcadores pueden ser medidos por el mismo neurólogo en la evaluación ambulatoria, en un corto período, de forma inocua y relativamente poco costosa, y a que hay datos suficientes que apoyan su presencia precoz en la evolución de la EP, hacen de esta evaluación combinada una estrategia diagnóstica prometedora en la identificación precoz de los pacientes con EP.
El uso combinado de estos marcadores, pese a disminuir la sensibilidad en el diagnóstico de pacientes con EP, consigue mejorar significativamente los valores de especificidad y valor predictivo positivo.
Nuestros resultados son comparables con los publicados previamente por Busse et al.14. Ellos analizaron el valor de la combinación de hiperecogenicidad de SN (criterio SN+ > 0,24cm2), alteración olfativa mediante SS-12 (criterio < 8 aciertos) y asimetría motora evaluada mediante UPDRS, en el diagnóstico diferencial entre EP y otras causas de parkinsonismo, en las que también se incluía a pacientes con TE. La mejor rentabilidad diagnóstica la obtenían con la asociación de la alteración olfativa y la SN+, con unos valores de sensibilidad, especificidad y valor predictivo positivo del 66, el 89% y el 95%, respectivamente, en comparación con los valores para cada marcador independiente, que en el caso de la alteración olfativa fueron del 75, el 70 y el 88%, y para la SN+ del 90%, el 63 y el 88, respectivamente.
Por su parte, Izawa et al.15 analizaron también la combinación de SN+ (criterio > 0,16cm2), alteración olfativa mediante OPSIT-J (test de identificación similar al SS-12 adaptado a la población japonesa) y gammagrafía miocárdica con MIBG en 33 pacientes con EP frente a 32 controles. Pese a las diferencias metodológicas (punto de corte de SN+ 0,16cm2 y test de olfación el OPSIT-J), la combinación de SN+ y olfación también mejoraba los resultados en sensibilidad, especificidad y valor predictivo positivo con un 61,8, un 100 y un 100%, respectivamente, frente a los valores individuales de cada marcador.
La alteración olfativa en la EP está presente en las fases más precoces de la enfermedad16,17, siendo compatible con los hallazgos neuropatológicos18 y sin clara correlación con la duración ni con la severidad de la enfermedad8. Sin embargo, este trastorno no es específico y se ha descrito también en pacientes con atrofia multisistema, demencia por cuerpos de Lewy y enfermedad de Alzheimer, aunque con prevalencias menores19, por lo que su evaluación de forma aislada podría tener un papel diagnóstico limitado.
En el caso de la EP, la prevalencia de esta alteración olfativa varía entre el 45 y el 96%8.
Estas diferencias pueden ser debidas a la distribución de edad, el tamaño de la muestra, los datos normativos o el tipo de test olfativo empleado. El principal motivo por el que decidimos emplear el SS-12 como test de olfación fue el corto tiempo de aplicación que precisa (unos 4 min).
Existen test olfativos más complejos que evalúan también el umbral y la discriminación de olores. De hecho, el SS-12 es un test de identificación simplificado del de 16 ítems. Sin embargo, aparte de ser test más complejos, costosos y que consumen más tiempo, hay evidencia a favor de que este subset de identificación es el componente más sensible para detectar la pérdida olfatoria en la EP8.
Sobre el punto de corte para definir la alteración olfativa, no existe acuerdo unánime. Existe una tabla normativa según edad y sexo para el SS-12 realizada en población centroeuropea, con el inconveniente de no estar validada en población española.
Algunos autores han aplicado este criterio normativo para definir la hiposmia8, mientras que otros han empleado un valor absoluto de corte, en < 920 o < 8 aciertos14, con lo que parece que se mejora la diferenciación entre los grupos diagnósticos.
Este último criterio fue el mismo empleado en nuestro estudio, obteniendo una frecuencia en EP del 70%, similar a la que obtuvieron estos autores.
Por otro lado, y de forma similar a lo obtenido por otros autores21,22, los resultados de puntuación en olfación han sido ligeramente menores en los pacientes con TE que en controles sanos, sin que estas diferencias fueran estadísticamente significativas.
La hiperecogenicidad de la SN, visualizada mediante ecografía transcraneal, se identifica en aproximadamente en el 90% de los pacientes con EP y en el 10% de los sujetos sanos.
Se trata de un marcador que además de aparecer en fases muy precoces de la EP, y mantenerse estable en su evolución23, parece mostrar en sujetos sin enfermedad conocida un riesgo aumentado de presentarla, al encontrarse una prevalencia aumentada en condiciones con una asociación conocida a la EP24.
Más recientemente se ha evidenciado como factor de riesgo en sujetos sanos de desarrollar EP en un estudio longitudinal a 3 años25, con un riesgo relativo de 17.
Sin embargo, la especificidad de este marcador también genera controversia, ya que puede aparecer, aunque en menor frecuencia, en otras enfermedades neurodegenerativas, como parkinsonismos atípicos (atrofia multisistema, parálisis supranuclear progresiva) y en la ataxia espinocerebelosa26. Incluso en sujetos sin enfermedad neurológica conocida, puede aparecer esta hiperecogenicidad aumentada, describiéndose según series en un 10% de los sujetos sanos aproximadamente, con cierta relación positiva con la edad.
En nuestra población de EP, hallamos este marcador en un 83,3% de los pacientes, prevalencia similar a las descritas en la literatura, así como en un 9,5% de los pacientes con TE y un 10% de los controles.
Es necesario recalcar las limitaciones de nuestro estudio. En primer lugar, el investigador que realiza los estudios ecográficos no es completamente ciego al diagnóstico del paciente, ya que parte de los pacientes procedían de su consulta y podía conocer el diagnóstico en el momento de la evaluación de los marcadores. Aunque en la evaluación olfativa consideramos que este sesgo tiende a ser nulo, para intentar minimizar este impacto en los estudios ecográficos, las imágenes eran grabadas y posteriormente, y de forma anónima, eran medidas offline.
Por otro lado, no disponemos de un normograma en una población española con el SS-12. Hemos empleado el normograma publicado por Hummel et al.12 realizado en población germana y con la posibilidad de que los factores culturales y raciales pueden influir en los resultados. Estudios posteriores, centrados en población sana de nuestro entorno, tendrán que validar cuál es el criterio óptimo para definir la alteración olfativa.
Por último, los controles eran seleccionados entre acompañantes y otros pacientes de la consulta, aunque todos ellos sin antecedentes personales ni familiares de enfermedad neurodegenerativa, trastorno del movimiento ni alteración olfativa conocida, por lo que pueden no representar adecuadamente a la población general y comprometer nuestra validez externa.
Concluimos que nuestros hallazgos apoyan la utilidad de emplear de forma combinada la evaluación ecográfica de la SN y la evaluación olfativa mediante SS-12 en el proceso diagnóstico de los pacientes con EP. La elevada especificidad y el valor predictivo positivo que muestran, junto a su inocuidad, corto tiempo y fácil aplicación en el ámbito de la neurología clínica, los convierten en una herramienta prometedora dentro del proceso diagnóstico de los pacientes con parkinsonismo, seleccionando a pacientes con elevado riesgo de presentar EP.
Futuros estudios tendrán que dilucidar su papel en las fases más precoces de la enfermedad, incluso en sujetos asintomáticos, incluyendo muestras amplias de pacientes con otras causas de parkinsonismo, quizás mejorando nuestra capacidad de diagnosticar más precozmente la enfermedad y, posiblemente, ayudando en la selección de pacientes candidatos para estudios de desarrollo de terapias modificadoras de la enfermedad.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses. No se ha recibido ninguna financiación externa para la realización de este trabajo.
Este trabajo fue presentado como comunicación oral durante la LXIV Reunión Anual de la Sociedad Española de Neurología, celebrada en Barcelona en 2012.