Presentamos el caso de una niña de 6 años, sin antecedentes de interés y con desarrollo psicomotor normal, que ingresa en la unidad de cuidados intensivos pediátricos tras convulsión generalizada con nivel de conciencia disminuido. Asocia cuadro catarral de 36h de evolución con un pico febril aislado de 39,6°C.
Al ingreso destaca disminución del nivel de conciencia (Glasgow 6-7) con movilidad exclusivamente tras estímulos vigorosos, movimientos oculares extrínsecos sin limitaciones en maniobra de ojos de muñeca, y disfagia sin otros signos de afectación troncoencefálica. Se realiza TC craneal, donde se observan lesiones hipodensas subcorticales y en tálamos bilaterales. En la analítica sanguínea presenta datos compatibles con fallo multiorgánico: hipertransaminasemia, coagulopatía, trombocitopenia y daño renal agudo. En el análisis del líquido cefalorraquídeo destaca leve hiperproteinorraquia (31mg/dl) y leucorraquia (38/μl), con predominio polimorfonuclear (70%).
Ante la sospecha inicial de encefalitis infecciosa se inician antibióticos y aciclovir, que se suspende con la negatividad de las pruebas microbiológicas.
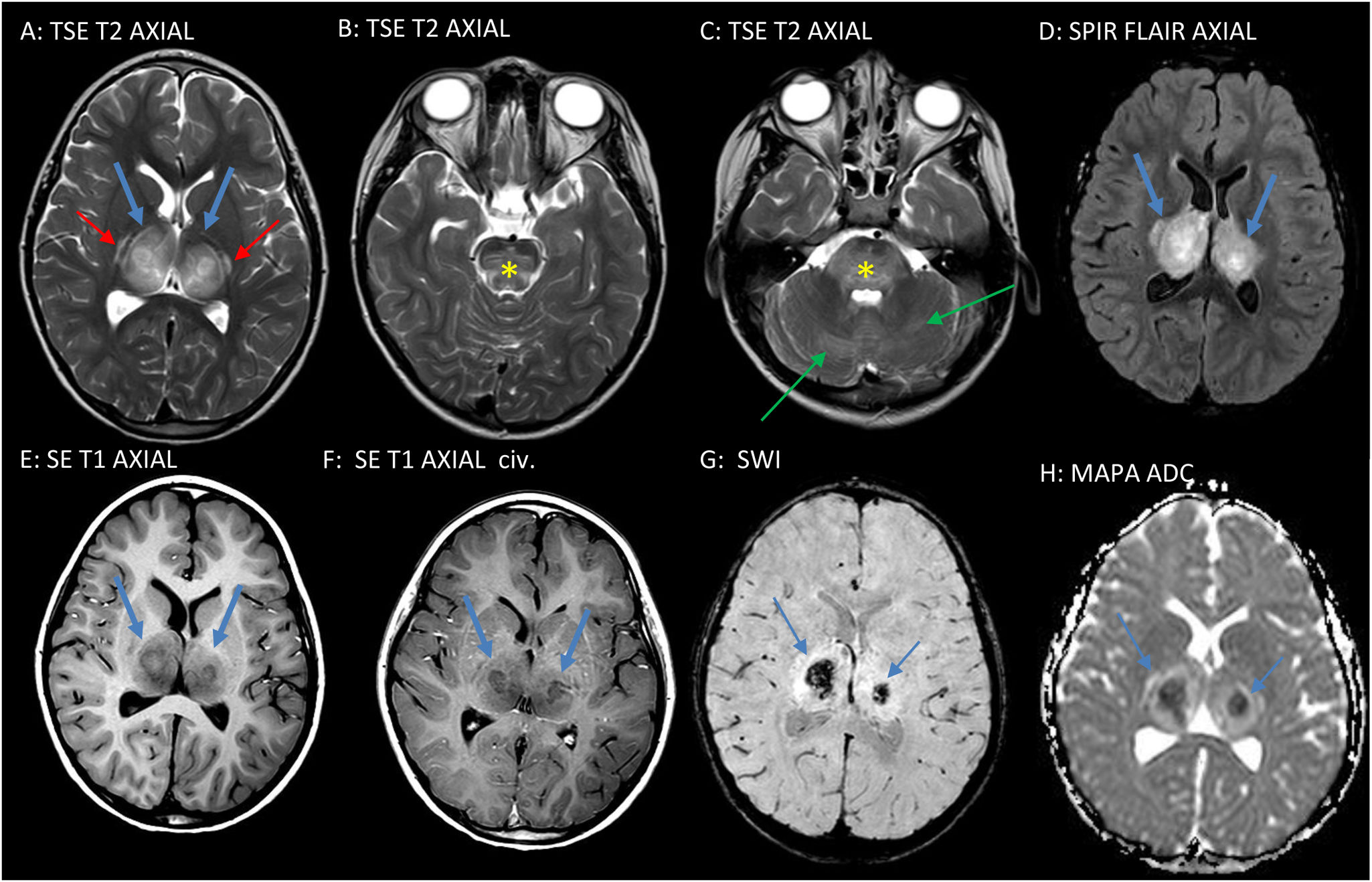
A las 36h de ingreso, persiste Glasgow de 6, ausencia de respuesta verbal y contacto ocular e importante bruxismo. No presenta crisis convulsivas. Se realiza resonancia magnética cerebral, que muestra lesiones bilaterales en tálamos, cápsulas internas, troncoencéfalo y cerebelo, así como zonas hemorrágicas en tálamos y protuberancia, compatibles con encefalitis aguda necrosante (EAN) (fig. 1). Ante una puntuación de gravedad 8 (riesgo alto), se inicia corticoterapia con metilprednisolona intravenosa 30mg/kg/día durante 5 días e inmunoglobulinas 2g/kg.
RM craneal que muestra aumento de volumen de ambos tálamos, con lesiones bilaterales y simétricas, hiperintensas en TSE T2 y SPIR FLAIR (flechas azules en A y D), con un centro aún más hiperintenso. En la secuencia SE T1 (flechas azules en E), dichas lesiones aparecen hipointensas, con un centro hiperintenso. El área central más hiperintensa en T1 muestra, en la segunda SWI, señal hipointensa compatible con hemosiderina por sangrado previo (flechas azules en G). Tras la administración de contraste intravenoso no muestran realce (flechas azules en F) y presentan restricción de la difusión en el mapa ADC (flechas azules en H). También se observa hiperintensidad de señal en TSE T2 y FLAIR de ambas cápsulas internas (flechas rojas en A), aumento de tamaño e hiperintensidad de señal del tronco del encéfalo, más evidente en la protuberancia (asterisco en B y C), y lesiones hiperintensas en T2 y FLAIR corticosubcorticales en ambos hemisferios cerebelosos (flechas verdes en C). Además, presentaba 2 lesiones focales en la sustancia blanca periventricular y 2 corticales milimétricas no mostradas.
A las 48h de ingreso se obtiene PCR en exudado nasofaríngeo positiva para gripe A, iniciándose oseltamivir. Presenta elevación significativa de interleucina-6, con niveles máximos de 65,2pg/ml (valor normal<4,3pg/ml) a los 3 días. Ante la ausencia de mejoría neurológica se administra una dosis única de tocilizumab 12mg/kg a los 4 días del inicio de los síntomas tras la normalización de las transaminasas y la trombocitopenia.
A los 6 días presenta mejoría del nivel de conciencia, aunque persiste la hipotonía con imposibilidad de sostén cefálico, afasia motora y disfagia. Al alta, 25 días después, mantiene nivel de conciencia normal, elaboración de frases simples, marcha normal, signos de afectación cerebelosa y movimientos coreicos que precisan tratamiento con tetrabenazina. Se realizan estudios metabólicos y panel genético de encefalitis agudas (incluyendo gen RANBP2), que resultan negativos.
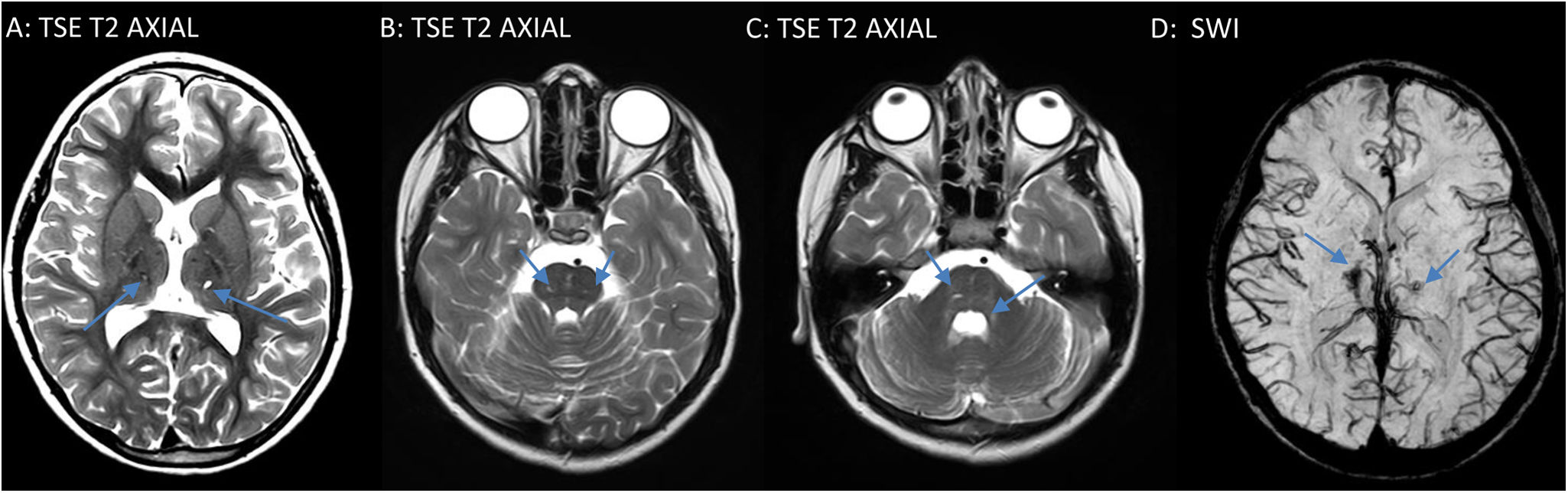
Tras un año de seguimiento persiste alteración cognitiva generalizada que abarca todos los dominios, con preservación de los procesos lingüísticos básicos. Mantiene temblor intencional distal con mejoría de los movimientos coreicos. Precisa rehabilitación neurocognitiva y logopedia. En la resonancia magnética de control realizada al año se objetivan pequeños focos de gliosis hemorrágicas bilaterales en ambos tálamos y protuberancia (fig. 2).
La EAN es una entidad rara en la infancia, cuya incidencia se estima en 1/1.000.000. Se caracteriza por un deterioro neurológico rápidamente progresivo asociado o no a crisis convulsivas durante los primeros 3 días de un cuadro infeccioso1.
En las pruebas de imagen suele observarse afectación bitalámica simétrica y en ocasiones de troncoencéfalo, así como proteinorraquia sin pleocitosis en líquido cefalorraquídeo. En la mayoría de los casos, no se objetivan aislamientos virales en líquido cefalorraquídeo ni existen signos de encefalitis en las autopsias2–4.
La etiología de la EAN no está clara. Se ha asociado a infecciones por parainfluenza, HHV6, parvovirus B19, enterovirus, SARS-CoV-2 (entre otros) y hasta un 10% a infecciones por gripe A y gripe B2,5,6.
La patogenia exacta es desconocida. Actualmente la hipótesis más aceptada es que el daño neurológico es secundario a una respuesta inmunitaria exagerada a un trigger infeccioso, desencadenando una tormenta de citocinas y elevación de interleucina-61,5,7,8. La EAN puede ser secundaria a una predisposición genética, habiéndose asociado a mutaciones del gen RANBP2, relacionado con una proteína nuclear que puede alterar la síntesis de citocinas2.
El tratamiento de primera línea de la EAN es la inmunoterapia con corticoides, asociada a inmunoglobulinas o plasmaféresis para intentar disminuir los niveles de citocinas proinflamatorias circulantes1,2,4.
Los pacientes diagnosticados de EAN tienen un mal pronóstico, con una elevada tasa de mortalidad (39%) y secuelas neurológicas y cognitivas. Menos del 10% logra una recuperación completa1. Entre los factores que asocian un peor pronóstico destacan las lesiones troncoencefálicas, una edad>4 años, shock al inicio del cuadro, trombocitopenia o hiperproteinorraquia>60mg/dl9.
Existen casos descritos sobre la administración de tocilizumab (anticuerpo monoclonal inhibidor del receptor de interleucina-6). Bloquear dicho receptor puede producir un efecto beneficioso durante la tormenta de citocinas y disminuir el daño secundario por excitotoxinas. Su administración precoz (preferiblemente en las primeras 24h) puede mejorar el pronóstico a corto y largo plazo en estos pacientes, incluso en aquellos con factores de mal pronóstico7,8.