Evaluar las tendencias temporales de la mortalidad por esclerosis múltiple (EM) en la población española (1981-2020), considerando la influencia de los efectos independientes de sexo, edad, periodo y cohorte de nacimiento.
MétodosLas defunciones por EM y las poblaciones necesarias para los cálculos se obtuvieron del Instituto Nacional de Estadística. Las tasas de mortalidad estandarizadas por edad (ASMR) y el análisis de tendencias se realizaron mediante el programa informático de regresión joinpoint. Se realizó un análisis edad-periodo-cohorte (APC) utilizando la herramienta estadística disponible en la web del Instituto Nacional del Cáncer de Estados Unidos para explorar la razón subyacente de la mortalidad por EM.
ResultadosLa ASMR aumentó significativamente tanto en mujeres como en hombres (1,7% y 1,2%, respectivamente). El análisis joinpoint no detectó ningún cambio de tendencia para las mujeres, pero para los hombres detecta un primer periodo en el que las tasas permanecen estables (1981-2000; cambio porcentual anual: −0,7%, no significativo) seguido de un periodo de aumento significativo (2000-2020; 2,6%, p<0,05). En cuanto a los efectos de periodo, se observó un aumento constante entre las mujeres desde principios de la década de 1990 y entre los hombres desde finales de esa misma década. Se detectó un aumento de la mortalidad relacionado con la cohorte de nacimiento: las mujeres nacidas a partir de 1916 ven aumentar su riesgo de mortalidad por EM hasta alcanzar un máximo en 1956, tras lo cual disminuye. En los hombres se observa un patrón similar, aunque con una década de retraso (de 1926 a 1966).
ConclusionesLa ASMR muestra un aumento constante en ambos sexos en las últimas décadas, aunque ha sido más intenso en los hombres. El patrón decreciente de la cohorte de nacimiento para la mortalidad por EM en hombres nacidos desde mediados de la década de 1960 y mujeres nacidas desde mediados de la década de 1950 es similar a los análisis de APC en otros países.
Assess time trends in mortality from multiple sclerosis (MS) in the Spanish population (1981-2020), considering the influence of independent effects of gender, age, period, and birth cohort.
MethodsMS deaths and populations needed for calculations were obtained from the National Institute of Statistics. Age-standardised mortality rates (ASMR) and trend analysis were performed using joinpoint regression software. Age-period-cohort (APC) analysis was performed using the web-based statistical tool of the US National Cancer Institute to explore the underlying reason for the MS mortality.
ResultsASMR increased significantly in both women and men (1.7% and 1.2% respectively). The joinpoint analysis detected no trend change for women, but for men it detects a first period where rates remain stable (1981-2000; annual percentage change: −0.7%, not significant) followed by a period of significant increase (2000-2020; 2.6%, P<.05). For period effects, a steady increase was observed among women since the early 1990s and among men since the late 1990s. A birth cohort-related increase in mortality was detected: women born from 1916 onwards see their risk of MS mortality increase until it peaks in 1956, after which it decreases. A similar pattern is observed in men, albeit with a decade delay (from 1926 to 1966).
ConclusionASMR shows a steady increase in both sexes over the last decades, although it has been more intense in men. The decreasing birth cohort pattern for MS mortality in men born since the mid-1960s and women born since the mid-1950s is similar to APC analyses in other countries.
La esclerosis múltiple (EM) es una enfermedad inflamatoria, desmielinizante y neurodegenerativa que en 2020 afectaba a unas 55.000 personas en España, aproximadamente 500.000 en Europa y unos 2,8 millones de personas en todo el mundo1. En los países desarrollados es la principal causa de discapacidad no traumática en adultos jóvenes2.
Se ha observado un aumento de la prevalencia de EM en varios países3,4, entre ellos España5, que se ha atribuido a las mejoras en el diseño de los estudios epidemiológicos, al diagnóstico y manejo de las complicaciones que han mejorado la supervivencia y al crecimiento global de la población6. La incidencia también ha aumentado, pero esto se ha atribuido a una detección más exhaustiva de nuevos casos en los últimos años7,8.
Las diferencias entre cohortes de nacimiento en las tasas de enfermedad son el objetivo clave del análisis edad-periodo-cohorte (A-P-C), que se utiliza desde hace tiempo en la investigación sobre el cáncer9,10 y el suicidio11, pero que también se ha empleado para la EM, tanto en nuestro país12 como en otros13,14, ya que las diferentes hipótesis sobre su etiopatogenia se han centrado en factores de riesgo que actúan en etapas tempranas de la vida.
El análisis A-P-C separa los distintos componentes de la tendencia temporal, cuantificando los eventos relacionados con la edad, el periodo de fallecimiento y la cohorte de nacimiento. Estos factores suelen tener efectos diferentes sobre los mecanismos biológicos subyacentes y los desencadenantes de enfermedades de causa incierta, como la EM. Así, los efectos específicos de la edad sugieren que las exposiciones y/o eventos relacionados con la edad que influyen en el riesgo de EM y los efectos del periodo de muerte tienen diferentes patrones de detección de casos de EM relacionados con cambios en la forma de identificar los casos (mejora del diagnóstico, cambio en la clasificación, etc.), mientras que los efectos de la cohorte de nacimiento pueden sugerir que los patrones de los factores de riesgo difieren de una cohorte de nacimiento a otra15. En este contexto, nos propusimos actualizar la información sobre mortalidad por EM en España y analizar los cambios en las tendencias temporales durante el periodo 1981-2020 utilizando el análisis A-P-C.
MétodosFuente de datosLos datos sobre muertes por EM para el periodo de estudio (1981-2020) y los datos poblacionales correspondientes fueron proporcionados por el Instituto Nacional de Estadística. Los códigos utilizados fueron el 340 para la novena edición y el código G35 para la décima edición de la Clasificación Internacional de Enfermedades (CIE).
Análisis estadísticoSe utilizó el programa informático Joinpoint Regression (desarrollado por el Instituto Nacional del Cáncer de EE.UU. para el análisis de datos del Programa de Vigilancia Epidemiológica y Resultados Finales) (disponible en https://surveillance.cancer.gov/joinpoint/) para calcular las tasas de mortalidad estandarizadas por edad y sexo (age-standardised mortality rates [ASMR]) utilizando el método directo (población estándar europea) y analizar las tendencias temporales.
Para aplicar el modelo A-P-C, el conjunto de datos se organizó en ocho periodos de 5años, de 1981-1985 a 2016-2020, y 11 grupos de edad de 5años, de 30-34 a 80-84 años. Esto determinó 18 cohortes de nacimiento (etiquetadas por año central de nacimiento, de 1901 a 1986). Para cada grupo de edad y periodo de 5años se calcularon las tasas de mortalidad específicas por edad.
Los efectos del A-P-C de muerte se evaluaron utilizando la herramienta web del modelo APC (Biostatistics Branch, National Cancer Institute, Bethesda, MD. https://analysistools.nci.nih.gov/apc/).
Para nuestros resultados, nos centramos principalmente en las funciones estimadas16: tasas longitudinales específicas por edad, razones de tasas (RR) específicas por periodo y cohorte, así como local drift (cambios porcentuales anuales para cada grupo de edad) con net drift (indica el cambio porcentual anual global). El grupo de edad central, el año natural central y el grupo de cohorte de nacimiento central sirvieron como grupos de referencia en todos los análisis A-P-C. Se utilizaron pruebas de chi-cuadrado de Wald para determinar la significación de las funciones estimables. El umbral de significación estadística se estableció en p<0,05 para todas las pruebas estadísticas de dos colas.
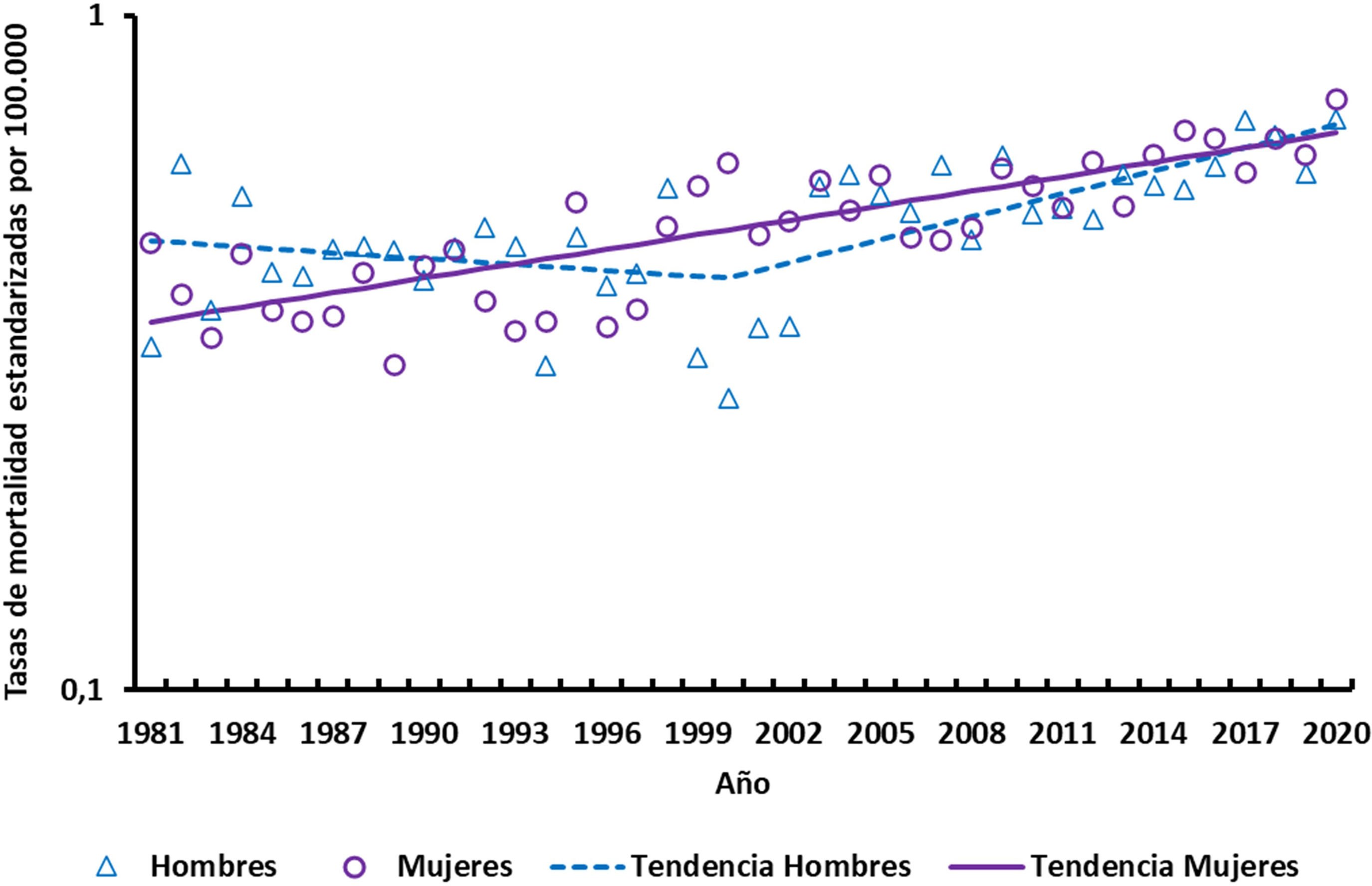
ResultadosEn los 40 años de nuestro estudio se han analizado 6.940 muertes por EM (3.949 en mujeres y 2.991 en hombres, con una proporción mujer/hombre de 1,3). Para los hombres, hay un aumento anual del 5% en el número de muertes (de 39 en 1981 a 121 en 2021). En el caso de las mujeres, se observa un aumento similar, de 66 muertes en 1981 a 183 en 2020 (aumento anual del 4%). Esta tendencia se refleja en la ASMR, que aumenta significativamente (p<0,05) tanto en mujeres como en hombres (cambio porcentual medio anual: durante el periodo de estudio 1,7% anual en mujeres y 1,2% anual en hombres). El análisis joinpoint no detecta un cambio de tendencia en las mujeres, pero en los hombres detecta un primer periodo en el que las tasas permanecen estables (1981-2000; cambio porcentual anual: −0,7%, no significativo) seguido de un periodo de aumento significativo (2000-2020; cambio porcentual anual: 2,6%, p<0,05) (fig. 1). Las ASMR fueron muy similares para hombres y mujeres, con una proporción mujeres/hombres de 1,0 (oscilando entre 0,6 en 1982 y 2,2 en 2000).
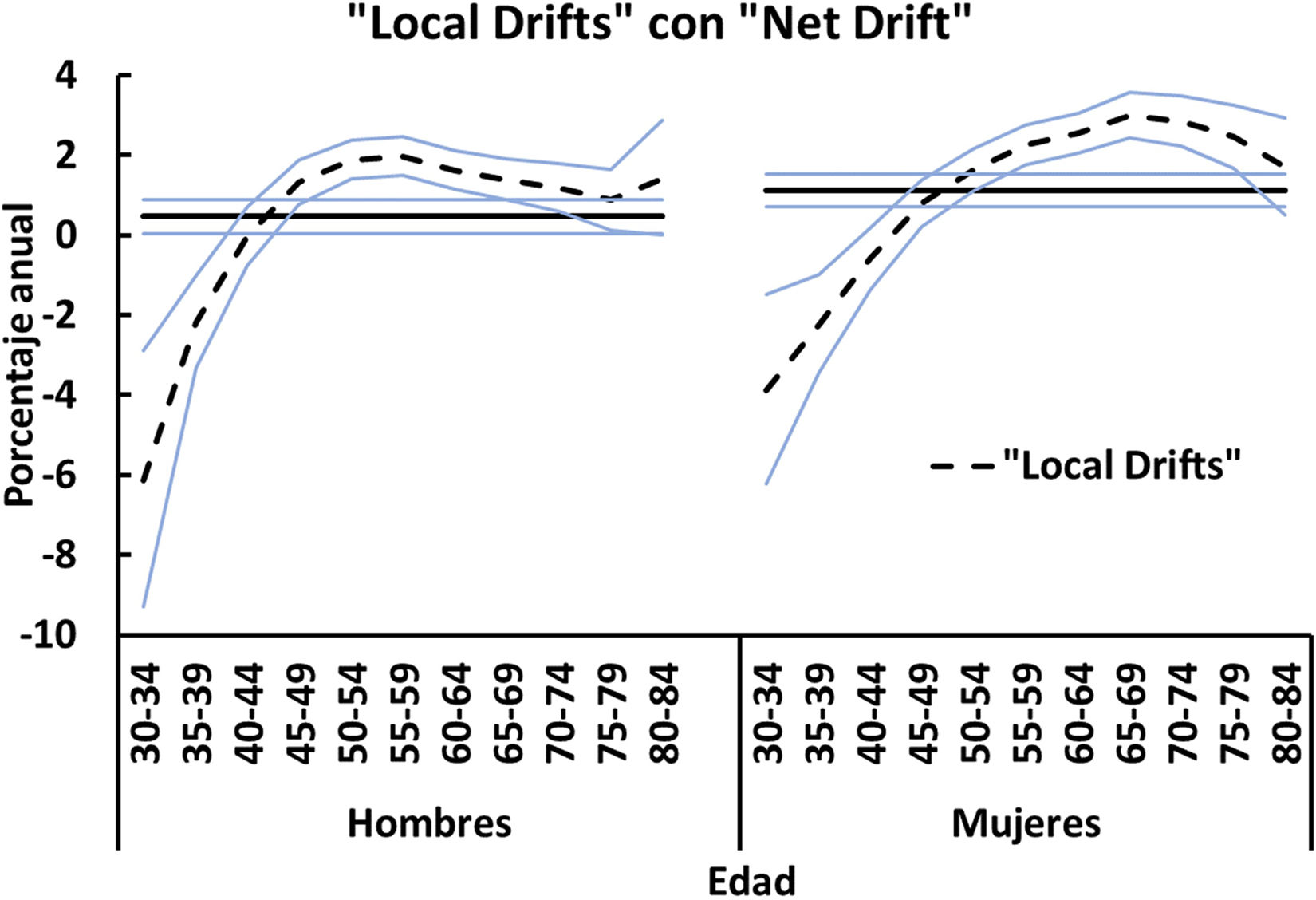
En los hombres, el cambio porcentual anual estimado (net drift) para los grupos de edad incluidos (30-84años) fue del 0,5% (p<0,05) y en las mujeres, del 1,1% (p<0,05). Tanto en los hombres como en las mujeres las tasas disminuyen significativamente por debajo de los 40años y aumentan por encima de los 44años. El grupo de edad de 40-44años permanece estable durante el periodo de estudio. En la figura 2 se muestra el cambio porcentual anual (local drift) por sexo para cada grupo de edad durante todo el periodo de estudio.
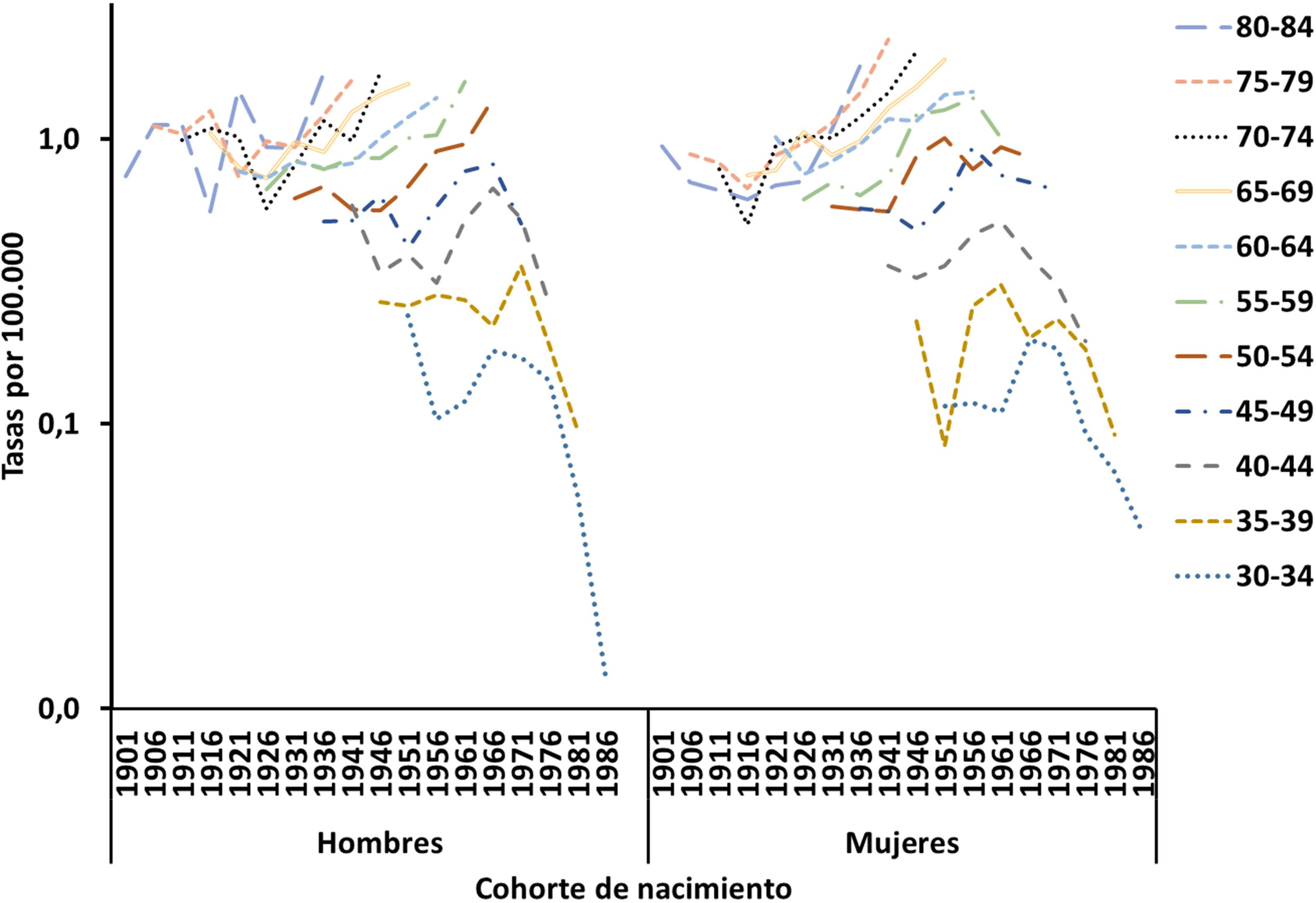
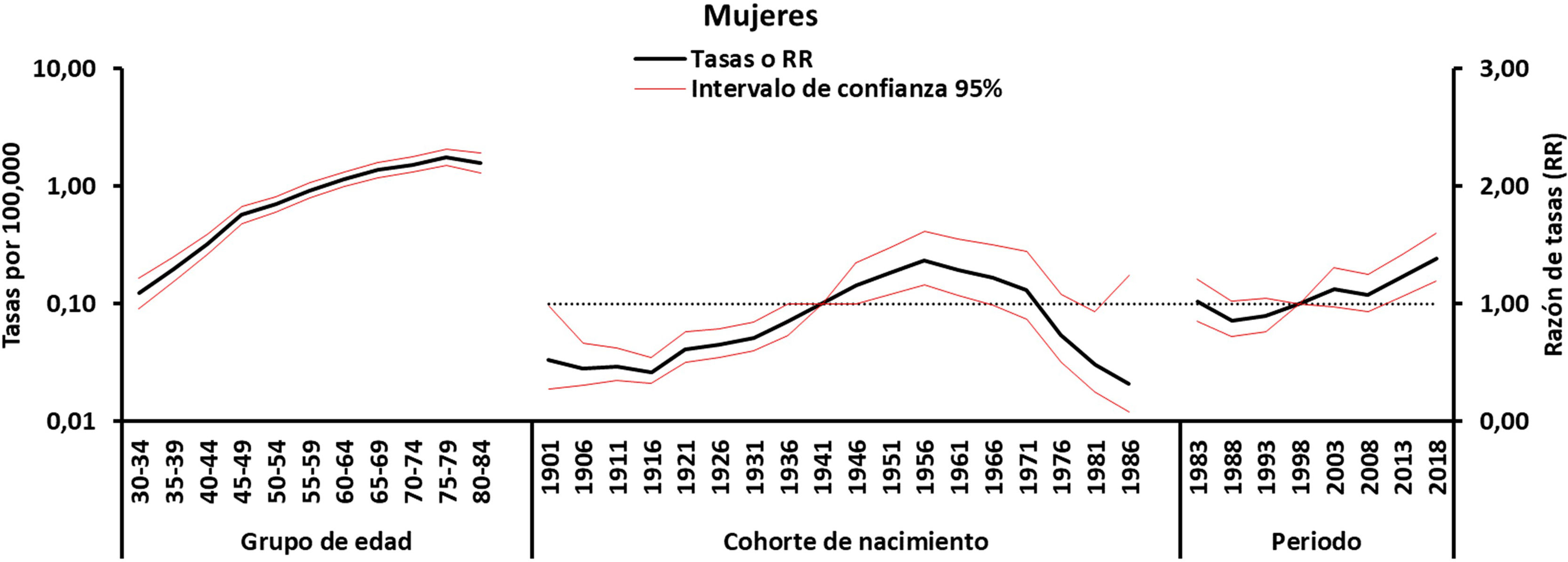
La figura 3 muestra las tendencias de las tasas de mortalidad por EM para hombres y mujeres por grupo de edad según el año de nacimiento (1902-1987) en España. Para ambos sexos, las tasas de cohortes de edad aumentaron para las personas mayores, pero disminuyeron para los grupos de edad más jóvenes, aunque para las mujeres esto se observó desde principios de los años sesenta y para los hombres desde finales de los setenta.
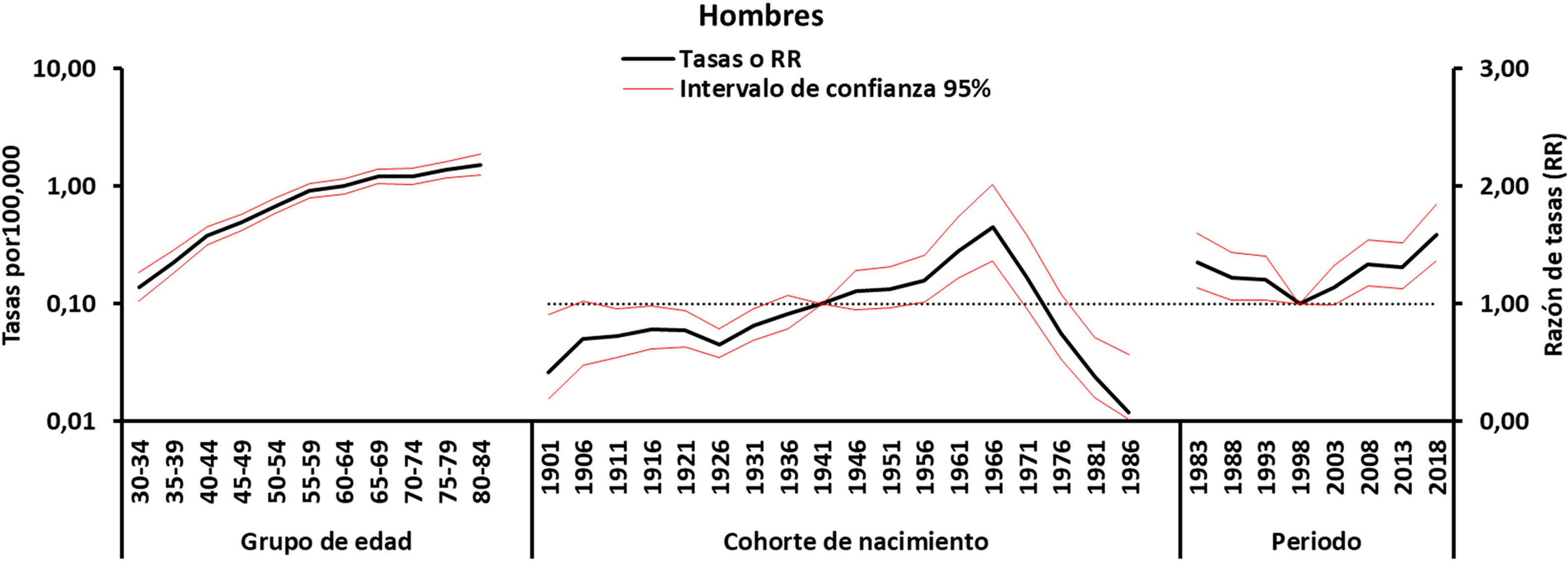
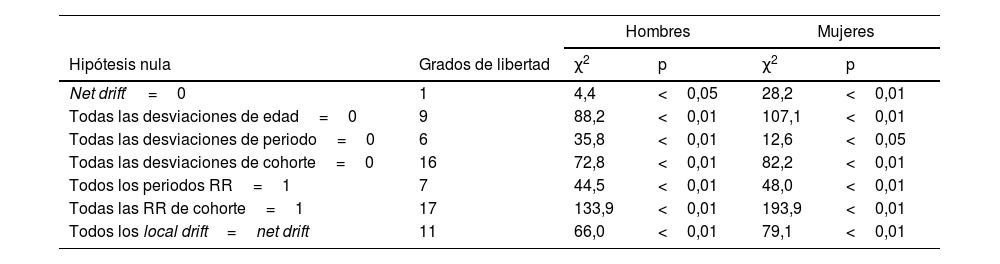
Los estimadores obtenidos a partir del modelo final de edad, periodo, cohorte para cada sexo se muestran en las figuras 4-5. El efecto edad (curva transversal de edad) se representa en escala logarítmica, dado que las tasas específicas aumentan exponencialmente en relación con esta variable y son interpretables como tasas esperadas de mortalidad específica por edad en el periodo de referencia ajustadas por efectos de cohorte. Los efectos de periodo y cohorte pueden interpretarse como cocientes de tasas (RR) específicos por edad en cada periodo o cohorte en relación con el periodo o cohorte de referencia. Los RR de cohorte y de periodo fueron estadísticamente significativos para ambos sexos (p<0,01), al igual que los net drift y los local drift (tabla 1).
Pruebas de chi-cuadrado de Wald para las funciones estimables en el modelo Edad-Periodo-Cohorte. Mortalidad por esclerosis múltiple en España 1981-2020 por sexo
| Hombres | Mujeres | ||||
|---|---|---|---|---|---|
| Hipótesis nula | Grados de libertad | χ2 | p | χ2 | p |
| Net drift’=0 | 1 | 4,4 | <0,05 | 28,2 | <0,01 |
| Todas las desviaciones de edad=0 | 9 | 88,2 | <0,01 | 107,1 | <0,01 |
| Todas las desviaciones de periodo=0 | 6 | 35,8 | <0,01 | 12,6 | <0,05 |
| Todas las desviaciones de cohorte=0 | 16 | 72,8 | <0,01 | 82,2 | <0,01 |
| Todos los periodos RR=1 | 7 | 44,5 | <0,01 | 48,0 | <0,01 |
| Todas las RR de cohorte=1 | 17 | 133,9 | <0,01 | 193,9 | <0,01 |
| Todos los local drift=net drift | 11 | 66,0 | <0,01 | 79,1 | <0,01 |
En cuanto a los efectos de período, se produjo un aumento sostenido en las mujeres a partir de principios de la década de 1990. En el caso de los hombres, se produjo un marcado aumento desde 1999, pero estuvo precedido por una estabilización del riesgo en los años anteriores.
Se detectó un aumento de la mortalidad relacionado con la cohorte de nacimiento: las mujeres nacidas a partir de 1916 ven aumentar su riesgo de mortalidad por EM hasta alcanzar un máximo en 1956, tras lo cual disminuye. En los hombres se observa un patrón similar, aunque con una década de retraso (de 1926 a 1966).
DiscusiónNuestros resultados muestran un análisis completo y actualizado de las tendencias temporales de la mortalidad por EM en España, según sexo y componentes temporales (edad, periodo y cohorte). Muestran ligeras diferencias en las tasas y tendencias entre hombres y mujeres.
En España, aunque la ASMR muestra un aumento constante en ambos sexos en las dos últimas décadas, ha sido más intenso en los hombres. Al igual que en un estudio anterior, los ASMR fueron muy similares en ambos sexos17.
En Estados Unidos, las tasas de mortalidad por EM parecen haber aumentado de forma constante durante el periodo comprendido entre 1999 y 2015, independientemente del sexo18. En Italia (1980-2015) se observó un descenso significativo de las tasas entre 1980 y 1995 en los hombres y hasta 1999 en las mujeres. Este descenso fue seguido de un aumento significativo en ambos sexos, pero más marcado en las mujeres (1,9% y 2,3% en hombres y mujeres, respectivamente)19.
Estas tendencias podrían deberse a cambios relacionados con la edad en el riesgo de morir por EM (efectos de edad), cambios en las clasificaciones de las causas de muerte, efectos a corto plazo de las mejoras diagnósticas y los tratamientos que reducirían la mortalidad por EM cerca de la muerte (efectos de periodo) y cambios relacionados con la cohorte de nacimiento a la que se pertenece (efectos de cohorte).
Efectos de la edadSe observa un rápido aumento de las tasas específicas por edad en ambos sexos (fig. 5). La proporción entre mujeres y hombres se sitúa en torno a1, y solo en los grupos de edad de 70-79años las mujeres presentan tasas ligeramente superiores a las de los hombres (1,3 proporción entre mujeres y hombres). Las mayores tasas de mortalidad entre los grupos de mayor edad son similares a las observadas en otros estudios y pueden estar mediadas por la inmunosenescencia y el mayor riesgo de infecciones, tumores y enfermedades autoinmunes a estas edades20.
Efecto del periodo de fallecimientoLos efectos de periodo suelen asociarse a cambios en el diagnóstico y la clasificación de la enfermedad, que obviamente ha cambiado considerablemente durante nuestro periodo de estudio. Nuestros resultados muestran un aumento constante en ambos sexos, aunque con un retraso de una década en el caso de los hombres (fig. 5), cuyas tasas se habían mantenido estables anteriormente. En ambos casos, el diagnóstico de EM se basaba únicamente en los hallazgos clínicos, ya que hasta 2001 (año de adopción de los criterios de McDonald) no se introdujeron criterios radiográficos y de laboratorio. Estos criterios se han revisado en varias ocasiones hasta la última revisión en 201721, lo que puede haber influido en la detección de casos (incidencia y prevalencia) y, por tanto, en las tendencias observadas en la mortalidad22. Los cambios en los criterios de diagnóstico de la EM en los últimos 25años han llevado a un diagnóstico más precoz y al inicio del tratamiento modificador de la enfermedad (TME) y, por tanto, han reducido el riesgo de progresión de la discapacidad23. Dado que las personas suelen vivir con EM durante muchos años, los factores que contribuyeron al cambio en la precisión diagnóstica deben haber existido antes de que se produjera realmente el cambio en la mortalidad relacionada con la EM. El aumento en la mortalidad relacionada con la EM en las últimas décadas puede deberse no solo al aumento en la prevalencia de la enfermedad, sino también al uso más extendido de la resonancia magnética, que mejora la precisión diagnóstica incluso en pacientes mayores. Sin embargo, es posible que el aumento en la detección de casos de inicio tardío también sea un factor contribuyente debido a la mayor disponibilidad de la resonancia magnética desde 1995. En España, a pesar de la introducción de los TME desde la década de 1990, del diagnóstico más precoz y de la mejor atención disponible para la EM, no se observa una mejoría en la tendencia de la mortalidad por EM. Por el contrario, seguimos observando una tasa de mortalidad creciente, independientemente del sexo, en todos los grupos mayores de 49años. El efecto de los TME es probablemente difícil de medir en las personas mayores debido a la evolución de la enfermedad. Un metaanálisis de ensayos clínicos de EM apoya la noción de que la edad es un modificador esencial de la eficacia de los TME, y sugiere que no hay beneficio predicho en recibir TME después de los 53años24.
Las revisiones de la CIE de la CIE-9 a la CIE-10 podrían influir en la evolución de las tendencias de mortalidad. Sin embargo, los estudios que evalúan los efectos de las revisiones de la CIE han documentado buenas tasas de inter-comparabilidad para la clasificación de enfermedades entre revisiones25.
Efectos de cohorteEl efecto de cohorte se refiere a la exposición a lo largo de la vida a factores de riesgo de enfermedad compartidos a lo largo de una generación. El patrón decreciente por cohorte de nacimiento para la mortalidad por EM en varones nacidos desde mediados de la década de 1960 y mujeres nacidas desde mediados de la década de 1950 (fig. 5), tras un periodo inicial de aumento, es similar a los hallazgos de análisis de A-P-C en otros países.
Un estudio26 basado en datos de 25 países durante el periodo 1951-2009 halló que las estimaciones por cohorte de nacimiento alcanzaron su máximo para las cohortes nacidas en la primera mitad del sigloxx y agrupó a los países en cinco grupos. Un primer grupo, formado por los países de Europa occidental y central, que alcanzó su máximo en torno a la década de 1920. Un segundo grupo (Dinamarca, Suecia, Italia, Irlanda y Escocia) que alcanzó su máximo en las cohortes nacidas en las décadas de 1920 y 1930. El tercer grupo (países de la Commonwealth, EE.UU. y Noruega) tuvo un pico doble o prolongado que comenzó en las décadas de 1910 o 1920 y terminó en la de 1950. El cuarto grupo (países mediterráneos y Finlandia) se caracterizó por un aumento sostenido hasta los años cincuenta. El quinto grupo, con los países de Europa del Este y Japón, no mostró un patrón particular.
El aumento de la proporción entre mujeres y hombres en la EM se ha atribuido a efectos de cohorte, ya que las mujeres de las cohortes de nacimiento más recientes pueden haber estado más expuestas o haber sido más vulnerables a los factores de riesgo ambientales que los hombres27.
Factores ambientales y de estilo de vida como la deficiencia de vitaminaD, el tabaquismo y la infección por el virus de Epstein-Barr28, que interactúan con factores genéticos, pueden contribuir a la susceptibilidad y a la gravedad de la enfermedad29.
Un estudio reciente (con datos de Reino Unido, Canadá, Países Bajos, Escocia, Suiza y Estados Unidos desde 1951 hasta 2020) sugiere que los patrones de cohortes de nacimiento observados al analizar la mortalidad por colitis ulcerosa, enfermedad de Crohn, linfoma de Hodgkin y EM pueden deberse al hecho de que estas pueden compartir un factor de riesgo ambiental común. Un hallazgo similar al de otro estudio sugiere que los patrones observados en las estimaciones del efecto de cohorte indicarían que el desarrollo de la enfermedad de Crohn y el de la EM se vieron influidos por la exposición a factores de riesgo en etapas tempranas de la vida30. Dicho factor de riesgo podría estar relacionado con el virus de Epstein Barr o su adquisición en una etapa temprana de la vida del paciente.
El tabaquismo y la obesidad tienen efectos perjudiciales sobre la función del sistema inmunitario y se han relacionado con la actividad y la progresión de la EM31,32. El aumento de la incidencia de EM observado en las mujeres danesas entre 1950 y 2009 se ha atribuido a un efecto de cohorte unido a un efecto de edad y periodo relacionado con los cambios en el estilo de vida de las mujeres, que puede incluir un menor número de nacimientos y un aumento de la obesidad y el tabaquismo33.
En España, los hombres empezaron a fumar durante la guerra civil y su prevalencia ha descendido desde la década de 1970 hasta la actualidad34. En las mujeres, la prevalencia del tabaquismo empezó a aumentar en la década de 1960 y disminuyó en 2006, aunque este descenso ha sido muy leve hasta los datos de prevalencia actuales35. La obesidad en los primeros años de vida se ha asociado significativamente con un mayor riesgo de EM36. Además, recientemente se ha revelado que el tejido adiposo es un órgano endocrino activo con capacidad para desencadenar inflamación crónica a través de las adipoquinas37. En España, durante las últimas décadas, se ha observado un aumento de la prevalencia de obesidad en casi todos los grupos de edad y sexo38,39.
Este estudio tiene varias limitaciones derivadas de la fuente de datos utilizada. Al no disponer de datos de incidencia, utilizamos datos de mortalidad procedentes de los certificados de defunción, que son la única fuente de datos disponible que cumple los criterios de continuidad y globalidad40. Los datos de mortalidad están limitados por el carácter incompleto de los registros de defunción y los escasos datos clínicos disponibles. Por lo tanto, en este estudio no se realizaron análisis estratificados por tipo de EM. Sin embargo, tienen la ventaja de poder disponer de datos estandarizados recogidos de forma rutinaria durante un largo periodo de tiempo. Además, aunque se ha hecho hincapié en las restricciones de los resultados epidemiológicos basados en estudios de mortalidad, siguen representando un elemento básico para comprender la enfermedad y sus determinantes. En segundo lugar, a pesar de la ventaja estadística de los modelos A-P-C, es necesaria cierta cautela a la hora de interpretar sus estimaciones debido a las conocidas deficiencias de este método. En este sentido, la variación aleatoria en las estimaciones de los parámetros clásicos del análisis A-P-C (especialmente de los efectos de las cohortes jóvenes, que a menudo se modelizan sobre números pequeños) puede dar lugar a proyecciones inexactas. Para evitarlo, utilizamos únicamente los grupos de edad de 30 a 84años.
Dada la naturaleza descriptiva de los análisis A-P-C, solo podemos sugerir posibles etiologías; de lo contrario, podríamos caer en la llamada falacia ecológica, que se produce cuando se asume que las relaciones identificadas en los datos a nivel de grupo son ciertas para los individuos41.
ConclusionesEn España, la ASMR muestra un aumento constante en ambos sexos en las dos últimas décadas, aunque ha sido más intenso en los hombres. El patrón decreciente de cohortes de nacimiento para la mortalidad por EM en hombres nacidos desde mediados de los años sesenta y mujeres nacidas desde mediados de los cincuenta es similar a los análisis de A-P-C en otros países. Esta epidemia oculta sugiere la existencia de factores de riesgo subyacentes desconocidos pero importantes para la EM.
- -
Pocos estudios han evaluado la mortalidad por esclerosis múltiple (EM) en España, y muchos de ellos tienen limitaciones, como analizar solo una región concreta del país o limitarse a registros hospitalarios.
- -
Analizamos las tendencias de la mortalidad por EM en España, durante un periodo de 40 años, utilizando efectos independientes de sexo, edad, periodo y cohorte.
- -
Las tasas de mortalidad por EM estandarizadas por edad han aumentado en ambos sexos durante las dos últimas décadas en España.
- -
Las tendencias en las cohortes de nacimiento han influido en el cambio del riesgo de EM a lo largo del sigloxx en España, al igual que en otros países europeos.
- -
Esta epidemia oculta sugiere la existencia de un factor de riesgo subyacente desconocido pero importante para la EM.
Esta investigación no ha recibido apoyo específico de instituciones del sector público, del sector comercial ni de organizaciones sin ánimo de lucro.
Consideraciones éticasDado que los datos extraídos del Instituto Nacional de Estadística fueron anonimizados, siguiendo los principios de buena práctica clínica y la Declaración de Helsinki, no se identificó a los participantes ni se accedió a información personal, este estudio no requirió el consentimiento del paciente ni la aprobación del comité ético (Ley 14/2007, de 3 de julio, de investigación biomédica [BOE, 4 de julio de 2007]) - PubMed, https://pubmed.ncbi.nlm.nih.gov/18201045/ (consultado el 27 de febrero de 2023).
Contribución de los autoresTodos los autores contribuyeron a la concepción y diseño del trabajo; la adquisición, análisis e interpretación de los datos; la redacción del trabajo y su revisión crítica para el contenido intelectual relevante; aprobaron la versión que se publicará; y son responsables de todos los aspectos del trabajo en garantizar que las cuestiones relacionadas con la exactitud o la integridad de cualquier parte del trabajo son debidamente investigados y resueltos.
Conflicto de interesesLos autores no declararon conflictos de intereses con respecto al contenido de este manuscrito.