La relación entre el trastorno del control de impulsos (TCI) y el trastorno de conducta del sueño REM (TCSR) no se ha aclarado todavía y los resultados de la literatura son contradictorios. Nuestro objetivo es valorar la asociación entre estos 2 trastornos y, a su vez, su presencia en dependencia de la terapia dopaminérgica.
MétodosUn total de 73 pacientes diagnosticados de enfermedad de Parkinson, en tratamiento con un único agonista dopaminérgico, fueron incluidos en el estudio, tras valoración clínica y habiendo completado el cuestionario de pregunta única para el TCSR y el cuestionario abreviado para los trastornos impulsivo-compulsivos en la enfermedad de Parkinson.
ResultadosLa edad media ± desviación estándar de los pacientes fue de 68,88±7,758 años. De ellos, 26 pacientes (35,6%) se clasificaron dentro de un TCSR-probable, presentando mayor prevalencia de síndrome rígido acinético no tremórico, más años de tratamiento con levodopa y con agonistas dopaminérgicos, y una relación significativa con el TCI (p=0,001) en comparación con el grupo sin TCSR-probable.
En cuanto al tratamiento con agonistas dopaminérgicos, se demostró la asociación significativa de la administración por vía oral con una mayor prevalencia de TCI, mientras que esta vía también se relacionó con mayor tendencia a desarrollar TCSR, diferencias en este caso no significativas.
ConclusionesNuestros datos confirman que el TCSR se relaciona con el TCI en la enfermedad de Parkinson.
The relationship between impulse control disorder (ICD) and REM sleep behaviour disorder (RBD) has not yet been clarified, and the literature reports contradictory results. Our purpose is to analyse the association between these 2 disorders and their presence in patients under dopaminergic treatment.
MethodsA total of 73 patients diagnosed with Parkinson's disease and treated with a single dopamine agonist were included in the study after undergoing clinical assessment and completing the single-question screen for REM sleep behaviour disorder and the short version of the questionnaire for impulsive-compulsive behaviours in Parkinson's disease.
ResultsMean age was 68.88 ± 7.758 years. Twenty-six patients (35.6%) were classified as probable-RBD. This group showed a significant association with ICD (P=.001) and had a higher prevalence of non-tremor akinetic rigid syndrome and longer duration of treatment with levodopa and dopamine agonists than the group without probable-RBD. We found a significant correlation between the use of oral dopamine agonists and ICD. Likewise, patients treated with oral dopamine agonists demonstrated a greater tendency toward presenting probable-RBD than patients taking dopamine agonists by other routes; the difference was non-significant.
ConclusionsThe present study confirms the association between RBD and a higher risk of developing symptoms of ICD in Parkinson's disease.
El trastorno de conducta del sueño REM (TCSR) es una parasomnia que se caracteriza por conductas motoras vigorosas, sueños de contenido desagradable y ausencia de atonía muscular durante la fase REM del sueño1. Esta alteración del sueño tiene predilección por alguna de las enfermedades neurodegenerativas, especialmente las sinucleinopatías, como la enfermedad de Parkinson (EP), la demencia por cuerpos de Lewy y la atrofia multisistémica2.
Todas las entidades en las que el TCSR está presente suelen compartir la característica de presentar una importante degeneración en el tronco del encéfalo, que probablemente altera las estructuras que en condiciones normales modulan el sueño REM. Por otra parte, el hecho de que el contenido de los sueños sea emocional, desagradable y angustioso indica que el sistema límbico, además del segmento mesopontino, también pueda estar implicado en la fisiopatología del TCSR1,3.
En el caso de la EP, la frecuencia del TCSR se ha reportado con un rango variable entre el 20 y el 72% en las diferentes series revisadas2 y puede preceder al inicio de los síntomas motores en años o incluso décadas.
Varios estudios han demostrado que los pacientes con Parkinson y TCSR tienen mayor afectación en los dominios motores y no motores, sugiriendo un proceso degenerativo más extenso4. Factores como mayor edad, la duración de la enfermedad, la mayor afectación motora con presencia de síndrome rígido acinético, las alucinaciones, la disfunción autonómica y las dosis elevadas de levodopa se asocian con el desarrollo de TCSR. En recientes investigaciones esta parasomnia se ha relacionado directamente con el aumento de riesgo de desarrollar trastorno de control de impulsos (TCI)4,5.
El desarrollo de TCI y conductas relacionadas (TCICR) es una complicación no motora de la EP. Se trata de alteraciones psicológicas caracterizadas por la incapacidad repetida y constante de resistir un impulso de realizar una acción que puede ser dañina para el paciente y para las personas que le rodean6. El espectro de estos trastornos comprende conductas como el punding (repetición de comportamientos estereotipados sin finalidad o utilidad concretas), el hobbysm (la búsqueda compulsiva de una afición, como la recogida o la limpieza), el walkabout (vagabundeo) y la alteración en el control de impulsos (sexuales, alimenticios, por comprar y por juegos de azar), e incluso la desregulación dopaminérgica. En todos ellos subyace la búsqueda de recompensa y su etiopatogenia parece estar relacionada con la reducción de los transportadores de dopamina en el estriado ventral7, la disfunción de la vía mesocorticolímica y la existencia de polimorfismos de los receptores D3 y D4 de la dopamina8. La prevalencia de estos trastornos en la EP se sitúa en torno al 8-28% de los pacientes, variando en función de la metodología de los diferentes estudios9-12, y se ha relacionado con menor edad de los pacientes, inicio temprano de los síntomas, historia familiar o personal de TCI, abuso de sustancias, trastorno bipolar e impulsividad4.
Dada la mayor severidad de los síntomas, tanto motores como no motores, en los pacientes con EP y TCSR, la hipótesis es que estos pacientes presentan alteraciones más severas en la vía dopaminérgica mesocorticolímbica, una de las bases fisiopatológicas del desarrollo del TCI.
En un intento de confirmar esta hipótesis planificamos un estudio en el que el objetivo principal fuera el valorar si existe una relación entre un TCSR probable y el desarrollo de TCICR.
Y si, por otro lado, el desarrollo de TCICR es una complicación no motora de la EP que se relaciona estrechamente con la terapia de reposición dopaminérgica (TRD)8; como objetivo secundario intentaremos ver si hay relación de ambos trastornos con el tratamiento parkinsoniano.
Pacientes y métodosEntre septiembre del 2014 y julio del 2015, un total de 73 pacientes diagnosticados de EP, según criterios clínicos13, pertenecientes a la consulta monográfica de EP de la Unidad de Trastornos del Movimiento del Hospital Clínico Lozano Blesa de Zaragoza, fueron incluidos en el estudio después de obtener el consentimiento informado. Todos ellos cumplían los criterios de inclusión y habían estado en tratamiento con un agonista dopaminérgico (AD) (pramipexol, ropinirol o rotigotina) al menos durante los 6 meses previos. Se excluyó a pacientes con deterioro cognitivo, psicosis, tratamientos previos con otros AD, estimulación cerebral profunda o perfusión continua de levodopa o apomorfina.
Se recogieron datos clínicos y demográficos de todos los pacientes (sexo, edad, inicio de la EP, grado de afectación motora con la escala de Hoehn y Yahr, presencia de fluctuaciones motoras y discinesias, y tratamiento concomitante). La dosis diaria equivalente de levodopa (DDELD) fue calculada de acuerdo con la fórmula de conversión sugerida en el estudio de Tomlinson et al.14.
Para evaluar un TCSR probable (TCSR-p), los participantes debían completar la pregunta única para TCSR (RBD1Q, por sus siglas en inglés, Single-Question Screen for REM Sleep Behavior Disorder), una herramienta validada de detección de TCSR basada en una pregunta15. El TCSR-p se definió por una respuesta positiva a la de RBD1Q.
Los participantes tuvieron que completar el cuestionario abreviado para los trastornos impulsivo-compulsivos en la EP, versión abreviada (QUIP-s)16. Este es un instrumento autoadministrado, específicamente desarrollado y validado para detectar la presencia de síntomas de TCI (con el juego, las compras, el comportamiento sexual y la comida) y comportamientos relacionados (punding, hobbysm, walkabout y síndrome de desregulación de dopamina) en las últimas 4 semanas. La presencia de TCI y comportamientos relacionados fue definida por cualquier respuesta positiva al QUIP-s (TCICR+). Los pacientes sin ninguna respuesta afirmativa fueron asignados al grupo TCICR–.
El análisis estadístico fue realizado utilizando el paquete estadístico SPSS versión 22.0. La significación estadística se consideró como riesgo alfa del 5% (p<0,05). Las características clínico-demográficas se presentaron mediante la media ± desviación estándar para las variables cuantitativas y con porcentajes para las cualitativas. Para el análisis bivariante se utilizó la prueba de la chi al cuadrado para las variables cualitativas, mientras que la t de Student fue utilizada para comparar las cuantitativas.
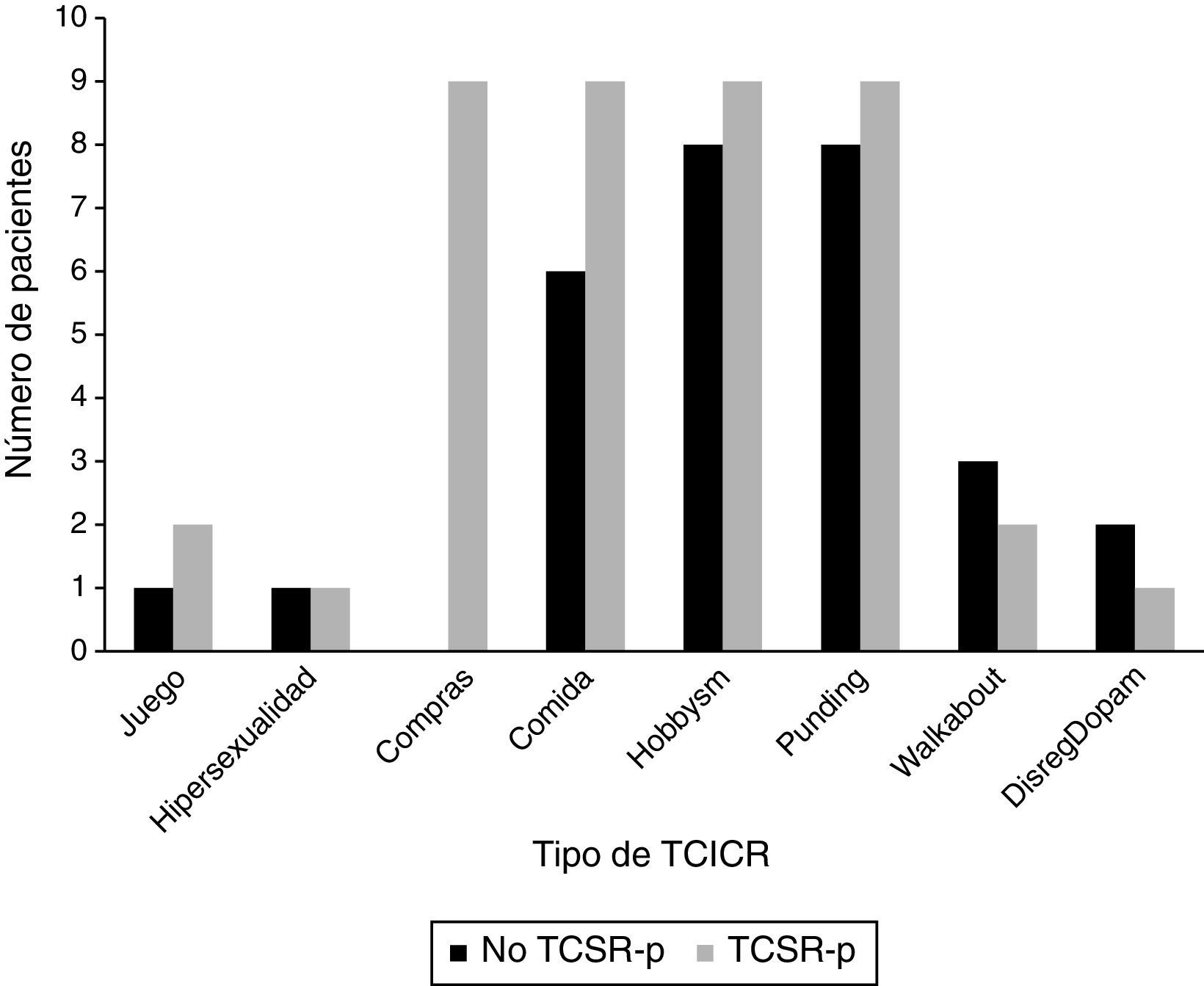
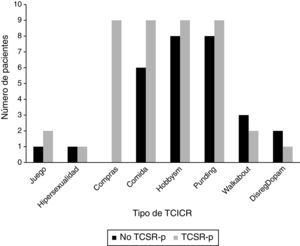
ResultadosFueron incluidos en el estudio 73 pacientes con EP tras la realización de su valoración clínica y después de completar ambos cuestionarios. La edad media de los pacientes fue 68,88 ± 7,758 años, el 50,7% de los pacientes varones. Un total de 26 pacientes (35,6%, 14 varones) se clasificaron dentro del grupo de TCSR-p. Las características clínicas y demográficas de los pacientes con TCSR-p y los no TCSR-p se presentan en la tabla 1.
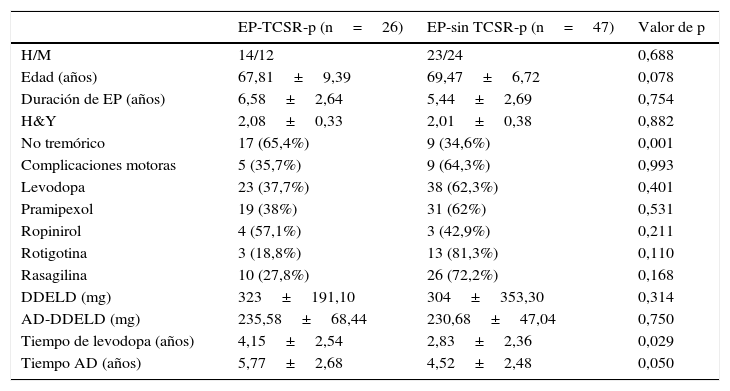
Características clínicas y demográficas de pacientes EP-TCSR-p y EP-sin TCSR-p
| EP-TCSR-p (n=26) | EP-sin TCSR-p (n=47) | Valor de p | |
|---|---|---|---|
| H/M | 14/12 | 23/24 | 0,688 |
| Edad (años) | 67,81±9,39 | 69,47±6,72 | 0,078 |
| Duración de EP (años) | 6,58±2,64 | 5,44±2,69 | 0,754 |
| H&Y | 2,08±0,33 | 2,01±0,38 | 0,882 |
| No tremórico | 17 (65,4%) | 9 (34,6%) | 0,001 |
| Complicaciones motoras | 5 (35,7%) | 9 (64,3%) | 0,993 |
| Levodopa | 23 (37,7%) | 38 (62,3%) | 0,401 |
| Pramipexol | 19 (38%) | 31 (62%) | 0,531 |
| Ropinirol | 4 (57,1%) | 3 (42,9%) | 0,211 |
| Rotigotina | 3 (18,8%) | 13 (81,3%) | 0,110 |
| Rasagilina | 10 (27,8%) | 26 (72,2%) | 0,168 |
| DDELD (mg) | 323±191,10 | 304±353,30 | 0,314 |
| AD-DDELD (mg) | 235,58±68,44 | 230,68±47,04 | 0,750 |
| Tiempo de levodopa (años) | 4,15±2,54 | 2,83±2,36 | 0,029 |
| Tiempo AD (años) | 5,77±2,68 | 4,52±2,48 | 0,050 |
Los datos se expresan en porcentaje o media±DE.
Dentro de los pacientes con TCSR-p se observó mayor prevalencia de síndrome rígido-acinético no tremórico que en el otro grupo, así como más tiempo de tratamiento tanto con levodopa como con los AD. Sin embargo, no se observaron diferencias significativas respecto al sexo, la edad, la duración de la enfermedad, el uso entre los diferentes AD o las complicaciones motoras. Hay que resaltar, aunque no fuera significativo, que el 81,3% de los pacientes tratados con rotigotina no presentaban TCSR-p, a diferencia del 62 y el 42,9% en el caso del pramipexol y ropinirol, respectivamente.
Se observó una relación significativa entre el TCSR-p y el TCICR (p=0,001). El 84,6% de los que tenían TCSR-p (n=22) presentaron al menos una respuesta positiva al QUIP-s, mientras que únicamente el 15,4% (n=4) no se relacionaron con ninguno de esos trastornos. En el caso de los pacientes sin TCSR-p, únicamente el 31,9% (n=15) obtuvieron alguna respuesta afirmativa al test.
Las frecuencias de los diferentes TCICR para los pacientes con TCSR-p y sin TCSR-p se muestran en la figura 1. Se debe destacar que tanto el comprar de manera compulsiva como el trastorno de ingesta compulsiva aparecían de manera significativa relacionados con el TCSR-p (p=0,001 y 0,028, respectivamente).
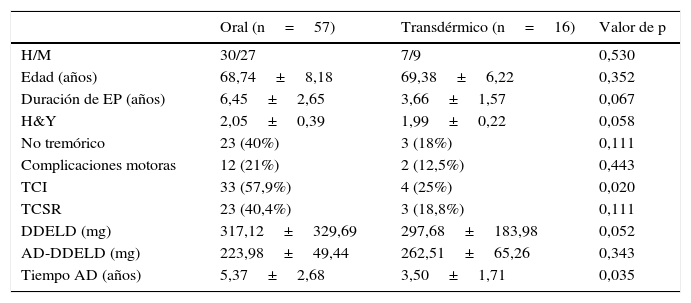
Por último, se dividió a los pacientes según estuviesen en tratamiento con AD por vía oral (pramipexol o ropinirol) o por vía transdérmica (rotigotina). La comparación de las distintas variables evaluadas en cada grupo se expone en la tabla 2. Se observó que el 57% de los pacientes tratados con fármacos por vía oral presentaban TCICR+, a diferencia del 25% de los tratados con rotigotina, con una p=0,021. En cuanto a la frecuencia de TCSR-p, también era superior en el grupo de tratamiento por vía oral (40,4% vs. 18,8%), aunque en este caso la diferencia no fue significativa
Características clínicas y demográficas en función de tratamiento por vía oral o transdérmico
| Oral (n=57) | Transdérmico (n=16) | Valor de p | |
|---|---|---|---|
| H/M | 30/27 | 7/9 | 0,530 |
| Edad (años) | 68,74±8,18 | 69,38±6,22 | 0,352 |
| Duración de EP (años) | 6,45±2,65 | 3,66±1,57 | 0,067 |
| H&Y | 2,05±0,39 | 1,99±0,22 | 0,058 |
| No tremórico | 23 (40%) | 3 (18%) | 0,111 |
| Complicaciones motoras | 12 (21%) | 2 (12,5%) | 0,443 |
| TCI | 33 (57,9%) | 4 (25%) | 0,020 |
| TCSR | 23 (40,4%) | 3 (18,8%) | 0,111 |
| DDELD (mg) | 317,12±329,69 | 297,68±183,98 | 0,052 |
| AD-DDELD (mg) | 223,98±49,44 | 262,51±65,26 | 0,343 |
| Tiempo AD (años) | 5,37±2,68 | 3,50±1,71 | 0,035 |
Los datos se expresan en porcentaje o media±DE.
Nuestros resultados parecen demostrar que la presencia de síntomas indicativos de un TCSR pueda estar relacionada con una mayor tendencia a desarrollar TCICR a lo largo de la EP.
Dicha asociación ha sido descrita con anterioridad en un estudio realizado por Kim et al., en el que un total de 944 pacientes con EP fueron entrevistados para valorar la presencia de TCSR y su relación con el TCI; se valoró que había relación entre ambos trastornos y que esta era estadísticamente significativa5. Posteriormente, en un estudio liderado por Bayard se rebatió esa idea con un estudio basado en pruebas gold standard (polisomnografía para el TCSR y entrevista estructurada para el TCICR); con los resultados obtenidos se concluyó que no existía tal asociación17. En febrero del 2015 Fantini et al.4 plantean de nuevo un estudio sobre el tema, con 260 pacientes diagnosticados de EP, dividiéndolos según tuvieran o no TCSR-p. Se observó que un 53% de los que presentaban TCSR-p tenían TCICR frente a un 28% de los que no tenían dicho trastorno del sueño, siendo esta diferencia significativa (p=0,0002).
Hemos querido valorar de nuevo la posibilidad de dicha relación, basándonos en la hipótesis de que los pacientes con EP y TCSR tienen unas alteraciones más severas en la vía mesocorticolímbica y, por lo tanto, son más susceptibles para desarrollar un TCI. La vía dopaminérgica mesocorticolímbica desempeña un papel importante en el estímulo de recompensa, en el aprendizaje por refuerzo y en la regulación del control de impulsos. Todo ello incluye al estriado ventral, la amígdala, el hipocampo y las regiones ventromedial y orbitofrontal del córtex prefrontal4.
Se conoce una relación entre las áreas límbicas implicadas en el control de impulsos y las implicadas en el sueño REM, entre ellas, el núcleo pedúnculo pontino. Este núcleo, situado a nivel del tronco del encéfalo, es el encargado de modular el sueño REM y está conectado con estructuras de los ganglios de la base y del sistema límbico, por lo que forma también parte del sistema de recompensa y desempeña un papel en la motivación, el aprendizaje por refuerzo y el control de respuesta18. Se sabe también que el sistema límbico regula las emociones durante el despertar y está activado durante el sueño REM, particularmente la amígdala, probablemente en relación con el contenido emocional de los sueños19.
Por todo lo descrito, y con la hipótesis de que un daño en el sistema límbico pueda ser el responsable al mismo tiempo de los sueños vividos y un TCI, creemos que la asociación observada en este estudio ha de tenerse en cuenta para estudios posteriores con mayor tamaño muestral y realización de estudios prospectivos.
Queremos resaltar que el porcentaje de pacientes con TCICR en nuestra serie (50,7%) fue mayor que el reportado por otros autores9,16, lo que atribuimos al uso del cuestionario QUIP-s para su identificación. Consideramos este test como una buena herramienta de cribado al tener una alta sensibilidad (94%)16; esta característica le permite identificar un gran número de casos que deben confirmarse mediante seguimiento o la realización de pruebas más específicas. En el caso del cuestionario utilizado para el diagnóstico de un TCSR probable, se realizó con la pregunta única para el TCSR, presentando en un estudio multicéntrico de junio del 201215 una sensibilidad y una especificidad similar al gold standard para el diagnóstico de esta patología, la polisomnografía, por lo que la consideramos una buena herramienta de cribado para la detección de esta patología.
Por otro lado, ya se conoce la asociación entre la exposición a AD y el desarrollo de TCICR, aunque son escasos los trabajos en los que se comparan los diferentes tipos de agonistas en función de la presencia o no de este trastorno. Un estudio español publicado en el 201420 concluía que los TCI se asociaban de manera significativa al tratamiento con AD por vía oral, en comparación con los transdérmicos, por lo que quisimos comprobar si esto se cumplía en nuestra muestra, y así fue, con una p=0,021.
Al querer relacionar este trastorno con el TCSR en los pacientes con EP, revisamos lo publicado hasta el momento en cuanto a tratamiento dopaminérgico en los problemas de sueño de los pacientes, descubriendo que el papel del mismo en este aspecto es heterogéneo. Se sabe que puede mejorar el sueño nocturno, reduciendo los síntomas motores y no motores asociados con la discontinuidad de la terapia de la noche. Los tratamientos que proporcionan liberación continua de dopamina, como la rotigotina, mejoran los dominios relacionados con el sueño de la Non-Motor Symptoms Scale21. Como ejemplos, en el estudio RECOVER, el parche transdérmico de rotigotina demostró mejoras significativas en el deterioro motor nocturno y la calidad global del sueño y en un estudio posterior este tratamiento se asoció a una mejora significativa de la fragmentación del sueño7.
Con todos estos supuestos, y teniendo en cuenta la relación con los TCICR, quisimos analizar si existía relación entre el TCSR y la terapia con AD en dependencia de la vía de administración; se encontraron diferencias, pero en este caso no significativas.
Los resultados de este estudio indican que el TCSR debería considerarse como un factor de riesgo per se para el desarrollo de síntomas de TCICR en la EP. El hecho de que el TCSR sea en muchas ocasiones un síntoma premotor de la enfermedad nos puede ayudar de cara a tener en cuenta que esos pacientes han de seguirse de manera más estrecha, ante la posibilidad de que desarrollen un TCICR a lo largo de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.